广州5年(2018-2022)中考1年模拟化学分类汇编专题11 计算题(含解析)
文档属性
| 名称 | 广州5年(2018-2022)中考1年模拟化学分类汇编专题11 计算题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 521.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-16 07:11:31 | ||
图片预览


文档简介
5年(2018-2022)中考1年模拟化学分项汇编
专题11 计算题
【5年中考】
1. (2022广州市中考)酚酞(C20H14O4)是常见的酸碱指示剂。下列关于酚酞的说法正确的是
A. 属于无机化合物
B. 相对分子质量为(12×20+1×14+16×4)g
C. C、H、O三种元素的质量比为(12×20):(1×14):(16×4)
D. 碳元素的质量分数为×100%
2.(2021广州中考)纤维素是棉花的主要成分,其化学式为(C6H10O5)n(n约为103~104)。下列关于纤维素的说法正确的是
A.属于无机化合物
B.相对分子质量为(12×6+1×10+16×5)
C.C、H、O三种元素的质量比为6:10:5
D.氧元素的质量分数为×100%
3. (2020广州中考)尿素是氮肥中最主要的一种,其化学式为CO(NH2)2。下列关于尿素的说法正确的是
A. CO(NH2)2中含有的原子是(NH2)2
B. C、O、N、H四种原子的个数比为1:1:1:4
C. 氮元素的质量分数为
D. C、O、N、H四种元素的质量比为12:16:14:1
4. (2019广州中考)从地沟油中提炼生物柴油是垃圾资源化的方法之一。生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是
A. C、H、O三种元素的质量比为19:38:2
B. 相对分子质量为(12×19+1×38+16×2)
C. C、H、O三种原子的个数比为12:1:16
D. 氧元素的质量分数为×100%
5. (2018广州中考)碳酸乙烯酯(C3H4O3)可用作锂电池电解液,下列有关碳酸乙烯酯的说法正确的是
A. 碳酸乙烯酯的相对分子质量为(12×3+1×4+16×3)g
B. 碳酸乙烯酯中C、H、O三种元素的质量比为12:1:16
C. 碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3
D. 碳酸乙烯酯中碳元素的质量分数=×100%
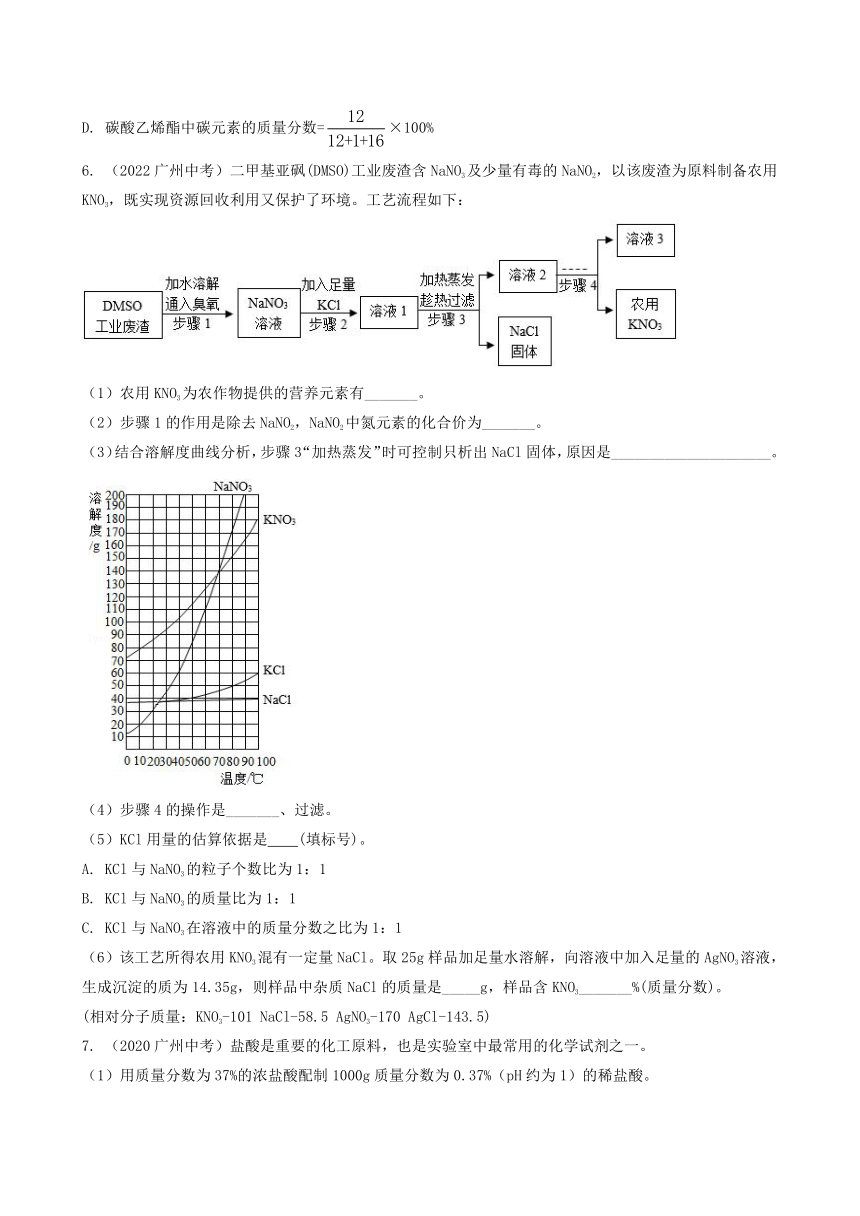
6. (2022广州中考)二甲基亚砜(DMSO)工业废渣含NaNO3及少量有毒的NaNO2,以该废渣为原料制备农用KNO3,既实现资源回收利用又保护了环境。工艺流程如下:
(1)农用KNO3为农作物提供的营养元素有_______。
(2)步骤1的作用是除去NaNO2,NaNO2中氮元素的化合价为_______。
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出NaCl固体,原因是_____________________。
(4)步骤4的操作是_______、过滤。
(5)KCl用量的估算依据是 (填标号)。
A. KCl与NaNO3的粒子个数比为1:1
B. KCl与NaNO3的质量比为1:1
C. KCl与NaNO3在溶液中的质量分数之比为1:1
(6)该工艺所得农用KNO3混有一定量NaCl。取25g样品加足量水溶解,向溶液中加入足量的AgNO3溶液,生成沉淀的质为14.35g,则样品中杂质NaCl的质量是_____g,样品含KNO3_______%(质量分数)。
(相对分子质量:KNO3-101 NaCl-58.5 AgNO3-170 AgCl-143.5)
7. (2020广州中考)盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。
(1)用质量分数为37%的浓盐酸配制1000g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为________g,所需浓盐酸的质量为________g。
②已知浓盐酸密度为1.19g/cm3,量取上述所需浓盐酸用到的仪器是_______(填标号)。
A 10mL量筒
B 50mL量筒
C 试管
D 胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在__________上。
(2)取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是_________________。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为________________。
②下列示意图中,与实验结果相符的是_________(填标号)。
8.(2022广州市中考)某校学生用盐酸和碳酸钙制备CO2,产生了大量废液。兴趣小组通过以下探究确定废液处理方案。
(1)废液成分的确定
①写出制备CO2的化学方程式_____________________。
②推测废液所含溶质
推测一:______________ 推测二:CaCl2和HCl
③若要用一种药品验证哪种推测成立,可选择的有哪些?_______(填标号)
A.石蕊溶液 B.AgNO3溶液 C.锌粒 D.CuO粉末
(2)废液的处理
实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3除去它们。
【提出问题】如何估算Na2CO3固休的用量?
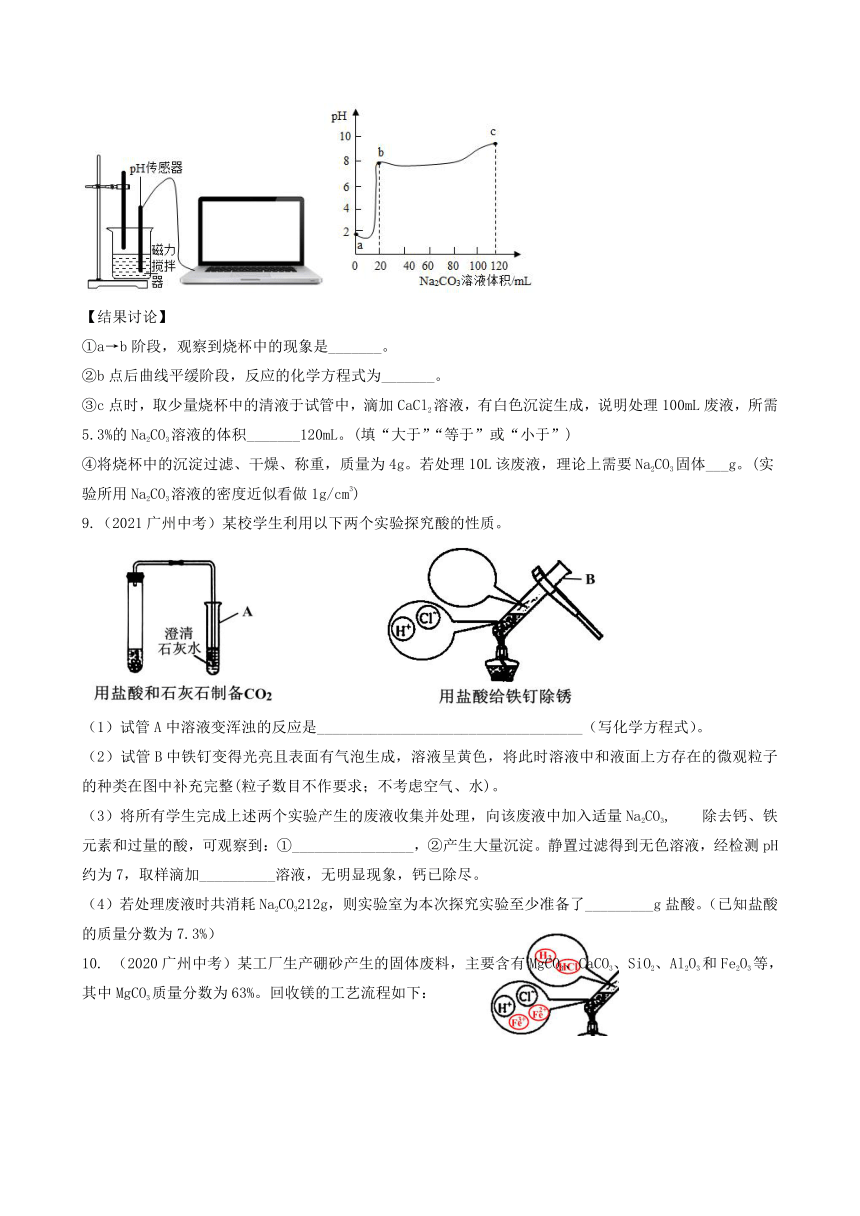
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。
【结果讨论】
①a→b阶段,观察到烧杯中的现象是_______。
②b点后曲线平缓阶段,反应的化学方程式为_______。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积_______120mL。(填“大于”“等于”或“小于”)
④将烧杯中的沉淀过滤、干燥、称重,质量为4g。若处理10L该废液,理论上需要Na2CO3固体___g。(实验所用Na2CO3溶液的密度近似看做1g/cm3)
9.(2021广州中考)某校学生利用以下两个实验探究酸的性质。
(1)试管A中溶液变浑浊的反应是___________________________________(写化学方程式)。
(2)试管B中铁钉变得光亮且表面有气泡生成,溶液呈黄色,将此时溶液中和液面上方存在的微观粒子的种类在图中补充完整(粒子数目不作要求;不考虑空气、水)。
(3)将所有学生完成上述两个实验产生的废液收集并处理,向该废液中加入适量Na2CO3, 除去钙、铁元素和过量的酸,可观察到:①________________,②产生大量沉淀。静置过滤得到无色溶液,经检测pH约为7,取样滴加__________溶液,无明显现象,钙已除尽。
(4)若处理废液时共消耗Na2CO3212g,则实验室为本次探究实验至少准备了_________g盐酸。(已知盐酸的质量分数为7.3%)
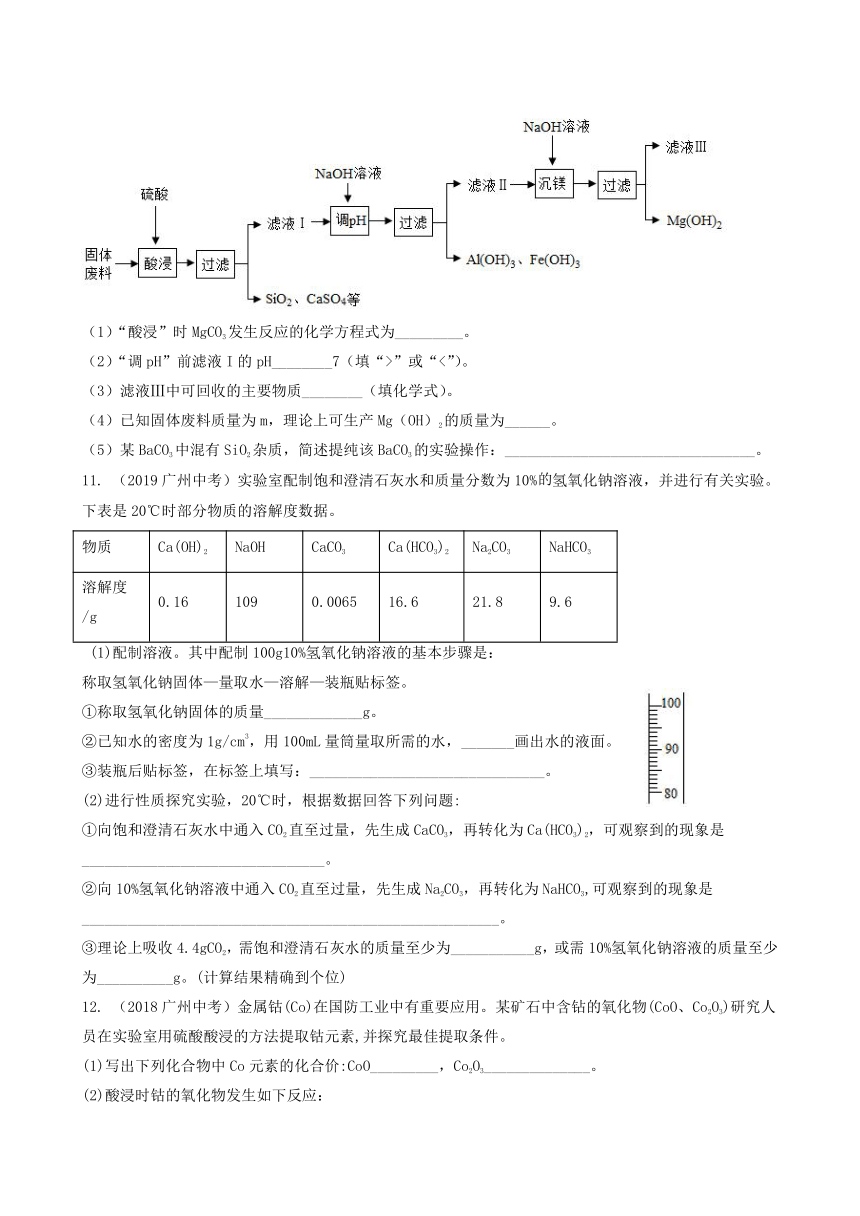
10. (2020广州中考)某工厂生产硼砂产生的固体废料,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3质量分数为63%。回收镁的工艺流程如下:
(1)“酸浸”时MgCO3发生反应的化学方程式为_________。
(2)“调pH”前滤液I的pH________7(填“>”或“<”)。
(3)滤液Ⅲ中可回收的主要物质________(填化学式)。
(4)已知固体废料质量为m,理论上可生产Mg(OH)2的质量为______。
(5)某BaCO3中混有SiO2杂质,简述提纯该BaCO3的实验操作:_________________________________。
11. (2019广州中考)实验室配制饱和澄清石灰水和质量分数为10%氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 Ca(OH)2 NaOH CaCO3 Ca(HCO3)2 Na2CO3 NaHCO3
溶解度/g 0.16 109 0.0065 16.6 21.8 9.6
(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体—量取水—溶解—装瓶贴标签。
①称取氢氧化钠固体的质量_____________g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,_______画出水的液面。
③装瓶后贴标签,在标签上填写:_______________________________。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是________________________________。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是_______________________________________________________。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为___________g,或需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到个位)
12. (2018广州中考)金属钴(Co)在国防工业中有重要应用。某矿石中含钻的氧化物(CoO、Co2O3)研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。
(1)写出下列化合物中Co元素的化合价:CoO_________,Co2O3______________。
(2)酸浸时钴的氧化物发生如下反应:
反应I CoO+H2SO4=CoSO4+H2O
反应Ⅱ 2Co2O3+4H2SO4=4CoSO4+O2↑+4H2O
反应Ⅲ Co2O3+2H2SO4+Na2SO3=2CoSO4+2H2O+Na2SO4
①反应后溶液中含钴元素的微粒是_________ (填化学符号)
②已知反应前矿石中CoO的质量为ag,Co2O3的质量为bg,则理论上可以生成CoSO4____g(用含a、b的式子表示)
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
编号 矿石用量(g) 硫酸用量(g) Na2SO3用量(g) 温度(℃) 钻元素浸出率(%)
1 85.71 12.62 0 85 56.39
2 85.71 6.31 0 85 49.98
3 85.71 6.31 0 65 43.33
4 85.71 6.31 0.43 65 73.95
5 85.71 6.31 0.86 65 74.77
①本实验研究了哪些因素对钴元素浸出率的影响__________________________________;
②根据上表数据,其他条件不变,温度升高,钴元素的浸出率___________________________;
③工业生产中采用实验______________(填编号)的提取条件更合理。
13. (2018广州中考)室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃) 0 20 25 40 50 60 80
溶解度(g) 69.2 74.5 76.4 81.8 855 89.4 98.0
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
【1年模拟】
1. (2022广州从化区一模)我国自主研发的新冠疫苗,主要原料是胰蛋白酶,其中一种胰蛋白酶的化学式为C6H15O12P3,相对分子质量为372,对于该胰蛋白酶说法正确的是
A. 该胰蛋白酶是一种高分子化合物
B. 该胰蛋白酶由36种元素组成
C. 该胰蛋白酶中碳、氧元素质量比3:8
D. 该胰蛋白酶一个分子的质量为372g
2. (2022广州市天河区二模)广州早茶文化远近驰名。茶叶中含有茶氨酸(C7H14N2O3)、锌、硒等多种成分。下列说法不正确的是
A. 茶氨酸属于有机物,“锌、硒”指的是元素
B. 茶氨酸的相对分子质量为()g
C. 泡茶时茶香四溢,体现了分子是运动的
D. 用茶杯内的纱网可分离茶叶和茶水,利用的是过滤的原理
3.(2022广州越秀区一模)广东地区因气候等原因喜欢饮用凉茶,凉茶具有消热解毒、凉血利明功效,主要成分是黑芥子甙(C10H17NO9S2),可以预防感冒。下列有关说法正确的是( )
A.黑芥子甙中含有39个原子
B.黑芥子甙中的氮元素的质量分数最小
C.黑芥子甙在氧气中充分燃烧只生成CO2和H2O
D.黑芥子甙中碳、氧、硫元素的质量比为17:9:2
4.(2022广州市天河区二模)阅读下列科普短文,回答问题。
2021年,考古学家利用碳-14断代法初步判定三星堆4号坑距今约3200至3000年。碳-14原子核中含6个质子与8个中子。生物死后体内的碳-14会不断衰变,碳-14原子核中1个中子变成1个质子,形成新的原子核。对比生物体内生前、死后碳-14的含量,可推算出其所属年代。
国家速滑馆利用CO2跨临界直冷制冰,就是将气态CO2通过加温加压形成超临界CO2流体(介于气态和液态之间的一种新的状态,兼有气体和液体的性质),后变为液态CO2,再变成气态完成制冰的过程。工业上可用CO2为原料合成燃料甲烷、甲醇(CH3OH),氮肥尿素等,合成尿素的反应:。
(1)碳-14原子核外电子数为_____________,其衰变形成的新原子属于___________元素(填元素符号)。
(2)超临界CO2流体是______(填“纯净物”“混合物”)。液态CO2能用于制冰的原因是________。
(3)甲醇充分燃烧的产物为______________。
(4)合成尿素时,参与反应的CO2与NH3的质量比为__________。尿素含氮量高,其氮元素的质量分数为_________(保留小数点后一位)。
5.(2022广州天河区一模)NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如图:下列说法正确的是( )
A.表示3个氢气分子
B.反应中元素的化合价都没有改变
C.参加反应的H2与生成的NH3分子个数比为1:2
D.生成物氨气是由N3﹣和H+构成
6.(2022广州越秀区一模)科学家将温室气体CH4和CO2在Ni基双金属催化作用下转化为两种气体燃料,反应的微观示意图如图。下列分析不正确的是( )
A.该转化过程的最终产物为H2和CO
B.该转化有助于减少碳排放实现碳中和
C.反应过程中,CH4与CO分子数之比为1:1
D.反应过程中,CO2与CO的质量比为11:14
7.(2022广州越秀区一模)SCR催化技术利用NH3与NO2反应,能有效降低柴油发动机工作时的氮氧化物排放量,示意图如图。下列有关该反应的说法正确的是( )
A.反应生成了氧气和水
B.反应前后分子总数不变
C.两种生成物的质量比为12:7
D.NH3与NO2按分子个数比4:3进行反应
8.(2022广州黄埔区一模)科学家发现,可以将树木纤维素转变成超级储能装置。如图是该反应的微观示意图,下列说法不正确的是( )
A.该反应属于置换反应
B.反应生成的Z、W两种物质的分子个数比为1:1
C.该反应前后原子的种类、数目均保持不变
D.参加反应的X、Y的质量总和等于生成的Z、W的质量总和
9.(2022广州市黄埔区一模)“侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3═NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是
A. 0℃时,NH4Cl的溶解度大于NaCl的溶解度
B. 20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数
C. 20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出
D. NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl
10.(2022广州市天河区二模)某化工厂利用软锰矿(主要成分为MnO2,含有少量Al2O3、MgO、SiO2等杂质)脱除燃煤烟气中的SO2,同时制得在电子工业有重要应用的MnCO3.工艺流程如下:
已知:①“脱硫浸锰”时主要发生的反应有。
②NH4F易溶于水。
(1)“脱硫浸锰”时,MgO与硫酸反应的化学方程式为_________________。
(2)“除铝”时,加入氨水后溶液的pH_______________(填“变大”“不变”“变小”)。
(3)若“除镁”“沉锰”时均发生复分解反应,则“除镁”发生的化学方程式为_______,“沉锰”加入的X溶液中一定含有的主要离子有_________(填离子符号)。
(4)若制得1250t含杂质8%的MnCO3粗产品,理论上需要含MnO287%的软锰矿的质量为_____t(不考虑流程中的损耗)。
11. (2022广州从化区一模)某同学进行H2O2溶液制备O2的实验探究。回答下列问题:
(1)向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
①写出用H2O2溶液制取O2的化学方程式:_____________________。
②用上述反应原理制备并收集一瓶干燥的O2,从上述装置中选择并组装一套装置,其连接顺序为_______→_______→_______(填编号)。
③实验室制取二氧化碳的发生装置和收集装置应选_______(填编号);若要制取88g的二氧化碳,需要10%的稀盐酸_______g。
(2)向5mL5%的H2O2溶液中加入2滴一定浓度的FeCl3溶液,立即产生大量气泡。某同学设计下列实验探究哪种微粒对H2O2溶液的分解起催化作用。
实验 H2O2溶液 加入溶液 实验现象
① 5mL5% 2滴NaCl溶液 无明显变化
② 5mL5% 2滴Na2SO4溶液 无明显变化
③ 5mL5% 2滴Fe2(SO4)3溶液 立即产生大量气泡
从上述实验现象,得出对H2O2溶液分解起催化作用的微粒是_______(填离于符号)。从循环利用的角度分析,MnO2和FeCl3溶液两种催化剂,_______更适合作为该反应的催化剂。
12.(2022广州市增城区二模)氧气是供给呼吸的重要物质,制取氧气的方法有很多种。
仪器的名称是 ______。
过氧化钠是一种淡黄色固体,是航空航天、潜水艇的供氧剂。常温下与水反应制取氧气,选择的发生装置是 ______填标号。检验该装置气密性的操作方法:首先夹紧弹簧夹,再 ____________,观察到 ________________________,证明气密性良好。
某兴趣小组在实验室用作催化剂分解制取氧气。
制取氧气的化学方程式是 ______________________________。
完全反应后要对固体剩余物进行回收。向固体剩余物中加入一定质量的的水,充分搅拌、静置、过滤。将滤渣洗涤、干燥、得到的黑色固体是 ______;蒸干滤液,可得氯化钾;需要称取的质量是 ______。
查阅资料可知:氯化钾在的溶解度是。为了能全部回收氯化钾,并最大限度节省能源,向上述完全反应后的固体剩余物中加入水的质量是 ______。
13. (2022广州市海珠区一模)实验室模拟工业上用某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4·7H2O,流程如下:
(1)“酸浸”过程中:
①有MnSO4生成,MnSO4在水溶液中解离出的阳离子是_______ (填离子符号)。
②MnCO3与H2SO4反应的化学方程式为________________________。
(2)“转化”时的主要反应是:NaClO+MnSO4+H2O=MnO2↓+H2SO4+X,X的化学式为_______。
(3)“过滤2”所得滤液中能分离出一种可循环使用的物质,该物质是_______(填化学式)。
(4)“操作1”中包括蒸发浓缩等一系列操作,蒸发浓缩时需要用到的仪器有铁架台、铁圈、酒精灯、玻璃棒和_______。
(5)若用10kg菱镁矿石可制得24.6kgMgSO4·7H2O (相对分子质量为246),则菱镁矿石中MgCO3的质量分数为_______。
14. (2022广州市番禺区一模)金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,Co元素常见的化合价为+2和+3。金属Co与酸反应后显+2,Co元素常见的化合物相关性质如下:
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
(1)根据金属化学性质的一般规律。下列预测合理的是___________。
A. 钴能够与氢氧化钠溶液反应
B. H2或者CO能够将钴的氧化物转化为金属钴
C. 钴能够与盐酸或者稀硫酸反应
D. 硫酸钴溶液中的硫酸锌可以加入钴粉除去
(2)碳酸钴(CoCO3)是一种难溶于水的粉红色固体,结合所学知识预测,CoCO3能与____(填物质类别)反应,验证预测的实验操作和预期现象是:取CoCO3固体于试管中_______。
(3)依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。.
限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
实验步骤 预期反应的化学方程式 预期反应的实验现象
__________________________ __________________________ __________________
___________________________ __________________________ __________________
(4)从含钴的矿石中提取钴的工艺过程一般是会先用足量的酸进行酸浸,酸浸时,钴的氧化物发生如下反应:
反应I:CoO + H2SO4 =CoSO4 +H2O
反应II:2Co2O3 + 4H2SO4 =4CoSO4 +4H2O +O2↑
反应III:Co2O3 +Na2SO3+2H2SO4 =2CoSO4 +2H2O +Na2SO4
①反应后溶液中含钴元素的微粒是:___________(填化学符号)。
②已知,反应前含有CoO和Co2O3 的矿石(矿石中钴元素的质量分数为59%)的质量为b g 则理论上可以生成CoSO4的质量为________________________(用含b的式子表示)。
15. (2022广州市白云区一模)N是空气中含量最高的元素。
(1)将含N物质进行分类,按要求写出化学式
单质 引起酸雨的氧化物 酸 含氮的不同化合价的盐
N2 ______________ HNO3 _______________
(2)镓元素的信息如图。
请设计理论上制备硝酸镓的三种方案(要求含镓原料分别属于不同的化合物类别)
方案 预期反应的化学方程式
① _________________________
② __________________________
③ __________________________
(3)若硫酸铝铵晶体【NH4Al(SO4)2】·12H2O,相对分子质量453】
①加热过程中,其质量随时间的变化如图所示。据此判断,从200℃到50℃间固体是否还存在结晶水,并作出解释。_______(是或否),____________________________。
②写出一个能与硫酸铝溶液发生反应的原子团_______。(写离子符号)
16. (2022广州黄埔区二模)某热电厂用脱硫得到的石膏(CaSO4·2H2O)生产K2SO4肥料的流程如图:
已知:不同温度下,硫酸钾在水溶液、氨溶液中的溶解度:
温度(℃) 0 10 25
水溶液 6.815 8.496 9.937
氨(8%)溶液 1.387 1.558 2.198
氨(35%)溶液 0.442 0.742 0.813
(1)在“脱硫”反应中,将CaCO3粉碎后与水混合成悬浊液的目的是___________。
(2)脱硫过程的化学方程式为:___________。
(3)石膏与饱和(NH4)2CO3溶液相混合发生反应Ⅰ,反应基本类型为___________。
(4)“操作I”的名称是___________。
(5)你认为反应Ⅱ在常温下能实现的原因是___________。
(6)CaSO4·2H2O受热会逐步失去结晶水。取纯净CaSO4·2H2O固体3.44g,进行加热,测定固体质量随温度的变化情况如图所示。CaSO4·2H2O相对分子质量为172。
H点的固体在T2~1400℃范围内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,写出发生反应的化学方程式___________。
17. (2022广州黄埔区二模)向一支装有少量CuO的试管中依次加入下列物质,实验操作如图所示,回答下列问题。
(1)图A实验中加入过量稀H2SO4后,观察到的现象___________。
(2)图B发生反应的化学方程式___________。
(3)如图D,向图C实验后所得溶液中插入新打磨的铝丝,画出图中溶液中一定存在的微观粒子_________。(微粒数目不做要求,不考虑空气、水)。
(4)实验开始时放入试管的CuO质量为4g,则实验最后取出的铝丝最多能增重___________g。
18. (2022广州市天河区二模)气体的制取实验是初中化学学习的重要内容。
(1)下列制取气体的实验,发生装置可选用甲的是____________(填字母)。
A. 二氧化锰与浓盐酸加热制取Cl2 B. 锌和稀硫酸制取H2
C. 块状硫化亚铁(FeS)和稀硫酸制取H2S D. 高锰酸钾制取O2
(2)某同学阅读课外资料得知:双氧水分解制取氧气除了用二氧化锰,还可以用氧化铜作催化剂,于是进行了以下实验探究:
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?
【设计实验】以收集到30mL氧气为标准,设计了下列两组实验(其他可能影响实验的因素均忽略)。
实验序号 氯酸钾的质量 其他物质及其质量 待测数据
甲 2.45g /
乙 2.45g CuO0.5g
①上述实验应测量的“待测数据”是_________。
【实验结论】
②实验甲比乙的“待测数据”更________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。实验乙中反应的化学方程式为_______,氯酸钾完全分解后,试管中剩余固体的质量为_______g。
答案解析
【5年中考】
1. (2022广州市中考)酚酞(C20H14O4)是常见的酸碱指示剂。下列关于酚酞的说法正确的是
A. 属于无机化合物
B. 相对分子质量为(12×20+1×14+16×4)g
C. C、H、O三种元素的质量比为(12×20):(1×14):(16×4)
D. 碳元素的质量分数为×100%
【答案】C
【解析】
A、根据酚酞的化学式知:酚酞是含有碳元素的化合物,属于有机物,错误;
B、相对分子质量的单位不是“g”,而是“1”,通常省略不写,错误;
C、酚酞中碳、氢、氧三种元素的质量比为(12×20):(1×14):(16×4)=120:7:32;正确;
D、酚酞中碳元素的质量分数为,错误。
故选C。
2.(2021广州中考)纤维素是棉花的主要成分,其化学式为(C6H10O5)n(n约为103~104)。下列关于纤维素的说法正确的是
A.属于无机化合物
B.相对分子质量为(12×6+1×10+16×5)
C.C、H、O三种元素的质量比为6:10:5
D.氧元素的质量分数为×100%
【答案】 D
【解析】
A.纤维素的化学式中含有碳元素,物质分类应为有机化合物,故A错误;
B.相对分子质量应为(12×6+1×10+16×5)×n,故B错误;
C.C、H、O三种元素的质量比为12×6:1×10:16×5,故C错误;
D.氧元素的质量分数为×100% = ×100%,故D正确。
3. (2020广州中考)尿素是氮肥中最主要的一种,其化学式为CO(NH2)2。下列关于尿素的说法正确的是
A. CO(NH2)2中含有的原子是(NH2)2
B. C、O、N、H四种原子的个数比为1:1:1:4
C. 氮元素的质量分数为
D. C、O、N、H四种元素的质量比为12:16:14:1
【答案】C
【解析】
化合物中各元素质量比=各原子的相对原子质量×原子个数之比
A、CO(NH2)2是由尿素分子构成的,不含有(NH2)2,故A不正确;
B、尿素的化学式为CO(NH2)2,C、O、N、H四种原子的个数比为,故B不正确;
C、,则氮元素的质量分数为,故C正确;
D、尿素的化学式为CO(NH2)2,C、O、N、H四种元素的质量比为,故D不正确。故选C。
4. (2019广州中考)从地沟油中提炼生物柴油是垃圾资源化的方法之一。生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是
A. C、H、O三种元素的质量比为19:38:2
B. 相对分子质量为(12×19+1×38+16×2)
C. C、H、O三种原子的个数比为12:1:16
D. 氧元素的质量分数为×100%
【答案】B
【解析】
化学中元素质量比等于原子个数比乘以相对原子质量比。
A、由硬脂酸甲酯(C19H38O2)可知,C、H、O三种元素的质量比为,故A不正确;
B、相对分子质量为(12×19+1×38+16×2),故B正确;
C、C、H、O三种原子的个数比为19:38:2,故C不正确;
D、氧元素的质量分数为,故D不正确。故选B。
5. (2018广州中考)碳酸乙烯酯(C3H4O3)可用作锂电池电解液,下列有关碳酸乙烯酯的说法正确的是
A. 碳酸乙烯酯的相对分子质量为(12×3+1×4+16×3)g
B. 碳酸乙烯酯中C、H、O三种元素的质量比为12:1:16
C. 碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3
D. 碳酸乙烯酯中碳元素的质量分数=×100%
【答案】C
【解析】
A. 碳酸乙烯酯的相对分子质量为12×3+1×4+16×3,相对分子质量单位为“1”,通常不写,错误;B. 碳酸乙烯酯中C、H、O三种元素的质量比为12×3:1×4:16×3,错误;C. 化学式中元素符号右下角的数字为一个分子中原子的个数,碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3,正确;D. ,碳酸乙烯酯中碳元素的质量分数= ×100%,错误。故选C。
6. (2022广州中考)二甲基亚砜(DMSO)工业废渣含NaNO3及少量有毒的NaNO2,以该废渣为原料制备农用KNO3,既实现资源回收利用又保护了环境。工艺流程如下:
(1)农用KNO3为农作物提供的营养元素有_______。
(2)步骤1的作用是除去NaNO2,NaNO2中氮元素的化合价为_______。
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出NaCl固体,原因是_____________________。
(4)步骤4的操作是_______、过滤。
(5)KCl用量的估算依据是 (填标号)。
A. KCl与NaNO3的粒子个数比为1:1
B. KCl与NaNO3的质量比为1:1
C. KCl与NaNO3在溶液中的质量分数之比为1:1
(6)该工艺所得农用KNO3混有一定量NaCl。取25g样品加足量水溶解,向溶液中加入足量的AgNO3溶液,生成沉淀的质为14.35g,则样品中杂质NaCl的质量是_____g,样品含KNO3_______%(质量分数)。
(相对分子质量:KNO3-101 NaCl-58.5 AgNO3-170 AgCl-143.5)
【答案】(1)钾元素和氮元素 (2)+3 (3)硝酸钾溶解度受温度影响比较大,氯化钠受温度影响比较小 (4)降温结晶 (5)A (6) ①. 5.85 ②. 76.6
【解析】
(1)KNO3为农作物提供的营养元素有钾元素和氮元素。
(2)NaNO2中钠元素的化合价为+1价,氧元素的化合价为-2价,设氮元素的化合价为x,根据“化合物中各元素的化合价之和为0”可知,1+x+(-2)×2=0,解得x=+3。
(3)硝酸钾溶解度受温度影响比较大,氯化钠受温度影响比较小,则“加热蒸发”时只析出氯化钠。
(4)由图可知,通过步骤4分离出了硝酸钾,而硝酸钾受温度影响比较大,且溶液2的温度比较高,则步骤4为降温结晶。
(5)加入氯化钾的目的是使溶液中的氯离子和钠离子结合为氯化钠析出,则因使氯化钾与硝酸钠的粒子个数比为1:1,故选A。
(6)设样品中杂质NaCl的质量是x,则:
x=5.85g
则样品中含KNO3的质量为 。
7. (2020广州中考)盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。
(1)用质量分数为37%的浓盐酸配制1000g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为________g,所需浓盐酸的质量为________g。
②已知浓盐酸密度为1.19g/cm3,量取上述所需浓盐酸用到的仪器是_______(填标号)。
A 10mL量筒
B 50mL量筒
C 试管
D 胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在__________上。
(2)取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是_________________。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为________________。
②下列示意图中,与实验结果相符的是_________(填标号)。
【答案】 ①. 3.7 ②. 10 ③. AD ④. 玻璃片或白瓷板 ⑤. 溶液由红色变成无色 ⑥. ⑦. D
【解析】
(1)①所配稀盐酸中溶质的质量=1000g0.37%=3.7g,所需浓盐酸的质量=3.7g37%=10g;
②所需浓盐酸的体积=10 g1.19g/cm3≈8.4mL,应选用10mL量筒和胶头滴管进行量取;
③测定所配稀盐酸的酸碱度,应将pH试纸放置在玻璃片或白瓷板上,用玻璃棒蘸取待测液滴到pH试纸上再与标准比色卡进行比较;
(2)氢氧化钙溶于水显碱性,滴加1滴酚酞溶液,溶液变红,再滴加稀盐酸至反应完全,盐酸和氢氧化钙反应生成氯化钙和水,溶液显中性,溶液由红色变成无色;
(3)①铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程为:;
②取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸,若铁过量或盐酸过量都会生成等质量的氢气,铁粉比铁片与盐酸的接触面积大,反应速率快,所用时间少,对比四个选项,只有D项正确。
8.(2022广州市中考)某校学生用盐酸和碳酸钙制备CO2,产生了大量废液。兴趣小组通过以下探究确定废液处理方案。
(1)废液成分的确定
①写出制备CO2的化学方程式_____________________。
②推测废液所含溶质
推测一:______________ 推测二:CaCl2和HCl
③若要用一种药品验证哪种推测成立,可选择的有哪些?_______(填标号)
A.石蕊溶液 B.AgNO3溶液 C.锌粒 D.CuO粉末
(2)废液的处理
实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3除去它们。
【提出问题】如何估算Na2CO3固休的用量?
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。
【结果讨论】
①a→b阶段,观察到烧杯中的现象是_______。
②b点后曲线平缓阶段,反应的化学方程式为_______。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积_______120mL。(填“大于”“等于”或“小于”)
④将烧杯中的沉淀过滤、干燥、称重,质量为4g。若处理10L该废液,理论上需要Na2CO3固体___g。(实验所用Na2CO3溶液的密度近似看做1g/cm3)
【答案】 ①. ②. CaCl2 ③. ACD ④. 有气泡产生 ⑤. ⑥. 小于 ⑦. 530
【解析】
(1)①实验室用大理石(或 石灰石)和稀盐酸制取CO2,大理石的主要成分碳酸钙和盐酸反应产生氯化钙、水和二氧化碳,化学方程式:。
②碳酸钙和盐酸恰好完全反应时溶质只有氯化钙,则推测一:氯化钙;盐酸过量时推测二:CaCl2和HCl;
③根据推测,主要是证明盐酸的有无即可判断是哪种推测;
A、盐酸会使石蕊试液变红色;则样品滴加石蕊试液后变红了,则有盐酸,推测二成立;如果石蕊试液不变色,推测一成立;正确;
B、溶液中有氯化钙,提供了氯离子,硝酸银和氯化钙反应产生氯化银沉淀和硝酸,盐酸和硝酸银也会产生氯化银沉淀,所以不能用硝酸银溶液验证是否有盐酸,错误;
C、盐酸和锌反应产生氯化锌和氢气,会产生气体;则锌粒中加入样品后产生气泡,则有盐酸,推测二成立;如果没有气泡,推测一成立;正确;
D、氧化铜和盐酸反应产生氯化铜和水,固体会减少或消失,溶液变蓝色;则氧化铜中加入样品后固体会减少或消失,溶液变蓝色,则有盐酸,推测二成立;如果固体不减少,溶液不变蓝色,推测一成立;正确;故选ACD。
(2)①废液中的溶质是CaCl2和HCl,向其中加入碳酸钠,碳酸钠先和盐酸反应产生氯化钠、水和二氧化碳,然后碳酸钠和氯化钙反应产生碳酸钙沉淀和氯化钠,根据图像a→b阶段,是碳酸钠和盐酸反应,则会观察到烧杯中有气泡产生。
②碳酸钠溶液显碱性,b点后曲线平缓阶段,是碳酸钠和氯化钙反应,氯化钠溶液显中性,反应的化学方程式为:。
③c点时,溶液显碱性,碳酸钠过量,结合图像分析,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积小于120mL。
④100mL废液,产生碳酸钙的质量是4g,设要碳酸钠的质量是x。
所需碳酸钠溶液的体积为:4.24g÷5.3%÷1g/mL=80mL, 即80mL碳酸钠溶液中含有碳酸钠4.24g,故100mL碳酸钠溶液中含有碳酸钠4.24g×100mL÷80mL=5.3g,因此若处理10L(即:10000mL)该废液,理论上需要Na2CO3固体质量为10000mL÷100mL×5.3g=530g;
故答案为:530。
9.(2021广州中考)某校学生利用以下两个实验探究酸的性质。
(1)试管A中溶液变浑浊的反应是___________________________________(写化学方程式)。
(2)试管B中铁钉变得光亮且表面有气泡生成,溶液呈黄色,将此时溶液中和液面上方存在的微观粒子的种类在图中补充完整(粒子数目不作要求;不考虑空气、水)。
(3)将所有学生完成上述两个实验产生的废液收集并处理,向该废液中加入适量Na2CO3, 除去钙、铁元素和过量的酸,可观察到:①________________,②产生大量沉淀。静置过滤得到无色溶液,经检测pH约为7,取样滴加__________溶液,无明显现象,钙已除尽。
(4)若处理废液时共消耗Na2CO3212g,则实验室为本次探究实验至少准备了_________g盐酸。(已知盐酸的质量分数为7.3%)
【答案】(1) Ca(OH)2 + CO2 ===CaCO3↓ + H2O (1分)
(2)见右图(2分)
(3)有气泡产生(1分);Na2CO3 (1分)
(4) 2000 (2分)
【解析】
(1)试管A中发生的反应是CO2与澄清石灰水发生的反应,故反应的化学方程式为 Ca(OH)2 + CO2 ===CaCO3↓ + H2O (1分)
(2)试管B中铁钉变得光亮,即铁锈已除去;铁钉表面有气泡生成,这气体是H2,即溶液中应有FeCl2;溶液呈黄色,说明溶液中的主要成分是FeCl3;由于盐酸是氯化氢气体的水溶液,气体溶解度随温度的升高而减小,图中溶液见到H+和Cl-离子,故应有HCl气体在试管内出现,故画出了见上的图所示的粒子。
(3)“过量的酸”会与加入的Na2CO3反应,故有气泡产生(1分);鉴别Ca2+离子可以使用Na2CO3溶液,因为Ca2+离子与中Na2CO3的CO32-结合成白色沉淀的CaCO3。
(4)加入适量Na2CO3是为了除去废液中的钙、铁元素和过量的酸,反应后的溶液呈中性(pH≈7),即溶液中只含有NaCl。故有
Na2CO3 ------ 2NaCl ------ 2HCl
106 73
212g X×7.3%
X= =2000g
10. (2020广州中考)某工厂生产硼砂产生的固体废料,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3质量分数为63%。回收镁的工艺流程如下:
(1)“酸浸”时MgCO3发生反应的化学方程式为_________。
(2)“调pH”前滤液I的pH________7(填“>”或“<”)。
(3)滤液Ⅲ中可回收的主要物质________(填化学式)。
(4)已知固体废料质量为m,理论上可生产Mg(OH)2的质量为______。
(5)某BaCO3中混有SiO2杂质,简述提纯该BaCO3的实验操作:_________________________________。
【答案】 ①. ②. < ③. ④. ⑤. 向样品中加入适量盐酸至不再产生气泡,过滤除去固体杂质SiO2,向滤液中加入适量的碳酸钠溶液至刚好不再产生沉淀,过滤,洗涤固体,烘干,得到碳酸钡固体
【解析】
(1)“酸浸”时MgCO3和硫酸发生反应,其化学方程式为;
(2)“调pH”前滤液I是酸浸之后产生的,会有硫酸,所以pH<7;
(3)酸浸之后,滤液I中的溶质有硫酸、硫酸镁、硫酸铝和硫酸铁,硫酸先和氢氧化钠反应产生水和硫酸钠;硫酸铝和硫酸铁和氢氧化钠反应产生氢氧化铝沉淀、氢氧化铁沉淀和硫酸钠;然后是硫酸镁和氢氧化钠反应产生氢氧化镁沉淀和硫酸钠,所以滤液Ⅲ中可回收的主要物质是硫酸钠,其化学式为;
(4)固体废料中MgCO3质量分数为63%;根据质量守恒定律,碳酸镁中的镁元素全部转化为Mg(OH)2;设可生产Mg(OH)2的质量为x,则:
,解得;
(5)从流程图中知道,SiO2不能和酸反应,BaCO3中和硫酸会产生难溶于酸的硫酸钡,BaCO3与盐酸反应生成氯化钡、水和二氧化碳,所以用盐酸进行反应。提纯该BaCO3的实验操作:向样品中加入适量盐酸至不再产生气泡,过滤除去固体杂质SiO2,向滤液中加入适量的碳酸钠溶液至刚好不再产生沉淀,过滤,洗涤固体,烘干,得到碳酸钡固体。
11. (2019广州中考)实验室配制饱和澄清石灰水和质量分数为10%氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 Ca(OH)2 NaOH CaCO3 Ca(HCO3)2 Na2CO3 NaHCO3
溶解度/g 0.16 109 0.0065 16.6 21.8 9.6
(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体—量取水—溶解—装瓶贴标签。
①称取氢氧化钠固体的质量_____________g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,_______画出水的液面。
③装瓶后贴标签,在标签上填写:_______________________________。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是________________________________。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是_______________________________________________________。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为___________g,或需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到个位)
【答案】 (1). 10.0 (2). (3). 氢氧化钠 10% (4). 先产生白色浑浊,继续通二氧化碳,溶液又变澄清 (5). 一段时间后出现白色沉淀 (6). 4632 (7). 80
【解析】
二氧化碳和氢氧化钙先生成沉淀和水,碳酸钙和二氧化碳和水再转化
,二氧化碳和氢氧化钠反应先生成和水,二氧化碳和碳酸钠和水再转化为。
(1) ①称取氢氧化钠固体的质量为。
②水的密度为1g/cm3,用100mL量筒量取所需的水,水的体积为,故图为。
③装瓶后贴标签,在标签上填写氢氧化钠(或NaOH) 10%。
(2)①向饱和澄清石灰水中通入直至过量,二氧化碳和氢氧化钙先生成沉淀和水,碳酸钙和二氧化碳和水再转化为,碳酸氢钙易溶于水,故可观察到的现象是先产生白色浑浊,继续通二氧化碳,溶液又变澄清。
②向10%氢氧化钠溶液中通入CO2直至过量,二氧化碳和氢氧化钠反应先生成和水,二氧化碳和碳酸钠和水再转化为,碳酸氢钠溶解度较小,故可观察到的现象是一段时间后出现白色沉淀。
③设吸收4.4gCO2,需氢氧化钙的质量至少为x
吸收4.4gCO2,需饱和澄清石灰水的质量至少为
设需10%氢氧化钠溶液的质量至少为y
故需10%氢氧化钠溶液的质量至少为80g。
12. (2018广州中考)金属钴(Co)在国防工业中有重要应用。某矿石中含钻的氧化物(CoO、Co2O3)研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。
(1)写出下列化合物中Co元素的化合价:CoO_________,Co2O3______________。
(2)酸浸时钴的氧化物发生如下反应:
反应I CoO+H2SO4=CoSO4+H2O
反应Ⅱ 2Co2O3+4H2SO4=4CoSO4+O2↑+4H2O
反应Ⅲ Co2O3+2H2SO4+Na2SO3=2CoSO4+2H2O+Na2SO4
①反应后溶液中含钴元素的微粒是_________ (填化学符号)
②已知反应前矿石中CoO的质量为ag,Co2O3的质量为bg,则理论上可以生成CoSO4____g(用含a、b的式子表示)
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
编号 矿石用量(g) 硫酸用量(g) Na2SO3用量(g) 温度(℃) 钻元素浸出率(%)
1 85.71 12.62 0 85 56.39
2 85.71 6.31 0 85 49.98
3 85.71 6.31 0 65 43.33
4 85.71 6.31 0.43 65 73.95
5 85.71 6.31 0.86 65 74.77
①本实验研究了哪些因素对钴元素浸出率的影响__________________________________;
②根据上表数据,其他条件不变,温度升高,钴元素的浸出率___________________________;
③工业生产中采用实验______________(填编号)的提取条件更合理。
【答案】 (1). +2 (2). +3 (3). Co2+ (4). 155×(a/75 + b/83) (5). 硫酸用量、亚硫酸钠用量、温度 (6). 增大 (7). 4
【解析】
(1)单质中元素的化合价为零,化合物中元素的化合价代数和为零。化合物中氧元素的化合价为-2价, CoO中Co为+2价,Co2O3中Co为+3价;(2) ①由上述方程式可知,反应后钴元素以CoSO4存在于溶液中,所以溶液中含钴元素的微粒是Co2+;②设CoO生成CoSO4的质量为x,Co2O3生成CoSO4的质量为y,
CoO+H2SO4=CoSO4+H2O
75 155
ag x 75/ag=166/x x=155×ag÷75
2Co2O3+4H2SO 4=4CoSO4+O2↑+4H2O
332 155×4
bg y 332/bg= 155×4/y y= 155×4×bg÷332
则理论上可以生成CoSO4的质量为:155×(a/75 + b/83);
(3) ①由表格中数据可知,对钴元素浸出率产生影响的因素有硫酸用量、亚硫酸钠用量、温度;②根据上表数据,其他条件不变,温度升高,钴元素的浸出率增大;③工业生产中应采用实验4的方案,虽然实验5的方案中钴元素浸出率最高,但考虑到实验4中亚硫酸钠的使用量接近实验5方案中的一半,综合考虑选择实验4的方案。
13. (2018广州中考)室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃) 0 20 25 40 50 60 80
溶解度(g) 69.2 74.5 76.4 81.8 855 89.4 98.0
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
【答案】 (1). 17.1 (2). 搅拌 (3). A C (4).
【解析】
(1) ①溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。由表格中数据可知,50℃时,氯化铜的溶解度为85.5g,用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液, 需称取CuCl2的质量是17.1g;②将称取的CuCl2固体和20mL水倒入烧杯中,用玻璃棒搅拌,直至固体完全溶解;(2) A.由题中信息可知,氯化铜的溶解度受温度影响不大,可用蒸发结晶法提纯。收集母液于敞口容器中,用报纸包住容器口,防止落入其他物质,引入杂质,待水分自然蒸干(蒸发结晶)后保存所得固体,则不会有含铜离子的液体排放,不会导致污染,正确;B.向母液中加入适量AgNO3,充分反应后生成的沉淀是氯化银,过滤,滤渣干燥保存,滤液中仍然有铜离子,倒入下水道,仍会导致污染;C.向母液中加入适量NaOH,生成氢氧化铜沉淀和氯化钠,充分反应后过滤,滤渣干燥保存,滤液中只有氯化钠,没有铜离子,倒入下水道,不会因重金属导致污染;(3)由题中信息可知,25℃时氯化铜的溶解度为76.4g,100g母液中含有氯化铜的质量为x,76.4g/176.4g=x/100g x=100g×76.4g÷176.4g;若用铁粉置换出母液中的铜,设100g母液需要铁粉的质量至少是y,
CuCl2 + Fe = FeCl2 + Cu
135 56
y 135/=56/y
【1年模拟】
1. (2022广州从化区一模)我国自主研发的新冠疫苗,主要原料是胰蛋白酶,其中一种胰蛋白酶的化学式为C6H15O12P3,相对分子质量为372,对于该胰蛋白酶说法正确的是
A. 该胰蛋白酶是一种高分子化合物
B. 该胰蛋白酶由36种元素组成
C. 该胰蛋白酶中碳、氧元素质量比3:8
D. 该胰蛋白酶一个分子的质量为372g
【答案】C
【解析】
A、高分子化合物相对分子质量高达几万,该胰蛋白酶相对分子质量仅为372,所以不是高分子化合物,说法错误;
B、该胰蛋白酶由碳、氢、氧、氮四种元素组成,一个该胰蛋白酶分子由个原子构成,说法错误;
C、该该胰蛋白酶中碳、氧元素质量比为,说法正确;
D、相对原子质量有单位,不是“g”,是“1”,省略不写,该胰蛋白酶的相对分子质量为372,该胰蛋白酶一个分子的质量不等于372g,说法错误。
故选C。
2. (2022广州市天河区二模)广州早茶文化远近驰名。茶叶中含有茶氨酸(C7H14N2O3)、锌、硒等多种成分。下列说法不正确的是
A. 茶氨酸属于有机物,“锌、硒”指的是元素
B. 茶氨酸的相对分子质量为()g
C. 泡茶时茶香四溢,体现了分子是运动的
D. 用茶杯内的纱网可分离茶叶和茶水,利用的是过滤的原理
【答案】B
【解析】
A、茶氨酸含碳元素,属于有机物,这里的“锌、硒”不是以分子、原子、单质的形式存在,而是强调存在的元素,与具体形态无关,不符合题意;
B、茶氨酸的相对分子质量是:12×7+14+14×2+16×3,相对分子质量是一个比值,单位为“1”,不是“g”,符合题意;
C、泡茶时茶香四溢,说明分子在不断运动,引起香味的分子四处扩散,从而茶香四溢,不符合题意;
D、用茶杯内的纱网可分离茶叶和茶水,实现固液分离,利用的是过滤的原理,不符合题意。
故选B。
3.(2022广州越秀区一模)广东地区因气候等原因喜欢饮用凉茶,凉茶具有消热解毒、凉血利明功效,主要成分是黑芥子甙(C10H17NO9S2),可以预防感冒。下列有关说法正确的是( )
A.黑芥子甙中含有39个原子
B.黑芥子甙中的氮元素的质量分数最小
C.黑芥子甙在氧气中充分燃烧只生成CO2和H2O
D.黑芥子甙中碳、氧、硫元素的质量比为17:9:2
【答案】B
【解析】A、1个黑芥子甙分子是由10个碳原子、17个氢原子、1个氮原子、9个氧原子和2个硫原子构成的,则1个黑芥子甙分子中含有39个原子,故选项说法错误。
B、黑芥子甙中C、H、N、O、S的元素质量比为(12×10):(1×17):(14×1):(16×9):(32×2)=120:17:14:144:64,则黑芥子甙中的氮元素的质量分数最小,故选项说法正确。
C、由质量守恒定律,反应前后元素种类不变,黑芥子甙在氧气中充分燃烧不是只生成CO2和H2O,还生成含硫元素和氮元素的物质,故选项说法错误。
D、黑芥子甙中碳、氧、硫元素的质量比为(12×10):(16×9):(32×2)≠17:9:2,故选项说法错误。
故选:B。
4.(2022广州市天河区二模)阅读下列科普短文,回答问题。
2021年,考古学家利用碳-14断代法初步判定三星堆4号坑距今约3200至3000年。碳-14原子核中含6个质子与8个中子。生物死后体内的碳-14会不断衰变,碳-14原子核中1个中子变成1个质子,形成新的原子核。对比生物体内生前、死后碳-14的含量,可推算出其所属年代。
国家速滑馆利用CO2跨临界直冷制冰,就是将气态CO2通过加温加压形成超临界CO2流体(介于气态和液态之间的一种新的状态,兼有气体和液体的性质),后变为液态CO2,再变成气态完成制冰的过程。工业上可用CO2为原料合成燃料甲烷、甲醇(CH3OH),氮肥尿素等,合成尿素的反应:。
(1)碳-14原子核外电子数为_____________,其衰变形成的新原子属于___________元素(填元素符号)。
(2)超临界CO2流体是______(填“纯净物”“混合物”)。液态CO2能用于制冰的原因是________。
(3)甲醇充分燃烧的产物为______________。
(4)合成尿素时,参与反应的CO2与NH3的质量比为__________。尿素含氮量高,其氮元素的质量分数为_________(保留小数点后一位)。
【答案】(1) ①. 6 ②. N
(2) ①. 纯净物 ②. 液态二氧化碳汽化吸热,能使周围温度降低 (3)二氧化碳和水
(4) ①. 22:17 ②. 46.7%
【解析】
(1)碳-14原子核中含6个质子与8个中子,在原子中,质子数=核外电子数,故碳-14原子核外电子数为6;
生物死后体内的碳-14会不断衰变,碳-14原子核中1个中子变成1个质子,形成新的原子核,故新原子的质子数为7,质子数=原子序数,7号元素氮元素,故填:N;
(2)超临界CO2流体由同种物质组成,属于纯净物;
液态CO2能用于制冰的原因是:液态二氧化碳汽化吸热,能使周围温度降低;
(3)由化学式可知,甲醇由C、H、O三种元素组成, 根据质量守恒定律,化学反应前后,元素的种类不变,可得甲醇充分燃烧生成二氧化碳和水;
(4)由化学方程式可知,合成尿素时,参与反应的CO2与NH3的质量比为:44:(17×2)=22:17;
尿素中氮元素的质量分数为:。
5.(2022广州天河区一模)NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如图:下列说法正确的是( )
A.表示3个氢气分子
B.反应中元素的化合价都没有改变
C.参加反应的H2与生成的NH3分子个数比为1:2
D.生成物氨气是由N3﹣和H+构成
【答案】A
【解析】由微观反应示意图可知,该反应是由氮气与氢气在催化剂的作用下反应生成氨气,化学方程式为N2+3H22NH3。
A、由微观反应示意图以及分子结构模型可知,表示3个氢分子,选项说法正确;
B、由化学方程式可知,反应物是两种单质,而生成物是一种化合物,因此反应前后元素的化合价一定改变,选项说法错误;
C、由化学方程式可知,参加反应的H2与生成的NH3个数比为3:2,选项说法错误;
D、生成物氨气是由氨分子构成的,每个氨气分子是一个氮原子和3个氢原子构成的,选项说法错误。
故选:A。
6.(2022广州越秀区一模)科学家将温室气体CH4和CO2在Ni基双金属催化作用下转化为两种气体燃料,反应的微观示意图如图。下列分析不正确的是( )
A.该转化过程的最终产物为H2和CO
B.该转化有助于减少碳排放实现碳中和
C.反应过程中,CH4与CO分子数之比为1:1
D.反应过程中,CO2与CO的质量比为11:14
【答案】C
【解析】由微观图示可知,化学方程式为:CH4+CO22CO+2H2。
A、由微观反应示意图可知,该反应的最终产物是H2和CO,故A正确;
B、由化学方程式可知,该转化有助于减少碳排放实现碳中和,故B正确;
C、由化学方程式可知,反应过程中,CH4与CO分子数之比为1:2,故C错误;
D、反应过程中,CO2与CO的质量比为44:(28×2)=11:14,故D正确。
故选:C。
7.(2022广州越秀区一模)SCR催化技术利用NH3与NO2反应,能有效降低柴油发动机工作时的氮氧化物排放量,示意图如图。下列有关该反应的说法正确的是( )
A.反应生成了氧气和水
B.反应前后分子总数不变
C.两种生成物的质量比为12:7
D.NH3与NO2按分子个数比4:3进行反应
【答案】D
【解析】由反应的示意图可知,反应的方程式是:8NH3+6NO27N2+12H2O。
A、由物质的变化可知,反应生成了氮气和水,故A错误;
B、由方程式的意义可知,每14个分子变化成了19个分子,反应前后分子总数增多了,故B错误;
C、由方程式的意义可知,两种生成物的质量比为(28×7):(18×12)=49:54,故C错误;
D、由方程式的意义可知,NH3与NO2按分子个数比8:6=4:3进行反应,故D正确。
故选:D。
8.(2022广州黄埔区一模)科学家发现,可以将树木纤维素转变成超级储能装置。如图是该反应的微观示意图,下列说法不正确的是( )
A.该反应属于置换反应
B.反应生成的Z、W两种物质的分子个数比为1:1
C.该反应前后原子的种类、数目均保持不变
D.参加反应的X、Y的质量总和等于生成的Z、W的质量总和
【答案】B
【解析】由反应的微观示意图可知,该反应是碳和氨气在催化剂和高温条件下反应生成了氮气和甲烷,反应的方程式是:3C+4NH32N2+3CH4。
A、该反应由一种单质和一种化合物反应,生成了另一种单质和另一种化合物,属于置换反应,故A正确;
B、由化学方程式可知,反应生成的Z、W两种物质的分子个数比为2:3,故B错误;
C、由微粒的变化可知,该反应前后原子的种类、个数均保持不变,故C正确;
D、由质量守恒定律可知,参加反应的X、Y的质量总和等于生成的Z、W的质量总和,故D正确。
故选:B。
9.(2022广州市黄埔区一模)“侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3═NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是
A. 0℃时,NH4Cl的溶解度大于NaCl的溶解度
B. 20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数
C. 20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出
D. NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl
【答案】D
【解析】
根据固体的溶解度曲线可以知道:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性;②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。根据题目信息和溶解度曲线可知:氯化铵、氯化钠、碳酸氢钠三种固体物质的溶解度,都是随温度升高而增大,而氯化钠的溶解度随温度的升高变化比较小。
A、由溶解度曲线可知,0℃时,NH4Cl的溶解度小于NaCl的溶解度,故A选项错误;
B、因为20℃时,NH4Cl的溶解度大于NaHCO3的溶解度,所以20℃时,NaHCO3饱和溶液中溶质的质量分数不一定大于NH4Cl不饱和溶液中溶质的质量分数,故B选项错误;
C、20℃时,NaHCO3的溶解度是9.6g,即在该温度下,100g水中最多溶解9.6gNaHCO3,,由化学反应方程式中的信息可知,5.85g NaCl和7.9g NH4HCO3反应能生成8.4gNaHCO3,所以20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,得到NaHCO3的不饱和溶液,不能析出NaHCO3晶体,故C选项错误;
D、NH4Cl溶解度受温度影响较大,NaCl的溶解度受温度影响较小,所以NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl,故D选项正确。
故选D。
10.(2022广州市天河区二模)某化工厂利用软锰矿(主要成分为MnO2,含有少量Al2O3、MgO、SiO2等杂质)脱除燃煤烟气中的SO2,同时制得在电子工业有重要应用的MnCO3.工艺流程如下:
已知:①“脱硫浸锰”时主要发生的反应有。
②NH4F易溶于水。
(1)“脱硫浸锰”时,MgO与硫酸反应的化学方程式为_________________。
(2)“除铝”时,加入氨水后溶液的pH_______________(填“变大”“不变”“变小”)。
(3)若“除镁”“沉锰”时均发生复分解反应,则“除镁”发生的化学方程式为_______,“沉锰”加入的X溶液中一定含有的主要离子有_________(填离子符号)。
(4)若制得1250t含杂质8%的MnCO3粗产品,理论上需要含MnO287%的软锰矿的质量为_____t(不考虑流程中的损耗)。
【答案】(1) (2)变大 (3)
①. ②. (4)1000
【解析】
软锰矿加入硫酸、含硫烟气,二氧化硅不反应被分离出来,锰、铝、镁转化为相应的盐溶液,滤液加入氨水去除铝元素、加入氟化铵除去镁元素,过滤得到滤液加入碳酸盐得到碳酸锰粗品;
(1)氧化镁和硫酸反应生成硫酸镁和水,;
(2)pH>7显碱性,pH=7显中性,pH<7显酸性;pH值越大碱性越强,pH值越小酸性越强。氨水溶液显碱性,加入氨水后溶液的pH变大;
(3)两种化合物交换成分生成另外两种化合物的反应,属于复分解反应,“除镁”发生的反应为硫酸镁和氟化铵生成氟化镁沉淀和硫酸铵,;“沉锰”反应得到碳酸锰沉淀,则加入的X溶液中一定含有的主要离子有碳酸根离子;
(4)根据质量守恒定律,反应前后锰元素质量不变,则制得1250t含杂质8%的MnCO3粗产品,理论上需要含MnO287%的软锰矿的质量为=1000t。
11. (2022广州从化区一模)某同学进行H2O2溶液制备O2的实验探究。回答下列问题:
(1)向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
①写出用H2O2溶液制取O2的化学方程式:_____________________。
②用上述反应原理制备并收集一瓶干燥的O2,从上述装置中选择并组装一套装置,其连接顺序为_______→_______→_______(填编号)。
③实验室制取二氧化碳的发生装置和收集装置应选_______(填编号);若要制取88g的二氧化碳,需要10%的稀盐酸_______g。
(2)向5mL5%的H2O2溶液中加入2滴一定浓度的FeCl3溶液,立即产生大量气泡。某同学设计下列实验探究哪种微粒对H2O2溶液的分解起催化作用。
实验 H2O2溶液 加入溶液 实验现象
① 5mL5% 2滴NaCl溶液 无明显变化
② 5mL5% 2滴Na2SO4溶液 无明显变化
③ 5mL5% 2滴Fe2(SO4)3溶液 立即产生大量气泡
从上述实验现象,得出对H2O2溶液分解起催化作用的微粒是_______(填离于符号)。从循环利用的角度分析,MnO2和FeCl3溶液两种催化剂,_______更适合作为该反应的催化剂。
【答案】(1) ①. ②. B ③. C ④. E ⑤. BE ⑥. 1460
(2) ①. ②. MnO2或二氧化锰
【解析】
(1)①过氧化氢在二氧化锰催化作用下,生成水和氧气,反应的化学方程式为,故填:;
②用H2O2溶液制取并收集一瓶干燥的O2,发生装置选择固液不加热型(B),用浓硫酸干燥(C),因为二氧化碳密度比空气大,能溶于水且与水反应,收集装置选择向上排空气法(E),故其连接顺序为B→C→E,故填:B;C;E;
③实验室用石灰石和稀盐酸制取二氧化碳,发生装置为固液不加热型(B),收集装置为向上排空气法(E);
解:设若要制取88g的二氧化碳,需要10%的稀盐酸溶质的质量为x。
6
x=146g
故需要需要10%的稀盐酸溶质的质量为
(2)①②说明钠离子、氯离子、硫酸根离子,都不能催化过氧化氢分解,由③可知,铁离子能催化过氧化氢的分解,从循环利用的角度分析,MnO2和FeCl3溶液两种催化剂,因为二氧化锰不溶于水,可以通过溶解、过滤、洗涤、干燥进行回收,循环利用,故填:;MnO2(或二氧化锰)。
12.(2022广州市增城区二模)氧气是供给呼吸的重要物质,制取氧气的方法有很多种。
仪器的名称是 ______。
过氧化钠是一种淡黄色固体,是航空航天、潜水艇的供氧剂。常温下与水反应制取氧气,选择的发生装置是 ______填标号。检验该装置气密性的操作方法:首先夹紧弹簧夹,再 ____________,观察到 ________________________,证明气密性良好。
某兴趣小组在实验室用作催化剂分解制取氧气。
制取氧气的化学方程式是 ______________________________。
完全反应后要对固体剩余物进行回收。向固体剩余物中加入一定质量的的水,充分搅拌、静置、过滤。将滤渣洗涤、干燥、得到的黑色固体是 ______;蒸干滤液,可得氯化钾;需要称取的质量是 ______。
查阅资料可知:氯化钾在的溶解度是。为了能全部回收氯化钾,并最大限度节省能源,向上述完全反应后的固体剩余物中加入水的质量是 ______。
【答案】锥形瓶 向长颈漏斗中注入一定量的水,形成一段水柱 水柱的高度差在一段时间内保持不变 二氧化锰
【解析】解:仪器的名称是锥形瓶;
过氧化钠和水在常温下制取氧气,属于固、液常温型,适合用装置作发生装置;检验该装置气密性的操作方法:首先夹紧弹簧夹,再向长颈漏斗中注入一定量的水,形成一段水柱,观察到水柱的高度差在一段时间内保持不变,证明气密性良好;
氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,反应的化学方程式为:;
二氧化锰是该反应的催化剂,反应前后质量和化学性质都不变,且不溶于水,反应生成的氯化钾溶于水,所以将滤渣洗涤、干燥、得到的黑色固体是二氧化锰;设称取氯化钾的质量为。
设加入水的质量为。
故答案为:
锥形瓶;
;向长颈漏斗中注入一定量的水,形成一段水柱;水柱的高度差在一段时间内保持不变;
;
二氧化锰;;
。
13. (2022广州市海珠区一模)实验室模拟工业上用某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4·7H2O,流程如下:
(1)“酸浸”过程中:
①有MnSO4生成,MnSO4在水溶液中解离出的阳离子是_______ (填离子符号)。
②MnCO3与H2SO4反应的化学方程式为________________________。
(2)“转化”时的主要反应是:NaClO+MnSO4+H2O=MnO2↓+H2SO4+X,X的化学式为_______。
(3)“过滤2”所得滤液中能分离出一种可循环使用的物质,该物质是_______(填化学式)。
(4)“操作1”中包括蒸发浓缩等一系列操作,蒸发浓缩时需要用到的仪器有铁架台、铁圈、酒精灯、玻璃棒和_______。
(5)若用10kg菱镁矿石可制得24.6kgMgSO4·7H2O (相对分子质量为246),则菱镁矿石中MgCO3的质量分数为_______。
【答案】(1) ①. Mn2+ ②. MnCO3+H2SO4=MnSO4+H2O+CO2↑
(2)NaCl (3)H2SO4 (4)蒸发皿 (5)84%
【解析】
(1)MnSO4在水溶液中解离出Mn2+和,Mn2+ 是阳离子,故①填 Mn2+ ;MnCO3与H2SO4反应生成硫酸锰、水和二氧化碳气体,故化学方程式②填MnCO3+H2SO4=MnSO4+H2O+CO2↑;
(2)“转化”时的主要反应是:NaClO+MnSO4+H2O=MnO2↓+H2SO4+X,根据质量守恒定律,反应前后原子个数相等,反应前,Na 1个,Cl 1个,S 1个,Mn 1个,H 2个,O 6个;反应后,Mn 1个,S 1个,H 2个,O 6个,则X中有Na 1个,Cl 1个,故化学式为NaCl ;
(3)“过滤2”所得滤液中能分离出一种可循环使用的物质,该物质是硫酸,化学式是H2SO4 ;
(4)“操作1”中包括蒸发浓缩等一系列操作,蒸发浓缩时需要用到的仪器有铁架台、铁圈、酒精灯、玻璃棒和蒸发皿;
(5)在24.6kgMgSO4·7H2O 中Mg的质量=24.6kg××100%=2.4kg,反应前后Mg的质量相等,则MgCO3 的质量=2.4kg÷×100%= 8.4kg,故10kg菱镁矿石中MgCO3的质量分数=×100%=84% 。
14. (2022广州市番禺区一模)金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,Co元素常见的化合价为+2和+3。金属Co与酸反应后显+2,Co元素常见的化合物相关性质如下:
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
(1)根据金属化学性质的一般规律。下列预测合理的是___________。
A. 钴能够与氢氧化钠溶液反应
B. H2或者CO能够将钴的氧化物转化为金属钴
C. 钴能够与盐酸或者稀硫酸反应
D. 硫酸钴溶液中的硫酸锌可以加入钴粉除去
(2)碳酸钴(CoCO3)是一种难溶于水的粉红色固体,结合所学知识预测,CoCO3能与____(填物质类别)反应,验证预测的实验操作和预期现象是:取CoCO3固体于试管中_______。
(3)依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。.
限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
实验步骤 预期反应的化学方程式 预期反应的实验现象
__________________________ __________________________ __________________
___________________________ __________________________ __________________
(4)从含钴的矿石中提取钴的工艺过程一般是会先用足量的酸进行酸浸,酸浸时,钴的氧化物发生如下反应:
反应I:CoO + H2SO4 =CoSO4 +H2O
反应II:2Co2O3 + 4H2SO4 =4CoSO4 +4H2O +O2↑
反应III:Co2O3 +Na2SO3+2H2SO4 =2CoSO4 +2H2O +Na2SO4
①反应后溶液中含钴元素的微粒是:___________(填化学符号)。
②已知,反应前含有CoO和Co2O3 的矿石(矿石中钴元素的质量分数为59%)的质量为b g 则理论上可以生成CoSO4的质量为________________________(用含b的式子表示)。
【答案】(1)BC (2) ①. 酸 ②. 加入稀盐酸,有气泡产生,溶液变为粉红色
(3) ①. 在试管中取少量钴粉,加入适量稀硫酸 ②.
③. 有气泡生成
④. 再继续加入碳酸钠溶液 ⑤.
⑥. 有粉红色沉淀生成
(4) ①. Co2+ ②. 1.55b g
【解析】
(1)A、活动性在氢前的金属能与酸反应,不与碱溶液反应,故A错误;
B、H2或者CO具有还原性,能够将钴的氧化物转化为金属钴,故B正确;
C、金属钴(Co)是一种“氢前金属”,能够与盐酸或者稀硫酸反应,故C正确;
D、金属钴的金属活动性介于Zn和Cu之间,所以钴和硫酸锌不反应,故D错误;
故选BC;
(2)碳酸钴属于碳酸盐,能与酸反应,生成对应的盐、水和二氧化碳;验证方法:取CoCO3固体于试管中,加入稀盐酸,有气泡产生,溶液变为粉红色;
(3)实验步骤:1.在试管中取少量钴粉,加入适量稀硫酸,钴与硫酸反应生成硫酸钴和氢气,化学方程式为:,能观察到有气泡生成;
2.再继续加入碳酸钠溶液,碳酸钠与硫酸钴反应生成碳酸钴沉淀和硫酸钠,化学方程式为:,能观察到有粉红色沉淀生成;
(4)①根据三个反应的化学方程式可看出,反应后生成CoSO4,溶液中存在Co2+;
②根据质量守恒定律,矿石中钴元素的质量=CoSO4中钴元素的质量=,则生成CoSO4的质量为=1.55b g。
15. (2022广州市白云区一模)N是空气中含量最高的元素。
(1)将含N物质进行分类,按要求写出化学式
单质 引起酸雨的氧化物 酸 含氮的不同化合价的盐
N2 ______________ HNO3 _______________
(2)镓元素的信息如图。
请设计理论上制备硝酸镓的三种方案(要求含镓原料分别属于不同的化合物类别)
方案 预期反应的化学方程式
① _________________________
② __________________________
③ __________________________
(3)若硫酸铝铵晶体【NH4Al(SO4)2】·12H2O,相对分子质量453】
①加热过程中,其质量随时间的变化如图所示。据此判断,从200℃到50℃间固体是否还存在结晶水,并作出解释。_______(是或否),____________________________。
②写出一个能与硫酸铝溶液发生反应的原子团_______。(写离子符号)
【答案】(1) ①. NO2 ②. NH4NO3
(2) ①. Ga2O3+6HNO3=2Ga(NO3)3+3H2O ②. Ga(OH)3+3HNO3=Ga(NO3)3+3H2O ③. Ga+3AgNO3=Ga(NO3)3+3Ag
(3) ①. 是 ②. 结晶水质量,结晶水完全失去固体质量4.53g-2.16g=2.37g,200℃固体质量2.46g>2.37g ③. OH-
【解析】
(1)二氧化氮和水生成硝酸,能引起酸雨,硝酸铵属于盐,硝酸铵中氮元素既有-3价,又有+5价,故填:NO2;NH4NO3。
(2)镓和硝酸银生成硝酸镓和银,氧化镓和硝酸生成硝酸镓和水,氢氧化镓和硝酸生成硝酸镓和水,故填:Ga2O3+6HNO3=2Ga(NO3)3+3H2O;Ga(OH)3+3HNO3=Ga(NO3)3+3H2O;Ga+3AgNO3=Ga(NO3)3+3Ag。
(3)①硫酸铝铵晶体【NH4Al(SO4)2】·12H2O中结晶水质量,结晶水完全失去质量4.53g-2.16g=2.37g,200℃固体质量2.46g>2.37g,说明固体还含有结晶水,故填:是;结晶水质量,结晶水完全失去质量4.53g-2.16g=2.37g,200℃固体质量2.46g>2.37g。
②铵根离子、铝离子和氢氧根离子不共存,能反应,故填:OH-。
16. (2022广州黄埔区二模)某热电厂用脱硫得到的石膏(CaSO4·2H2O)生产K2SO4肥料的流程如图:
已知:不同温度下,硫酸钾在水溶液、氨溶液中的溶解度:
温度(℃) 0 10 25
水溶液 6.815 8.496 9.937
氨(8%)溶液 1.387 1.558 2.198
氨(35%)溶液 0.442 0.742 0.813
(1)在“脱硫”反应中,将CaCO3粉碎后与水混合成悬浊液的目的是___________。
(2)脱硫过程的化学方程式为:___________。
(3)石膏与饱和(NH4)2CO3溶液相混合发生反应Ⅰ,反应基本类型为___________。
(4)“操作I”的名称是___________。
(5)你认为反应Ⅱ在常温下能实现的原因是___________。
(6)CaSO4·2H2O受热会逐步失去结晶水。取纯净CaSO4·2H2O固体3.44g,进行加热,测定固体质量随温度的变化情况如图所示。CaSO4·2H2O相对分子质量为172。
H点的固体在T2~1400℃范围内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,写出发生反应的化学方程式___________。
【答案】(1)增大反应物的接触面积,加快反应速率
(2)CO2 (3)复分解反应
(4)过滤 (5)硫酸钾在浓氨水中溶解度较小,首先到达饱和结晶析出得到硫酸钾固体
(6)
【解析】
由流程可知,含二氧化硫的烟气加入空气和碳酸钙脱硫后得到石膏,加入碳酸铵溶液得到碳酸钙沉淀和硫酸铵,过滤除去沉淀,得到滤液加入氯化钾和浓氨水得到氯化铵和硫酸钾;
(1)将CaCO3粉碎后与水混合成悬浊液的目的是增大反应物的接触面积,加快反应速率;
(2)根据质量守恒定律,反应前后原子数目种类不变,反应前钙、碳、氧、硫、氢原子数目分别为2、2、16、2、8,反应后钙、碳、氧、硫、氢原子数目分别为2、0、12、2、8,故空格处填:CO2;
(3)已知,石膏为CaSO4·2H2O,石膏与饱和(NH4)2CO3溶液相混合发生反应Ⅰ生成碳酸钙沉淀和硫酸铵,反应是两种化合物交换成分生成另外两种化合物的反应,属于复分解反应;
(4)“操作I”是分离固液的操作,名称是过滤;
(5)由溶解度图表可知,反应Ⅱ在常温下能实现的原因是硫酸钾在浓氨水中溶解度较小,首先到达饱和结晶析出得到硫酸钾固体;
(6)已知,CaSO4·2H2O受热会逐步失去结晶水。如果纯净CaSO4·2H2O固体3.44g全部失去结晶水后得到固体质量为,故H为CaSO4固体;
H点的固体在T2~1400℃范围内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,根据质量守恒定律可知,反应前后元素种类不变,刺激性气味气体为二氧化硫,硫元素化合价在反应后降低,那么应该有元素化合价升高,则另一种气体为氧气,故反应分解生成氧化钙、氧气、二氧化硫,化学方程式为。
17. (2022广州黄埔区二模)向一支装有少量CuO的试管中依次加入下列物质,实验操作如图所示,回答下列问题。
(1)图A实验中加入过量稀H2SO4后,观察到的现象___________。
(2)图B发生反应的化学方程式___________。
(3)如图D,向图C实验后所得溶液中插入新打磨的铝丝,画出图中溶液中一定存在的微观粒子_________。(微粒数目不做要求,不考虑空气、水)。
(4)实验开始时放入试管的CuO质量为4g,则实验最后取出的铝丝最多能增重___________g。
【答案】(1)固体逐渐溶解,无色溶液变为蓝色
(2)、
(3) (4)2.3
【解析】
(1)硫酸和氧化铜能反应生成硫酸铜和水,反应的化学反应方程式为:,A中加入过量硫酸后,观察到的现象固体逐渐溶解,无色溶液变为蓝色;
(2)B中加入过量的氢氧化钠后,氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠,反应的化学方程式为:,过量的硫酸与氢氧化钠反应生成硫酸钠和水,反应的化学方程式为:;
(3)A中加入过量硫酸后,氧化铜和硫酸反应生成硫酸铜和水;B中加入过量的氢氧化钠后,氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠,氢氧化钠和硫酸反应生成硫酸钠和水;图C实验中加入过量稀硫酸后,硫酸与过量的氢氧化钠反应生成硫酸钠和水,硫酸与氢氧化铜反应生成硫酸铜和水,因此C反应停止后,所得溶液中含有的溶质是硫酸、硫酸钠和硫酸铜。
向图C实验后所得溶液中插入新打磨的铝丝,铝和硫酸反应生成硫酸铝和氢气,铝和硫酸铜反应生成铜和硫酸铝,因此溶液中一定含有硫酸钠,硫酸铝,溶液中一定存在的微观粒子是钠离子、铝离子、硫酸根离子,图像为 。
(4)因求实验最后取出的铝丝最多能增重多少,所以假设过量的硫酸的质量无限接近于0,硫酸消耗铝的质量忽略不计。
设反应生成的硫酸铜的质量为x,析出铜的质量为y,消耗铝的质量为z
x=8g
y=3.2g,z=0.9g
则实验最后取出的铝丝最多能增重3.2g-0.9g=2.3g。
18. (2022广州市天河区二模)气体的制取实验是初中化学学习的重要内容。
(1)下列制取气体的实验,发生装置可选用甲的是____________(填字母)。
A. 二氧化锰与浓盐酸加热制取Cl2 B. 锌和稀硫酸制取H2
C. 块状硫化亚铁(FeS)和稀硫酸制取H2S D. 高锰酸钾制取O2
(2)某同学阅读课外资料得知:双氧水分解制取氧气除了用二氧化锰,还可以用氧化铜作催化剂,于是进行了以下实验探究:
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?
【设计实验】以收集到30mL氧气为标准,设计了下列两组实验(其他可能影响实验的因素均忽略)。
实验序号 氯酸钾的质量 其他物质及其质量 待测数据
甲 2.45g /
乙 2.45g CuO0.5g
①上述实验应测量的“待测数据”是_________。
【实验结论】
②实验甲比乙的“待测数据”更________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。实验乙中反应的化学方程式为_______,氯酸钾完全分解后,试管中剩余固体的质量为_______g。
【答案】 ①. D ②. 收集30mL氧气所需要的时间 ③. 大 ④. ⑤. 1.99
【解析】
(1)装置甲为固体加热反应;
A、二氧化锰与浓盐酸加热制取Cl2为固液加热反应,错误;
B、锌和稀硫酸制取H2为固液不加热反应,错误;
C、块状硫化亚铁(FeS)和稀硫酸制取H2S为固液不加热反应,错误;
D、高锰酸钾制取O2为固体加热反应,正确;
故选D;
(2)设计实验:
①催化剂改变反应速率,以收集到30mL氧气为标准,探究氧化铜是否也能作氯酸钾分解的催化剂;则应测量的“待测数据”是收集30mL氧气所需要的时间;
实验结论:
②实验甲没有加入氧化铜,则甲比乙的“待测数据”更大,甲中反应速率更慢,说明氧化铜能加快氯酸钾的分解速率。实验乙中反应为氯酸钾在氧化铜催化作用下加热生成氯化钾和氧气:;
由化学方程式体现的质量关系可知,氯酸钾完全分解后,生成氯化钾质量为1.49g,催化剂氧化铜质量反应前后不变,故试管中剩余固体质量为1.49g+0.5g=1.99g。
专题11 计算题
【5年中考】
1. (2022广州市中考)酚酞(C20H14O4)是常见的酸碱指示剂。下列关于酚酞的说法正确的是
A. 属于无机化合物
B. 相对分子质量为(12×20+1×14+16×4)g
C. C、H、O三种元素的质量比为(12×20):(1×14):(16×4)
D. 碳元素的质量分数为×100%
2.(2021广州中考)纤维素是棉花的主要成分,其化学式为(C6H10O5)n(n约为103~104)。下列关于纤维素的说法正确的是
A.属于无机化合物
B.相对分子质量为(12×6+1×10+16×5)
C.C、H、O三种元素的质量比为6:10:5
D.氧元素的质量分数为×100%
3. (2020广州中考)尿素是氮肥中最主要的一种,其化学式为CO(NH2)2。下列关于尿素的说法正确的是
A. CO(NH2)2中含有的原子是(NH2)2
B. C、O、N、H四种原子的个数比为1:1:1:4
C. 氮元素的质量分数为
D. C、O、N、H四种元素的质量比为12:16:14:1
4. (2019广州中考)从地沟油中提炼生物柴油是垃圾资源化的方法之一。生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是
A. C、H、O三种元素的质量比为19:38:2
B. 相对分子质量为(12×19+1×38+16×2)
C. C、H、O三种原子的个数比为12:1:16
D. 氧元素的质量分数为×100%
5. (2018广州中考)碳酸乙烯酯(C3H4O3)可用作锂电池电解液,下列有关碳酸乙烯酯的说法正确的是
A. 碳酸乙烯酯的相对分子质量为(12×3+1×4+16×3)g
B. 碳酸乙烯酯中C、H、O三种元素的质量比为12:1:16
C. 碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3
D. 碳酸乙烯酯中碳元素的质量分数=×100%
6. (2022广州中考)二甲基亚砜(DMSO)工业废渣含NaNO3及少量有毒的NaNO2,以该废渣为原料制备农用KNO3,既实现资源回收利用又保护了环境。工艺流程如下:
(1)农用KNO3为农作物提供的营养元素有_______。
(2)步骤1的作用是除去NaNO2,NaNO2中氮元素的化合价为_______。
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出NaCl固体,原因是_____________________。
(4)步骤4的操作是_______、过滤。
(5)KCl用量的估算依据是 (填标号)。
A. KCl与NaNO3的粒子个数比为1:1
B. KCl与NaNO3的质量比为1:1
C. KCl与NaNO3在溶液中的质量分数之比为1:1
(6)该工艺所得农用KNO3混有一定量NaCl。取25g样品加足量水溶解,向溶液中加入足量的AgNO3溶液,生成沉淀的质为14.35g,则样品中杂质NaCl的质量是_____g,样品含KNO3_______%(质量分数)。
(相对分子质量:KNO3-101 NaCl-58.5 AgNO3-170 AgCl-143.5)
7. (2020广州中考)盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。
(1)用质量分数为37%的浓盐酸配制1000g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为________g,所需浓盐酸的质量为________g。
②已知浓盐酸密度为1.19g/cm3,量取上述所需浓盐酸用到的仪器是_______(填标号)。
A 10mL量筒
B 50mL量筒
C 试管
D 胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在__________上。
(2)取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是_________________。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为________________。
②下列示意图中,与实验结果相符的是_________(填标号)。
8.(2022广州市中考)某校学生用盐酸和碳酸钙制备CO2,产生了大量废液。兴趣小组通过以下探究确定废液处理方案。
(1)废液成分的确定
①写出制备CO2的化学方程式_____________________。
②推测废液所含溶质
推测一:______________ 推测二:CaCl2和HCl
③若要用一种药品验证哪种推测成立,可选择的有哪些?_______(填标号)
A.石蕊溶液 B.AgNO3溶液 C.锌粒 D.CuO粉末
(2)废液的处理
实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3除去它们。
【提出问题】如何估算Na2CO3固休的用量?
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。
【结果讨论】
①a→b阶段,观察到烧杯中的现象是_______。
②b点后曲线平缓阶段,反应的化学方程式为_______。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积_______120mL。(填“大于”“等于”或“小于”)
④将烧杯中的沉淀过滤、干燥、称重,质量为4g。若处理10L该废液,理论上需要Na2CO3固体___g。(实验所用Na2CO3溶液的密度近似看做1g/cm3)
9.(2021广州中考)某校学生利用以下两个实验探究酸的性质。
(1)试管A中溶液变浑浊的反应是___________________________________(写化学方程式)。
(2)试管B中铁钉变得光亮且表面有气泡生成,溶液呈黄色,将此时溶液中和液面上方存在的微观粒子的种类在图中补充完整(粒子数目不作要求;不考虑空气、水)。
(3)将所有学生完成上述两个实验产生的废液收集并处理,向该废液中加入适量Na2CO3, 除去钙、铁元素和过量的酸,可观察到:①________________,②产生大量沉淀。静置过滤得到无色溶液,经检测pH约为7,取样滴加__________溶液,无明显现象,钙已除尽。
(4)若处理废液时共消耗Na2CO3212g,则实验室为本次探究实验至少准备了_________g盐酸。(已知盐酸的质量分数为7.3%)
10. (2020广州中考)某工厂生产硼砂产生的固体废料,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3质量分数为63%。回收镁的工艺流程如下:
(1)“酸浸”时MgCO3发生反应的化学方程式为_________。
(2)“调pH”前滤液I的pH________7(填“>”或“<”)。
(3)滤液Ⅲ中可回收的主要物质________(填化学式)。
(4)已知固体废料质量为m,理论上可生产Mg(OH)2的质量为______。
(5)某BaCO3中混有SiO2杂质,简述提纯该BaCO3的实验操作:_________________________________。
11. (2019广州中考)实验室配制饱和澄清石灰水和质量分数为10%氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 Ca(OH)2 NaOH CaCO3 Ca(HCO3)2 Na2CO3 NaHCO3
溶解度/g 0.16 109 0.0065 16.6 21.8 9.6
(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体—量取水—溶解—装瓶贴标签。
①称取氢氧化钠固体的质量_____________g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,_______画出水的液面。
③装瓶后贴标签,在标签上填写:_______________________________。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是________________________________。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是_______________________________________________________。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为___________g,或需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到个位)
12. (2018广州中考)金属钴(Co)在国防工业中有重要应用。某矿石中含钻的氧化物(CoO、Co2O3)研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。
(1)写出下列化合物中Co元素的化合价:CoO_________,Co2O3______________。
(2)酸浸时钴的氧化物发生如下反应:
反应I CoO+H2SO4=CoSO4+H2O
反应Ⅱ 2Co2O3+4H2SO4=4CoSO4+O2↑+4H2O
反应Ⅲ Co2O3+2H2SO4+Na2SO3=2CoSO4+2H2O+Na2SO4
①反应后溶液中含钴元素的微粒是_________ (填化学符号)
②已知反应前矿石中CoO的质量为ag,Co2O3的质量为bg,则理论上可以生成CoSO4____g(用含a、b的式子表示)
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
编号 矿石用量(g) 硫酸用量(g) Na2SO3用量(g) 温度(℃) 钻元素浸出率(%)
1 85.71 12.62 0 85 56.39
2 85.71 6.31 0 85 49.98
3 85.71 6.31 0 65 43.33
4 85.71 6.31 0.43 65 73.95
5 85.71 6.31 0.86 65 74.77
①本实验研究了哪些因素对钴元素浸出率的影响__________________________________;
②根据上表数据,其他条件不变,温度升高,钴元素的浸出率___________________________;
③工业生产中采用实验______________(填编号)的提取条件更合理。
13. (2018广州中考)室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃) 0 20 25 40 50 60 80
溶解度(g) 69.2 74.5 76.4 81.8 855 89.4 98.0
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
【1年模拟】
1. (2022广州从化区一模)我国自主研发的新冠疫苗,主要原料是胰蛋白酶,其中一种胰蛋白酶的化学式为C6H15O12P3,相对分子质量为372,对于该胰蛋白酶说法正确的是
A. 该胰蛋白酶是一种高分子化合物
B. 该胰蛋白酶由36种元素组成
C. 该胰蛋白酶中碳、氧元素质量比3:8
D. 该胰蛋白酶一个分子的质量为372g
2. (2022广州市天河区二模)广州早茶文化远近驰名。茶叶中含有茶氨酸(C7H14N2O3)、锌、硒等多种成分。下列说法不正确的是
A. 茶氨酸属于有机物,“锌、硒”指的是元素
B. 茶氨酸的相对分子质量为()g
C. 泡茶时茶香四溢,体现了分子是运动的
D. 用茶杯内的纱网可分离茶叶和茶水,利用的是过滤的原理
3.(2022广州越秀区一模)广东地区因气候等原因喜欢饮用凉茶,凉茶具有消热解毒、凉血利明功效,主要成分是黑芥子甙(C10H17NO9S2),可以预防感冒。下列有关说法正确的是( )
A.黑芥子甙中含有39个原子
B.黑芥子甙中的氮元素的质量分数最小
C.黑芥子甙在氧气中充分燃烧只生成CO2和H2O
D.黑芥子甙中碳、氧、硫元素的质量比为17:9:2
4.(2022广州市天河区二模)阅读下列科普短文,回答问题。
2021年,考古学家利用碳-14断代法初步判定三星堆4号坑距今约3200至3000年。碳-14原子核中含6个质子与8个中子。生物死后体内的碳-14会不断衰变,碳-14原子核中1个中子变成1个质子,形成新的原子核。对比生物体内生前、死后碳-14的含量,可推算出其所属年代。
国家速滑馆利用CO2跨临界直冷制冰,就是将气态CO2通过加温加压形成超临界CO2流体(介于气态和液态之间的一种新的状态,兼有气体和液体的性质),后变为液态CO2,再变成气态完成制冰的过程。工业上可用CO2为原料合成燃料甲烷、甲醇(CH3OH),氮肥尿素等,合成尿素的反应:。
(1)碳-14原子核外电子数为_____________,其衰变形成的新原子属于___________元素(填元素符号)。
(2)超临界CO2流体是______(填“纯净物”“混合物”)。液态CO2能用于制冰的原因是________。
(3)甲醇充分燃烧的产物为______________。
(4)合成尿素时,参与反应的CO2与NH3的质量比为__________。尿素含氮量高,其氮元素的质量分数为_________(保留小数点后一位)。
5.(2022广州天河区一模)NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如图:下列说法正确的是( )
A.表示3个氢气分子
B.反应中元素的化合价都没有改变
C.参加反应的H2与生成的NH3分子个数比为1:2
D.生成物氨气是由N3﹣和H+构成
6.(2022广州越秀区一模)科学家将温室气体CH4和CO2在Ni基双金属催化作用下转化为两种气体燃料,反应的微观示意图如图。下列分析不正确的是( )
A.该转化过程的最终产物为H2和CO
B.该转化有助于减少碳排放实现碳中和
C.反应过程中,CH4与CO分子数之比为1:1
D.反应过程中,CO2与CO的质量比为11:14
7.(2022广州越秀区一模)SCR催化技术利用NH3与NO2反应,能有效降低柴油发动机工作时的氮氧化物排放量,示意图如图。下列有关该反应的说法正确的是( )
A.反应生成了氧气和水
B.反应前后分子总数不变
C.两种生成物的质量比为12:7
D.NH3与NO2按分子个数比4:3进行反应
8.(2022广州黄埔区一模)科学家发现,可以将树木纤维素转变成超级储能装置。如图是该反应的微观示意图,下列说法不正确的是( )
A.该反应属于置换反应
B.反应生成的Z、W两种物质的分子个数比为1:1
C.该反应前后原子的种类、数目均保持不变
D.参加反应的X、Y的质量总和等于生成的Z、W的质量总和
9.(2022广州市黄埔区一模)“侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3═NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是
A. 0℃时,NH4Cl的溶解度大于NaCl的溶解度
B. 20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数
C. 20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出
D. NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl
10.(2022广州市天河区二模)某化工厂利用软锰矿(主要成分为MnO2,含有少量Al2O3、MgO、SiO2等杂质)脱除燃煤烟气中的SO2,同时制得在电子工业有重要应用的MnCO3.工艺流程如下:
已知:①“脱硫浸锰”时主要发生的反应有。
②NH4F易溶于水。
(1)“脱硫浸锰”时,MgO与硫酸反应的化学方程式为_________________。
(2)“除铝”时,加入氨水后溶液的pH_______________(填“变大”“不变”“变小”)。
(3)若“除镁”“沉锰”时均发生复分解反应,则“除镁”发生的化学方程式为_______,“沉锰”加入的X溶液中一定含有的主要离子有_________(填离子符号)。
(4)若制得1250t含杂质8%的MnCO3粗产品,理论上需要含MnO287%的软锰矿的质量为_____t(不考虑流程中的损耗)。
11. (2022广州从化区一模)某同学进行H2O2溶液制备O2的实验探究。回答下列问题:
(1)向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
①写出用H2O2溶液制取O2的化学方程式:_____________________。
②用上述反应原理制备并收集一瓶干燥的O2,从上述装置中选择并组装一套装置,其连接顺序为_______→_______→_______(填编号)。
③实验室制取二氧化碳的发生装置和收集装置应选_______(填编号);若要制取88g的二氧化碳,需要10%的稀盐酸_______g。
(2)向5mL5%的H2O2溶液中加入2滴一定浓度的FeCl3溶液,立即产生大量气泡。某同学设计下列实验探究哪种微粒对H2O2溶液的分解起催化作用。
实验 H2O2溶液 加入溶液 实验现象
① 5mL5% 2滴NaCl溶液 无明显变化
② 5mL5% 2滴Na2SO4溶液 无明显变化
③ 5mL5% 2滴Fe2(SO4)3溶液 立即产生大量气泡
从上述实验现象,得出对H2O2溶液分解起催化作用的微粒是_______(填离于符号)。从循环利用的角度分析,MnO2和FeCl3溶液两种催化剂,_______更适合作为该反应的催化剂。
12.(2022广州市增城区二模)氧气是供给呼吸的重要物质,制取氧气的方法有很多种。
仪器的名称是 ______。
过氧化钠是一种淡黄色固体,是航空航天、潜水艇的供氧剂。常温下与水反应制取氧气,选择的发生装置是 ______填标号。检验该装置气密性的操作方法:首先夹紧弹簧夹,再 ____________,观察到 ________________________,证明气密性良好。
某兴趣小组在实验室用作催化剂分解制取氧气。
制取氧气的化学方程式是 ______________________________。
完全反应后要对固体剩余物进行回收。向固体剩余物中加入一定质量的的水,充分搅拌、静置、过滤。将滤渣洗涤、干燥、得到的黑色固体是 ______;蒸干滤液,可得氯化钾;需要称取的质量是 ______。
查阅资料可知:氯化钾在的溶解度是。为了能全部回收氯化钾,并最大限度节省能源,向上述完全反应后的固体剩余物中加入水的质量是 ______。
13. (2022广州市海珠区一模)实验室模拟工业上用某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4·7H2O,流程如下:
(1)“酸浸”过程中:
①有MnSO4生成,MnSO4在水溶液中解离出的阳离子是_______ (填离子符号)。
②MnCO3与H2SO4反应的化学方程式为________________________。
(2)“转化”时的主要反应是:NaClO+MnSO4+H2O=MnO2↓+H2SO4+X,X的化学式为_______。
(3)“过滤2”所得滤液中能分离出一种可循环使用的物质,该物质是_______(填化学式)。
(4)“操作1”中包括蒸发浓缩等一系列操作,蒸发浓缩时需要用到的仪器有铁架台、铁圈、酒精灯、玻璃棒和_______。
(5)若用10kg菱镁矿石可制得24.6kgMgSO4·7H2O (相对分子质量为246),则菱镁矿石中MgCO3的质量分数为_______。
14. (2022广州市番禺区一模)金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,Co元素常见的化合价为+2和+3。金属Co与酸反应后显+2,Co元素常见的化合物相关性质如下:
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
(1)根据金属化学性质的一般规律。下列预测合理的是___________。
A. 钴能够与氢氧化钠溶液反应
B. H2或者CO能够将钴的氧化物转化为金属钴
C. 钴能够与盐酸或者稀硫酸反应
D. 硫酸钴溶液中的硫酸锌可以加入钴粉除去
(2)碳酸钴(CoCO3)是一种难溶于水的粉红色固体,结合所学知识预测,CoCO3能与____(填物质类别)反应,验证预测的实验操作和预期现象是:取CoCO3固体于试管中_______。
(3)依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。.
限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
实验步骤 预期反应的化学方程式 预期反应的实验现象
__________________________ __________________________ __________________
___________________________ __________________________ __________________
(4)从含钴的矿石中提取钴的工艺过程一般是会先用足量的酸进行酸浸,酸浸时,钴的氧化物发生如下反应:
反应I:CoO + H2SO4 =CoSO4 +H2O
反应II:2Co2O3 + 4H2SO4 =4CoSO4 +4H2O +O2↑
反应III:Co2O3 +Na2SO3+2H2SO4 =2CoSO4 +2H2O +Na2SO4
①反应后溶液中含钴元素的微粒是:___________(填化学符号)。
②已知,反应前含有CoO和Co2O3 的矿石(矿石中钴元素的质量分数为59%)的质量为b g 则理论上可以生成CoSO4的质量为________________________(用含b的式子表示)。
15. (2022广州市白云区一模)N是空气中含量最高的元素。
(1)将含N物质进行分类,按要求写出化学式
单质 引起酸雨的氧化物 酸 含氮的不同化合价的盐
N2 ______________ HNO3 _______________
(2)镓元素的信息如图。
请设计理论上制备硝酸镓的三种方案(要求含镓原料分别属于不同的化合物类别)
方案 预期反应的化学方程式
① _________________________
② __________________________
③ __________________________
(3)若硫酸铝铵晶体【NH4Al(SO4)2】·12H2O,相对分子质量453】
①加热过程中,其质量随时间的变化如图所示。据此判断,从200℃到50℃间固体是否还存在结晶水,并作出解释。_______(是或否),____________________________。
②写出一个能与硫酸铝溶液发生反应的原子团_______。(写离子符号)
16. (2022广州黄埔区二模)某热电厂用脱硫得到的石膏(CaSO4·2H2O)生产K2SO4肥料的流程如图:
已知:不同温度下,硫酸钾在水溶液、氨溶液中的溶解度:
温度(℃) 0 10 25
水溶液 6.815 8.496 9.937
氨(8%)溶液 1.387 1.558 2.198
氨(35%)溶液 0.442 0.742 0.813
(1)在“脱硫”反应中,将CaCO3粉碎后与水混合成悬浊液的目的是___________。
(2)脱硫过程的化学方程式为:___________。
(3)石膏与饱和(NH4)2CO3溶液相混合发生反应Ⅰ,反应基本类型为___________。
(4)“操作I”的名称是___________。
(5)你认为反应Ⅱ在常温下能实现的原因是___________。
(6)CaSO4·2H2O受热会逐步失去结晶水。取纯净CaSO4·2H2O固体3.44g,进行加热,测定固体质量随温度的变化情况如图所示。CaSO4·2H2O相对分子质量为172。
H点的固体在T2~1400℃范围内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,写出发生反应的化学方程式___________。
17. (2022广州黄埔区二模)向一支装有少量CuO的试管中依次加入下列物质,实验操作如图所示,回答下列问题。
(1)图A实验中加入过量稀H2SO4后,观察到的现象___________。
(2)图B发生反应的化学方程式___________。
(3)如图D,向图C实验后所得溶液中插入新打磨的铝丝,画出图中溶液中一定存在的微观粒子_________。(微粒数目不做要求,不考虑空气、水)。
(4)实验开始时放入试管的CuO质量为4g,则实验最后取出的铝丝最多能增重___________g。
18. (2022广州市天河区二模)气体的制取实验是初中化学学习的重要内容。
(1)下列制取气体的实验,发生装置可选用甲的是____________(填字母)。
A. 二氧化锰与浓盐酸加热制取Cl2 B. 锌和稀硫酸制取H2
C. 块状硫化亚铁(FeS)和稀硫酸制取H2S D. 高锰酸钾制取O2
(2)某同学阅读课外资料得知:双氧水分解制取氧气除了用二氧化锰,还可以用氧化铜作催化剂,于是进行了以下实验探究:
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?
【设计实验】以收集到30mL氧气为标准,设计了下列两组实验(其他可能影响实验的因素均忽略)。
实验序号 氯酸钾的质量 其他物质及其质量 待测数据
甲 2.45g /
乙 2.45g CuO0.5g
①上述实验应测量的“待测数据”是_________。
【实验结论】
②实验甲比乙的“待测数据”更________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。实验乙中反应的化学方程式为_______,氯酸钾完全分解后,试管中剩余固体的质量为_______g。
答案解析
【5年中考】
1. (2022广州市中考)酚酞(C20H14O4)是常见的酸碱指示剂。下列关于酚酞的说法正确的是
A. 属于无机化合物
B. 相对分子质量为(12×20+1×14+16×4)g
C. C、H、O三种元素的质量比为(12×20):(1×14):(16×4)
D. 碳元素的质量分数为×100%
【答案】C
【解析】
A、根据酚酞的化学式知:酚酞是含有碳元素的化合物,属于有机物,错误;
B、相对分子质量的单位不是“g”,而是“1”,通常省略不写,错误;
C、酚酞中碳、氢、氧三种元素的质量比为(12×20):(1×14):(16×4)=120:7:32;正确;
D、酚酞中碳元素的质量分数为,错误。
故选C。
2.(2021广州中考)纤维素是棉花的主要成分,其化学式为(C6H10O5)n(n约为103~104)。下列关于纤维素的说法正确的是
A.属于无机化合物
B.相对分子质量为(12×6+1×10+16×5)
C.C、H、O三种元素的质量比为6:10:5
D.氧元素的质量分数为×100%
【答案】 D
【解析】
A.纤维素的化学式中含有碳元素,物质分类应为有机化合物,故A错误;
B.相对分子质量应为(12×6+1×10+16×5)×n,故B错误;
C.C、H、O三种元素的质量比为12×6:1×10:16×5,故C错误;
D.氧元素的质量分数为×100% = ×100%,故D正确。
3. (2020广州中考)尿素是氮肥中最主要的一种,其化学式为CO(NH2)2。下列关于尿素的说法正确的是
A. CO(NH2)2中含有的原子是(NH2)2
B. C、O、N、H四种原子的个数比为1:1:1:4
C. 氮元素的质量分数为
D. C、O、N、H四种元素的质量比为12:16:14:1
【答案】C
【解析】
化合物中各元素质量比=各原子的相对原子质量×原子个数之比
A、CO(NH2)2是由尿素分子构成的,不含有(NH2)2,故A不正确;
B、尿素的化学式为CO(NH2)2,C、O、N、H四种原子的个数比为,故B不正确;
C、,则氮元素的质量分数为,故C正确;
D、尿素的化学式为CO(NH2)2,C、O、N、H四种元素的质量比为,故D不正确。故选C。
4. (2019广州中考)从地沟油中提炼生物柴油是垃圾资源化的方法之一。生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是
A. C、H、O三种元素的质量比为19:38:2
B. 相对分子质量为(12×19+1×38+16×2)
C. C、H、O三种原子的个数比为12:1:16
D. 氧元素的质量分数为×100%
【答案】B
【解析】
化学中元素质量比等于原子个数比乘以相对原子质量比。
A、由硬脂酸甲酯(C19H38O2)可知,C、H、O三种元素的质量比为,故A不正确;
B、相对分子质量为(12×19+1×38+16×2),故B正确;
C、C、H、O三种原子的个数比为19:38:2,故C不正确;
D、氧元素的质量分数为,故D不正确。故选B。
5. (2018广州中考)碳酸乙烯酯(C3H4O3)可用作锂电池电解液,下列有关碳酸乙烯酯的说法正确的是
A. 碳酸乙烯酯的相对分子质量为(12×3+1×4+16×3)g
B. 碳酸乙烯酯中C、H、O三种元素的质量比为12:1:16
C. 碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3
D. 碳酸乙烯酯中碳元素的质量分数=×100%
【答案】C
【解析】
A. 碳酸乙烯酯的相对分子质量为12×3+1×4+16×3,相对分子质量单位为“1”,通常不写,错误;B. 碳酸乙烯酯中C、H、O三种元素的质量比为12×3:1×4:16×3,错误;C. 化学式中元素符号右下角的数字为一个分子中原子的个数,碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3,正确;D. ,碳酸乙烯酯中碳元素的质量分数= ×100%,错误。故选C。
6. (2022广州中考)二甲基亚砜(DMSO)工业废渣含NaNO3及少量有毒的NaNO2,以该废渣为原料制备农用KNO3,既实现资源回收利用又保护了环境。工艺流程如下:
(1)农用KNO3为农作物提供的营养元素有_______。
(2)步骤1的作用是除去NaNO2,NaNO2中氮元素的化合价为_______。
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出NaCl固体,原因是_____________________。
(4)步骤4的操作是_______、过滤。
(5)KCl用量的估算依据是 (填标号)。
A. KCl与NaNO3的粒子个数比为1:1
B. KCl与NaNO3的质量比为1:1
C. KCl与NaNO3在溶液中的质量分数之比为1:1
(6)该工艺所得农用KNO3混有一定量NaCl。取25g样品加足量水溶解,向溶液中加入足量的AgNO3溶液,生成沉淀的质为14.35g,则样品中杂质NaCl的质量是_____g,样品含KNO3_______%(质量分数)。
(相对分子质量:KNO3-101 NaCl-58.5 AgNO3-170 AgCl-143.5)
【答案】(1)钾元素和氮元素 (2)+3 (3)硝酸钾溶解度受温度影响比较大,氯化钠受温度影响比较小 (4)降温结晶 (5)A (6) ①. 5.85 ②. 76.6
【解析】
(1)KNO3为农作物提供的营养元素有钾元素和氮元素。
(2)NaNO2中钠元素的化合价为+1价,氧元素的化合价为-2价,设氮元素的化合价为x,根据“化合物中各元素的化合价之和为0”可知,1+x+(-2)×2=0,解得x=+3。
(3)硝酸钾溶解度受温度影响比较大,氯化钠受温度影响比较小,则“加热蒸发”时只析出氯化钠。
(4)由图可知,通过步骤4分离出了硝酸钾,而硝酸钾受温度影响比较大,且溶液2的温度比较高,则步骤4为降温结晶。
(5)加入氯化钾的目的是使溶液中的氯离子和钠离子结合为氯化钠析出,则因使氯化钾与硝酸钠的粒子个数比为1:1,故选A。
(6)设样品中杂质NaCl的质量是x,则:
x=5.85g
则样品中含KNO3的质量为 。
7. (2020广州中考)盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。
(1)用质量分数为37%的浓盐酸配制1000g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为________g,所需浓盐酸的质量为________g。
②已知浓盐酸密度为1.19g/cm3,量取上述所需浓盐酸用到的仪器是_______(填标号)。
A 10mL量筒
B 50mL量筒
C 试管
D 胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在__________上。
(2)取少量氢氧化钙粉末于试管中,加入2mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是_________________。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为________________。
②下列示意图中,与实验结果相符的是_________(填标号)。
【答案】 ①. 3.7 ②. 10 ③. AD ④. 玻璃片或白瓷板 ⑤. 溶液由红色变成无色 ⑥. ⑦. D
【解析】
(1)①所配稀盐酸中溶质的质量=1000g0.37%=3.7g,所需浓盐酸的质量=3.7g37%=10g;
②所需浓盐酸的体积=10 g1.19g/cm3≈8.4mL,应选用10mL量筒和胶头滴管进行量取;
③测定所配稀盐酸的酸碱度,应将pH试纸放置在玻璃片或白瓷板上,用玻璃棒蘸取待测液滴到pH试纸上再与标准比色卡进行比较;
(2)氢氧化钙溶于水显碱性,滴加1滴酚酞溶液,溶液变红,再滴加稀盐酸至反应完全,盐酸和氢氧化钙反应生成氯化钙和水,溶液显中性,溶液由红色变成无色;
(3)①铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程为:;
②取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸,若铁过量或盐酸过量都会生成等质量的氢气,铁粉比铁片与盐酸的接触面积大,反应速率快,所用时间少,对比四个选项,只有D项正确。
8.(2022广州市中考)某校学生用盐酸和碳酸钙制备CO2,产生了大量废液。兴趣小组通过以下探究确定废液处理方案。
(1)废液成分的确定
①写出制备CO2的化学方程式_____________________。
②推测废液所含溶质
推测一:______________ 推测二:CaCl2和HCl
③若要用一种药品验证哪种推测成立,可选择的有哪些?_______(填标号)
A.石蕊溶液 B.AgNO3溶液 C.锌粒 D.CuO粉末
(2)废液的处理
实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3除去它们。
【提出问题】如何估算Na2CO3固休的用量?
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。
【结果讨论】
①a→b阶段,观察到烧杯中的现象是_______。
②b点后曲线平缓阶段,反应的化学方程式为_______。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积_______120mL。(填“大于”“等于”或“小于”)
④将烧杯中的沉淀过滤、干燥、称重,质量为4g。若处理10L该废液,理论上需要Na2CO3固体___g。(实验所用Na2CO3溶液的密度近似看做1g/cm3)
【答案】 ①. ②. CaCl2 ③. ACD ④. 有气泡产生 ⑤. ⑥. 小于 ⑦. 530
【解析】
(1)①实验室用大理石(或 石灰石)和稀盐酸制取CO2,大理石的主要成分碳酸钙和盐酸反应产生氯化钙、水和二氧化碳,化学方程式:。
②碳酸钙和盐酸恰好完全反应时溶质只有氯化钙,则推测一:氯化钙;盐酸过量时推测二:CaCl2和HCl;
③根据推测,主要是证明盐酸的有无即可判断是哪种推测;
A、盐酸会使石蕊试液变红色;则样品滴加石蕊试液后变红了,则有盐酸,推测二成立;如果石蕊试液不变色,推测一成立;正确;
B、溶液中有氯化钙,提供了氯离子,硝酸银和氯化钙反应产生氯化银沉淀和硝酸,盐酸和硝酸银也会产生氯化银沉淀,所以不能用硝酸银溶液验证是否有盐酸,错误;
C、盐酸和锌反应产生氯化锌和氢气,会产生气体;则锌粒中加入样品后产生气泡,则有盐酸,推测二成立;如果没有气泡,推测一成立;正确;
D、氧化铜和盐酸反应产生氯化铜和水,固体会减少或消失,溶液变蓝色;则氧化铜中加入样品后固体会减少或消失,溶液变蓝色,则有盐酸,推测二成立;如果固体不减少,溶液不变蓝色,推测一成立;正确;故选ACD。
(2)①废液中的溶质是CaCl2和HCl,向其中加入碳酸钠,碳酸钠先和盐酸反应产生氯化钠、水和二氧化碳,然后碳酸钠和氯化钙反应产生碳酸钙沉淀和氯化钠,根据图像a→b阶段,是碳酸钠和盐酸反应,则会观察到烧杯中有气泡产生。
②碳酸钠溶液显碱性,b点后曲线平缓阶段,是碳酸钠和氯化钙反应,氯化钠溶液显中性,反应的化学方程式为:。
③c点时,溶液显碱性,碳酸钠过量,结合图像分析,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积小于120mL。
④100mL废液,产生碳酸钙的质量是4g,设要碳酸钠的质量是x。
所需碳酸钠溶液的体积为:4.24g÷5.3%÷1g/mL=80mL, 即80mL碳酸钠溶液中含有碳酸钠4.24g,故100mL碳酸钠溶液中含有碳酸钠4.24g×100mL÷80mL=5.3g,因此若处理10L(即:10000mL)该废液,理论上需要Na2CO3固体质量为10000mL÷100mL×5.3g=530g;
故答案为:530。
9.(2021广州中考)某校学生利用以下两个实验探究酸的性质。
(1)试管A中溶液变浑浊的反应是___________________________________(写化学方程式)。
(2)试管B中铁钉变得光亮且表面有气泡生成,溶液呈黄色,将此时溶液中和液面上方存在的微观粒子的种类在图中补充完整(粒子数目不作要求;不考虑空气、水)。
(3)将所有学生完成上述两个实验产生的废液收集并处理,向该废液中加入适量Na2CO3, 除去钙、铁元素和过量的酸,可观察到:①________________,②产生大量沉淀。静置过滤得到无色溶液,经检测pH约为7,取样滴加__________溶液,无明显现象,钙已除尽。
(4)若处理废液时共消耗Na2CO3212g,则实验室为本次探究实验至少准备了_________g盐酸。(已知盐酸的质量分数为7.3%)
【答案】(1) Ca(OH)2 + CO2 ===CaCO3↓ + H2O (1分)
(2)见右图(2分)
(3)有气泡产生(1分);Na2CO3 (1分)
(4) 2000 (2分)
【解析】
(1)试管A中发生的反应是CO2与澄清石灰水发生的反应,故反应的化学方程式为 Ca(OH)2 + CO2 ===CaCO3↓ + H2O (1分)
(2)试管B中铁钉变得光亮,即铁锈已除去;铁钉表面有气泡生成,这气体是H2,即溶液中应有FeCl2;溶液呈黄色,说明溶液中的主要成分是FeCl3;由于盐酸是氯化氢气体的水溶液,气体溶解度随温度的升高而减小,图中溶液见到H+和Cl-离子,故应有HCl气体在试管内出现,故画出了见上的图所示的粒子。
(3)“过量的酸”会与加入的Na2CO3反应,故有气泡产生(1分);鉴别Ca2+离子可以使用Na2CO3溶液,因为Ca2+离子与中Na2CO3的CO32-结合成白色沉淀的CaCO3。
(4)加入适量Na2CO3是为了除去废液中的钙、铁元素和过量的酸,反应后的溶液呈中性(pH≈7),即溶液中只含有NaCl。故有
Na2CO3 ------ 2NaCl ------ 2HCl
106 73
212g X×7.3%
X= =2000g
10. (2020广州中考)某工厂生产硼砂产生的固体废料,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3质量分数为63%。回收镁的工艺流程如下:
(1)“酸浸”时MgCO3发生反应的化学方程式为_________。
(2)“调pH”前滤液I的pH________7(填“>”或“<”)。
(3)滤液Ⅲ中可回收的主要物质________(填化学式)。
(4)已知固体废料质量为m,理论上可生产Mg(OH)2的质量为______。
(5)某BaCO3中混有SiO2杂质,简述提纯该BaCO3的实验操作:_________________________________。
【答案】 ①. ②. < ③. ④. ⑤. 向样品中加入适量盐酸至不再产生气泡,过滤除去固体杂质SiO2,向滤液中加入适量的碳酸钠溶液至刚好不再产生沉淀,过滤,洗涤固体,烘干,得到碳酸钡固体
【解析】
(1)“酸浸”时MgCO3和硫酸发生反应,其化学方程式为;
(2)“调pH”前滤液I是酸浸之后产生的,会有硫酸,所以pH<7;
(3)酸浸之后,滤液I中的溶质有硫酸、硫酸镁、硫酸铝和硫酸铁,硫酸先和氢氧化钠反应产生水和硫酸钠;硫酸铝和硫酸铁和氢氧化钠反应产生氢氧化铝沉淀、氢氧化铁沉淀和硫酸钠;然后是硫酸镁和氢氧化钠反应产生氢氧化镁沉淀和硫酸钠,所以滤液Ⅲ中可回收的主要物质是硫酸钠,其化学式为;
(4)固体废料中MgCO3质量分数为63%;根据质量守恒定律,碳酸镁中的镁元素全部转化为Mg(OH)2;设可生产Mg(OH)2的质量为x,则:
,解得;
(5)从流程图中知道,SiO2不能和酸反应,BaCO3中和硫酸会产生难溶于酸的硫酸钡,BaCO3与盐酸反应生成氯化钡、水和二氧化碳,所以用盐酸进行反应。提纯该BaCO3的实验操作:向样品中加入适量盐酸至不再产生气泡,过滤除去固体杂质SiO2,向滤液中加入适量的碳酸钠溶液至刚好不再产生沉淀,过滤,洗涤固体,烘干,得到碳酸钡固体。
11. (2019广州中考)实验室配制饱和澄清石灰水和质量分数为10%氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 Ca(OH)2 NaOH CaCO3 Ca(HCO3)2 Na2CO3 NaHCO3
溶解度/g 0.16 109 0.0065 16.6 21.8 9.6
(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体—量取水—溶解—装瓶贴标签。
①称取氢氧化钠固体的质量_____________g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,_______画出水的液面。
③装瓶后贴标签,在标签上填写:_______________________________。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是________________________________。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是_______________________________________________________。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为___________g,或需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到个位)
【答案】 (1). 10.0 (2). (3). 氢氧化钠 10% (4). 先产生白色浑浊,继续通二氧化碳,溶液又变澄清 (5). 一段时间后出现白色沉淀 (6). 4632 (7). 80
【解析】
二氧化碳和氢氧化钙先生成沉淀和水,碳酸钙和二氧化碳和水再转化
,二氧化碳和氢氧化钠反应先生成和水,二氧化碳和碳酸钠和水再转化为。
(1) ①称取氢氧化钠固体的质量为。
②水的密度为1g/cm3,用100mL量筒量取所需的水,水的体积为,故图为。
③装瓶后贴标签,在标签上填写氢氧化钠(或NaOH) 10%。
(2)①向饱和澄清石灰水中通入直至过量,二氧化碳和氢氧化钙先生成沉淀和水,碳酸钙和二氧化碳和水再转化为,碳酸氢钙易溶于水,故可观察到的现象是先产生白色浑浊,继续通二氧化碳,溶液又变澄清。
②向10%氢氧化钠溶液中通入CO2直至过量,二氧化碳和氢氧化钠反应先生成和水,二氧化碳和碳酸钠和水再转化为,碳酸氢钠溶解度较小,故可观察到的现象是一段时间后出现白色沉淀。
③设吸收4.4gCO2,需氢氧化钙的质量至少为x
吸收4.4gCO2,需饱和澄清石灰水的质量至少为
设需10%氢氧化钠溶液的质量至少为y
故需10%氢氧化钠溶液的质量至少为80g。
12. (2018广州中考)金属钴(Co)在国防工业中有重要应用。某矿石中含钻的氧化物(CoO、Co2O3)研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。
(1)写出下列化合物中Co元素的化合价:CoO_________,Co2O3______________。
(2)酸浸时钴的氧化物发生如下反应:
反应I CoO+H2SO4=CoSO4+H2O
反应Ⅱ 2Co2O3+4H2SO4=4CoSO4+O2↑+4H2O
反应Ⅲ Co2O3+2H2SO4+Na2SO3=2CoSO4+2H2O+Na2SO4
①反应后溶液中含钴元素的微粒是_________ (填化学符号)
②已知反应前矿石中CoO的质量为ag,Co2O3的质量为bg,则理论上可以生成CoSO4____g(用含a、b的式子表示)
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
编号 矿石用量(g) 硫酸用量(g) Na2SO3用量(g) 温度(℃) 钻元素浸出率(%)
1 85.71 12.62 0 85 56.39
2 85.71 6.31 0 85 49.98
3 85.71 6.31 0 65 43.33
4 85.71 6.31 0.43 65 73.95
5 85.71 6.31 0.86 65 74.77
①本实验研究了哪些因素对钴元素浸出率的影响__________________________________;
②根据上表数据,其他条件不变,温度升高,钴元素的浸出率___________________________;
③工业生产中采用实验______________(填编号)的提取条件更合理。
【答案】 (1). +2 (2). +3 (3). Co2+ (4). 155×(a/75 + b/83) (5). 硫酸用量、亚硫酸钠用量、温度 (6). 增大 (7). 4
【解析】
(1)单质中元素的化合价为零,化合物中元素的化合价代数和为零。化合物中氧元素的化合价为-2价, CoO中Co为+2价,Co2O3中Co为+3价;(2) ①由上述方程式可知,反应后钴元素以CoSO4存在于溶液中,所以溶液中含钴元素的微粒是Co2+;②设CoO生成CoSO4的质量为x,Co2O3生成CoSO4的质量为y,
CoO+H2SO4=CoSO4+H2O
75 155
ag x 75/ag=166/x x=155×ag÷75
2Co2O3+4H2SO 4=4CoSO4+O2↑+4H2O
332 155×4
bg y 332/bg= 155×4/y y= 155×4×bg÷332
则理论上可以生成CoSO4的质量为:155×(a/75 + b/83);
(3) ①由表格中数据可知,对钴元素浸出率产生影响的因素有硫酸用量、亚硫酸钠用量、温度;②根据上表数据,其他条件不变,温度升高,钴元素的浸出率增大;③工业生产中应采用实验4的方案,虽然实验5的方案中钴元素浸出率最高,但考虑到实验4中亚硫酸钠的使用量接近实验5方案中的一半,综合考虑选择实验4的方案。
13. (2018广州中考)室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃) 0 20 25 40 50 60 80
溶解度(g) 69.2 74.5 76.4 81.8 855 89.4 98.0
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
【答案】 (1). 17.1 (2). 搅拌 (3). A C (4).
【解析】
(1) ①溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。由表格中数据可知,50℃时,氯化铜的溶解度为85.5g,用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液, 需称取CuCl2的质量是17.1g;②将称取的CuCl2固体和20mL水倒入烧杯中,用玻璃棒搅拌,直至固体完全溶解;(2) A.由题中信息可知,氯化铜的溶解度受温度影响不大,可用蒸发结晶法提纯。收集母液于敞口容器中,用报纸包住容器口,防止落入其他物质,引入杂质,待水分自然蒸干(蒸发结晶)后保存所得固体,则不会有含铜离子的液体排放,不会导致污染,正确;B.向母液中加入适量AgNO3,充分反应后生成的沉淀是氯化银,过滤,滤渣干燥保存,滤液中仍然有铜离子,倒入下水道,仍会导致污染;C.向母液中加入适量NaOH,生成氢氧化铜沉淀和氯化钠,充分反应后过滤,滤渣干燥保存,滤液中只有氯化钠,没有铜离子,倒入下水道,不会因重金属导致污染;(3)由题中信息可知,25℃时氯化铜的溶解度为76.4g,100g母液中含有氯化铜的质量为x,76.4g/176.4g=x/100g x=100g×76.4g÷176.4g;若用铁粉置换出母液中的铜,设100g母液需要铁粉的质量至少是y,
CuCl2 + Fe = FeCl2 + Cu
135 56
y 135/=56/y
【1年模拟】
1. (2022广州从化区一模)我国自主研发的新冠疫苗,主要原料是胰蛋白酶,其中一种胰蛋白酶的化学式为C6H15O12P3,相对分子质量为372,对于该胰蛋白酶说法正确的是
A. 该胰蛋白酶是一种高分子化合物
B. 该胰蛋白酶由36种元素组成
C. 该胰蛋白酶中碳、氧元素质量比3:8
D. 该胰蛋白酶一个分子的质量为372g
【答案】C
【解析】
A、高分子化合物相对分子质量高达几万,该胰蛋白酶相对分子质量仅为372,所以不是高分子化合物,说法错误;
B、该胰蛋白酶由碳、氢、氧、氮四种元素组成,一个该胰蛋白酶分子由个原子构成,说法错误;
C、该该胰蛋白酶中碳、氧元素质量比为,说法正确;
D、相对原子质量有单位,不是“g”,是“1”,省略不写,该胰蛋白酶的相对分子质量为372,该胰蛋白酶一个分子的质量不等于372g,说法错误。
故选C。
2. (2022广州市天河区二模)广州早茶文化远近驰名。茶叶中含有茶氨酸(C7H14N2O3)、锌、硒等多种成分。下列说法不正确的是
A. 茶氨酸属于有机物,“锌、硒”指的是元素
B. 茶氨酸的相对分子质量为()g
C. 泡茶时茶香四溢,体现了分子是运动的
D. 用茶杯内的纱网可分离茶叶和茶水,利用的是过滤的原理
【答案】B
【解析】
A、茶氨酸含碳元素,属于有机物,这里的“锌、硒”不是以分子、原子、单质的形式存在,而是强调存在的元素,与具体形态无关,不符合题意;
B、茶氨酸的相对分子质量是:12×7+14+14×2+16×3,相对分子质量是一个比值,单位为“1”,不是“g”,符合题意;
C、泡茶时茶香四溢,说明分子在不断运动,引起香味的分子四处扩散,从而茶香四溢,不符合题意;
D、用茶杯内的纱网可分离茶叶和茶水,实现固液分离,利用的是过滤的原理,不符合题意。
故选B。
3.(2022广州越秀区一模)广东地区因气候等原因喜欢饮用凉茶,凉茶具有消热解毒、凉血利明功效,主要成分是黑芥子甙(C10H17NO9S2),可以预防感冒。下列有关说法正确的是( )
A.黑芥子甙中含有39个原子
B.黑芥子甙中的氮元素的质量分数最小
C.黑芥子甙在氧气中充分燃烧只生成CO2和H2O
D.黑芥子甙中碳、氧、硫元素的质量比为17:9:2
【答案】B
【解析】A、1个黑芥子甙分子是由10个碳原子、17个氢原子、1个氮原子、9个氧原子和2个硫原子构成的,则1个黑芥子甙分子中含有39个原子,故选项说法错误。
B、黑芥子甙中C、H、N、O、S的元素质量比为(12×10):(1×17):(14×1):(16×9):(32×2)=120:17:14:144:64,则黑芥子甙中的氮元素的质量分数最小,故选项说法正确。
C、由质量守恒定律,反应前后元素种类不变,黑芥子甙在氧气中充分燃烧不是只生成CO2和H2O,还生成含硫元素和氮元素的物质,故选项说法错误。
D、黑芥子甙中碳、氧、硫元素的质量比为(12×10):(16×9):(32×2)≠17:9:2,故选项说法错误。
故选:B。
4.(2022广州市天河区二模)阅读下列科普短文,回答问题。
2021年,考古学家利用碳-14断代法初步判定三星堆4号坑距今约3200至3000年。碳-14原子核中含6个质子与8个中子。生物死后体内的碳-14会不断衰变,碳-14原子核中1个中子变成1个质子,形成新的原子核。对比生物体内生前、死后碳-14的含量,可推算出其所属年代。
国家速滑馆利用CO2跨临界直冷制冰,就是将气态CO2通过加温加压形成超临界CO2流体(介于气态和液态之间的一种新的状态,兼有气体和液体的性质),后变为液态CO2,再变成气态完成制冰的过程。工业上可用CO2为原料合成燃料甲烷、甲醇(CH3OH),氮肥尿素等,合成尿素的反应:。
(1)碳-14原子核外电子数为_____________,其衰变形成的新原子属于___________元素(填元素符号)。
(2)超临界CO2流体是______(填“纯净物”“混合物”)。液态CO2能用于制冰的原因是________。
(3)甲醇充分燃烧的产物为______________。
(4)合成尿素时,参与反应的CO2与NH3的质量比为__________。尿素含氮量高,其氮元素的质量分数为_________(保留小数点后一位)。
【答案】(1) ①. 6 ②. N
(2) ①. 纯净物 ②. 液态二氧化碳汽化吸热,能使周围温度降低 (3)二氧化碳和水
(4) ①. 22:17 ②. 46.7%
【解析】
(1)碳-14原子核中含6个质子与8个中子,在原子中,质子数=核外电子数,故碳-14原子核外电子数为6;
生物死后体内的碳-14会不断衰变,碳-14原子核中1个中子变成1个质子,形成新的原子核,故新原子的质子数为7,质子数=原子序数,7号元素氮元素,故填:N;
(2)超临界CO2流体由同种物质组成,属于纯净物;
液态CO2能用于制冰的原因是:液态二氧化碳汽化吸热,能使周围温度降低;
(3)由化学式可知,甲醇由C、H、O三种元素组成, 根据质量守恒定律,化学反应前后,元素的种类不变,可得甲醇充分燃烧生成二氧化碳和水;
(4)由化学方程式可知,合成尿素时,参与反应的CO2与NH3的质量比为:44:(17×2)=22:17;
尿素中氮元素的质量分数为:。
5.(2022广州天河区一模)NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如图:下列说法正确的是( )
A.表示3个氢气分子
B.反应中元素的化合价都没有改变
C.参加反应的H2与生成的NH3分子个数比为1:2
D.生成物氨气是由N3﹣和H+构成
【答案】A
【解析】由微观反应示意图可知,该反应是由氮气与氢气在催化剂的作用下反应生成氨气,化学方程式为N2+3H22NH3。
A、由微观反应示意图以及分子结构模型可知,表示3个氢分子,选项说法正确;
B、由化学方程式可知,反应物是两种单质,而生成物是一种化合物,因此反应前后元素的化合价一定改变,选项说法错误;
C、由化学方程式可知,参加反应的H2与生成的NH3个数比为3:2,选项说法错误;
D、生成物氨气是由氨分子构成的,每个氨气分子是一个氮原子和3个氢原子构成的,选项说法错误。
故选:A。
6.(2022广州越秀区一模)科学家将温室气体CH4和CO2在Ni基双金属催化作用下转化为两种气体燃料,反应的微观示意图如图。下列分析不正确的是( )
A.该转化过程的最终产物为H2和CO
B.该转化有助于减少碳排放实现碳中和
C.反应过程中,CH4与CO分子数之比为1:1
D.反应过程中,CO2与CO的质量比为11:14
【答案】C
【解析】由微观图示可知,化学方程式为:CH4+CO22CO+2H2。
A、由微观反应示意图可知,该反应的最终产物是H2和CO,故A正确;
B、由化学方程式可知,该转化有助于减少碳排放实现碳中和,故B正确;
C、由化学方程式可知,反应过程中,CH4与CO分子数之比为1:2,故C错误;
D、反应过程中,CO2与CO的质量比为44:(28×2)=11:14,故D正确。
故选:C。
7.(2022广州越秀区一模)SCR催化技术利用NH3与NO2反应,能有效降低柴油发动机工作时的氮氧化物排放量,示意图如图。下列有关该反应的说法正确的是( )
A.反应生成了氧气和水
B.反应前后分子总数不变
C.两种生成物的质量比为12:7
D.NH3与NO2按分子个数比4:3进行反应
【答案】D
【解析】由反应的示意图可知,反应的方程式是:8NH3+6NO27N2+12H2O。
A、由物质的变化可知,反应生成了氮气和水,故A错误;
B、由方程式的意义可知,每14个分子变化成了19个分子,反应前后分子总数增多了,故B错误;
C、由方程式的意义可知,两种生成物的质量比为(28×7):(18×12)=49:54,故C错误;
D、由方程式的意义可知,NH3与NO2按分子个数比8:6=4:3进行反应,故D正确。
故选:D。
8.(2022广州黄埔区一模)科学家发现,可以将树木纤维素转变成超级储能装置。如图是该反应的微观示意图,下列说法不正确的是( )
A.该反应属于置换反应
B.反应生成的Z、W两种物质的分子个数比为1:1
C.该反应前后原子的种类、数目均保持不变
D.参加反应的X、Y的质量总和等于生成的Z、W的质量总和
【答案】B
【解析】由反应的微观示意图可知,该反应是碳和氨气在催化剂和高温条件下反应生成了氮气和甲烷,反应的方程式是:3C+4NH32N2+3CH4。
A、该反应由一种单质和一种化合物反应,生成了另一种单质和另一种化合物,属于置换反应,故A正确;
B、由化学方程式可知,反应生成的Z、W两种物质的分子个数比为2:3,故B错误;
C、由微粒的变化可知,该反应前后原子的种类、个数均保持不变,故C正确;
D、由质量守恒定律可知,参加反应的X、Y的质量总和等于生成的Z、W的质量总和,故D正确。
故选:B。
9.(2022广州市黄埔区一模)“侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3═NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是
A. 0℃时,NH4Cl的溶解度大于NaCl的溶解度
B. 20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数
C. 20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出
D. NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl
【答案】D
【解析】
根据固体的溶解度曲线可以知道:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性;②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。根据题目信息和溶解度曲线可知:氯化铵、氯化钠、碳酸氢钠三种固体物质的溶解度,都是随温度升高而增大,而氯化钠的溶解度随温度的升高变化比较小。
A、由溶解度曲线可知,0℃时,NH4Cl的溶解度小于NaCl的溶解度,故A选项错误;
B、因为20℃时,NH4Cl的溶解度大于NaHCO3的溶解度,所以20℃时,NaHCO3饱和溶液中溶质的质量分数不一定大于NH4Cl不饱和溶液中溶质的质量分数,故B选项错误;
C、20℃时,NaHCO3的溶解度是9.6g,即在该温度下,100g水中最多溶解9.6gNaHCO3,,由化学反应方程式中的信息可知,5.85g NaCl和7.9g NH4HCO3反应能生成8.4gNaHCO3,所以20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,得到NaHCO3的不饱和溶液,不能析出NaHCO3晶体,故C选项错误;
D、NH4Cl溶解度受温度影响较大,NaCl的溶解度受温度影响较小,所以NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl,故D选项正确。
故选D。
10.(2022广州市天河区二模)某化工厂利用软锰矿(主要成分为MnO2,含有少量Al2O3、MgO、SiO2等杂质)脱除燃煤烟气中的SO2,同时制得在电子工业有重要应用的MnCO3.工艺流程如下:
已知:①“脱硫浸锰”时主要发生的反应有。
②NH4F易溶于水。
(1)“脱硫浸锰”时,MgO与硫酸反应的化学方程式为_________________。
(2)“除铝”时,加入氨水后溶液的pH_______________(填“变大”“不变”“变小”)。
(3)若“除镁”“沉锰”时均发生复分解反应,则“除镁”发生的化学方程式为_______,“沉锰”加入的X溶液中一定含有的主要离子有_________(填离子符号)。
(4)若制得1250t含杂质8%的MnCO3粗产品,理论上需要含MnO287%的软锰矿的质量为_____t(不考虑流程中的损耗)。
【答案】(1) (2)变大 (3)
①. ②. (4)1000
【解析】
软锰矿加入硫酸、含硫烟气,二氧化硅不反应被分离出来,锰、铝、镁转化为相应的盐溶液,滤液加入氨水去除铝元素、加入氟化铵除去镁元素,过滤得到滤液加入碳酸盐得到碳酸锰粗品;
(1)氧化镁和硫酸反应生成硫酸镁和水,;
(2)pH>7显碱性,pH=7显中性,pH<7显酸性;pH值越大碱性越强,pH值越小酸性越强。氨水溶液显碱性,加入氨水后溶液的pH变大;
(3)两种化合物交换成分生成另外两种化合物的反应,属于复分解反应,“除镁”发生的反应为硫酸镁和氟化铵生成氟化镁沉淀和硫酸铵,;“沉锰”反应得到碳酸锰沉淀,则加入的X溶液中一定含有的主要离子有碳酸根离子;
(4)根据质量守恒定律,反应前后锰元素质量不变,则制得1250t含杂质8%的MnCO3粗产品,理论上需要含MnO287%的软锰矿的质量为=1000t。
11. (2022广州从化区一模)某同学进行H2O2溶液制备O2的实验探究。回答下列问题:
(1)向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
①写出用H2O2溶液制取O2的化学方程式:_____________________。
②用上述反应原理制备并收集一瓶干燥的O2,从上述装置中选择并组装一套装置,其连接顺序为_______→_______→_______(填编号)。
③实验室制取二氧化碳的发生装置和收集装置应选_______(填编号);若要制取88g的二氧化碳,需要10%的稀盐酸_______g。
(2)向5mL5%的H2O2溶液中加入2滴一定浓度的FeCl3溶液,立即产生大量气泡。某同学设计下列实验探究哪种微粒对H2O2溶液的分解起催化作用。
实验 H2O2溶液 加入溶液 实验现象
① 5mL5% 2滴NaCl溶液 无明显变化
② 5mL5% 2滴Na2SO4溶液 无明显变化
③ 5mL5% 2滴Fe2(SO4)3溶液 立即产生大量气泡
从上述实验现象,得出对H2O2溶液分解起催化作用的微粒是_______(填离于符号)。从循环利用的角度分析,MnO2和FeCl3溶液两种催化剂,_______更适合作为该反应的催化剂。
【答案】(1) ①. ②. B ③. C ④. E ⑤. BE ⑥. 1460
(2) ①. ②. MnO2或二氧化锰
【解析】
(1)①过氧化氢在二氧化锰催化作用下,生成水和氧气,反应的化学方程式为,故填:;
②用H2O2溶液制取并收集一瓶干燥的O2,发生装置选择固液不加热型(B),用浓硫酸干燥(C),因为二氧化碳密度比空气大,能溶于水且与水反应,收集装置选择向上排空气法(E),故其连接顺序为B→C→E,故填:B;C;E;
③实验室用石灰石和稀盐酸制取二氧化碳,发生装置为固液不加热型(B),收集装置为向上排空气法(E);
解:设若要制取88g的二氧化碳,需要10%的稀盐酸溶质的质量为x。
6
x=146g
故需要需要10%的稀盐酸溶质的质量为
(2)①②说明钠离子、氯离子、硫酸根离子,都不能催化过氧化氢分解,由③可知,铁离子能催化过氧化氢的分解,从循环利用的角度分析,MnO2和FeCl3溶液两种催化剂,因为二氧化锰不溶于水,可以通过溶解、过滤、洗涤、干燥进行回收,循环利用,故填:;MnO2(或二氧化锰)。
12.(2022广州市增城区二模)氧气是供给呼吸的重要物质,制取氧气的方法有很多种。
仪器的名称是 ______。
过氧化钠是一种淡黄色固体,是航空航天、潜水艇的供氧剂。常温下与水反应制取氧气,选择的发生装置是 ______填标号。检验该装置气密性的操作方法:首先夹紧弹簧夹,再 ____________,观察到 ________________________,证明气密性良好。
某兴趣小组在实验室用作催化剂分解制取氧气。
制取氧气的化学方程式是 ______________________________。
完全反应后要对固体剩余物进行回收。向固体剩余物中加入一定质量的的水,充分搅拌、静置、过滤。将滤渣洗涤、干燥、得到的黑色固体是 ______;蒸干滤液,可得氯化钾;需要称取的质量是 ______。
查阅资料可知:氯化钾在的溶解度是。为了能全部回收氯化钾,并最大限度节省能源,向上述完全反应后的固体剩余物中加入水的质量是 ______。
【答案】锥形瓶 向长颈漏斗中注入一定量的水,形成一段水柱 水柱的高度差在一段时间内保持不变 二氧化锰
【解析】解:仪器的名称是锥形瓶;
过氧化钠和水在常温下制取氧气,属于固、液常温型,适合用装置作发生装置;检验该装置气密性的操作方法:首先夹紧弹簧夹,再向长颈漏斗中注入一定量的水,形成一段水柱,观察到水柱的高度差在一段时间内保持不变,证明气密性良好;
氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,反应的化学方程式为:;
二氧化锰是该反应的催化剂,反应前后质量和化学性质都不变,且不溶于水,反应生成的氯化钾溶于水,所以将滤渣洗涤、干燥、得到的黑色固体是二氧化锰;设称取氯化钾的质量为。
设加入水的质量为。
故答案为:
锥形瓶;
;向长颈漏斗中注入一定量的水,形成一段水柱;水柱的高度差在一段时间内保持不变;
;
二氧化锰;;
。
13. (2022广州市海珠区一模)实验室模拟工业上用某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4·7H2O,流程如下:
(1)“酸浸”过程中:
①有MnSO4生成,MnSO4在水溶液中解离出的阳离子是_______ (填离子符号)。
②MnCO3与H2SO4反应的化学方程式为________________________。
(2)“转化”时的主要反应是:NaClO+MnSO4+H2O=MnO2↓+H2SO4+X,X的化学式为_______。
(3)“过滤2”所得滤液中能分离出一种可循环使用的物质,该物质是_______(填化学式)。
(4)“操作1”中包括蒸发浓缩等一系列操作,蒸发浓缩时需要用到的仪器有铁架台、铁圈、酒精灯、玻璃棒和_______。
(5)若用10kg菱镁矿石可制得24.6kgMgSO4·7H2O (相对分子质量为246),则菱镁矿石中MgCO3的质量分数为_______。
【答案】(1) ①. Mn2+ ②. MnCO3+H2SO4=MnSO4+H2O+CO2↑
(2)NaCl (3)H2SO4 (4)蒸发皿 (5)84%
【解析】
(1)MnSO4在水溶液中解离出Mn2+和,Mn2+ 是阳离子,故①填 Mn2+ ;MnCO3与H2SO4反应生成硫酸锰、水和二氧化碳气体,故化学方程式②填MnCO3+H2SO4=MnSO4+H2O+CO2↑;
(2)“转化”时的主要反应是:NaClO+MnSO4+H2O=MnO2↓+H2SO4+X,根据质量守恒定律,反应前后原子个数相等,反应前,Na 1个,Cl 1个,S 1个,Mn 1个,H 2个,O 6个;反应后,Mn 1个,S 1个,H 2个,O 6个,则X中有Na 1个,Cl 1个,故化学式为NaCl ;
(3)“过滤2”所得滤液中能分离出一种可循环使用的物质,该物质是硫酸,化学式是H2SO4 ;
(4)“操作1”中包括蒸发浓缩等一系列操作,蒸发浓缩时需要用到的仪器有铁架台、铁圈、酒精灯、玻璃棒和蒸发皿;
(5)在24.6kgMgSO4·7H2O 中Mg的质量=24.6kg××100%=2.4kg,反应前后Mg的质量相等,则MgCO3 的质量=2.4kg÷×100%= 8.4kg,故10kg菱镁矿石中MgCO3的质量分数=×100%=84% 。
14. (2022广州市番禺区一模)金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,Co元素常见的化合价为+2和+3。金属Co与酸反应后显+2,Co元素常见的化合物相关性质如下:
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
(1)根据金属化学性质的一般规律。下列预测合理的是___________。
A. 钴能够与氢氧化钠溶液反应
B. H2或者CO能够将钴的氧化物转化为金属钴
C. 钴能够与盐酸或者稀硫酸反应
D. 硫酸钴溶液中的硫酸锌可以加入钴粉除去
(2)碳酸钴(CoCO3)是一种难溶于水的粉红色固体,结合所学知识预测,CoCO3能与____(填物质类别)反应,验证预测的实验操作和预期现象是:取CoCO3固体于试管中_______。
(3)依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。.
限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
实验步骤 预期反应的化学方程式 预期反应的实验现象
__________________________ __________________________ __________________
___________________________ __________________________ __________________
(4)从含钴的矿石中提取钴的工艺过程一般是会先用足量的酸进行酸浸,酸浸时,钴的氧化物发生如下反应:
反应I:CoO + H2SO4 =CoSO4 +H2O
反应II:2Co2O3 + 4H2SO4 =4CoSO4 +4H2O +O2↑
反应III:Co2O3 +Na2SO3+2H2SO4 =2CoSO4 +2H2O +Na2SO4
①反应后溶液中含钴元素的微粒是:___________(填化学符号)。
②已知,反应前含有CoO和Co2O3 的矿石(矿石中钴元素的质量分数为59%)的质量为b g 则理论上可以生成CoSO4的质量为________________________(用含b的式子表示)。
【答案】(1)BC (2) ①. 酸 ②. 加入稀盐酸,有气泡产生,溶液变为粉红色
(3) ①. 在试管中取少量钴粉,加入适量稀硫酸 ②.
③. 有气泡生成
④. 再继续加入碳酸钠溶液 ⑤.
⑥. 有粉红色沉淀生成
(4) ①. Co2+ ②. 1.55b g
【解析】
(1)A、活动性在氢前的金属能与酸反应,不与碱溶液反应,故A错误;
B、H2或者CO具有还原性,能够将钴的氧化物转化为金属钴,故B正确;
C、金属钴(Co)是一种“氢前金属”,能够与盐酸或者稀硫酸反应,故C正确;
D、金属钴的金属活动性介于Zn和Cu之间,所以钴和硫酸锌不反应,故D错误;
故选BC;
(2)碳酸钴属于碳酸盐,能与酸反应,生成对应的盐、水和二氧化碳;验证方法:取CoCO3固体于试管中,加入稀盐酸,有气泡产生,溶液变为粉红色;
(3)实验步骤:1.在试管中取少量钴粉,加入适量稀硫酸,钴与硫酸反应生成硫酸钴和氢气,化学方程式为:,能观察到有气泡生成;
2.再继续加入碳酸钠溶液,碳酸钠与硫酸钴反应生成碳酸钴沉淀和硫酸钠,化学方程式为:,能观察到有粉红色沉淀生成;
(4)①根据三个反应的化学方程式可看出,反应后生成CoSO4,溶液中存在Co2+;
②根据质量守恒定律,矿石中钴元素的质量=CoSO4中钴元素的质量=,则生成CoSO4的质量为=1.55b g。
15. (2022广州市白云区一模)N是空气中含量最高的元素。
(1)将含N物质进行分类,按要求写出化学式
单质 引起酸雨的氧化物 酸 含氮的不同化合价的盐
N2 ______________ HNO3 _______________
(2)镓元素的信息如图。
请设计理论上制备硝酸镓的三种方案(要求含镓原料分别属于不同的化合物类别)
方案 预期反应的化学方程式
① _________________________
② __________________________
③ __________________________
(3)若硫酸铝铵晶体【NH4Al(SO4)2】·12H2O,相对分子质量453】
①加热过程中,其质量随时间的变化如图所示。据此判断,从200℃到50℃间固体是否还存在结晶水,并作出解释。_______(是或否),____________________________。
②写出一个能与硫酸铝溶液发生反应的原子团_______。(写离子符号)
【答案】(1) ①. NO2 ②. NH4NO3
(2) ①. Ga2O3+6HNO3=2Ga(NO3)3+3H2O ②. Ga(OH)3+3HNO3=Ga(NO3)3+3H2O ③. Ga+3AgNO3=Ga(NO3)3+3Ag
(3) ①. 是 ②. 结晶水质量,结晶水完全失去固体质量4.53g-2.16g=2.37g,200℃固体质量2.46g>2.37g ③. OH-
【解析】
(1)二氧化氮和水生成硝酸,能引起酸雨,硝酸铵属于盐,硝酸铵中氮元素既有-3价,又有+5价,故填:NO2;NH4NO3。
(2)镓和硝酸银生成硝酸镓和银,氧化镓和硝酸生成硝酸镓和水,氢氧化镓和硝酸生成硝酸镓和水,故填:Ga2O3+6HNO3=2Ga(NO3)3+3H2O;Ga(OH)3+3HNO3=Ga(NO3)3+3H2O;Ga+3AgNO3=Ga(NO3)3+3Ag。
(3)①硫酸铝铵晶体【NH4Al(SO4)2】·12H2O中结晶水质量,结晶水完全失去质量4.53g-2.16g=2.37g,200℃固体质量2.46g>2.37g,说明固体还含有结晶水,故填:是;结晶水质量,结晶水完全失去质量4.53g-2.16g=2.37g,200℃固体质量2.46g>2.37g。
②铵根离子、铝离子和氢氧根离子不共存,能反应,故填:OH-。
16. (2022广州黄埔区二模)某热电厂用脱硫得到的石膏(CaSO4·2H2O)生产K2SO4肥料的流程如图:
已知:不同温度下,硫酸钾在水溶液、氨溶液中的溶解度:
温度(℃) 0 10 25
水溶液 6.815 8.496 9.937
氨(8%)溶液 1.387 1.558 2.198
氨(35%)溶液 0.442 0.742 0.813
(1)在“脱硫”反应中,将CaCO3粉碎后与水混合成悬浊液的目的是___________。
(2)脱硫过程的化学方程式为:___________。
(3)石膏与饱和(NH4)2CO3溶液相混合发生反应Ⅰ,反应基本类型为___________。
(4)“操作I”的名称是___________。
(5)你认为反应Ⅱ在常温下能实现的原因是___________。
(6)CaSO4·2H2O受热会逐步失去结晶水。取纯净CaSO4·2H2O固体3.44g,进行加热,测定固体质量随温度的变化情况如图所示。CaSO4·2H2O相对分子质量为172。
H点的固体在T2~1400℃范围内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,写出发生反应的化学方程式___________。
【答案】(1)增大反应物的接触面积,加快反应速率
(2)CO2 (3)复分解反应
(4)过滤 (5)硫酸钾在浓氨水中溶解度较小,首先到达饱和结晶析出得到硫酸钾固体
(6)
【解析】
由流程可知,含二氧化硫的烟气加入空气和碳酸钙脱硫后得到石膏,加入碳酸铵溶液得到碳酸钙沉淀和硫酸铵,过滤除去沉淀,得到滤液加入氯化钾和浓氨水得到氯化铵和硫酸钾;
(1)将CaCO3粉碎后与水混合成悬浊液的目的是增大反应物的接触面积,加快反应速率;
(2)根据质量守恒定律,反应前后原子数目种类不变,反应前钙、碳、氧、硫、氢原子数目分别为2、2、16、2、8,反应后钙、碳、氧、硫、氢原子数目分别为2、0、12、2、8,故空格处填:CO2;
(3)已知,石膏为CaSO4·2H2O,石膏与饱和(NH4)2CO3溶液相混合发生反应Ⅰ生成碳酸钙沉淀和硫酸铵,反应是两种化合物交换成分生成另外两种化合物的反应,属于复分解反应;
(4)“操作I”是分离固液的操作,名称是过滤;
(5)由溶解度图表可知,反应Ⅱ在常温下能实现的原因是硫酸钾在浓氨水中溶解度较小,首先到达饱和结晶析出得到硫酸钾固体;
(6)已知,CaSO4·2H2O受热会逐步失去结晶水。如果纯净CaSO4·2H2O固体3.44g全部失去结晶水后得到固体质量为,故H为CaSO4固体;
H点的固体在T2~1400℃范围内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,根据质量守恒定律可知,反应前后元素种类不变,刺激性气味气体为二氧化硫,硫元素化合价在反应后降低,那么应该有元素化合价升高,则另一种气体为氧气,故反应分解生成氧化钙、氧气、二氧化硫,化学方程式为。
17. (2022广州黄埔区二模)向一支装有少量CuO的试管中依次加入下列物质,实验操作如图所示,回答下列问题。
(1)图A实验中加入过量稀H2SO4后,观察到的现象___________。
(2)图B发生反应的化学方程式___________。
(3)如图D,向图C实验后所得溶液中插入新打磨的铝丝,画出图中溶液中一定存在的微观粒子_________。(微粒数目不做要求,不考虑空气、水)。
(4)实验开始时放入试管的CuO质量为4g,则实验最后取出的铝丝最多能增重___________g。
【答案】(1)固体逐渐溶解,无色溶液变为蓝色
(2)、
(3) (4)2.3
【解析】
(1)硫酸和氧化铜能反应生成硫酸铜和水,反应的化学反应方程式为:,A中加入过量硫酸后,观察到的现象固体逐渐溶解,无色溶液变为蓝色;
(2)B中加入过量的氢氧化钠后,氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠,反应的化学方程式为:,过量的硫酸与氢氧化钠反应生成硫酸钠和水,反应的化学方程式为:;
(3)A中加入过量硫酸后,氧化铜和硫酸反应生成硫酸铜和水;B中加入过量的氢氧化钠后,氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠,氢氧化钠和硫酸反应生成硫酸钠和水;图C实验中加入过量稀硫酸后,硫酸与过量的氢氧化钠反应生成硫酸钠和水,硫酸与氢氧化铜反应生成硫酸铜和水,因此C反应停止后,所得溶液中含有的溶质是硫酸、硫酸钠和硫酸铜。
向图C实验后所得溶液中插入新打磨的铝丝,铝和硫酸反应生成硫酸铝和氢气,铝和硫酸铜反应生成铜和硫酸铝,因此溶液中一定含有硫酸钠,硫酸铝,溶液中一定存在的微观粒子是钠离子、铝离子、硫酸根离子,图像为 。
(4)因求实验最后取出的铝丝最多能增重多少,所以假设过量的硫酸的质量无限接近于0,硫酸消耗铝的质量忽略不计。
设反应生成的硫酸铜的质量为x,析出铜的质量为y,消耗铝的质量为z
x=8g
y=3.2g,z=0.9g
则实验最后取出的铝丝最多能增重3.2g-0.9g=2.3g。
18. (2022广州市天河区二模)气体的制取实验是初中化学学习的重要内容。
(1)下列制取气体的实验,发生装置可选用甲的是____________(填字母)。
A. 二氧化锰与浓盐酸加热制取Cl2 B. 锌和稀硫酸制取H2
C. 块状硫化亚铁(FeS)和稀硫酸制取H2S D. 高锰酸钾制取O2
(2)某同学阅读课外资料得知:双氧水分解制取氧气除了用二氧化锰,还可以用氧化铜作催化剂,于是进行了以下实验探究:
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?
【设计实验】以收集到30mL氧气为标准,设计了下列两组实验(其他可能影响实验的因素均忽略)。
实验序号 氯酸钾的质量 其他物质及其质量 待测数据
甲 2.45g /
乙 2.45g CuO0.5g
①上述实验应测量的“待测数据”是_________。
【实验结论】
②实验甲比乙的“待测数据”更________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。实验乙中反应的化学方程式为_______,氯酸钾完全分解后,试管中剩余固体的质量为_______g。
【答案】 ①. D ②. 收集30mL氧气所需要的时间 ③. 大 ④. ⑤. 1.99
【解析】
(1)装置甲为固体加热反应;
A、二氧化锰与浓盐酸加热制取Cl2为固液加热反应,错误;
B、锌和稀硫酸制取H2为固液不加热反应,错误;
C、块状硫化亚铁(FeS)和稀硫酸制取H2S为固液不加热反应,错误;
D、高锰酸钾制取O2为固体加热反应,正确;
故选D;
(2)设计实验:
①催化剂改变反应速率,以收集到30mL氧气为标准,探究氧化铜是否也能作氯酸钾分解的催化剂;则应测量的“待测数据”是收集30mL氧气所需要的时间;
实验结论:
②实验甲没有加入氧化铜,则甲比乙的“待测数据”更大,甲中反应速率更慢,说明氧化铜能加快氯酸钾的分解速率。实验乙中反应为氯酸钾在氧化铜催化作用下加热生成氯化钾和氧气:;
由化学方程式体现的质量关系可知,氯酸钾完全分解后,生成氯化钾质量为1.49g,催化剂氧化铜质量反应前后不变,故试管中剩余固体质量为1.49g+0.5g=1.99g。
同课章节目录
