专题10 表格数据题-【冲刺中考】2023年中考化学二轮复习精品课件(共31张PPT)
文档属性
| 名称 | 专题10 表格数据题-【冲刺中考】2023年中考化学二轮复习精品课件(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-16 00:00:00 | ||
图片预览







文档简介
(共31张PPT)
专题10 表格数据题
2 0 2 3 年 中 考 化 学 第 二 轮 复 习
T H E R E V I E W O F C H E M I S T R Y
人教版
广州专用
人教版
这是近几年广州中考常考的题型,是广州中考向高中化学和高考化学靠拢的体现。本题型主要考查对化学实验产生的数据进行分析和处理的能力,涉及的考点主要有:
①根据表格数据获取结论,如2020年广州中考的第(2)问;
②根据表格获取的结论比较数据大小或确定数据范围,如2022年;
③根据表格判断实验因素(即自变量),如2018年中考第①问;
④根据表格数据判断工业生产应选择的合理/最佳实验条件,如2018年中考第③问;
⑤根据表格数据分析实验目的(如2016、2015年广州中考);
⑥根据题目要求选择优化的反应条件(如2015年广州中考)。综上,中考表格数据分析处理的考查都离不开对表格数据的处理,因此掌握表格数据的处理方法就尤为重要。
命题分析
处理表格数据,要先看表名(或题干中找信息)了解研究目的,再看横、纵表头明确要研究的实验因素与研究内容(即确定好自变量与因变量);最后运用控制变量法进行对比数据分析,分析数据变化趋势获取规律(或结论)。
此外在回答相应的数据结论或目的时,要注意控制变量,即在要规律的开头加上一句话“在其他条件相同的情况下”或“在···条件相同的情况下”。
解题思路分析
增大
减小
氧气的量或质量
考点即练
1、数据处理(学会运用控制变量法,关键在于找到对比项)
2、①问目的(指未确定的因素)
答题技巧:探究(比较)XX对XX的影响
②问结论(指已确定的因素)
答题技巧:其他条件不变时,XX 越XX,XX越XX 。
(问几个因素写几个)
解题思路分析
3、找关键字眼:“最佳条件” “最优”
化工制备则需考虑成本、工艺等因素
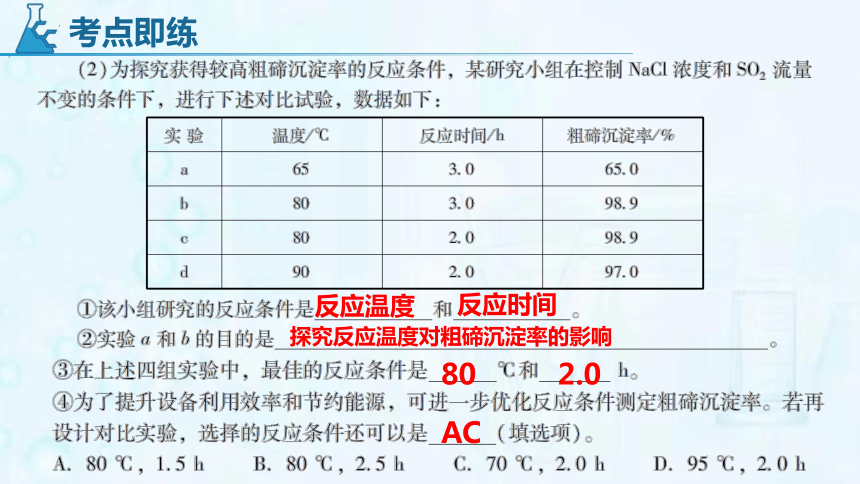
反应温度
反应时间
探究反应温度对粗碲沉淀率的影响
考点即练
80
2.0
AC
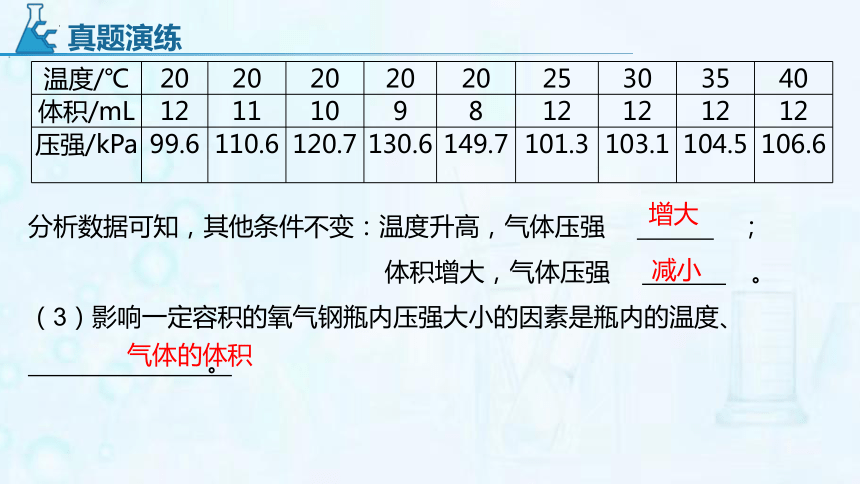
1.(2020 广州节选)今年5月5日成功首飞的长征五号B运载火箭,采用了低温高压液氢作燃料。
(1)从分子的角度分析,氢气变成液氢时发生变化的是 。
(2)如图1所示,将一定量氧气封闭在注射器中,改变氧气的体积和温度,记录不同条件下注射器中氧气的压强大小,结果如表:
真题演练
分子之间的间隔变小
分析数据可知,其他条件不变:温度升高,气体压强 ;
体积增大,气体压强 。
(3)影响一定容积的氧气钢瓶内压强大小的因素是瓶内的温度、 。
温度/℃ 20 20 20 20 20 25 30 35 40
体积/mL 12 11 10 9 8 12 12 12 12
压强/kPa 99.6 110.6 120.7 130.6 149.7 101.3 103.1 104.5 106.6
真题演练
增大
减小
气体的体积
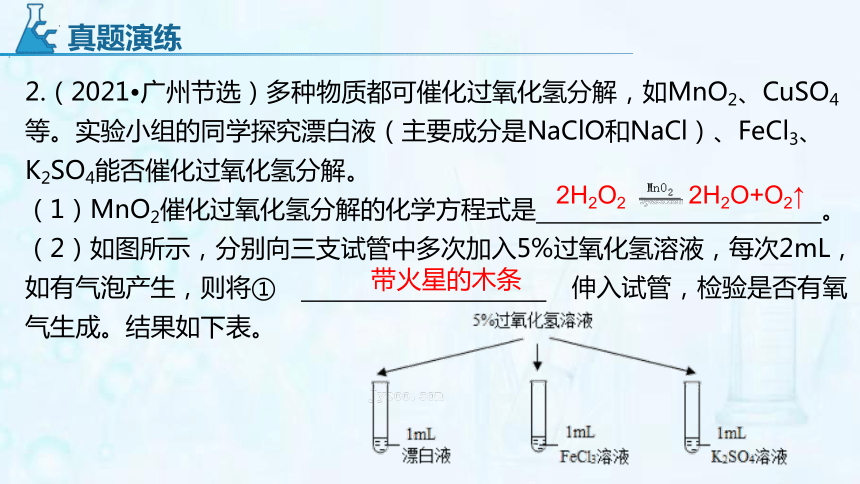
2.(2021 广州节选)多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是NaClO和NaCl)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是 。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将① 伸入试管,检验是否有氧气生成。结果如下表。
真题演练
2H2O2 2H2O+O2↑
带火星的木条
(3)下列物质中,也可能是过氧化氢分解的催化剂的是 (填标号)。
A.CuCl2 B.Fe2(SO4)3
C.Na2SO4 D.KCl
研究对象 第1次 第2次 第3次 第4次
漂白液 大量气泡 较多气泡 少量气泡 无气泡
FeCl3溶液 较多气泡 较多气泡 较多气泡 较多气泡
K2SO4溶液 ② , / / /
实验结论 ⅰ.实验中产生的气体都是氧气。(查阅得知:NaClO+H2O2═O2↑+NaCl+H2O)ⅱ.K2SO4不能催化过氧化氢分解。ⅲ.③ 可能是过氧化氢分解的催化剂。ⅳ.…… 真题演练
无气泡产生
FeCl3
AB
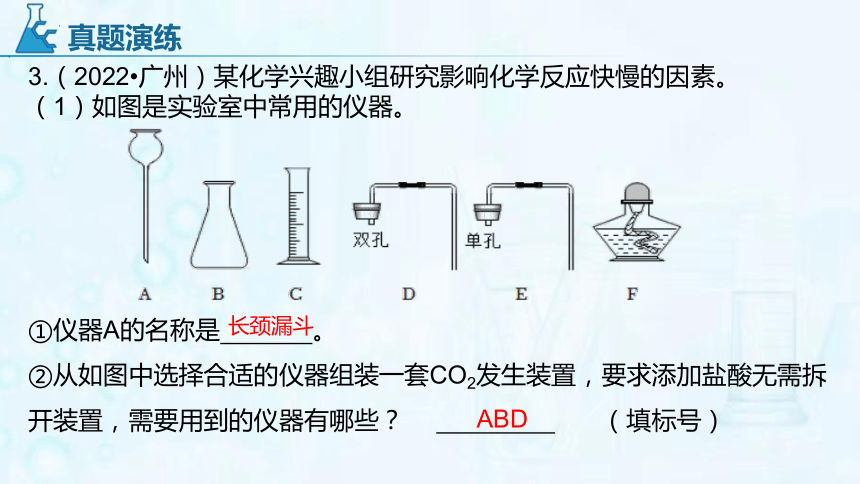
3.(2022 广州)某化学兴趣小组研究影响化学反应快慢的因素。
(1)如图是实验室中常用的仪器。
①仪器A的名称是 。
②从如图中选择合适的仪器组装一套CO2发生装置,要求添加盐酸无需拆开装置,需要用到的仪器有哪些? (填标号)
真题演练
长颈漏斗
ABD
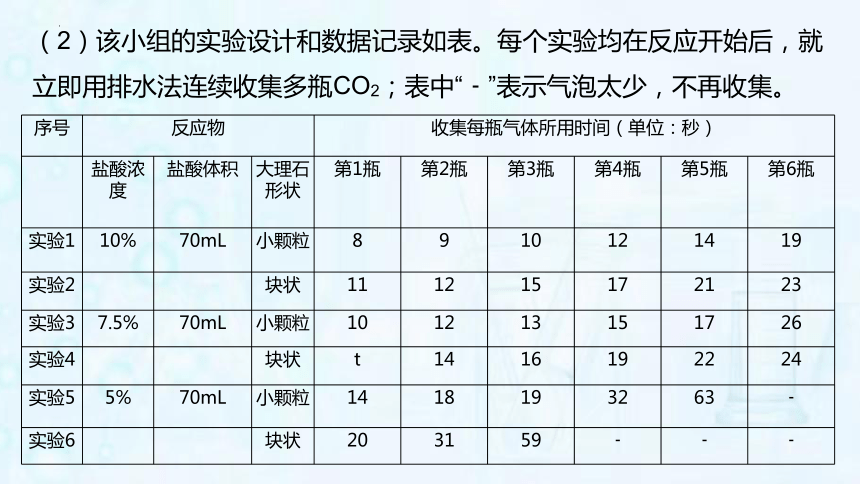
(2)该小组的实验设计和数据记录如表。每个实验均在反应开始后,就立即用排水法连续收集多瓶CO2;表中“﹣”表示气泡太少,不再收集。
序号 反应物 收集每瓶气体所用时间(单位:秒) 盐酸浓度 盐酸体积 大理石形状 第1瓶 第2瓶 第3瓶 第4瓶 第5瓶 第6瓶
实验1 10% 70mL 小颗粒 8 9 10 12 14 19
实验2 块状 11 12 15 17 21 23
实验3 7.5% 70mL 小颗粒 10 12 13 15 17 26
实验4 块状 t 14 16 19 22 24
实验5 5% 70mL 小颗粒 14 18 19 32 63 ﹣
实验6 块状 20 31 59 ﹣ ﹣ ﹣
①该小组研究了哪些因素对反应快慢的影响? 。
②为了分析浓度对反应快慢的影响,可对比表中实验 (填标号)。
A.2和3 B.2和4
C.4和5 D.1和6
③根据实验数据反映出的规律,表中数值t的合理范围是:
<t< 。
(3)该小组在反应开始后立即收集第1瓶气体,你认为该做法合理吗?说出你的观点并阐述理由。
盐酸浓度、大理石形状
B
11
14
合理,每个实验均在反应开始后,就立即用排水法,收集的空气体积一样多。
课后作业
1.催化还原CO2是解决温室效应及能源问题的重要手段之一。某实验室在催化剂作用下,用H2还原CO2,控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
序号 T(℃) 催化剂 CO2转化率(%)
① 270 催化剂1 12.3
② 270 催化剂2 10.9
③ 280 催化剂1 15.3
④ 280 催化剂2 12.0
强化训练
(1)本实验研究了哪些因素对H2还原CO2的影响?
。
(2)根据上表数据,其他条件不变,温度升高,CO2的
转化率 。
(3)除上述影响因素外,还可通过改变 来探究影响CO2转化率的因素。
(4)从分子的角度分析,将二氧化碳气体进行加压降温时,发生变化的是 。
温度和催化剂种类
增大
CO2和H2初始投料比
分子间的间隙
强化训练
2. “重结晶”是将蒸发结晶得到的无水氢氧化锶粗品溶于适量热水,趁热滤去未溶解的固体后,冷却结晶得到Sr(OH)2 8H2O。为探究蒸馏水用量对Sr(OH)2 8H2O纯度及产率的影响,设计一系列探究实验,结果如表所示。分析表格数据可知,最合适的实验条件为 (填序号),当蒸馏水用量大于该条件时,Sr(OH)2 8H2O产率减小,试推测其原因 ,
。
5
随着蒸馏水溶剂的增加,在冷却结晶过滤的过程中
部分氢氧化锶留在母液中导致产率过低
强化训练
序号 1 2 3 4 5 6 7
无水Sr(OH)2粗品质量/g 10.0 10.0 10.0 10.0 10.0 10.0 10.0
蒸馏水质量/g 40.0 50.0 60.0 70.0 80.0 90.0 100
Sr(OH)2 8H2O纯度/% 98.6 98.6 98.6 98.6 98.6 98.6 98.6
Sr(OH)2 8H2O产率% 17.91 53.36 63.50 72.66 92.17 89.65 88.93
强化训练
(1)将精制氢氧化锶配成溶液,与氯化镁溶液在90℃时反应一段时间,写出反应的化学方程式 ,判断MgCl2已经加足的方法是 ,
。
(2)步骤⑤降温结晶制备SrCl2 H2O,需要40%的SrCl2溶液100g,该溶液可由10%的SrCl2溶液蒸发 g水获得。
Sr(OH)2+MgCl2=Mg(OH)2↓+SrCl2
取反应后的上层清液
滴加氯化镁溶液观察是否有沉淀生成
300
强化训练
3. 实验小组围绕金属镁展开系列实验。
(1)镁在常温下能与空气中的氧气反应,表面形成一层致密的氧化物薄膜,该反应的化学方程式为 。
(2)镁与酸的反应:向试管中放入几小块镁片;把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如图1所示。请回答:
2Mg+O2=2MgO
强化训练
①实验中观察到的现象有: ,
。
②如图2为滴入盐酸前烧杯内澄清石灰水的离子情况示意图,请将滴加
5mL盐酸后,烧杯内离子情况在图中补充完整 (不考虑空气和水)。
镁条逐渐溶解,剧烈反应,有气泡产生
澄清石灰水变浑浊
强化训练
(3)镁与水的反应:
查阅资料:1.Mg在冷水中就可以反应生成难溶性碱和氢气,但反应很慢;2.NH4Cl可以加快镁与水的反应。
为探究NaHCO3、NaCl、K2SO4对镁与水反应是否有促进作用,实验小组用如图装置进行对比实验。结果如下。
实验序号 a b c
盐溶液(浓度相同) NaHCO3 NaCl K2SO4
溶液起始pH 8.3 7 7
30min时产生气体体积(mL) 0.7 <0.1 <0.1
气体的主要成分 H2 30min时镁条表面情况 有固体附着(固体可溶于盐酸) 强化训练
①实验结论: (填物质名称)对镁与水反应有促进作用。
②根据上述资料及实验,下列物质中,也可能对镁与水反应有促进作用的是 (填字母)。
A.(NH4)2SO4 B.KCl
C.Na2SO4 D.KHCO3
③写出Mg在冷水中反应的化学方程式
。
4.下表数据是在一定温度下,金属镁和镍分别在表面生成氧化薄膜的实验记录:
碳酸氢钠
AD
Mg+2H2O═Mg(OH)2+H2↑
强化训练
注:a和b均为与温度有关的常数,nm表示“纳米”
①在一定温度下,镁表面生成氧化薄膜的化学方程式
为 。
②镁与镍比较, 生成氧化物薄膜的速度更快。
2Mg+O2 2MgO
反应时间/h 1 4 9 16 25
镁表面氧化薄膜层厚/nm 0.05a 0.2a 0.45a 0.8a 1.25a
镍表面氧化薄膜层厚/nm b 2b 3b 4b 5b
镁
强化训练
5.实验人员分别探究了双氧水、漂白粉、漂粉精处理该厂废水的最佳药剂使用条件。其实验数据如表:
药剂使用条件:
药剂 适应pH值 反应时间/min 药剂与COD用量比 COD去除率/%
双氧水 4~5 ≥4 7.7:1 91.9
漂白粉 4﹣10 ≥10 ≥14.5:1 91.6
漂粉精 4~10 ≥6 ≥7.3:1 93.8
强化训练
若不考虑成本因素,你认为,处理该厂废水的最佳药剂是 。选择的原因是: ,
。 (请写出其中的两点)
漂粉精
适应的pH范围广,去除相同COD的量,使用的量最少
COD去除率高(从中任选两点回答即可)
强化训练
6.绿矾(FeSO4 7H2O)古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。课外小组的同学对其变色产生兴趣,开展如下探究活动。
【查阅资料】
ⅰ.含有Fe3+的盐溶液遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
【进行实验】
强化训练
实验1:分别取等量10% FeSO4溶液进行下列三组实验
序号 ① ② ③
操作
实验现象 溶液逐渐变为黄色 更长时间后溶液变为黄色 溶液颜色不变
强化训练
实验2:分别取等量10% FeSO4溶液进行下列四组实验
编号 A B C D
实验内容
现象 30min 变黄 不变色 变黄 不变色
2h 黄色加深 不变色;滴加KSCN溶液,略显红色 黄色加深 不变色;滴加KSCN溶液,无明显现象
强化训练
实验3:如图所示,取10%的Fe2(SO4)3溶液20mL于小烧杯中,加入一定量铁粉,搅拌,观察到铁粉减少,溶液变为浅绿色。
(1)实验1的探究了 个问题。其问题之一是
,
。
(2)探究2的B实验中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。
4FeSO4+2H2SO4+O2═2Fe2(SO4)3+ 。
两
氧气可使硫酸亚铁氧化为硫酸铁
(或氧气浓度越高,硫酸亚铁被氧化速率越快)
2H2O
强化训练
(3)实验3探究铁钉在抑制硫酸亚铁变质中所起的作用,原理用化学方程式表示为 。
(4)从实验结果看,单纯向FeSO4溶液中放入铁钉, (填“能”或“不能”)抑制FeSO4变质。
(5)向硫酸亚铁溶液中加入稀硫酸能抑制其变质,得出此结论的依据
是 。
Fe2(SO4)3+Fe=3FeSO4
不能
实验A与B
强化训练
专题10 表格数据题
2 0 2 3 年 中 考 化 学 第 二 轮 复 习
T H E R E V I E W O F C H E M I S T R Y
人教版
广州专用
人教版
这是近几年广州中考常考的题型,是广州中考向高中化学和高考化学靠拢的体现。本题型主要考查对化学实验产生的数据进行分析和处理的能力,涉及的考点主要有:
①根据表格数据获取结论,如2020年广州中考的第(2)问;
②根据表格获取的结论比较数据大小或确定数据范围,如2022年;
③根据表格判断实验因素(即自变量),如2018年中考第①问;
④根据表格数据判断工业生产应选择的合理/最佳实验条件,如2018年中考第③问;
⑤根据表格数据分析实验目的(如2016、2015年广州中考);
⑥根据题目要求选择优化的反应条件(如2015年广州中考)。综上,中考表格数据分析处理的考查都离不开对表格数据的处理,因此掌握表格数据的处理方法就尤为重要。
命题分析
处理表格数据,要先看表名(或题干中找信息)了解研究目的,再看横、纵表头明确要研究的实验因素与研究内容(即确定好自变量与因变量);最后运用控制变量法进行对比数据分析,分析数据变化趋势获取规律(或结论)。
此外在回答相应的数据结论或目的时,要注意控制变量,即在要规律的开头加上一句话“在其他条件相同的情况下”或“在···条件相同的情况下”。
解题思路分析
增大
减小
氧气的量或质量
考点即练
1、数据处理(学会运用控制变量法,关键在于找到对比项)
2、①问目的(指未确定的因素)
答题技巧:探究(比较)XX对XX的影响
②问结论(指已确定的因素)
答题技巧:其他条件不变时,XX 越XX,XX越XX 。
(问几个因素写几个)
解题思路分析
3、找关键字眼:“最佳条件” “最优”
化工制备则需考虑成本、工艺等因素
反应温度
反应时间
探究反应温度对粗碲沉淀率的影响
考点即练
80
2.0
AC
1.(2020 广州节选)今年5月5日成功首飞的长征五号B运载火箭,采用了低温高压液氢作燃料。
(1)从分子的角度分析,氢气变成液氢时发生变化的是 。
(2)如图1所示,将一定量氧气封闭在注射器中,改变氧气的体积和温度,记录不同条件下注射器中氧气的压强大小,结果如表:
真题演练
分子之间的间隔变小
分析数据可知,其他条件不变:温度升高,气体压强 ;
体积增大,气体压强 。
(3)影响一定容积的氧气钢瓶内压强大小的因素是瓶内的温度、 。
温度/℃ 20 20 20 20 20 25 30 35 40
体积/mL 12 11 10 9 8 12 12 12 12
压强/kPa 99.6 110.6 120.7 130.6 149.7 101.3 103.1 104.5 106.6
真题演练
增大
减小
气体的体积
2.(2021 广州节选)多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是NaClO和NaCl)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是 。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将① 伸入试管,检验是否有氧气生成。结果如下表。
真题演练
2H2O2 2H2O+O2↑
带火星的木条
(3)下列物质中,也可能是过氧化氢分解的催化剂的是 (填标号)。
A.CuCl2 B.Fe2(SO4)3
C.Na2SO4 D.KCl
研究对象 第1次 第2次 第3次 第4次
漂白液 大量气泡 较多气泡 少量气泡 无气泡
FeCl3溶液 较多气泡 较多气泡 较多气泡 较多气泡
K2SO4溶液 ② , / / /
实验结论 ⅰ.实验中产生的气体都是氧气。(查阅得知:NaClO+H2O2═O2↑+NaCl+H2O)ⅱ.K2SO4不能催化过氧化氢分解。ⅲ.③ 可能是过氧化氢分解的催化剂。ⅳ.…… 真题演练
无气泡产生
FeCl3
AB
3.(2022 广州)某化学兴趣小组研究影响化学反应快慢的因素。
(1)如图是实验室中常用的仪器。
①仪器A的名称是 。
②从如图中选择合适的仪器组装一套CO2发生装置,要求添加盐酸无需拆开装置,需要用到的仪器有哪些? (填标号)
真题演练
长颈漏斗
ABD
(2)该小组的实验设计和数据记录如表。每个实验均在反应开始后,就立即用排水法连续收集多瓶CO2;表中“﹣”表示气泡太少,不再收集。
序号 反应物 收集每瓶气体所用时间(单位:秒) 盐酸浓度 盐酸体积 大理石形状 第1瓶 第2瓶 第3瓶 第4瓶 第5瓶 第6瓶
实验1 10% 70mL 小颗粒 8 9 10 12 14 19
实验2 块状 11 12 15 17 21 23
实验3 7.5% 70mL 小颗粒 10 12 13 15 17 26
实验4 块状 t 14 16 19 22 24
实验5 5% 70mL 小颗粒 14 18 19 32 63 ﹣
实验6 块状 20 31 59 ﹣ ﹣ ﹣
①该小组研究了哪些因素对反应快慢的影响? 。
②为了分析浓度对反应快慢的影响,可对比表中实验 (填标号)。
A.2和3 B.2和4
C.4和5 D.1和6
③根据实验数据反映出的规律,表中数值t的合理范围是:
<t< 。
(3)该小组在反应开始后立即收集第1瓶气体,你认为该做法合理吗?说出你的观点并阐述理由。
盐酸浓度、大理石形状
B
11
14
合理,每个实验均在反应开始后,就立即用排水法,收集的空气体积一样多。
课后作业
1.催化还原CO2是解决温室效应及能源问题的重要手段之一。某实验室在催化剂作用下,用H2还原CO2,控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
序号 T(℃) 催化剂 CO2转化率(%)
① 270 催化剂1 12.3
② 270 催化剂2 10.9
③ 280 催化剂1 15.3
④ 280 催化剂2 12.0
强化训练
(1)本实验研究了哪些因素对H2还原CO2的影响?
。
(2)根据上表数据,其他条件不变,温度升高,CO2的
转化率 。
(3)除上述影响因素外,还可通过改变 来探究影响CO2转化率的因素。
(4)从分子的角度分析,将二氧化碳气体进行加压降温时,发生变化的是 。
温度和催化剂种类
增大
CO2和H2初始投料比
分子间的间隙
强化训练
2. “重结晶”是将蒸发结晶得到的无水氢氧化锶粗品溶于适量热水,趁热滤去未溶解的固体后,冷却结晶得到Sr(OH)2 8H2O。为探究蒸馏水用量对Sr(OH)2 8H2O纯度及产率的影响,设计一系列探究实验,结果如表所示。分析表格数据可知,最合适的实验条件为 (填序号),当蒸馏水用量大于该条件时,Sr(OH)2 8H2O产率减小,试推测其原因 ,
。
5
随着蒸馏水溶剂的增加,在冷却结晶过滤的过程中
部分氢氧化锶留在母液中导致产率过低
强化训练
序号 1 2 3 4 5 6 7
无水Sr(OH)2粗品质量/g 10.0 10.0 10.0 10.0 10.0 10.0 10.0
蒸馏水质量/g 40.0 50.0 60.0 70.0 80.0 90.0 100
Sr(OH)2 8H2O纯度/% 98.6 98.6 98.6 98.6 98.6 98.6 98.6
Sr(OH)2 8H2O产率% 17.91 53.36 63.50 72.66 92.17 89.65 88.93
强化训练
(1)将精制氢氧化锶配成溶液,与氯化镁溶液在90℃时反应一段时间,写出反应的化学方程式 ,判断MgCl2已经加足的方法是 ,
。
(2)步骤⑤降温结晶制备SrCl2 H2O,需要40%的SrCl2溶液100g,该溶液可由10%的SrCl2溶液蒸发 g水获得。
Sr(OH)2+MgCl2=Mg(OH)2↓+SrCl2
取反应后的上层清液
滴加氯化镁溶液观察是否有沉淀生成
300
强化训练
3. 实验小组围绕金属镁展开系列实验。
(1)镁在常温下能与空气中的氧气反应,表面形成一层致密的氧化物薄膜,该反应的化学方程式为 。
(2)镁与酸的反应:向试管中放入几小块镁片;把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如图1所示。请回答:
2Mg+O2=2MgO
强化训练
①实验中观察到的现象有: ,
。
②如图2为滴入盐酸前烧杯内澄清石灰水的离子情况示意图,请将滴加
5mL盐酸后,烧杯内离子情况在图中补充完整 (不考虑空气和水)。
镁条逐渐溶解,剧烈反应,有气泡产生
澄清石灰水变浑浊
强化训练
(3)镁与水的反应:
查阅资料:1.Mg在冷水中就可以反应生成难溶性碱和氢气,但反应很慢;2.NH4Cl可以加快镁与水的反应。
为探究NaHCO3、NaCl、K2SO4对镁与水反应是否有促进作用,实验小组用如图装置进行对比实验。结果如下。
实验序号 a b c
盐溶液(浓度相同) NaHCO3 NaCl K2SO4
溶液起始pH 8.3 7 7
30min时产生气体体积(mL) 0.7 <0.1 <0.1
气体的主要成分 H2 30min时镁条表面情况 有固体附着(固体可溶于盐酸) 强化训练
①实验结论: (填物质名称)对镁与水反应有促进作用。
②根据上述资料及实验,下列物质中,也可能对镁与水反应有促进作用的是 (填字母)。
A.(NH4)2SO4 B.KCl
C.Na2SO4 D.KHCO3
③写出Mg在冷水中反应的化学方程式
。
4.下表数据是在一定温度下,金属镁和镍分别在表面生成氧化薄膜的实验记录:
碳酸氢钠
AD
Mg+2H2O═Mg(OH)2+H2↑
强化训练
注:a和b均为与温度有关的常数,nm表示“纳米”
①在一定温度下,镁表面生成氧化薄膜的化学方程式
为 。
②镁与镍比较, 生成氧化物薄膜的速度更快。
2Mg+O2 2MgO
反应时间/h 1 4 9 16 25
镁表面氧化薄膜层厚/nm 0.05a 0.2a 0.45a 0.8a 1.25a
镍表面氧化薄膜层厚/nm b 2b 3b 4b 5b
镁
强化训练
5.实验人员分别探究了双氧水、漂白粉、漂粉精处理该厂废水的最佳药剂使用条件。其实验数据如表:
药剂使用条件:
药剂 适应pH值 反应时间/min 药剂与COD用量比 COD去除率/%
双氧水 4~5 ≥4 7.7:1 91.9
漂白粉 4﹣10 ≥10 ≥14.5:1 91.6
漂粉精 4~10 ≥6 ≥7.3:1 93.8
强化训练
若不考虑成本因素,你认为,处理该厂废水的最佳药剂是 。选择的原因是: ,
。 (请写出其中的两点)
漂粉精
适应的pH范围广,去除相同COD的量,使用的量最少
COD去除率高(从中任选两点回答即可)
强化训练
6.绿矾(FeSO4 7H2O)古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。课外小组的同学对其变色产生兴趣,开展如下探究活动。
【查阅资料】
ⅰ.含有Fe3+的盐溶液遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
【进行实验】
强化训练
实验1:分别取等量10% FeSO4溶液进行下列三组实验
序号 ① ② ③
操作
实验现象 溶液逐渐变为黄色 更长时间后溶液变为黄色 溶液颜色不变
强化训练
实验2:分别取等量10% FeSO4溶液进行下列四组实验
编号 A B C D
实验内容
现象 30min 变黄 不变色 变黄 不变色
2h 黄色加深 不变色;滴加KSCN溶液,略显红色 黄色加深 不变色;滴加KSCN溶液,无明显现象
强化训练
实验3:如图所示,取10%的Fe2(SO4)3溶液20mL于小烧杯中,加入一定量铁粉,搅拌,观察到铁粉减少,溶液变为浅绿色。
(1)实验1的探究了 个问题。其问题之一是
,
。
(2)探究2的B实验中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。
4FeSO4+2H2SO4+O2═2Fe2(SO4)3+ 。
两
氧气可使硫酸亚铁氧化为硫酸铁
(或氧气浓度越高,硫酸亚铁被氧化速率越快)
2H2O
强化训练
(3)实验3探究铁钉在抑制硫酸亚铁变质中所起的作用,原理用化学方程式表示为 。
(4)从实验结果看,单纯向FeSO4溶液中放入铁钉, (填“能”或“不能”)抑制FeSO4变质。
(5)向硫酸亚铁溶液中加入稀硫酸能抑制其变质,得出此结论的依据
是 。
Fe2(SO4)3+Fe=3FeSO4
不能
实验A与B
强化训练
同课章节目录
