专题08 物质的转化和制备-【冲刺中考】2023年中考化学二轮复习精品课件(共24张PPT)
文档属性
| 名称 | 专题08 物质的转化和制备-【冲刺中考】2023年中考化学二轮复习精品课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-16 10:42:53 | ||
图片预览






文档简介
(共24张PPT)
专题08 物质的转化和制备
2 0 2 3 年 中 考 化 学 第 二 轮 复 习
T H E R E V I E W O F C H E M I S T R Y
人教版
广州专用
人教版
物质性质预测或推测题型是广州中考最近几年的新题型,其基本的设题原理是根据物质的类别,物质的构成去推测物质的可能性质,或推测制取不熟知物质的可能过程(以书写相关化学方程式的形式出现),设置分值为9-10分,它算是最近三年广州中考的压轴题。
在能力层面主要考核考生从题目的文字、表和图片中获取信息、运用所学的知识进行信息分类,并根据分类进行信息处理的能力,考查考生化学实验报告书写的能力。
主要考查的方法有:
(1)物质的分类
(2)物质类别的性质
(3)物质间的相互关系
(4)常见离子及其代表性物质的性质和物质的鉴别等。
命题分析
一、性质预测:
①将物质拆成对应的阴、阳离子
②根据溶解性表和复分解反应条件(反应物无酸必可溶,产物H2O、↑、↓之一)、金属活动性顺序表写出可反应的物质类别(细化到是否可溶性,如可溶性碱、活泼金属)
③陌生的物质结合题目给的资料推测可发生的反应
(如:是否受热分解、表格是否有相应的沉淀)
一般考查
复分解反应、置换反应
预测的依据:
①若有模板则按照参考模板填写
②没有模板,则写成:XX(物质)中含有XX(离子),可与XX(离子)反应生成XX(物质)。
如:Na2CO3中含有CO32-,可与H+反应生成H2O和CO2
解题思路分析
一、物质性质的预测
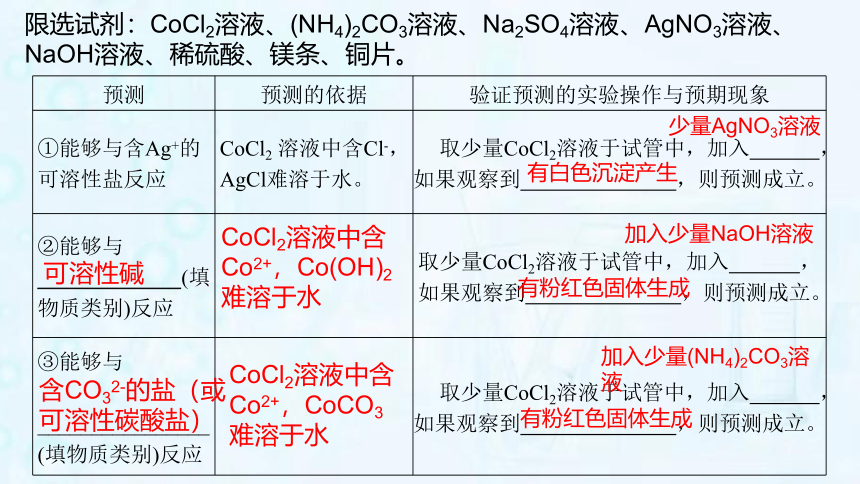
1.(2019.广州)已知金属钴(Co)的活动性与铁相似,请预测氯化钴(CoCl2)的化学性质,说明预测的依据,并设计实验验证。经查阅资料,钴的化合物相关性质如下:
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中溶的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
考点即练
限选试剂:CoCl2溶液、(NH4)2CO3溶液、Na2SO4溶液、AgNO3溶液、NaOH溶液、稀硫酸、镁条、铜片。
预测 预测的依据 验证预测的实验操作与预期现象
①能够与含Ag+的 可溶性盐反应 CoCl2 溶液中含Cl-, AgCl难溶于水。 取少量CoCl2溶液于试管中,加入 ,如果观察到 ,则预测成立。
②能够与 _____________(填物质类别)反应
取少量CoCl2溶液于试管中,加入 ,如果观察到 ,则预测成立。
③能够与 ________________ (填物质类别)反应 取少量CoCl2溶液于试管中,加入 ,如果观察到 ,则预测成立。
少量AgNO3溶液
有白色沉淀产生
可溶性碱
CoCl2溶液中含Co2+,Co(OH)2难溶于水
加入少量NaOH溶液
有粉红色固体生成
含CO32-的盐(或可溶性碳酸盐)
CoCl2溶液中含Co2+,CoCO3难溶于水
加入少量(NH4)2CO3溶液
有粉红色固体生成
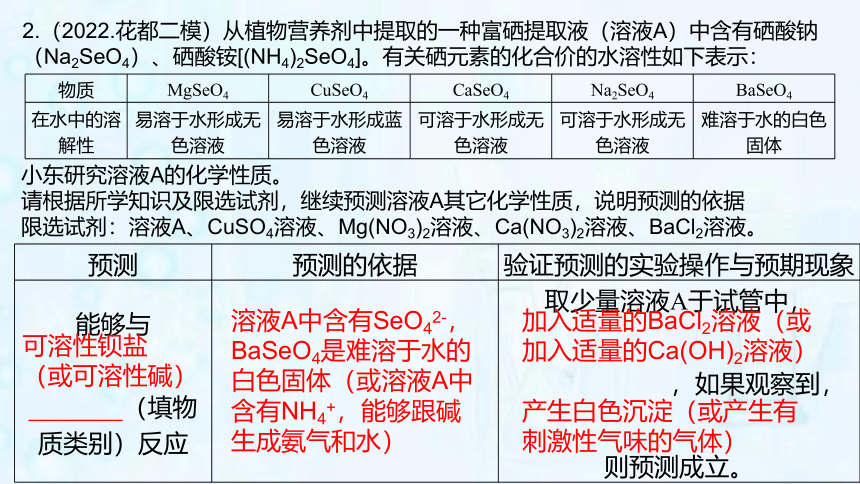
小东研究溶液A的化学性质。
请根据所学知识及限选试剂,继续预测溶液A其它化学性质,说明预测的依据
限选试剂:溶液A、CuSO4溶液、Mg(NO3)2溶液、Ca(NO3)2溶液、BaCl2溶液。
预测 预测的依据 验证预测的实验操作与预期现象
能够与 (填物质类别)反应 取少量溶液A于试管中,
,如果观察到,
则预测成立。
可溶性钡盐(或可溶性碱)
溶液A中含有SeO42-,BaSeO4是难溶于水的白色固体(或溶液A中含有NH4+,能够跟碱生成氨气和水)
加入适量的BaCl2溶液(或加入适量的Ca(OH)2溶液)
产生白色沉淀(或产生有刺激性气味的气体)
2.(2022.花都二模)从植物营养剂中提取的一种富硒提取液(溶液A)中含有硒酸钠(Na2SeO4)、硒酸铵[(NH4)2SeO4]。有关硒元素的化合价的水溶性如下表示:
物质 MgSeO4 CuSeO4 CaSeO4 Na2SeO4 BaSeO4
在水中的溶解性 易溶于水形成无色溶液 易溶于水形成蓝色溶液 可溶于水形成无色溶液 可溶于水形成无色溶液 难溶于水的白色固体
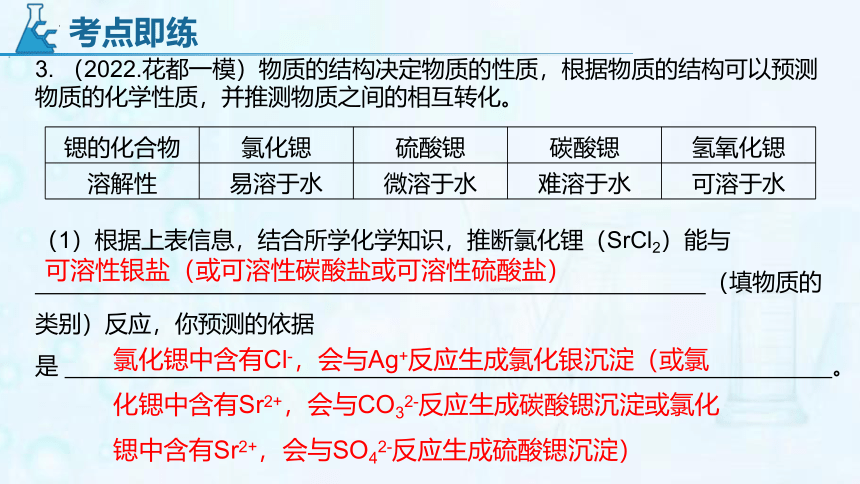
3. (2022.花都一模)物质的结构决定物质的性质,根据物质的结构可以预测物质的化学性质,并推测物质之间的相互转化。
锶的化合物 氯化锶 硫酸锶 碳酸锶 氢氧化锶
溶解性 易溶于水 微溶于水 难溶于水 可溶于水
(1)根据上表信息,结合所学化学知识,推断氯化锂(SrCl2)能与
(填物质的类别)反应,你预测的依据是 。
可溶性银盐(或可溶性碳酸盐或可溶性硫酸盐)
氯化锶中含有Cl-,会与Ag+反应生成氯化银沉淀(或氯化锶中含有Sr2+,会与CO32-反应生成碳酸锶沉淀或氯化锶中含有Sr2+,会与SO42-反应生成硫酸锶沉淀)
考点即练
二、物质制备:
依据的反应规律:
①若有模板则按照参考模板填写
②没有模板,则写成:
例 X与XX反应生成X(沉淀、气体或水),
或 。
活泼金属+酸→盐+氢气
①将物质拆成对应的阴、阳离子
②阴离子 对应的酸或盐,首选酸
阳离子 金属单质、氧化物、盐、碱
③要符合复分解反应条件(反应物无酸必可溶,产物H2O、↑、↓之一)、金属活动性顺序
一般考查
复分解反应、置换反应
解题思路分析
1.(2021.广州)已知硫酸镉易溶于水,设计三种制备硫酸镉的方案(要求含镉原料分别属于不同的物质类别)。完成下表:
方案 预期反应的化学方程式 依据的反应规律
① 金属活动性顺序里,前面的金属能把后面的金属从它化合物的溶液里置换出来
②
③ (略)
Cd+CuSO4=Cu+CdSO4
CdO+H2SO4=H2O+CdSO4
Cd(OH)2+H2SO4=2H2O+CdSO4
④CdCO3+H2SO4=CdSO4+2H2O+CO2↑
酸+金属氧化物→盐+水
或酸与金属氧化物反应生成盐和水
考点即练
2.(2020.广州)将化学物质进行合理分类是研究物质及其变化的常用方法。
(1)以下物质的分类对于预测其化学性质没有帮助的是_____ (填标号)。
A.二氧化硫属于非金属氧化物 B.锌属于“氢前金属”
C.氢氧化锰属于白色固体 D.硫酸亚铁属于硫酸盐
(2)碳酸锂(Li2CO3) 广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。结合所学知识预测,Li2CO3能与____(填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中,________________________________。
C
酸
滴入稀盐酸,固体溶解并产生气泡
考点即练
(3)依据各类物质之间的反应规律,设计两种制备Li2CO3 的方案(要求依据两种不同的反应规律),完成下表:
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 两种盐反应生成两种新盐生成物中有沉淀
② ________
Na2CO3溶液
Li2SO4 + Na2CO3 = Li2CO3↓ + Na2SO4
LiOH溶液
CO2
2LiOH + CO2 = Li2CO3↓ + H2O
碱与非金属氧化物反应生成盐和水
考点即练
1.(2022.广州)镓(Ga)及其化合物应用广泛。常用于半导体、合金材料等工业。已知:镓在化合物中常显+3价;金属活动性顺序:Zn> Ga >Fe。
(1)镓的氧化物的化学式为________。
(2)氢氧化镓是难溶于水的白色固体。
①上述信息中能用于推测氢氧化镓化学性质的是_____ (填标号)。
A.“氢氧化镓” B.“难溶于水” C.“白色固体”
②取少量氢氧化镓固体于试管中,加入无色溶液X,充分振荡后固体完全溶解。溶液X可能是______或_______ (填化学式) 。
(3)设计金属镓转化为氢氧化镓的一种方案:__________________________ (依次写出化学方程式)。
Ga2O3
AB
HCl
H2SO4
2Ga + 6HCl == 2CaCl3 + 3H2↑
GaCl3 +3NaOH === Ga(OH)3↓+ 3NaCl
真题演练
2.(2021.广州)镉(Cd)及其化合物在电镀、电池、颜料等领域中有广泛应用。镉是种“氢前金属”,金属活动性介于锌和铜之间。镉元素常见化合价为+2。
(1)将含镉物质进行分类,各举一例填入图中(写化学式)。
(2)根据金属化学性质的一般规律,下列预测合理的是 (填标号)。
A.镉能与氢氧化钠溶液反应
B.H2或CO能将镉的氧化物转化为金属镉
C.镉能与盐酸或稀硫酸反应
D.硫酸镉溶液中的硫酸锌可加入镉粉除去
BC
CdO
Cd(OH)2
CdCl2或CdSO4或CdCO3
课后作业
1.(2022.从化一模)Goodenough等人因在锂离子电池及钴酸锂(LiCoO2)、 磷酸铁锂(LiFePO4) 等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)新能源电动汽车使用的磷酸铁锂电池反应原理为:LiFePO4 FePO4 + Li,该反应充电时,发生的化学反应属于 反应(填基本反应类型)。
(2)以下分类对于预测该物质化学性质没有帮助的是 (填标号)。
A.磷酸铁锂属于磷酸盐 B.锂属于“活泼金属”
C.钴酸锂属于白色固体 D.磷酸铁属于铁盐
分解
C
强化训练
(3)快据各类物质之间的反应规律,设计两种制备磷酸铁(FePO4) 的方案(要求依据两种不同的反应规律)。
已知:①磷酸铁(FePO4) 的铁元素正三价,是一种几乎不溶于水的白色固体;②磷酸(H3PO4)为可溶性酸。完成下表:
方案 原料 预期反应的化学方程式 依据的反应规律
① 金属氧化物与酸反应生成盐和水
②
Fe2O3和H3PO4
Fe2O3+2H3PO4= 2FePO4+3H2O
H3PO4和Fe(OH)3
H3PO4+Fe(OH)3= FePO4+3H2O
酸与碱反应生成盐和水
强化训练
2. (2022.番禺一模)金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,Co元素常见的化合价为+2和+3。金属Co与酸反应后显+2,Co元素常见的化合物相关性质如下:
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
(1)根据金属化学性质的一般规律。下列预测合理的是 。
A. 钴能够与氢氧化钠溶液反应
B. H2或者CO能够将钴的氧化物转化为金属钴
C. 钴能够与盐酸或者稀硫酸反应
D. 硫酸钴溶液中的硫酸锌可以加入钴粉除去
BC
强化训练
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
(2)碳酸钴(CoCO3)是一种难溶于水的粉红色固体,结合所学知识预测,CoCO3能与 (填物质类别)反应,验证预测的实验操作和预期现象是:取CoCO3固体于试管中, 。
加入稀盐酸,有气泡产生,溶液变为粉红色
酸
强化训练
(3)依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。
限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
实验步骤 预期反应的化学方程式 预期反应的实验现象
在试管中取少量钴粉,加入适量稀硫酸。
Co+H2SO4=CoSO4+H2↑
固体溶解,有气泡产生
再继续加入碳酸钠溶液。
Na2CO3+CoSO4=CoCO3↓+Na2 SO4
有粉红色沉淀生成
强化训练
3. (2022.黄埔二模)金属镍(Ni)是电动车动力电池制造的关键原料。近期镍价上升引发了新能源汽车价格上涨。已知:镍的金属活动性介于铁和锡之间,镍元素在化合物中常见化合价为+2价,20℃时,硫酸镍易溶于水,氢氧化镍和碳酸镍难溶于水。
(1)根据金属化学性质的一般规律,下列关于镍的化学性质预测合理的是 (填标号)。
A. 一定条件下,镍能与氧气反应
B. 镍能与稀盐酸反应
C. 高温时,CO能将氧化镍转化为金属镍
D. 镁放入硫酸镍溶液无明显变化
(2)下图是以碳酸镍(NiCO3)为原料制取硫酸镍晶体的过程,请回答相关问题:
①结合所学知识预测,试剂A属于 。(填物质类别)
ABC
酸
强化训练
②系列操作包括加入适量的硫酸。目的之一为控制硫酸镍溶液的pH,以稳定硫酸镍晶体的质量。若过程中硫酸加入过量,现需减少该硫酸镍溶液中硫酸的量,请设计下列减少硫酸的方案(要求依据两种不同的反应规律)。完成下表:
方案 试剂 预测反应的化学方程式 依据的反应规律
Ⅰ Ni 活泼金属与酸反应,生成盐和氢气
Ⅱ 略
Ⅲ 略
Ni+H2SO4=NiSO4+H2↑
NiO
NiO+H2SO4=NiSO4+H2O
NiCO3或 Ni(OH)2
NiCO3+H2SO4=NiSO4+H2O+CO2↑或
Ni(OH)2 + H2SO4= NiSO4+2H2O
4. (2022.南沙一模节选)镍(Ni)、钴(Co)及其化合物在工业上有广泛应用。
碳酸镍、硫酸镍均为重要的化工中间体,在这些化合物中镍元素的化合价都是+2。
碳酸镍难溶于水,结合所学知识预测,其能与 (填物质类别)反应。
硫酸镍溶液显浅绿色主要是由于含有 (填离子符号)。工业上一般以镍的含氧化合物制备硫酸镍,请依据反应规律设计两种制备硫酸镍的方案。
方案 预期反应的化学方程式 依据的反应规律
① 某些金属氧化物与酸反应,生成盐和水
② 碱与酸中和,生成盐和水
酸
Ni2+
H2SO4+NiO=NiSO4+H2O
H2SO4+Ni(OH)2=NiSO4+2H2O
强化训练
5. (2022.增城二模)镓(Ga)是化学史上第一个先从理论预言,后在自然界中被发现验证的化学元素。
(1)镓元素在化合物中常显+3价,硫酸镓的化学式是 。
(2)为了探究金属镓在常见金属中的活动性顺序。将金属镓放入足量的稀硫酸中,观察到镓表面有气泡产生并完全溶解,据此可得到的结论是 。
(3)若要进一步探究金属稼在常见金属中的活动性顺序,下列实验有必要做的是 (填编号)。
A.将金属稼放入硫酸铜溶液中
B.将金属稼放入硫酸亚铁溶液中
C.将金属镓放入稀盐酸中
Ga2(SO4)3
Ga 排在 H 的前面
B
强化训练
(4)以稀硫酸为原料之一,除上述反应外,再设计两种制备硫酸镓的方案。完成下表:
方案 预期反应的化学方程式 依据的反应规律
① 略
② 略
Ga2O3 +3H2SO4 =Ga2(SO4)3 +3H2O
2Ga(OH)3 +3H2SO4 =Ga2(SO4)3 +6H2O
或Ga2(CO3)3 +3H2SO4 =Ga2(SO4)3 +3H2O+3CO2↑
强化训练
专题08 物质的转化和制备
2 0 2 3 年 中 考 化 学 第 二 轮 复 习
T H E R E V I E W O F C H E M I S T R Y
人教版
广州专用
人教版
物质性质预测或推测题型是广州中考最近几年的新题型,其基本的设题原理是根据物质的类别,物质的构成去推测物质的可能性质,或推测制取不熟知物质的可能过程(以书写相关化学方程式的形式出现),设置分值为9-10分,它算是最近三年广州中考的压轴题。
在能力层面主要考核考生从题目的文字、表和图片中获取信息、运用所学的知识进行信息分类,并根据分类进行信息处理的能力,考查考生化学实验报告书写的能力。
主要考查的方法有:
(1)物质的分类
(2)物质类别的性质
(3)物质间的相互关系
(4)常见离子及其代表性物质的性质和物质的鉴别等。
命题分析
一、性质预测:
①将物质拆成对应的阴、阳离子
②根据溶解性表和复分解反应条件(反应物无酸必可溶,产物H2O、↑、↓之一)、金属活动性顺序表写出可反应的物质类别(细化到是否可溶性,如可溶性碱、活泼金属)
③陌生的物质结合题目给的资料推测可发生的反应
(如:是否受热分解、表格是否有相应的沉淀)
一般考查
复分解反应、置换反应
预测的依据:
①若有模板则按照参考模板填写
②没有模板,则写成:XX(物质)中含有XX(离子),可与XX(离子)反应生成XX(物质)。
如:Na2CO3中含有CO32-,可与H+反应生成H2O和CO2
解题思路分析
一、物质性质的预测
1.(2019.广州)已知金属钴(Co)的活动性与铁相似,请预测氯化钴(CoCl2)的化学性质,说明预测的依据,并设计实验验证。经查阅资料,钴的化合物相关性质如下:
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中溶的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
考点即练
限选试剂:CoCl2溶液、(NH4)2CO3溶液、Na2SO4溶液、AgNO3溶液、NaOH溶液、稀硫酸、镁条、铜片。
预测 预测的依据 验证预测的实验操作与预期现象
①能够与含Ag+的 可溶性盐反应 CoCl2 溶液中含Cl-, AgCl难溶于水。 取少量CoCl2溶液于试管中,加入 ,如果观察到 ,则预测成立。
②能够与 _____________(填物质类别)反应
取少量CoCl2溶液于试管中,加入 ,如果观察到 ,则预测成立。
③能够与 ________________ (填物质类别)反应 取少量CoCl2溶液于试管中,加入 ,如果观察到 ,则预测成立。
少量AgNO3溶液
有白色沉淀产生
可溶性碱
CoCl2溶液中含Co2+,Co(OH)2难溶于水
加入少量NaOH溶液
有粉红色固体生成
含CO32-的盐(或可溶性碳酸盐)
CoCl2溶液中含Co2+,CoCO3难溶于水
加入少量(NH4)2CO3溶液
有粉红色固体生成
小东研究溶液A的化学性质。
请根据所学知识及限选试剂,继续预测溶液A其它化学性质,说明预测的依据
限选试剂:溶液A、CuSO4溶液、Mg(NO3)2溶液、Ca(NO3)2溶液、BaCl2溶液。
预测 预测的依据 验证预测的实验操作与预期现象
能够与 (填物质类别)反应 取少量溶液A于试管中,
,如果观察到,
则预测成立。
可溶性钡盐(或可溶性碱)
溶液A中含有SeO42-,BaSeO4是难溶于水的白色固体(或溶液A中含有NH4+,能够跟碱生成氨气和水)
加入适量的BaCl2溶液(或加入适量的Ca(OH)2溶液)
产生白色沉淀(或产生有刺激性气味的气体)
2.(2022.花都二模)从植物营养剂中提取的一种富硒提取液(溶液A)中含有硒酸钠(Na2SeO4)、硒酸铵[(NH4)2SeO4]。有关硒元素的化合价的水溶性如下表示:
物质 MgSeO4 CuSeO4 CaSeO4 Na2SeO4 BaSeO4
在水中的溶解性 易溶于水形成无色溶液 易溶于水形成蓝色溶液 可溶于水形成无色溶液 可溶于水形成无色溶液 难溶于水的白色固体
3. (2022.花都一模)物质的结构决定物质的性质,根据物质的结构可以预测物质的化学性质,并推测物质之间的相互转化。
锶的化合物 氯化锶 硫酸锶 碳酸锶 氢氧化锶
溶解性 易溶于水 微溶于水 难溶于水 可溶于水
(1)根据上表信息,结合所学化学知识,推断氯化锂(SrCl2)能与
(填物质的类别)反应,你预测的依据是 。
可溶性银盐(或可溶性碳酸盐或可溶性硫酸盐)
氯化锶中含有Cl-,会与Ag+反应生成氯化银沉淀(或氯化锶中含有Sr2+,会与CO32-反应生成碳酸锶沉淀或氯化锶中含有Sr2+,会与SO42-反应生成硫酸锶沉淀)
考点即练
二、物质制备:
依据的反应规律:
①若有模板则按照参考模板填写
②没有模板,则写成:
例 X与XX反应生成X(沉淀、气体或水),
或 。
活泼金属+酸→盐+氢气
①将物质拆成对应的阴、阳离子
②阴离子 对应的酸或盐,首选酸
阳离子 金属单质、氧化物、盐、碱
③要符合复分解反应条件(反应物无酸必可溶,产物H2O、↑、↓之一)、金属活动性顺序
一般考查
复分解反应、置换反应
解题思路分析
1.(2021.广州)已知硫酸镉易溶于水,设计三种制备硫酸镉的方案(要求含镉原料分别属于不同的物质类别)。完成下表:
方案 预期反应的化学方程式 依据的反应规律
① 金属活动性顺序里,前面的金属能把后面的金属从它化合物的溶液里置换出来
②
③ (略)
Cd+CuSO4=Cu+CdSO4
CdO+H2SO4=H2O+CdSO4
Cd(OH)2+H2SO4=2H2O+CdSO4
④CdCO3+H2SO4=CdSO4+2H2O+CO2↑
酸+金属氧化物→盐+水
或酸与金属氧化物反应生成盐和水
考点即练
2.(2020.广州)将化学物质进行合理分类是研究物质及其变化的常用方法。
(1)以下物质的分类对于预测其化学性质没有帮助的是_____ (填标号)。
A.二氧化硫属于非金属氧化物 B.锌属于“氢前金属”
C.氢氧化锰属于白色固体 D.硫酸亚铁属于硫酸盐
(2)碳酸锂(Li2CO3) 广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。结合所学知识预测,Li2CO3能与____(填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中,________________________________。
C
酸
滴入稀盐酸,固体溶解并产生气泡
考点即练
(3)依据各类物质之间的反应规律,设计两种制备Li2CO3 的方案(要求依据两种不同的反应规律),完成下表:
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 两种盐反应生成两种新盐生成物中有沉淀
② ________
Na2CO3溶液
Li2SO4 + Na2CO3 = Li2CO3↓ + Na2SO4
LiOH溶液
CO2
2LiOH + CO2 = Li2CO3↓ + H2O
碱与非金属氧化物反应生成盐和水
考点即练
1.(2022.广州)镓(Ga)及其化合物应用广泛。常用于半导体、合金材料等工业。已知:镓在化合物中常显+3价;金属活动性顺序:Zn> Ga >Fe。
(1)镓的氧化物的化学式为________。
(2)氢氧化镓是难溶于水的白色固体。
①上述信息中能用于推测氢氧化镓化学性质的是_____ (填标号)。
A.“氢氧化镓” B.“难溶于水” C.“白色固体”
②取少量氢氧化镓固体于试管中,加入无色溶液X,充分振荡后固体完全溶解。溶液X可能是______或_______ (填化学式) 。
(3)设计金属镓转化为氢氧化镓的一种方案:__________________________ (依次写出化学方程式)。
Ga2O3
AB
HCl
H2SO4
2Ga + 6HCl == 2CaCl3 + 3H2↑
GaCl3 +3NaOH === Ga(OH)3↓+ 3NaCl
真题演练
2.(2021.广州)镉(Cd)及其化合物在电镀、电池、颜料等领域中有广泛应用。镉是种“氢前金属”,金属活动性介于锌和铜之间。镉元素常见化合价为+2。
(1)将含镉物质进行分类,各举一例填入图中(写化学式)。
(2)根据金属化学性质的一般规律,下列预测合理的是 (填标号)。
A.镉能与氢氧化钠溶液反应
B.H2或CO能将镉的氧化物转化为金属镉
C.镉能与盐酸或稀硫酸反应
D.硫酸镉溶液中的硫酸锌可加入镉粉除去
BC
CdO
Cd(OH)2
CdCl2或CdSO4或CdCO3
课后作业
1.(2022.从化一模)Goodenough等人因在锂离子电池及钴酸锂(LiCoO2)、 磷酸铁锂(LiFePO4) 等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)新能源电动汽车使用的磷酸铁锂电池反应原理为:LiFePO4 FePO4 + Li,该反应充电时,发生的化学反应属于 反应(填基本反应类型)。
(2)以下分类对于预测该物质化学性质没有帮助的是 (填标号)。
A.磷酸铁锂属于磷酸盐 B.锂属于“活泼金属”
C.钴酸锂属于白色固体 D.磷酸铁属于铁盐
分解
C
强化训练
(3)快据各类物质之间的反应规律,设计两种制备磷酸铁(FePO4) 的方案(要求依据两种不同的反应规律)。
已知:①磷酸铁(FePO4) 的铁元素正三价,是一种几乎不溶于水的白色固体;②磷酸(H3PO4)为可溶性酸。完成下表:
方案 原料 预期反应的化学方程式 依据的反应规律
① 金属氧化物与酸反应生成盐和水
②
Fe2O3和H3PO4
Fe2O3+2H3PO4= 2FePO4+3H2O
H3PO4和Fe(OH)3
H3PO4+Fe(OH)3= FePO4+3H2O
酸与碱反应生成盐和水
强化训练
2. (2022.番禺一模)金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,Co元素常见的化合价为+2和+3。金属Co与酸反应后显+2,Co元素常见的化合物相关性质如下:
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
(1)根据金属化学性质的一般规律。下列预测合理的是 。
A. 钴能够与氢氧化钠溶液反应
B. H2或者CO能够将钴的氧化物转化为金属钴
C. 钴能够与盐酸或者稀硫酸反应
D. 硫酸钴溶液中的硫酸锌可以加入钴粉除去
BC
强化训练
物质 CoO Co(OH)2 CoCl2 CoSO4 Co(NO3)2 CoCO3
在水中的溶解性 难溶于水的灰绿色固体 难溶于水的粉红色固体 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 易溶于水形成粉红色溶液 难溶于水的粉红色固体
(2)碳酸钴(CoCO3)是一种难溶于水的粉红色固体,结合所学知识预测,CoCO3能与 (填物质类别)反应,验证预测的实验操作和预期现象是:取CoCO3固体于试管中, 。
加入稀盐酸,有气泡产生,溶液变为粉红色
酸
强化训练
(3)依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。
限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
实验步骤 预期反应的化学方程式 预期反应的实验现象
在试管中取少量钴粉,加入适量稀硫酸。
Co+H2SO4=CoSO4+H2↑
固体溶解,有气泡产生
再继续加入碳酸钠溶液。
Na2CO3+CoSO4=CoCO3↓+Na2 SO4
有粉红色沉淀生成
强化训练
3. (2022.黄埔二模)金属镍(Ni)是电动车动力电池制造的关键原料。近期镍价上升引发了新能源汽车价格上涨。已知:镍的金属活动性介于铁和锡之间,镍元素在化合物中常见化合价为+2价,20℃时,硫酸镍易溶于水,氢氧化镍和碳酸镍难溶于水。
(1)根据金属化学性质的一般规律,下列关于镍的化学性质预测合理的是 (填标号)。
A. 一定条件下,镍能与氧气反应
B. 镍能与稀盐酸反应
C. 高温时,CO能将氧化镍转化为金属镍
D. 镁放入硫酸镍溶液无明显变化
(2)下图是以碳酸镍(NiCO3)为原料制取硫酸镍晶体的过程,请回答相关问题:
①结合所学知识预测,试剂A属于 。(填物质类别)
ABC
酸
强化训练
②系列操作包括加入适量的硫酸。目的之一为控制硫酸镍溶液的pH,以稳定硫酸镍晶体的质量。若过程中硫酸加入过量,现需减少该硫酸镍溶液中硫酸的量,请设计下列减少硫酸的方案(要求依据两种不同的反应规律)。完成下表:
方案 试剂 预测反应的化学方程式 依据的反应规律
Ⅰ Ni 活泼金属与酸反应,生成盐和氢气
Ⅱ 略
Ⅲ 略
Ni+H2SO4=NiSO4+H2↑
NiO
NiO+H2SO4=NiSO4+H2O
NiCO3或 Ni(OH)2
NiCO3+H2SO4=NiSO4+H2O+CO2↑或
Ni(OH)2 + H2SO4= NiSO4+2H2O
4. (2022.南沙一模节选)镍(Ni)、钴(Co)及其化合物在工业上有广泛应用。
碳酸镍、硫酸镍均为重要的化工中间体,在这些化合物中镍元素的化合价都是+2。
碳酸镍难溶于水,结合所学知识预测,其能与 (填物质类别)反应。
硫酸镍溶液显浅绿色主要是由于含有 (填离子符号)。工业上一般以镍的含氧化合物制备硫酸镍,请依据反应规律设计两种制备硫酸镍的方案。
方案 预期反应的化学方程式 依据的反应规律
① 某些金属氧化物与酸反应,生成盐和水
② 碱与酸中和,生成盐和水
酸
Ni2+
H2SO4+NiO=NiSO4+H2O
H2SO4+Ni(OH)2=NiSO4+2H2O
强化训练
5. (2022.增城二模)镓(Ga)是化学史上第一个先从理论预言,后在自然界中被发现验证的化学元素。
(1)镓元素在化合物中常显+3价,硫酸镓的化学式是 。
(2)为了探究金属镓在常见金属中的活动性顺序。将金属镓放入足量的稀硫酸中,观察到镓表面有气泡产生并完全溶解,据此可得到的结论是 。
(3)若要进一步探究金属稼在常见金属中的活动性顺序,下列实验有必要做的是 (填编号)。
A.将金属稼放入硫酸铜溶液中
B.将金属稼放入硫酸亚铁溶液中
C.将金属镓放入稀盐酸中
Ga2(SO4)3
Ga 排在 H 的前面
B
强化训练
(4)以稀硫酸为原料之一,除上述反应外,再设计两种制备硫酸镓的方案。完成下表:
方案 预期反应的化学方程式 依据的反应规律
① 略
② 略
Ga2O3 +3H2SO4 =Ga2(SO4)3 +3H2O
2Ga(OH)3 +3H2SO4 =Ga2(SO4)3 +6H2O
或Ga2(CO3)3 +3H2SO4 =Ga2(SO4)3 +3H2O+3CO2↑
强化训练
同课章节目录
