2.2.2氯气的实验室制法课件(19页)2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.2氯气的实验室制法课件(19页)2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-16 16:58:49 | ||
图片预览




文档简介
(共19张PPT)
人教版必修第一册
第二章 海水中的重要元素
——钠和氯
第二节 氯及其化合物
2.2 氯气的实验室制法
氯气有什么用途?
自来水消毒
制漂白液
制氯化氢
制漂白粉
漂粉精
氯气是重要的化工原料
如何制取?
氯及其化合物
二、氯气的实验室制法:
氯气的发现应该归功于瑞典化学家舍勒,舍勒发现氯气是在1774年,当时他正在研究软锰矿(即二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种有强烈刺激性气味的黄绿色气体,这种气体就是氯气。
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
现在这种方法仍然是实验室制取氯气的重要方法之一
浓
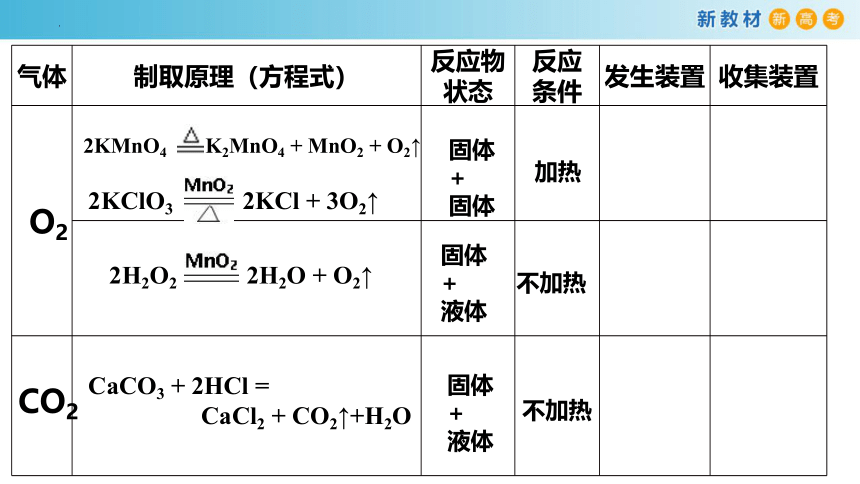
气体 制取原理(方程式) 反应物状态 反应 条件 发生装置 收集装置
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl =
CaCl2 + CO2↑+H2O
固体+
固体
固体+
液体
固体+
液体
加热
不加热
不加热
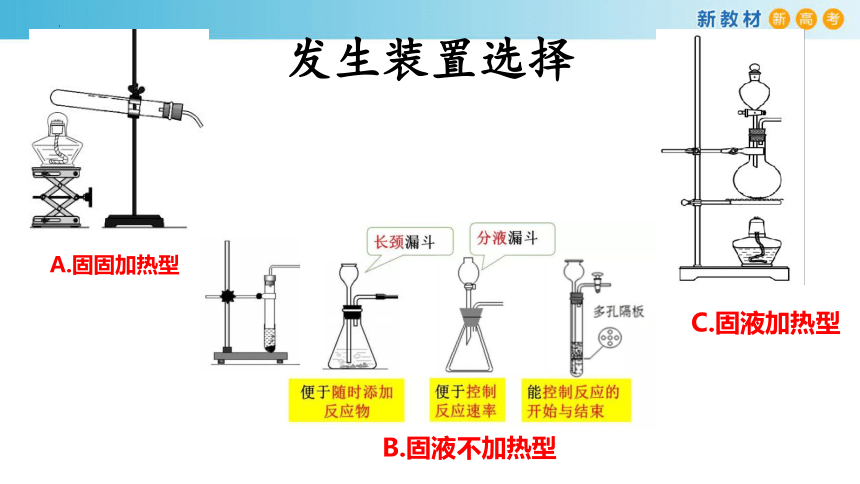
发生装置选择
A.固固加热型
B.固液不加热型
C.固液加热型
气体 制取原理(方程式) 反应物状态 反应 条件 发生装置 收集装置
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl =
CaCl2 + CO2↑+H2O
固体+
固体
固体+
液体
固体+
液体
加热
不加热
不加热
氯及其化合物
二、氯气的实验室制法:
氯气的实验室制取是固体+液体加热制取气体,不属于初中学习的任何一种实验室制取模型,一般会选取分液漏斗、圆底烧瓶和酒精灯组装气体发生装置。
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
在分液漏斗和圆底烧瓶中应该分别加入什么试剂?
浓盐酸
MnO2
收集装置选择
适用:气体与水不反应且难溶于水
如:H2、O2
适用:气体密度比空气大 不与空气反应
如:CO2 ,O2 ,Cl2
适用:气体密度比空气小 不与空气反应
如:H2 ,CH4
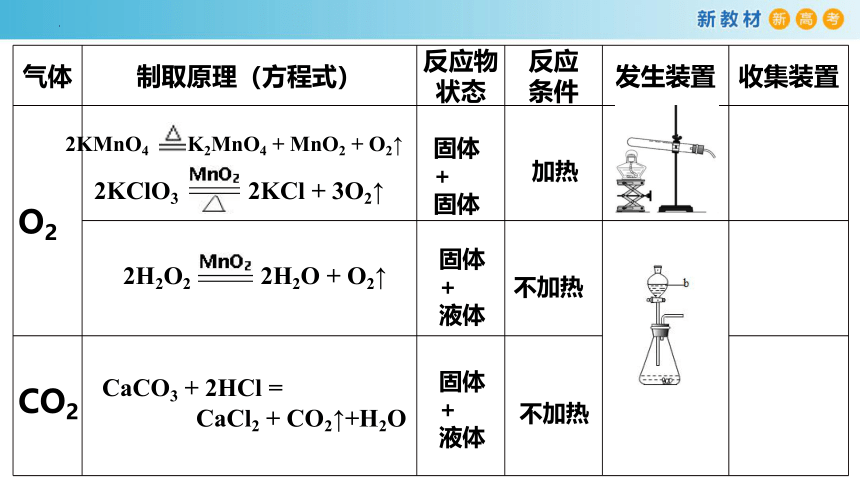
气体 制取原理(方程式) 反应物状态 反应 条件 发生装置 收集装置
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl =
CaCl2 + CO2↑+H2O
固体+
固体
固体+
液体
固体+
液体
加热
不加热
不加热
气体 制取原理(方程式) 反应物状态 反应 条件 装置图
O2
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl =
CaCl2 + CO2↑+H2O
固体+
固体
固体+
液体
固体+
液体
加热
不加热
不加热
氯气应该使用什么方法进行收集?
实验室制氯气是否需要进行尾气吸收?用什么溶液吸收氯气尾气?
向上排空气法
需要,因为氯气有毒,会污染空气,用NaOH溶液吸收
按照这种方法得到的氯气会有什么杂质
HCl和H2O
除H2O用浓硫酸
除HCl用什么?
选用饱和食盐水,HCl的溶解度约为1:500,只要有水就能将HCl溶解除去,氯气溶解度约为1:2,选用饱和食盐水可以在很大程度上降低Cl2在水中的溶解度,避免氯气的大量损失。
先除去哪一种杂质?
HCl
Ca(OH)2在水中溶解度低,吸收不完全
氯及其化合物
二、氯气的实验室制法:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
氯气的实验室制备
制取装置
内容解读
发生装置:
固液加热型
除杂装置:
饱和食盐水(HCl),浓硫酸(H2O)
收集装置:
向上排空气法
尾气处理:
NaOH溶液吸收
思考:如何验满?
(1)将湿润的蓝色石蕊试纸放在集气瓶口,试纸先变红后褪色
(2)将湿润的淀粉KI试纸放在集气瓶口,试纸变蓝
实验室制取气体的装置一般包括发生装置和收集装置,还有可能有除杂装置和尾气处理装置
顺序是什么?
发生装置→除杂装置→收集装置→尾气处理装置
装置 选择装置的根据
发生装置
除杂装置
收集装置
尾气处理装置
反应物状态,反应条件
气体和杂质的性质
气体密度、气体在是否溶于水或与水反应
气体性质
已知实验室可以用亚硫酸钠(Na2SO3)固体和浓硫酸加热反应制取二氧化硫(SO2),SO2属于酸性氧化物,在水中的溶解度为1:40,根据上述原则,画出实验室制取二氧化硫的装置图。
如果考虑到二氧化硫溶解度太大,有可能发生倒吸,可将尾气处理装置改为防倒吸装置
尾气吸收装置选择
吸收速率不是很快,溶解度也不是很大的气体
难吸收,可点燃的气体
如:CO
吸收速率快,溶解度大的气体
如:NH3,HCl
SO2, CO2,NO2等通入碱液
目的:防止尾气污染空气
目的:防止倒吸
1、氯气的实验室制法:
2、收集气体装置连接顺序及考虑因素:
小结:
发生装置→除杂装置→收集装置→尾气处理装置
反应物状态,
反应条件
气体和杂
质的性质
气体密度、
气体是否溶于
水或与水反应
气体性质
学完本节课你要掌握?
1、氯气的制备原理
2、实验用到的各部分装置及仪器名称
3、饱和氯化钠溶液的作用
4、浓硫酸的作用
5、尾气吸收的原理
6、氯气的验满方法
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
除去Cl2中混有的HCl气体
除去Cl2中混有的水蒸气(干燥Cl2)
Cl2 +2NaOH===NaCl + NaClO + H2O
(1)将湿润的淀粉KI试纸放在集气瓶口,试纸变蓝
(2)将湿润的蓝色石蕊试纸放在集气瓶口,试纸先变红后褪色
某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
(1)写出Ⅰ装置烧瓶中发生的反应的离子方程式:
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是
装置Ⅲ的作用是干燥氯气,应盛放
(3)实验开始后,先 a b(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外溢,再 a b,换好集气瓶后,继续收集氯气.
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的是 (填序号)
A.氢氧化钠溶液 B.浓硫酸 C.水.
人教版必修第一册
第二章 海水中的重要元素
——钠和氯
第二节 氯及其化合物
2.2 氯气的实验室制法
氯气有什么用途?
自来水消毒
制漂白液
制氯化氢
制漂白粉
漂粉精
氯气是重要的化工原料
如何制取?
氯及其化合物
二、氯气的实验室制法:
氯气的发现应该归功于瑞典化学家舍勒,舍勒发现氯气是在1774年,当时他正在研究软锰矿(即二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种有强烈刺激性气味的黄绿色气体,这种气体就是氯气。
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
现在这种方法仍然是实验室制取氯气的重要方法之一
浓
气体 制取原理(方程式) 反应物状态 反应 条件 发生装置 收集装置
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl =
CaCl2 + CO2↑+H2O
固体+
固体
固体+
液体
固体+
液体
加热
不加热
不加热
发生装置选择
A.固固加热型
B.固液不加热型
C.固液加热型
气体 制取原理(方程式) 反应物状态 反应 条件 发生装置 收集装置
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl =
CaCl2 + CO2↑+H2O
固体+
固体
固体+
液体
固体+
液体
加热
不加热
不加热
氯及其化合物
二、氯气的实验室制法:
氯气的实验室制取是固体+液体加热制取气体,不属于初中学习的任何一种实验室制取模型,一般会选取分液漏斗、圆底烧瓶和酒精灯组装气体发生装置。
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
在分液漏斗和圆底烧瓶中应该分别加入什么试剂?
浓盐酸
MnO2
收集装置选择
适用:气体与水不反应且难溶于水
如:H2、O2
适用:气体密度比空气大 不与空气反应
如:CO2 ,O2 ,Cl2
适用:气体密度比空气小 不与空气反应
如:H2 ,CH4
气体 制取原理(方程式) 反应物状态 反应 条件 发生装置 收集装置
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl =
CaCl2 + CO2↑+H2O
固体+
固体
固体+
液体
固体+
液体
加热
不加热
不加热
气体 制取原理(方程式) 反应物状态 反应 条件 装置图
O2
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl =
CaCl2 + CO2↑+H2O
固体+
固体
固体+
液体
固体+
液体
加热
不加热
不加热
氯气应该使用什么方法进行收集?
实验室制氯气是否需要进行尾气吸收?用什么溶液吸收氯气尾气?
向上排空气法
需要,因为氯气有毒,会污染空气,用NaOH溶液吸收
按照这种方法得到的氯气会有什么杂质
HCl和H2O
除H2O用浓硫酸
除HCl用什么?
选用饱和食盐水,HCl的溶解度约为1:500,只要有水就能将HCl溶解除去,氯气溶解度约为1:2,选用饱和食盐水可以在很大程度上降低Cl2在水中的溶解度,避免氯气的大量损失。
先除去哪一种杂质?
HCl
Ca(OH)2在水中溶解度低,吸收不完全
氯及其化合物
二、氯气的实验室制法:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
氯气的实验室制备
制取装置
内容解读
发生装置:
固液加热型
除杂装置:
饱和食盐水(HCl),浓硫酸(H2O)
收集装置:
向上排空气法
尾气处理:
NaOH溶液吸收
思考:如何验满?
(1)将湿润的蓝色石蕊试纸放在集气瓶口,试纸先变红后褪色
(2)将湿润的淀粉KI试纸放在集气瓶口,试纸变蓝
实验室制取气体的装置一般包括发生装置和收集装置,还有可能有除杂装置和尾气处理装置
顺序是什么?
发生装置→除杂装置→收集装置→尾气处理装置
装置 选择装置的根据
发生装置
除杂装置
收集装置
尾气处理装置
反应物状态,反应条件
气体和杂质的性质
气体密度、气体在是否溶于水或与水反应
气体性质
已知实验室可以用亚硫酸钠(Na2SO3)固体和浓硫酸加热反应制取二氧化硫(SO2),SO2属于酸性氧化物,在水中的溶解度为1:40,根据上述原则,画出实验室制取二氧化硫的装置图。
如果考虑到二氧化硫溶解度太大,有可能发生倒吸,可将尾气处理装置改为防倒吸装置
尾气吸收装置选择
吸收速率不是很快,溶解度也不是很大的气体
难吸收,可点燃的气体
如:CO
吸收速率快,溶解度大的气体
如:NH3,HCl
SO2, CO2,NO2等通入碱液
目的:防止尾气污染空气
目的:防止倒吸
1、氯气的实验室制法:
2、收集气体装置连接顺序及考虑因素:
小结:
发生装置→除杂装置→收集装置→尾气处理装置
反应物状态,
反应条件
气体和杂
质的性质
气体密度、
气体是否溶于
水或与水反应
气体性质
学完本节课你要掌握?
1、氯气的制备原理
2、实验用到的各部分装置及仪器名称
3、饱和氯化钠溶液的作用
4、浓硫酸的作用
5、尾气吸收的原理
6、氯气的验满方法
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
除去Cl2中混有的HCl气体
除去Cl2中混有的水蒸气(干燥Cl2)
Cl2 +2NaOH===NaCl + NaClO + H2O
(1)将湿润的淀粉KI试纸放在集气瓶口,试纸变蓝
(2)将湿润的蓝色石蕊试纸放在集气瓶口,试纸先变红后褪色
某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
(1)写出Ⅰ装置烧瓶中发生的反应的离子方程式:
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是
装置Ⅲ的作用是干燥氯气,应盛放
(3)实验开始后,先 a b(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外溢,再 a b,换好集气瓶后,继续收集氯气.
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的是 (填序号)
A.氢氧化钠溶液 B.浓硫酸 C.水.
