江苏省宿迁地区2022-2023学年高一下学期期中考试化学试题(含答案)
文档属性
| 名称 | 江苏省宿迁地区2022-2023学年高一下学期期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 717.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-17 10:25:29 | ||
图片预览

文档简介
宿迁地区2022-2023学年高一下学期期中考试
化学试卷
可能用到的相对原子质量:H1C12______N14O16______Mn55
一、单项选择题:共16题,每题3分,共48分。每小题只有一个选项最符合题意。
1.下列反应属于吸热反应且属于氧化还原反应的是( )
A.二氧化碳与赤热的碳生成一氧化碳的反应
B.葡萄糖在人体内氧化分解
C.柠檬酸与碳酸氢钠的反应
D.锌粒与稀反应制取
2.如图是反应的速率(v)和时间(t)关系图,有关叙述错误的是( )
A.内,反应依然进行着
B.内,反应处于平衡状态
C.内,、不断减小,不断增大
D.内,、、相等,且不再变化
3.氢氧燃料电池的能量转化率较高,且产物是,无污染,是一种具有应用前景的绿色电源。下列有关氢氧燃料电池的说法不正确的是( )
A.通入氢气的电极发生氧化反应
B.正极的电极反应式为
C.放电过程中碱性电解液的pH不变
D.碱性电解液中阳离子向通入氧气的方向移动
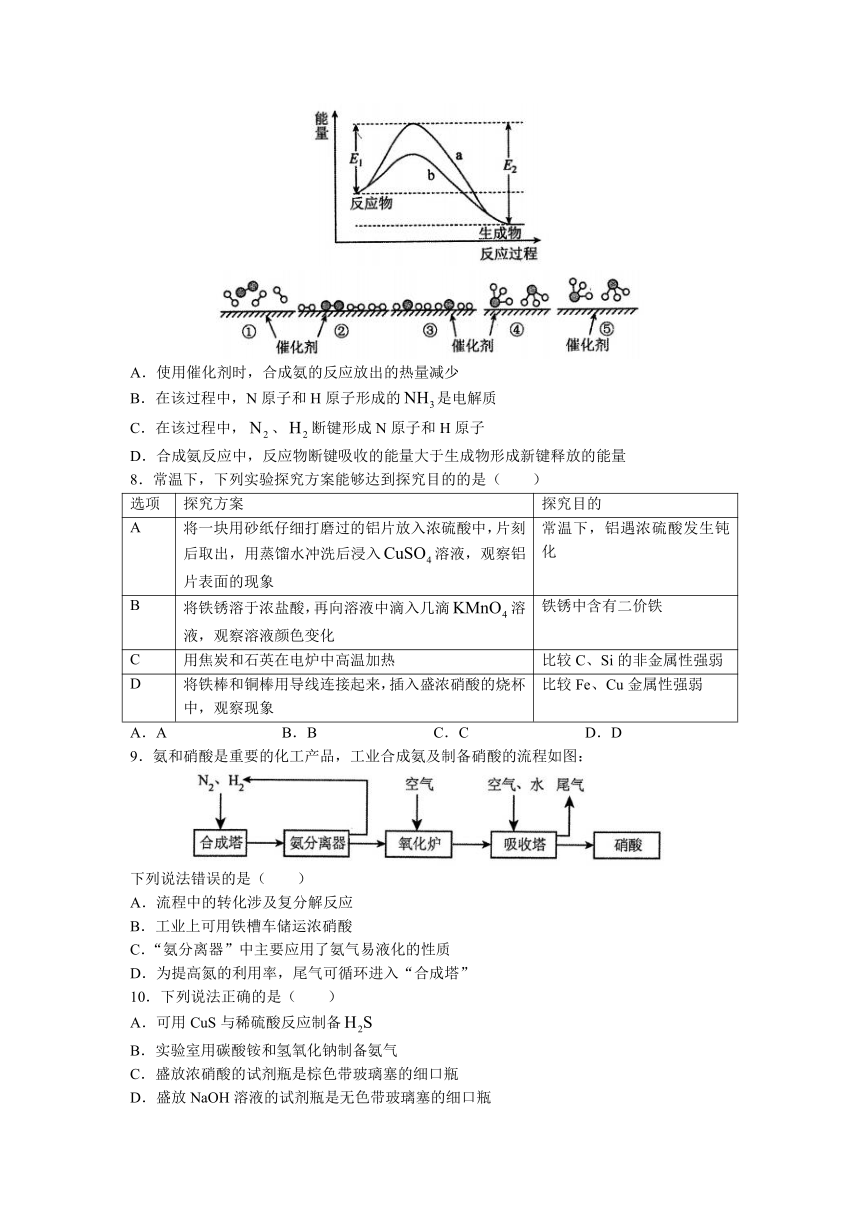
4.能量之间可相互转化。关于化学能与其他能量相互转化的说法正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.化石燃料是可再生能源,燃烧时将化学能转变为热能
C.如图I所示的装置能将化学能转变为电能
D.金刚石转化为石墨能量变化如图Ⅱ所示,则金刚石比石墨稳定
5.图像法是研究化学反应的一种常用方法。已知化学反应的能量变化曲线如图所示,则下列叙述中正确的是( )
A.每生成2 mol 时吸收b kJ能量
B.该反应热 kJ mol
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A-A键和1 mol B-B键时放出a kJ能量
6.在恒温恒容下,反应,达到平衡状态的标志是()
A.的浓度不再变化
B.A、B、C、D的反应速率之比为2∶2∶3∶1
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内各气体浓度相等
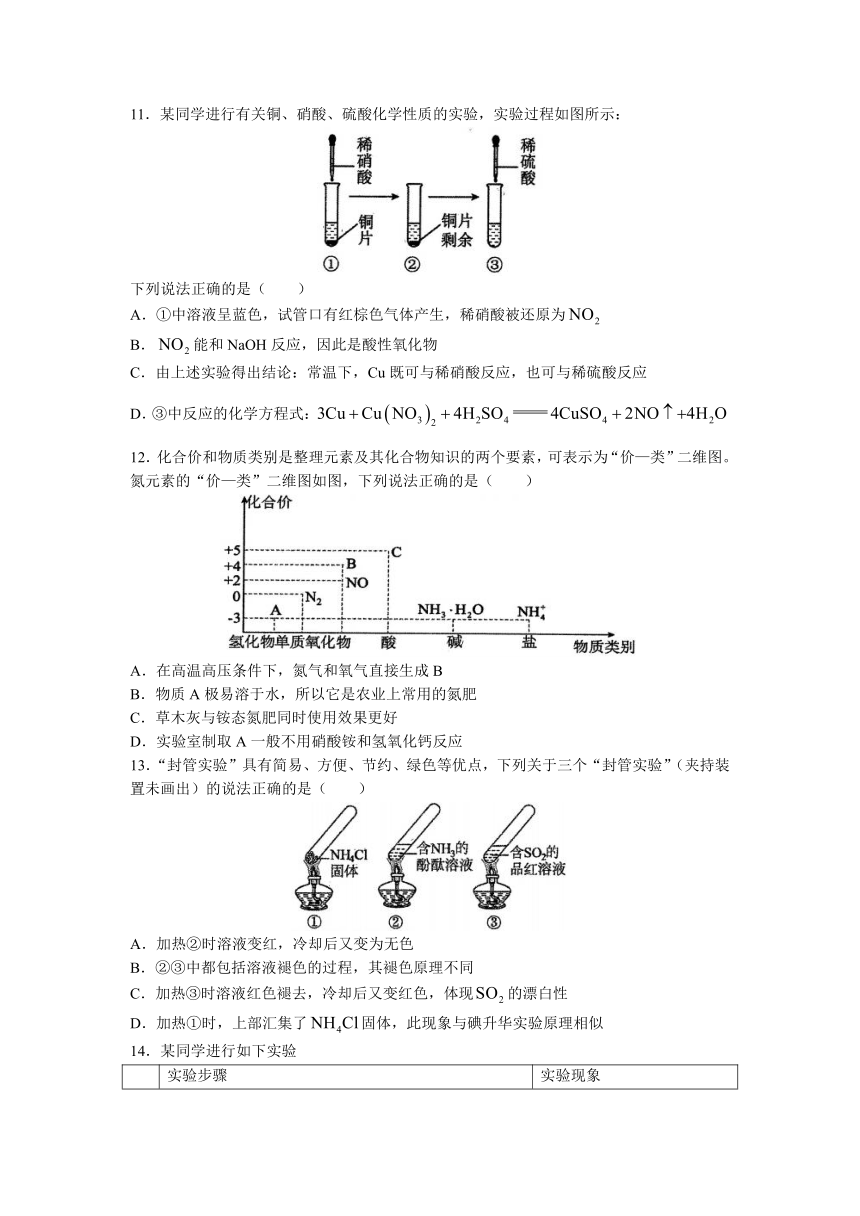
7.N 和H 在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用、、分别表示、、,下列说法正确的是( )
A.使用催化剂时,合成氨的反应放出的热量减少
B.在该过程中,N原子和H原子形成的是电解质
C.在该过程中,、断键形成N原子和H原子
D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
8.常温下,下列实验探究方案能够达到探究目的的是( )
选项 探究方案 探究目的
A 将一块用砂纸仔细打磨过的铝片放入浓硫酸中,片刻后取出,用蒸馏水冲洗后浸入溶液,观察铝片表面的现象 常温下,铝遇浓硫酸发生钝化
B 将铁锈溶于浓盐酸,再向溶液中滴入几滴溶液,观察溶液颜色变化 铁锈中含有二价铁
C 用焦炭和石英在电炉中高温加热 比较C、Si的非金属性强弱
D 将铁棒和铜棒用导线连接起来,插入盛浓硝酸的烧杯中,观察现象 比较Fe、Cu金属性强弱
A.A B.B C.C D.D
9.氨和硝酸是重要的化工产品,工业合成氨及制备硝酸的流程如图:
下列说法错误的是( )
A.流程中的转化涉及复分解反应
B.工业上可用铁槽车储运浓硝酸
C.“氨分离器”中主要应用了氨气易液化的性质
D.为提高氮的利用率,尾气可循环进入“合成塔”
10.下列说法正确的是( )
A.可用CuS与稀硫酸反应制备
B.实验室用碳酸铵和氢氧化钠制备氨气
C.盛放浓硝酸的试剂瓶是棕色带玻璃塞的细口瓶
D.盛放NaOH溶液的试剂瓶是无色带玻璃塞的细口瓶
11.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
下列说法正确的是( )
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为
B.能和NaOH反应,因此是酸性氧化物
C.由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D.③中反应的化学方程式:
12.化合价和物质类别是整理元素及其化合物知识的两个要素,可表示为“价—类”二维图。氮元素的“价—类”二维图如图,下列说法正确的是( )
A.在高温高压条件下,氮气和氧气直接生成B
B.物质A极易溶于水,所以它是农业上常用的氮肥
C.草木灰与铵态氮肥同时使用效果更好
D.实验室制取A一般不用硝酸铵和氢氧化钙反应
13.“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
A.加热②时溶液变红,冷却后又变为无色
B.②③中都包括溶液褪色的过程,其褪色原理不同
C.加热③时溶液红色褪去,冷却后又变红色,体现的漂白性
D.加热①时,上部汇集了固体,此现象与碘升华实验原理相似
14.某同学进行如下实验
实验步骤 实验现象
Ⅰ 将固体加入试管中,并将湿润的pH试纸置于试管口;试管口略向下倾斜,对试管底部进行加热 试纸颜色变化:黄色→蓝色(pH≈10)→黄色→红色(pH≈2);试管中部有白色固体附着
Ⅱ 将饱和溶液滴在pH试纸上 试纸颜色变化:黄色→橙黄色(pH≈5)
下列说法不正确的是( )
A.根据Ⅰ中试纸变蓝,说明发生了分解反应
B.根据Ⅰ中试纸颜色变化,说明氨气比氯化氢气体扩散速率快
C.Ⅰ中试纸变成红色,不是由于生成造成的
D.根据试纸颜色变蓝色,说明宜用加热的方法制备
15.侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应。将析出的固体灼烧获取纯碱。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是( )
A.制取氨气 B.制 C.分离 D.制
16.下列叙述不正确的是( )
A.易液化,液氨常用作制冷剂
B.稀硝酸和铁反应产生的氢气可为工业制氨提供原料
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存
D.和NO都不是碱性氧化物
二、非选择题:共3题,共52分。
17.(18分)1909年,化学家哈伯用和在高温高压条件下首次合成了氨气,反应原理为,从能量的变化和反应的快慢等角度研究。
(1)从能量的变化角度分析,下列反应符合图a的有____________,符合图b的有____________
①铝与稀盐酸反应 ②氢氧化钡晶体与氯化铵晶体反应
③盐酸和碳酸氢钠反应 ④甲烷的燃烧
(2)从反应快慢的角度,能加快合成氨气速率的措施是____________
A.升高温度 B.容器容积不变,充入惰性气体Ar
C.容器压强不变,充入惰性气体Ar D.使用催化剂
(3)在500℃、30 MPa下,断裂1 mol H-H键、1 mol N-H键、1 mol N≡N键需要吸收的能量分别为436 kJ、391 kJ、946.5 kJ。向体积为2 L某一密闭的容器中充入3 mol 和1 mol ,在催化剂条件下进行上述反应
①此时断裂的H-H键吸收的热量______(填“>”、“<”或“=”)1308 kJ,原因是____________。
②若在5分钟时测得反应器中生成的物质的量为0.4 mol,则用表示的速率为______;的转化率为____________;放出的热量为____________kJ。
③能说明该反应达到平衡的标志是____________
a.反应速率
b.各组分的物质的量不变
c.体系的压强不再发生变化
d.混合气体的密度不变(相同状况)
e.
f.单位时间内3 mol H-H键断裂参加反应,同时2 mol N-H键也断裂参加反应
18.(18分)某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中装置A、F分别为氨气和氯气的发生装置,装置C为纯净、干燥的氯气与氨气发生反应的装置。回答下列问题:
(1)装置F中的圆底烧瓶加热时要垫______。装置A的圆底烧瓶中盛放的固体物质可选用______(填字母)。
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置B、D的作用均为____________。从装置C的b处逸出的尾气中含有少量,为防止其污染环境,可将尾气通过盛有______溶液的洗气瓶。
(3)装置F的圆底烧瓶中发生反应的离子方程式为,在这个反应中氧化剂与还原剂的物质的量之比____________,还原产物与氧化产物的物质的量之比____________。装置E的作用是除去中的HCl,洗气瓶中盛放的试剂为____________。
(4)写出足量铜和稀硝酸反应方程式:____________________________________,该反应中表现酸性的硝酸与做氧化剂的硝酸物质的量之比为____________。
19.(16分)已知氮元素及其化合物的转化关系如下图所示,回答下列问题。
(1)①~④各步转化中,属于氮的固定的是_____(填序号)
(2)实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气。
①化学方程式是____________。
②干燥氨气不可选用的试剂是____________(填字母)。
a.浓硫酸 b.NaOH固体 c.碱石灰
(3)工业上用氨气制备NO的化学方程式是____________。
(4)工业制硝酸时尾气中含有NO、,可用以下方法吸收:
①NaOH溶液吸收法。发生的反应有:,
②用不同浓度的NaOH溶液吸收含量不同的尾气,关系如下图:
(α表示尾气里NO、中的含量)
ⅰ.根据上图得知______(填字母)
a.NaOH溶液浓度越大,氮氧化物的吸收率越大
b.含量越大,氮氧化物的吸收率越大
ⅱ.当α小于50%时,加入能提升氮氧化物的吸收率,原因是____________。
(5)电化学气敏传感器可用于监测环境中氨气的含量,其工作原理示意如图:
①负极的电极式为____________。
②反应消耗的与的物质的量之比为____________。
高一化学参考答案
1 2 3 4 5 6
A D C A B A
7 8 9 10 11 12
C A A C D D
13 14 15 16
B D C B
二、非选评题:共3题,共52分。
17.(18分)(1) ①④ ②③
(2)AD
(3)< 该反应是可逆反应,反应物不可能完全消耗 20% 18.3 ②③⑤
18.(18分)(1) 石棉网 b
(2)干燥气体 氢氧化钠
(3)1:2 1:1 饱和食盐水
(4)(3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O) 3:1
19.(16分)(1)①
(2)2NH4Cl + Ca(OH)2CaCl2 +2NH3↑+ 2H2O a
(3)4NH3+5O24NO + 6H2O
(4)b 根据图中信息可知,氮氧化物的吸收率随NO2的含量增大而增大。当混合气体中NO2含量小于50%时,具有氧化性的H2O2的存在,会使NO氧化成NO2,NO2的含量增大,从而使氮氧化物的吸收率增大
(5)2NH3-6e-+6OH-=N2+6H2O 4:3
化学试卷
可能用到的相对原子质量:H1C12______N14O16______Mn55
一、单项选择题:共16题,每题3分,共48分。每小题只有一个选项最符合题意。
1.下列反应属于吸热反应且属于氧化还原反应的是( )
A.二氧化碳与赤热的碳生成一氧化碳的反应
B.葡萄糖在人体内氧化分解
C.柠檬酸与碳酸氢钠的反应
D.锌粒与稀反应制取
2.如图是反应的速率(v)和时间(t)关系图,有关叙述错误的是( )
A.内,反应依然进行着
B.内,反应处于平衡状态
C.内,、不断减小,不断增大
D.内,、、相等,且不再变化
3.氢氧燃料电池的能量转化率较高,且产物是,无污染,是一种具有应用前景的绿色电源。下列有关氢氧燃料电池的说法不正确的是( )
A.通入氢气的电极发生氧化反应
B.正极的电极反应式为
C.放电过程中碱性电解液的pH不变
D.碱性电解液中阳离子向通入氧气的方向移动
4.能量之间可相互转化。关于化学能与其他能量相互转化的说法正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.化石燃料是可再生能源,燃烧时将化学能转变为热能
C.如图I所示的装置能将化学能转变为电能
D.金刚石转化为石墨能量变化如图Ⅱ所示,则金刚石比石墨稳定
5.图像法是研究化学反应的一种常用方法。已知化学反应的能量变化曲线如图所示,则下列叙述中正确的是( )
A.每生成2 mol 时吸收b kJ能量
B.该反应热 kJ mol
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A-A键和1 mol B-B键时放出a kJ能量
6.在恒温恒容下,反应,达到平衡状态的标志是()
A.的浓度不再变化
B.A、B、C、D的反应速率之比为2∶2∶3∶1
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内各气体浓度相等
7.N 和H 在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用、、分别表示、、,下列说法正确的是( )
A.使用催化剂时,合成氨的反应放出的热量减少
B.在该过程中,N原子和H原子形成的是电解质
C.在该过程中,、断键形成N原子和H原子
D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
8.常温下,下列实验探究方案能够达到探究目的的是( )
选项 探究方案 探究目的
A 将一块用砂纸仔细打磨过的铝片放入浓硫酸中,片刻后取出,用蒸馏水冲洗后浸入溶液,观察铝片表面的现象 常温下,铝遇浓硫酸发生钝化
B 将铁锈溶于浓盐酸,再向溶液中滴入几滴溶液,观察溶液颜色变化 铁锈中含有二价铁
C 用焦炭和石英在电炉中高温加热 比较C、Si的非金属性强弱
D 将铁棒和铜棒用导线连接起来,插入盛浓硝酸的烧杯中,观察现象 比较Fe、Cu金属性强弱
A.A B.B C.C D.D
9.氨和硝酸是重要的化工产品,工业合成氨及制备硝酸的流程如图:
下列说法错误的是( )
A.流程中的转化涉及复分解反应
B.工业上可用铁槽车储运浓硝酸
C.“氨分离器”中主要应用了氨气易液化的性质
D.为提高氮的利用率,尾气可循环进入“合成塔”
10.下列说法正确的是( )
A.可用CuS与稀硫酸反应制备
B.实验室用碳酸铵和氢氧化钠制备氨气
C.盛放浓硝酸的试剂瓶是棕色带玻璃塞的细口瓶
D.盛放NaOH溶液的试剂瓶是无色带玻璃塞的细口瓶
11.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
下列说法正确的是( )
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为
B.能和NaOH反应,因此是酸性氧化物
C.由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D.③中反应的化学方程式:
12.化合价和物质类别是整理元素及其化合物知识的两个要素,可表示为“价—类”二维图。氮元素的“价—类”二维图如图,下列说法正确的是( )
A.在高温高压条件下,氮气和氧气直接生成B
B.物质A极易溶于水,所以它是农业上常用的氮肥
C.草木灰与铵态氮肥同时使用效果更好
D.实验室制取A一般不用硝酸铵和氢氧化钙反应
13.“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
A.加热②时溶液变红,冷却后又变为无色
B.②③中都包括溶液褪色的过程,其褪色原理不同
C.加热③时溶液红色褪去,冷却后又变红色,体现的漂白性
D.加热①时,上部汇集了固体,此现象与碘升华实验原理相似
14.某同学进行如下实验
实验步骤 实验现象
Ⅰ 将固体加入试管中,并将湿润的pH试纸置于试管口;试管口略向下倾斜,对试管底部进行加热 试纸颜色变化:黄色→蓝色(pH≈10)→黄色→红色(pH≈2);试管中部有白色固体附着
Ⅱ 将饱和溶液滴在pH试纸上 试纸颜色变化:黄色→橙黄色(pH≈5)
下列说法不正确的是( )
A.根据Ⅰ中试纸变蓝,说明发生了分解反应
B.根据Ⅰ中试纸颜色变化,说明氨气比氯化氢气体扩散速率快
C.Ⅰ中试纸变成红色,不是由于生成造成的
D.根据试纸颜色变蓝色,说明宜用加热的方法制备
15.侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应。将析出的固体灼烧获取纯碱。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是( )
A.制取氨气 B.制 C.分离 D.制
16.下列叙述不正确的是( )
A.易液化,液氨常用作制冷剂
B.稀硝酸和铁反应产生的氢气可为工业制氨提供原料
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存
D.和NO都不是碱性氧化物
二、非选择题:共3题,共52分。
17.(18分)1909年,化学家哈伯用和在高温高压条件下首次合成了氨气,反应原理为,从能量的变化和反应的快慢等角度研究。
(1)从能量的变化角度分析,下列反应符合图a的有____________,符合图b的有____________
①铝与稀盐酸反应 ②氢氧化钡晶体与氯化铵晶体反应
③盐酸和碳酸氢钠反应 ④甲烷的燃烧
(2)从反应快慢的角度,能加快合成氨气速率的措施是____________
A.升高温度 B.容器容积不变,充入惰性气体Ar
C.容器压强不变,充入惰性气体Ar D.使用催化剂
(3)在500℃、30 MPa下,断裂1 mol H-H键、1 mol N-H键、1 mol N≡N键需要吸收的能量分别为436 kJ、391 kJ、946.5 kJ。向体积为2 L某一密闭的容器中充入3 mol 和1 mol ,在催化剂条件下进行上述反应
①此时断裂的H-H键吸收的热量______(填“>”、“<”或“=”)1308 kJ,原因是____________。
②若在5分钟时测得反应器中生成的物质的量为0.4 mol,则用表示的速率为______;的转化率为____________;放出的热量为____________kJ。
③能说明该反应达到平衡的标志是____________
a.反应速率
b.各组分的物质的量不变
c.体系的压强不再发生变化
d.混合气体的密度不变(相同状况)
e.
f.单位时间内3 mol H-H键断裂参加反应,同时2 mol N-H键也断裂参加反应
18.(18分)某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中装置A、F分别为氨气和氯气的发生装置,装置C为纯净、干燥的氯气与氨气发生反应的装置。回答下列问题:
(1)装置F中的圆底烧瓶加热时要垫______。装置A的圆底烧瓶中盛放的固体物质可选用______(填字母)。
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置B、D的作用均为____________。从装置C的b处逸出的尾气中含有少量,为防止其污染环境,可将尾气通过盛有______溶液的洗气瓶。
(3)装置F的圆底烧瓶中发生反应的离子方程式为,在这个反应中氧化剂与还原剂的物质的量之比____________,还原产物与氧化产物的物质的量之比____________。装置E的作用是除去中的HCl,洗气瓶中盛放的试剂为____________。
(4)写出足量铜和稀硝酸反应方程式:____________________________________,该反应中表现酸性的硝酸与做氧化剂的硝酸物质的量之比为____________。
19.(16分)已知氮元素及其化合物的转化关系如下图所示,回答下列问题。
(1)①~④各步转化中,属于氮的固定的是_____(填序号)
(2)实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气。
①化学方程式是____________。
②干燥氨气不可选用的试剂是____________(填字母)。
a.浓硫酸 b.NaOH固体 c.碱石灰
(3)工业上用氨气制备NO的化学方程式是____________。
(4)工业制硝酸时尾气中含有NO、,可用以下方法吸收:
①NaOH溶液吸收法。发生的反应有:,
②用不同浓度的NaOH溶液吸收含量不同的尾气,关系如下图:
(α表示尾气里NO、中的含量)
ⅰ.根据上图得知______(填字母)
a.NaOH溶液浓度越大,氮氧化物的吸收率越大
b.含量越大,氮氧化物的吸收率越大
ⅱ.当α小于50%时,加入能提升氮氧化物的吸收率,原因是____________。
(5)电化学气敏传感器可用于监测环境中氨气的含量,其工作原理示意如图:
①负极的电极式为____________。
②反应消耗的与的物质的量之比为____________。
高一化学参考答案
1 2 3 4 5 6
A D C A B A
7 8 9 10 11 12
C A A C D D
13 14 15 16
B D C B
二、非选评题:共3题,共52分。
17.(18分)(1) ①④ ②③
(2)AD
(3)< 该反应是可逆反应,反应物不可能完全消耗 20% 18.3 ②③⑤
18.(18分)(1) 石棉网 b
(2)干燥气体 氢氧化钠
(3)1:2 1:1 饱和食盐水
(4)(3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O) 3:1
19.(16分)(1)①
(2)2NH4Cl + Ca(OH)2CaCl2 +2NH3↑+ 2H2O a
(3)4NH3+5O24NO + 6H2O
(4)b 根据图中信息可知,氮氧化物的吸收率随NO2的含量增大而增大。当混合气体中NO2含量小于50%时,具有氧化性的H2O2的存在,会使NO氧化成NO2,NO2的含量增大,从而使氮氧化物的吸收率增大
(5)2NH3-6e-+6OH-=N2+6H2O 4:3
同课章节目录
