鲁教版初中化学九年级下册 第八单元 海水中的化学 测试题
文档属性
| 名称 | 鲁教版初中化学九年级下册 第八单元 海水中的化学 测试题 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-07-28 16:26:09 | ||
图片预览


文档简介
第八单元 海水中的化学
(45分钟 100分)
可能用到的相对原子质量:H-1 C-12 O-16 Na-23
一、选择题(本题包括15小题,每小题3分,共45分)
1.我国化学家侯德榜改进了一种化工产品的工业生产技术,其产品获得美国费城万国博览会金奖,这种生产技术用于( )
A.生产烧碱 B.生产纯碱
C.精制粗盐 D.生产尿素
2.下列过程发生化学变化的是( )
①海水晒盐 ②海水制碱 ③海水淡化 ④海水制镁
A.全部 B.只有② C.只有②④ D.②③④
3.如图是实验室里一瓶标签破损的白色粉末 ( http: / / www.21cnjy.com )状固体。小明同学取出少量该固体放入一洁净试管中,加水振荡后固体溶解,形成无色透明溶液,继续加入少量盐酸,有无色、无味的气体产生。该固体可能是( )
A.Na2SO4 B.NaCl
C.Na2CO3 D.NaOH
4.鱼胆弄破后会使鱼肉粘上一种叫胆汁酸(一种酸)的难溶于水的物质,使鱼肉变苦,要清除这种苦味,可用下列何种溶液冲洗最为适宜( )
A.食盐水 B.醋酸 C.纯碱溶液 D.烧碱溶液
5.下列有关海水晒盐的几种说法,错误的是( )
A.海水成为食盐的饱和溶液后才能析出晶体
B.盐场必须建在阳光充足、雨量少的地区
C.结晶池中析出盐后的母液没有用途,为防止污染须排入大海
D.盐场利用日晒、风吹晒盐,采取的是蒸发结晶的方法
6.下列措施不能证明海水是混合物的是( )
( http: / / www.21cnjy.com )
7.下图是分离与提纯海水的流程:
( http: / / www.21cnjy.com )
下列有关认识错误的是( )
A.常用于淡化海水的方法有蒸馏法、过滤法等
B.粗盐提纯为较纯净的食盐晶体的操作为:溶解、过滤、蒸发
C.通常在苦卤中加入熟石灰制取氢氧化镁
D.海水中的食盐用途广泛,例如侯德榜利用食盐为原料制得了纯碱
8.下列物质中,与CO2、CuCl2溶液、Na2CO3溶液都能发生反应,且都有明显现象的是( )
A.NaOH B.Ca(OH)2 C.H2SO4 D.HCl
9.滴有酚酞的氢氧化钙溶液与下列物质恰好完全反应后仍显红色的是( )
A.稀硫酸 B.氯化铜溶液
C.碳酸钾溶液 D.二氧化碳
10.下列两种物质的溶液混合后,能发生反应,且溶液的总质量不会发生改变的是( )
A.氢氧化钠溶液和稀盐酸
B.碳酸钠溶液和稀盐酸
C.氯化钠溶液和稀硫酸
D.碳酸钠溶液和氯化钙溶液
11.(双选)(2012·湛江中考)从所给数据分析,下列选项正确的是( )
温度/℃ 10 30 50 60
溶解度/g 氯化钠 35.8 36.3 37.0 37.3
硝酸钾 20.9 45.8 85.5 110
A.欲从海水中获得氯化钠,可采用蒸发结晶的方法
B.将50 ℃时的硝酸钾饱和溶液降温到10 ℃,有晶体析出
C.60 ℃时,往100 g水中加入100 g硝酸钾,可得到饱和溶液200 g
D.物质的溶解度均随温度的升高而增大或随温度的降低而减小
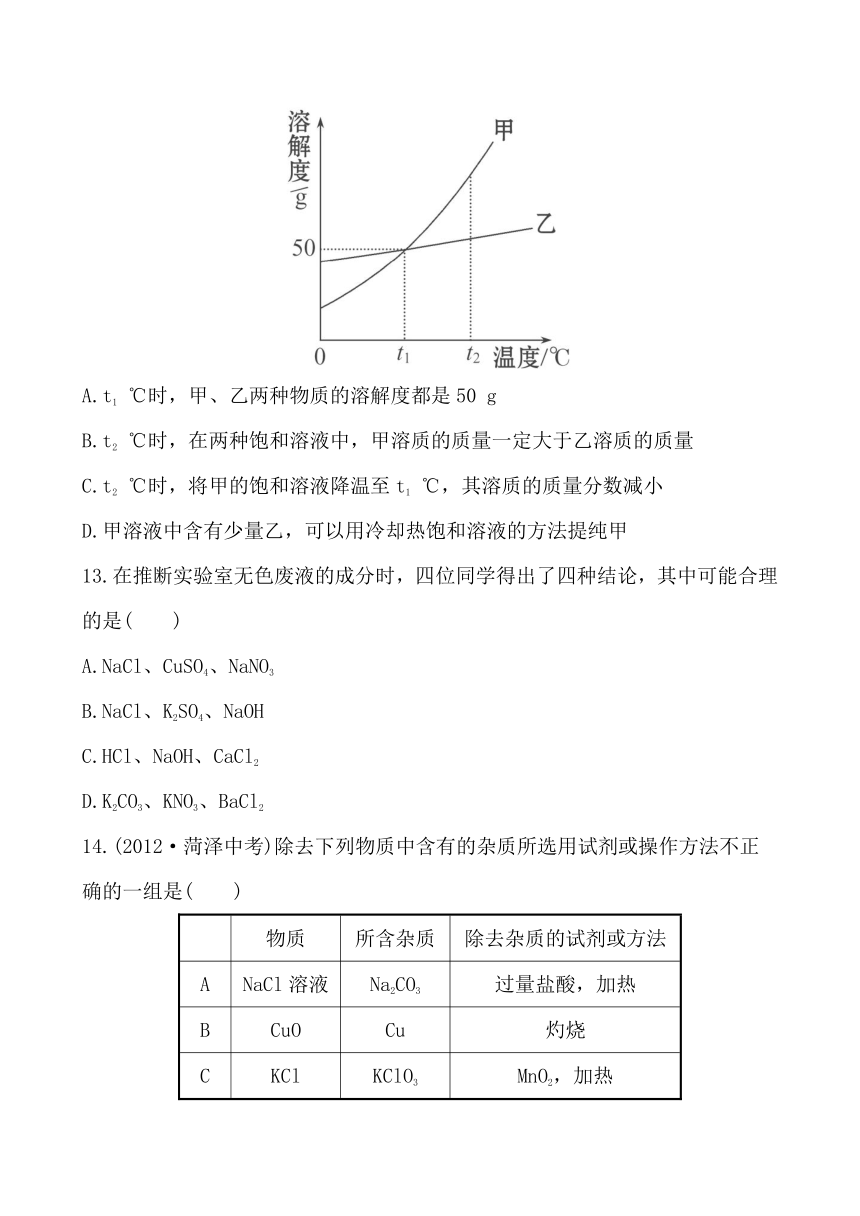
12.如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是( )
( http: / / www.21cnjy.com )
A.t1 ℃时,甲、乙两种物质的溶解度都是50 g
B.t2 ℃时,在两种饱和溶液中,甲溶质的质量一定大于乙溶质的质量
C.t2 ℃时,将甲的饱和溶液降温至t1 ℃,其溶质的质量分数减小
D.甲溶液中含有少量乙,可以用冷却热饱和溶液的方法提纯甲
13.在推断实验室无色废液的成分时,四位同学得出了四种结论,其中可能合理的是( )
A.NaCl、CuSO4、NaNO3
B.NaCl、K2SO4、NaOH
C.HCl、NaOH、CaCl2
D.K2CO3、KNO3、BaCl2
14.(2012·菏泽中考)除去下列物质中含有的杂质所选用试剂或操作方法不正确的一组是( )
物质 所含杂质 除去杂质的试剂或方法
A NaCl溶液 Na2CO3 过量盐酸,加热
B CuO Cu 灼烧
C KCl KClO3 MnO2,加热
D O2 H2O 浓硫酸,干燥
15.如图所示,X溶液与AgNO3、Na2CO3、Na2SO4三种溶液发生反应均生成白色沉淀。则X可能是下列哪种物质的溶液( )
( http: / / www.21cnjy.com )
A.HNO3或KNO3 B.HCl或H2SO4
C.BaCl2或CaCl2 D.NaOH 或Ca(OH)2
二、填空与简答题(本题包括4小题,共25分)
16.(8分)现有生活中的下列物质,请回答有关问题:
( http: / / www.21cnjy.com )
( http: / / www.21cnjy.com )
(1)纯碱属______类(填“酸”“碱”或“盐”),其水溶液的pH______7(填“大于”“小于”或“等于”);
(2)上述物质中含碳酸钙的是________(填序号);
(3)发酵粉的主要成分是(填化学式)__________;
(4)上述四种物质(或其中的主要成分)共同的化学性质是都能跟______反应;
(5)工业上可利用上述物质中的________溶液(填溶质化学名称)与石灰水反应制取氢氧化钠,有关反应的化学方程式为_____________________________。
17.(6分)如果以碳酸钙、碳酸钠、水为原料制取氢氧化钠,可设计如下反应过程:
( http: / / www.21cnjy.com )
请写出有关反应的化学方程式①_____________________________________;
②_______________________________________________________________;
③_______________________________________________________________。
18.(3分)20 ℃时,分别向盛有10 g水的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,可观察到如图所示的现象。
( http: / / www.21cnjy.com )
(1)20 ℃时,________(填“A”或“B”)试管中的溶液一定是饱和溶液;
(2)图中表示甲物质溶解度曲线的是____ ( http: / / www.21cnjy.com )____(填“a”或“b”),要使A试管中剩余的固体继续溶解可采用的方法是__________________________________
_________________________________________________________________。
19.(8分)(2011·陕西中考)下表是KNO3在不同温度时的溶解度,请回答下列问题。
温度/ ℃ 0 20 40 60 80 100
溶解度/g 13.3 31.6 63.9 110 169 246
(1)分析表中数据,归纳出KNO3的溶解度随温度变化的规律________________
__________________________________________________________________。
(2)20 ℃时,在装有5 ( http: / / www.21cnjy.com ) g KNO3晶体的试管中,加入10 g水并充分振荡,此时所得溶液为________(选填“饱和”或“不饱和”)溶液。再将该试管放入盛有热水的烧杯中,使试管内溶液温度升至60 ℃,此时试管内的溶液中溶质与溶剂的质量比为________。
(3)配制一定溶质质量分数的KNO3溶液时,溶解过程所需要的仪器有________。
三、实验与探究题(本题包括2小题,共20分)
20.(8分)某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:
( http: / / www.21cnjy.com )
(1)操作①、②、③依次为下图中的(填字母)________。
( http: / / www.21cnjy.com )
(2)若NaCl的产率偏低(产率=100%),则可能的原因是(填字母)________。
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.溶解含有泥沙的粗食盐时,加入的水量不足
(3)用上述实验所得NaCl晶体配制5 ( http: / / www.21cnjy.com )% NaCl溶液50.0 g,需称取NaCl______g,配制时需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、________。
21.(12分)某兴趣小组发现一袋 ( http: / / www.21cnjy.com )腌制松花蛋的泥料,配料表上的成分是氧化钙、纯碱和食盐。他们要探究在腌制松花蛋过程中都有哪些物质对鸭蛋起作用。于是取少量泥料在水中溶解,充分搅拌后过滤,取滤液探究其成分。
【猜想与假设】他们都认为滤液中一定 ( http: / / www.21cnjy.com )有NaCl和NaOH。生成氢氧化钠的化学方程式为____________________________________________________________
__________________________________________________________________。
对其他成分他们分别做出了如下猜想:
小亮猜想:还可能有Na2CO3
小强猜想:还可能有Ca(OH)2和Na2CO3
你认为谁的猜想是错误的________,理由是_____________________________
__________________________________________________________________。
你还能做出的猜想是:还可能有_______________________________________
__________________________________________________________________。
【活动与探究】小亮取一定量的滤液于试管中,向其中滴加了几滴稀盐酸,振荡,没有气泡,于是他得出结论:没有Na2CO3。
请你选择CO2以外的物质,设计一个实验方案验证你的猜想。
实验步骤 现象及相应结论
【反思】小强认为小亮的结论不严密,理由是___________________________
__________________________________________________________________。
四、计算题(本题包括2小题,共10分)
22.(5分)现有13.7 g由Na2CO3与NaHCO3组成的混合物,其中Na2CO3占5.3 g,请计算
(1)混合物中碳元素与氧元素的质量比为________;
(2)混合物中钠元素的质量分数为________。(精确至0.1%)
23.(5分)用“侯氏联合制碱法”制取的纯碱 ( http: / / www.21cnjy.com )(Na2CO3)中常含有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12 g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73 g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6 g。
试计算:
(1)产生二氧化碳气体的质量是________ g。
(2)该厂生产的纯碱中碳酸钠的质量分数。(计算结果精确到0.1%)
答案解析
1.【解析】选B。侯德榜为我国的制碱工业作出了杰出贡献,这里的“碱”指的是纯碱。
2.【解析】选C。海水制碱产生了新物质碳酸钠,海水制镁产生了新物质镁。
3.【解析】选C。本题考查酸、碱、盐的性质。四种固体都能溶于水形成无色溶液,但只有碳酸钠与盐酸反应产生无色、无味的二氧化碳气体。
4.【解析】选C。由题意可 ( http: / / www.21cnjy.com )知,要清除这种苦味,应该加入一种碱性物质,食盐水显中性,A错误;醋酸显酸性,B错误;纯碱溶液显碱性,C正确;烧碱溶液尽管显碱性,但具有很强的腐蚀性,不符合题意,本题应选C。
5.【解析】选C。海水晒盐后的母液中,盐类的浓度较大,可从中提取许多化工原料,例如将MgCl2的浓缩液用于海水制镁。
6.【解析】选B。将海水 ( http: / / www.21cnjy.com )蒸发可得到固体,可证明海水是混合物;将海水过滤不会得到固体,无法证明海水是混合物;向海水中滴加氢氧化钠溶液,海水中的氯化镁能与氢氧化钠反应生成氢氧化镁沉淀,向海水中滴加硝酸银溶液,海水中的氯化钠可与硝酸银反应生成氯化银沉淀,这些沉淀现象的产生,可帮助我们确定海水是混合物。
7.【解析】选A。过滤法可除去海水中的 ( http: / / www.21cnjy.com )不溶物,但无法除去海水中可溶性的盐类,故无法达到淡化海水的目的,A错误;粗盐中混有泥沙,可通过溶解、过滤、蒸发的顺序除去泥沙,得到较为纯净的食盐,B正确;苦卤中含有可溶性镁盐,加入熟石灰可制取氢氧化镁,C正确;侯德榜制取纯碱所用原料主要为食盐、氨气、二氧化碳等,D正确。
8.【解析】选B。NaOH能与CO2反 ( http: / / www.21cnjy.com )应,但无明显现象,NaOH与Na2CO3溶液不反应,A不合题意;CO2能与Ca(OH)2的水溶液反应且能使其变浑浊,Ca(OH)2的水溶液能与CuCl2溶液反应产生蓝色沉淀,Ca(OH)2的水溶液能与Na2CO3溶液反应产生白色沉淀,所以B正确;H2SO4、HCl、与CO2、CuCl2溶液均不反应,C、D均不合题意。
9.【解析】选C。氢氧化钙溶液分别 ( http: / / www.21cnjy.com )与稀硫酸、氯化铜溶液、二氧化碳恰好完全反应时,溶液均为中性,因此溶液应显无色;氢氧化钙溶液与碳酸钾溶液恰好完全反应时,由于生成了氢氧化钾,因此溶液显碱性,酚酞遇碱变红,所以溶液仍显红色。故选C。
10.【解析】选A。氢氧化钠溶液和稀盐酸反应,不产生气体,也不产生沉淀,溶液的总质量不会发生改变。
11.【解析】选A、B。本题考查溶解度的 ( http: / / www.21cnjy.com )灵活应用能力,解题的关键是掌握溶解度的正确理解和应用。根据溶解度表格数据可知,氯化钠的溶解度受温度影响较小,要得到晶体,需要采用蒸发溶剂的方法,A正确;由溶解度表可以看出,硝酸钾的溶解度随温度的升高而增大,降温饱和溶液会有晶体析出,B正确;
60℃时,硝酸钾的溶解度是110 g ( http: / / www.21cnjy.com ),即60℃时,100 g水中溶解110 g硝酸钾,恰好达到饱和状态,C错误;不是所有物质溶解度均随温度的升高而增大或随温度的降低而减小,例如氢氧化钙的溶解度随温度的升高而降低,D错误。
12.【解析】选B。t1 ℃时,甲、乙 ( http: / / www.21cnjy.com )两种物质的溶解度曲线相交于一点,即它们的溶解度相等都是50 g,A正确;t2 ℃时甲物质的溶解度虽大于乙物质的溶解度,但因未指明溶液质量,就无法比较甲、乙的溶质质量多少,故B错;甲物质的溶解度随温度的升高而增大,降温时,饱和溶液中有溶质析出,故其溶质的质量分数减小,C正确;甲物质的溶解度受温度影响变化大,乙物质的溶解度受温度影响变化不大,可用冷却热饱和溶液的方法提纯甲,故D正确。
13.【解析】选B。所得废液需 ( http: / / www.21cnjy.com )满足两个条件,一是无色,可排除A选项,因为CuSO4溶液为蓝色,二是废液中的成分不能发生复分解反应,可排除C、D选项,因为C选项中HCl和NaOH反应生成NaCl和水,D选项中K2CO3和BaCl2反应生成BaCO3沉淀和KCl。
14.【解析】选C。本题考查学生除杂质 ( http: / / www.21cnjy.com )的能力。解答本题的关键应明确除杂质的原则:(1)在除掉杂质时不增加新杂质。(2)被提纯的物质不能减少或改变。由此分析,A选项正确,因为加入的盐酸可以和碳酸钠反应生成氯化钠、水和二氧化碳,过量的盐酸在加热时可以除去。B选项正确,因为灼烧时,铜会和氧气反应生成氧化铜。C选项错误,因为加入二氧化锰加热后,虽然除去了氯酸钾,但是剩余的物质是氯化钾和二氧化锰,又引入了二氧化锰新杂质。D选项正确,因为浓硫酸具有吸水性,可以除去氧气中的水蒸气。
15.【解析】选C。解答本题的关键有两点, ( http: / / www.21cnjy.com )一是要弄清复分解反应的反应规律,二是要熟悉初中化学中的常见沉淀。解题时可采用排除法,A选项中两种物质与题干中的三种物质均无沉淀生成;B选项中HCl与Na2CO3、Na2SO4均无沉淀生成;D选项NaOH与Na2CO3、Na2SO4均不发生反应。
16.【解析】(1)纯碱由金属离子(Na+)和酸根离子(CO32-)构成,属于盐;碳酸钠的水溶液呈碱性,pH大于7。
(2)鸡蛋壳的主要成分为碳酸 ( http: / / www.21cnjy.com )钙,天安门华表的主要成分也是碳酸钙。(3)发酵粉的主要成分为小苏打,化学式为NaHCO3。(4)NaHCO3 、Na2CO3 、CaCO3都能与酸反应产生CO2气体。(5)工业上利用Na2CO3溶液与石灰水反应制取NaOH,反应的化学方程式为Na2CO3+Ca(OH)2====CaCO3↓+2NaOH。
答案:(1)盐 大于 (2)③④ (3)NaHCO3 (4)酸
(5)碳酸钠 Na2CO3+Ca(OH)2====CaCO3↓+2NaOH
17.【解析】本题难度较低,关键是掌握好化学方程式的配平、反应条件等内容。
答案:①CaCO3CaO+CO2↑
②CaO+H2O====Ca(OH)2
③Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
18.【解析】(1)有剩余固体的溶液一 ( http: / / www.21cnjy.com )定是饱和溶液;(2)由题意知20 ℃时甲的溶解能力小,结合图示,甲为b;甲虽然有剩余,但仍随温度的升高而增大,故使固体溶解可采用升高温度或加入溶剂的方法。
答案:(1)A (2)b 升高温度或增加溶剂
19.【解析】(1)根据表中溶解度随温 ( http: / / www.21cnjy.com )度变化的数据可知,KNO3的溶解度随温度的升高而增大。(2)20 ℃时,硝酸钾的溶解度为31.6 g,即在该温度下100 g水中最多溶解31.6 g的硝酸钾,那么10 g水中最多溶解硝酸钾的质量为3.16 g,故所得溶液为饱和溶液;当温度升高至60 ℃时,硝酸钾的溶解度为110 g,此时5 g 硝酸钾全部溶解,溶液中溶质与溶剂的质量比为5 g∶10 g=1∶2。(3)溶解操作中需要的仪器是烧杯、玻璃棒。
答案:(1)KNO3的溶解度随温度的升高而增大
(2)饱和 1∶2 (3)烧杯和玻璃棒
20.【解析】(1)粗盐提纯的步骤为:溶解、过滤、蒸发结晶等。
(2)B项,蒸发时有固体(氯化钠)溅出, ( http: / / www.21cnjy.com )C项,溶解含有泥沙的粗食盐时,加入的水量不足,氯化钠没有完全溶解,都可导致实际所得晶体的质量减少,导致NaCl的产率偏低。
(3)配制溶液时,先称取质量为5%50.0 g=2.5 g的氯化钠,再用量筒量取
47.5 mL水。
答案:(1)C、B、A (2)B、C (3)2.5 量筒
21.【解析】氧化钙会和水反应生成氢氧化钙, ( http: / / www.21cnjy.com )氢氧化钙与碳酸钠反应就会生成碳酸钙沉淀和氢氧化钠;Ca(OH)2和Na2CO3不可能同时存在,否则二者会继续发生反应,因此小强的猜想错误;分析已给出的猜想可知,还有一种可能是滤液中除NaCl和NaOH外还可能有Ca(OH)2;验证Ca(OH)2的存在可利用Ca(OH)2 能与碳酸钠溶液反应生成白色沉淀CaCO3的性质进行;由于滤液中有NaOH,因为滴加盐酸,盐酸首先会与氢氧化钠反应,然后再与Na2CO3反应,由于题目中只滴加了几滴稀盐酸,因此不能根据没有气泡,就得出没有Na2CO3的结论。
答案:【猜想与假设】Na2CO3+Ca(OH)2==== CaCO3↓+2NaOH 小强
Na2CO3和Ca(OH)2不能共存 Ca(OH)2
【活动与探究】取少量滤液于试管中,向 ( http: / / www.21cnjy.com )其中加入碳酸钠溶液 若产生白色沉淀,则证明滤液中有Ca(OH)2;若不产生白色沉淀,则证明滤液中没有Ca(OH)2(其他合理答案也可)
【反思】滴加盐酸量很少,在氢氧化钠未反应完之前,不会产生气泡
22.【解析】(1)在Na2CO3或N ( http: / / www.21cnjy.com )aHCO3中,碳原子与氧原子的个数比都是1︰3,故混合物中碳元素与氧元素的质量比为12︰(163)=1︰4;(2)5.3 g Na2CO3中钠元素的质量为:(5.3 g232)/(232+12+163)100%=2.3 g;NaHCO3中钠元素的质量为(13.7 g-5.3 g)23/(23+1+12+163)100%=2.3 g,故混合物中钠元素的质量分数为100%≈33.6%。
答案:(1)1︰4 (2)33.6%
23.【解析】(1)二氧化碳气体的质量=12 g+73 g-80.6 g=4.4 g。
(2)Na2CO3和氯化钠的混合物中加入 ( http: / / www.21cnjy.com )盐酸,Na2CO3会和盐酸反应生成二氧化碳,而氯化钠和盐酸不反应,根据CO2的质量为4.4 g,可求出Na2CO3的质量,进而求出碳酸钠的质量分数。
答案:(1)4.4
(2)解:设12 g纯碱样品中碳酸钠的质量为x
Na2CO3+2HCl====2NaCl+H2O+CO2↑
106 44
x 4.4 g
106∶44=x∶4.4 g
解得x=10.6 g
碳酸钠的质量分数为:10.6 g/12 g100%≈88.3%
答:该厂生产的纯碱中碳酸钠的质量分数约为88.3%。
(45分钟 100分)
可能用到的相对原子质量:H-1 C-12 O-16 Na-23
一、选择题(本题包括15小题,每小题3分,共45分)
1.我国化学家侯德榜改进了一种化工产品的工业生产技术,其产品获得美国费城万国博览会金奖,这种生产技术用于( )
A.生产烧碱 B.生产纯碱
C.精制粗盐 D.生产尿素
2.下列过程发生化学变化的是( )
①海水晒盐 ②海水制碱 ③海水淡化 ④海水制镁
A.全部 B.只有② C.只有②④ D.②③④
3.如图是实验室里一瓶标签破损的白色粉末 ( http: / / www.21cnjy.com )状固体。小明同学取出少量该固体放入一洁净试管中,加水振荡后固体溶解,形成无色透明溶液,继续加入少量盐酸,有无色、无味的气体产生。该固体可能是( )
A.Na2SO4 B.NaCl
C.Na2CO3 D.NaOH
4.鱼胆弄破后会使鱼肉粘上一种叫胆汁酸(一种酸)的难溶于水的物质,使鱼肉变苦,要清除这种苦味,可用下列何种溶液冲洗最为适宜( )
A.食盐水 B.醋酸 C.纯碱溶液 D.烧碱溶液
5.下列有关海水晒盐的几种说法,错误的是( )
A.海水成为食盐的饱和溶液后才能析出晶体
B.盐场必须建在阳光充足、雨量少的地区
C.结晶池中析出盐后的母液没有用途,为防止污染须排入大海
D.盐场利用日晒、风吹晒盐,采取的是蒸发结晶的方法
6.下列措施不能证明海水是混合物的是( )
( http: / / www.21cnjy.com )
7.下图是分离与提纯海水的流程:
( http: / / www.21cnjy.com )
下列有关认识错误的是( )
A.常用于淡化海水的方法有蒸馏法、过滤法等
B.粗盐提纯为较纯净的食盐晶体的操作为:溶解、过滤、蒸发
C.通常在苦卤中加入熟石灰制取氢氧化镁
D.海水中的食盐用途广泛,例如侯德榜利用食盐为原料制得了纯碱
8.下列物质中,与CO2、CuCl2溶液、Na2CO3溶液都能发生反应,且都有明显现象的是( )
A.NaOH B.Ca(OH)2 C.H2SO4 D.HCl
9.滴有酚酞的氢氧化钙溶液与下列物质恰好完全反应后仍显红色的是( )
A.稀硫酸 B.氯化铜溶液
C.碳酸钾溶液 D.二氧化碳
10.下列两种物质的溶液混合后,能发生反应,且溶液的总质量不会发生改变的是( )
A.氢氧化钠溶液和稀盐酸
B.碳酸钠溶液和稀盐酸
C.氯化钠溶液和稀硫酸
D.碳酸钠溶液和氯化钙溶液
11.(双选)(2012·湛江中考)从所给数据分析,下列选项正确的是( )
温度/℃ 10 30 50 60
溶解度/g 氯化钠 35.8 36.3 37.0 37.3
硝酸钾 20.9 45.8 85.5 110
A.欲从海水中获得氯化钠,可采用蒸发结晶的方法
B.将50 ℃时的硝酸钾饱和溶液降温到10 ℃,有晶体析出
C.60 ℃时,往100 g水中加入100 g硝酸钾,可得到饱和溶液200 g
D.物质的溶解度均随温度的升高而增大或随温度的降低而减小
12.如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是( )
( http: / / www.21cnjy.com )
A.t1 ℃时,甲、乙两种物质的溶解度都是50 g
B.t2 ℃时,在两种饱和溶液中,甲溶质的质量一定大于乙溶质的质量
C.t2 ℃时,将甲的饱和溶液降温至t1 ℃,其溶质的质量分数减小
D.甲溶液中含有少量乙,可以用冷却热饱和溶液的方法提纯甲
13.在推断实验室无色废液的成分时,四位同学得出了四种结论,其中可能合理的是( )
A.NaCl、CuSO4、NaNO3
B.NaCl、K2SO4、NaOH
C.HCl、NaOH、CaCl2
D.K2CO3、KNO3、BaCl2
14.(2012·菏泽中考)除去下列物质中含有的杂质所选用试剂或操作方法不正确的一组是( )
物质 所含杂质 除去杂质的试剂或方法
A NaCl溶液 Na2CO3 过量盐酸,加热
B CuO Cu 灼烧
C KCl KClO3 MnO2,加热
D O2 H2O 浓硫酸,干燥
15.如图所示,X溶液与AgNO3、Na2CO3、Na2SO4三种溶液发生反应均生成白色沉淀。则X可能是下列哪种物质的溶液( )
( http: / / www.21cnjy.com )
A.HNO3或KNO3 B.HCl或H2SO4
C.BaCl2或CaCl2 D.NaOH 或Ca(OH)2
二、填空与简答题(本题包括4小题,共25分)
16.(8分)现有生活中的下列物质,请回答有关问题:
( http: / / www.21cnjy.com )
( http: / / www.21cnjy.com )
(1)纯碱属______类(填“酸”“碱”或“盐”),其水溶液的pH______7(填“大于”“小于”或“等于”);
(2)上述物质中含碳酸钙的是________(填序号);
(3)发酵粉的主要成分是(填化学式)__________;
(4)上述四种物质(或其中的主要成分)共同的化学性质是都能跟______反应;
(5)工业上可利用上述物质中的________溶液(填溶质化学名称)与石灰水反应制取氢氧化钠,有关反应的化学方程式为_____________________________。
17.(6分)如果以碳酸钙、碳酸钠、水为原料制取氢氧化钠,可设计如下反应过程:
( http: / / www.21cnjy.com )
请写出有关反应的化学方程式①_____________________________________;
②_______________________________________________________________;
③_______________________________________________________________。
18.(3分)20 ℃时,分别向盛有10 g水的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,可观察到如图所示的现象。
( http: / / www.21cnjy.com )
(1)20 ℃时,________(填“A”或“B”)试管中的溶液一定是饱和溶液;
(2)图中表示甲物质溶解度曲线的是____ ( http: / / www.21cnjy.com )____(填“a”或“b”),要使A试管中剩余的固体继续溶解可采用的方法是__________________________________
_________________________________________________________________。
19.(8分)(2011·陕西中考)下表是KNO3在不同温度时的溶解度,请回答下列问题。
温度/ ℃ 0 20 40 60 80 100
溶解度/g 13.3 31.6 63.9 110 169 246
(1)分析表中数据,归纳出KNO3的溶解度随温度变化的规律________________
__________________________________________________________________。
(2)20 ℃时,在装有5 ( http: / / www.21cnjy.com ) g KNO3晶体的试管中,加入10 g水并充分振荡,此时所得溶液为________(选填“饱和”或“不饱和”)溶液。再将该试管放入盛有热水的烧杯中,使试管内溶液温度升至60 ℃,此时试管内的溶液中溶质与溶剂的质量比为________。
(3)配制一定溶质质量分数的KNO3溶液时,溶解过程所需要的仪器有________。
三、实验与探究题(本题包括2小题,共20分)
20.(8分)某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:
( http: / / www.21cnjy.com )
(1)操作①、②、③依次为下图中的(填字母)________。
( http: / / www.21cnjy.com )
(2)若NaCl的产率偏低(产率=100%),则可能的原因是(填字母)________。
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.溶解含有泥沙的粗食盐时,加入的水量不足
(3)用上述实验所得NaCl晶体配制5 ( http: / / www.21cnjy.com )% NaCl溶液50.0 g,需称取NaCl______g,配制时需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、________。
21.(12分)某兴趣小组发现一袋 ( http: / / www.21cnjy.com )腌制松花蛋的泥料,配料表上的成分是氧化钙、纯碱和食盐。他们要探究在腌制松花蛋过程中都有哪些物质对鸭蛋起作用。于是取少量泥料在水中溶解,充分搅拌后过滤,取滤液探究其成分。
【猜想与假设】他们都认为滤液中一定 ( http: / / www.21cnjy.com )有NaCl和NaOH。生成氢氧化钠的化学方程式为____________________________________________________________
__________________________________________________________________。
对其他成分他们分别做出了如下猜想:
小亮猜想:还可能有Na2CO3
小强猜想:还可能有Ca(OH)2和Na2CO3
你认为谁的猜想是错误的________,理由是_____________________________
__________________________________________________________________。
你还能做出的猜想是:还可能有_______________________________________
__________________________________________________________________。
【活动与探究】小亮取一定量的滤液于试管中,向其中滴加了几滴稀盐酸,振荡,没有气泡,于是他得出结论:没有Na2CO3。
请你选择CO2以外的物质,设计一个实验方案验证你的猜想。
实验步骤 现象及相应结论
【反思】小强认为小亮的结论不严密,理由是___________________________
__________________________________________________________________。
四、计算题(本题包括2小题,共10分)
22.(5分)现有13.7 g由Na2CO3与NaHCO3组成的混合物,其中Na2CO3占5.3 g,请计算
(1)混合物中碳元素与氧元素的质量比为________;
(2)混合物中钠元素的质量分数为________。(精确至0.1%)
23.(5分)用“侯氏联合制碱法”制取的纯碱 ( http: / / www.21cnjy.com )(Na2CO3)中常含有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12 g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73 g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6 g。
试计算:
(1)产生二氧化碳气体的质量是________ g。
(2)该厂生产的纯碱中碳酸钠的质量分数。(计算结果精确到0.1%)
答案解析
1.【解析】选B。侯德榜为我国的制碱工业作出了杰出贡献,这里的“碱”指的是纯碱。
2.【解析】选C。海水制碱产生了新物质碳酸钠,海水制镁产生了新物质镁。
3.【解析】选C。本题考查酸、碱、盐的性质。四种固体都能溶于水形成无色溶液,但只有碳酸钠与盐酸反应产生无色、无味的二氧化碳气体。
4.【解析】选C。由题意可 ( http: / / www.21cnjy.com )知,要清除这种苦味,应该加入一种碱性物质,食盐水显中性,A错误;醋酸显酸性,B错误;纯碱溶液显碱性,C正确;烧碱溶液尽管显碱性,但具有很强的腐蚀性,不符合题意,本题应选C。
5.【解析】选C。海水晒盐后的母液中,盐类的浓度较大,可从中提取许多化工原料,例如将MgCl2的浓缩液用于海水制镁。
6.【解析】选B。将海水 ( http: / / www.21cnjy.com )蒸发可得到固体,可证明海水是混合物;将海水过滤不会得到固体,无法证明海水是混合物;向海水中滴加氢氧化钠溶液,海水中的氯化镁能与氢氧化钠反应生成氢氧化镁沉淀,向海水中滴加硝酸银溶液,海水中的氯化钠可与硝酸银反应生成氯化银沉淀,这些沉淀现象的产生,可帮助我们确定海水是混合物。
7.【解析】选A。过滤法可除去海水中的 ( http: / / www.21cnjy.com )不溶物,但无法除去海水中可溶性的盐类,故无法达到淡化海水的目的,A错误;粗盐中混有泥沙,可通过溶解、过滤、蒸发的顺序除去泥沙,得到较为纯净的食盐,B正确;苦卤中含有可溶性镁盐,加入熟石灰可制取氢氧化镁,C正确;侯德榜制取纯碱所用原料主要为食盐、氨气、二氧化碳等,D正确。
8.【解析】选B。NaOH能与CO2反 ( http: / / www.21cnjy.com )应,但无明显现象,NaOH与Na2CO3溶液不反应,A不合题意;CO2能与Ca(OH)2的水溶液反应且能使其变浑浊,Ca(OH)2的水溶液能与CuCl2溶液反应产生蓝色沉淀,Ca(OH)2的水溶液能与Na2CO3溶液反应产生白色沉淀,所以B正确;H2SO4、HCl、与CO2、CuCl2溶液均不反应,C、D均不合题意。
9.【解析】选C。氢氧化钙溶液分别 ( http: / / www.21cnjy.com )与稀硫酸、氯化铜溶液、二氧化碳恰好完全反应时,溶液均为中性,因此溶液应显无色;氢氧化钙溶液与碳酸钾溶液恰好完全反应时,由于生成了氢氧化钾,因此溶液显碱性,酚酞遇碱变红,所以溶液仍显红色。故选C。
10.【解析】选A。氢氧化钠溶液和稀盐酸反应,不产生气体,也不产生沉淀,溶液的总质量不会发生改变。
11.【解析】选A、B。本题考查溶解度的 ( http: / / www.21cnjy.com )灵活应用能力,解题的关键是掌握溶解度的正确理解和应用。根据溶解度表格数据可知,氯化钠的溶解度受温度影响较小,要得到晶体,需要采用蒸发溶剂的方法,A正确;由溶解度表可以看出,硝酸钾的溶解度随温度的升高而增大,降温饱和溶液会有晶体析出,B正确;
60℃时,硝酸钾的溶解度是110 g ( http: / / www.21cnjy.com ),即60℃时,100 g水中溶解110 g硝酸钾,恰好达到饱和状态,C错误;不是所有物质溶解度均随温度的升高而增大或随温度的降低而减小,例如氢氧化钙的溶解度随温度的升高而降低,D错误。
12.【解析】选B。t1 ℃时,甲、乙 ( http: / / www.21cnjy.com )两种物质的溶解度曲线相交于一点,即它们的溶解度相等都是50 g,A正确;t2 ℃时甲物质的溶解度虽大于乙物质的溶解度,但因未指明溶液质量,就无法比较甲、乙的溶质质量多少,故B错;甲物质的溶解度随温度的升高而增大,降温时,饱和溶液中有溶质析出,故其溶质的质量分数减小,C正确;甲物质的溶解度受温度影响变化大,乙物质的溶解度受温度影响变化不大,可用冷却热饱和溶液的方法提纯甲,故D正确。
13.【解析】选B。所得废液需 ( http: / / www.21cnjy.com )满足两个条件,一是无色,可排除A选项,因为CuSO4溶液为蓝色,二是废液中的成分不能发生复分解反应,可排除C、D选项,因为C选项中HCl和NaOH反应生成NaCl和水,D选项中K2CO3和BaCl2反应生成BaCO3沉淀和KCl。
14.【解析】选C。本题考查学生除杂质 ( http: / / www.21cnjy.com )的能力。解答本题的关键应明确除杂质的原则:(1)在除掉杂质时不增加新杂质。(2)被提纯的物质不能减少或改变。由此分析,A选项正确,因为加入的盐酸可以和碳酸钠反应生成氯化钠、水和二氧化碳,过量的盐酸在加热时可以除去。B选项正确,因为灼烧时,铜会和氧气反应生成氧化铜。C选项错误,因为加入二氧化锰加热后,虽然除去了氯酸钾,但是剩余的物质是氯化钾和二氧化锰,又引入了二氧化锰新杂质。D选项正确,因为浓硫酸具有吸水性,可以除去氧气中的水蒸气。
15.【解析】选C。解答本题的关键有两点, ( http: / / www.21cnjy.com )一是要弄清复分解反应的反应规律,二是要熟悉初中化学中的常见沉淀。解题时可采用排除法,A选项中两种物质与题干中的三种物质均无沉淀生成;B选项中HCl与Na2CO3、Na2SO4均无沉淀生成;D选项NaOH与Na2CO3、Na2SO4均不发生反应。
16.【解析】(1)纯碱由金属离子(Na+)和酸根离子(CO32-)构成,属于盐;碳酸钠的水溶液呈碱性,pH大于7。
(2)鸡蛋壳的主要成分为碳酸 ( http: / / www.21cnjy.com )钙,天安门华表的主要成分也是碳酸钙。(3)发酵粉的主要成分为小苏打,化学式为NaHCO3。(4)NaHCO3 、Na2CO3 、CaCO3都能与酸反应产生CO2气体。(5)工业上利用Na2CO3溶液与石灰水反应制取NaOH,反应的化学方程式为Na2CO3+Ca(OH)2====CaCO3↓+2NaOH。
答案:(1)盐 大于 (2)③④ (3)NaHCO3 (4)酸
(5)碳酸钠 Na2CO3+Ca(OH)2====CaCO3↓+2NaOH
17.【解析】本题难度较低,关键是掌握好化学方程式的配平、反应条件等内容。
答案:①CaCO3CaO+CO2↑
②CaO+H2O====Ca(OH)2
③Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
18.【解析】(1)有剩余固体的溶液一 ( http: / / www.21cnjy.com )定是饱和溶液;(2)由题意知20 ℃时甲的溶解能力小,结合图示,甲为b;甲虽然有剩余,但仍随温度的升高而增大,故使固体溶解可采用升高温度或加入溶剂的方法。
答案:(1)A (2)b 升高温度或增加溶剂
19.【解析】(1)根据表中溶解度随温 ( http: / / www.21cnjy.com )度变化的数据可知,KNO3的溶解度随温度的升高而增大。(2)20 ℃时,硝酸钾的溶解度为31.6 g,即在该温度下100 g水中最多溶解31.6 g的硝酸钾,那么10 g水中最多溶解硝酸钾的质量为3.16 g,故所得溶液为饱和溶液;当温度升高至60 ℃时,硝酸钾的溶解度为110 g,此时5 g 硝酸钾全部溶解,溶液中溶质与溶剂的质量比为5 g∶10 g=1∶2。(3)溶解操作中需要的仪器是烧杯、玻璃棒。
答案:(1)KNO3的溶解度随温度的升高而增大
(2)饱和 1∶2 (3)烧杯和玻璃棒
20.【解析】(1)粗盐提纯的步骤为:溶解、过滤、蒸发结晶等。
(2)B项,蒸发时有固体(氯化钠)溅出, ( http: / / www.21cnjy.com )C项,溶解含有泥沙的粗食盐时,加入的水量不足,氯化钠没有完全溶解,都可导致实际所得晶体的质量减少,导致NaCl的产率偏低。
(3)配制溶液时,先称取质量为5%50.0 g=2.5 g的氯化钠,再用量筒量取
47.5 mL水。
答案:(1)C、B、A (2)B、C (3)2.5 量筒
21.【解析】氧化钙会和水反应生成氢氧化钙, ( http: / / www.21cnjy.com )氢氧化钙与碳酸钠反应就会生成碳酸钙沉淀和氢氧化钠;Ca(OH)2和Na2CO3不可能同时存在,否则二者会继续发生反应,因此小强的猜想错误;分析已给出的猜想可知,还有一种可能是滤液中除NaCl和NaOH外还可能有Ca(OH)2;验证Ca(OH)2的存在可利用Ca(OH)2 能与碳酸钠溶液反应生成白色沉淀CaCO3的性质进行;由于滤液中有NaOH,因为滴加盐酸,盐酸首先会与氢氧化钠反应,然后再与Na2CO3反应,由于题目中只滴加了几滴稀盐酸,因此不能根据没有气泡,就得出没有Na2CO3的结论。
答案:【猜想与假设】Na2CO3+Ca(OH)2==== CaCO3↓+2NaOH 小强
Na2CO3和Ca(OH)2不能共存 Ca(OH)2
【活动与探究】取少量滤液于试管中,向 ( http: / / www.21cnjy.com )其中加入碳酸钠溶液 若产生白色沉淀,则证明滤液中有Ca(OH)2;若不产生白色沉淀,则证明滤液中没有Ca(OH)2(其他合理答案也可)
【反思】滴加盐酸量很少,在氢氧化钠未反应完之前,不会产生气泡
22.【解析】(1)在Na2CO3或N ( http: / / www.21cnjy.com )aHCO3中,碳原子与氧原子的个数比都是1︰3,故混合物中碳元素与氧元素的质量比为12︰(163)=1︰4;(2)5.3 g Na2CO3中钠元素的质量为:(5.3 g232)/(232+12+163)100%=2.3 g;NaHCO3中钠元素的质量为(13.7 g-5.3 g)23/(23+1+12+163)100%=2.3 g,故混合物中钠元素的质量分数为100%≈33.6%。
答案:(1)1︰4 (2)33.6%
23.【解析】(1)二氧化碳气体的质量=12 g+73 g-80.6 g=4.4 g。
(2)Na2CO3和氯化钠的混合物中加入 ( http: / / www.21cnjy.com )盐酸,Na2CO3会和盐酸反应生成二氧化碳,而氯化钠和盐酸不反应,根据CO2的质量为4.4 g,可求出Na2CO3的质量,进而求出碳酸钠的质量分数。
答案:(1)4.4
(2)解:设12 g纯碱样品中碳酸钠的质量为x
Na2CO3+2HCl====2NaCl+H2O+CO2↑
106 44
x 4.4 g
106∶44=x∶4.4 g
解得x=10.6 g
碳酸钠的质量分数为:10.6 g/12 g100%≈88.3%
答:该厂生产的纯碱中碳酸钠的质量分数约为88.3%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
