江苏省徐州市铜山区2022-2023学年高一下学期期中考试化学(合格考)试题(含答案)
文档属性
| 名称 | 江苏省徐州市铜山区2022-2023学年高一下学期期中考试化学(合格考)试题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 671.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-17 10:31:18 | ||
图片预览



文档简介
徐州市铜山区2022-2023学年高一下学期期中考试
化学试题(合格考)
注意事项:
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷包含选择题(第1题~第28题,共28题84分)、非选择题(第29题~第30题,共2题16分)共两部分。考生答题全部在答题卡上,答在本试卷上无效。本次考试时间75分钟。考试结束后,考生答题全部答在答题卡上,答在本试卷上无效。本次考试时间75分钟。考试结束后,请将本试卷和答题卡一并放在桌面,等待监考员收回。
2.答题前,请务必将自己的姓名、准考证号用书写黑色字迹的0.5毫米签字笔填写在本试卷及答题卡上。
3.请认真核对监考员在答题卡右上角所粘贴条形码上的姓名、准考证号是否与本人的相符合。
4.答选择题必须用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,请用橡皮擦干净后,再选涂其他答案。答非选择题必须用书写黑色字迹的0.5毫米签字笔写在答题卡上的指定位置,在其他位置答题一律无效。
本卷可能用到的相对原子质量:H-1 C-12 O-16 S-32 Zn-65
一、本大题共28小题,每小题3分,共计84分。在每小题的四个选项中,只有一个选项符合题目要求。
1.碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低;碳中和是指通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。有利于实现“碳达峰、碳中和”的是( )
A.石油裂化 B.粮食酿酒 C.燃煤脱硫 D.风能发电
2.许多化学物质在日常生活中有俗名,下列物质的俗名与化学式对应正确的是( )
A.烧碱—NaOH B.小苏打—
C.胆矾— D.水银—Ag
3.标准状况下,的质量约为( )
A.16g B.32g C.64g D.8g
4.Mo的一种核素为。该核素的中子数为( )
A.92 B.42 C.50 D.8
5.下列物质中,属于电解质的是( )
A. B. C.NaOH D.Ag
6.下列过程中发生化学变化的是( )
A.氨气液化 B.煤的干馏 C.干冰升华 D.石油分馏
7.实验室配制的NaCl溶液,不需要使用的仪器是( )
A.分液漏斗 B.烧杯 C.玻璃棒 D.容量瓶
8.下列物质中仅存在离子键不存在共价键的是( )
A.MgO B. C. D.HCl
9.在含有大量、、的溶液中,还可能大量存在的离子是( )
A. B. C. D.
10.反应可用于制取粗硅,该反应属于( )
A.化合反应 B.复分解反应 C.置换反应 D.分解反应
11.下列各组物质互为同位素的是( )
A.和 B.金刚石和石墨 C.和 D.和
12.反应可用于制备含氯消毒剂。下列化学用语表示正确的是( )
A.的结构示意图:
B.NaOH的电子式:
C.的结构式:H—O—H
D.NaClO的电离方程式:
13.氨的催化氧化是工业制硝酸的基础:。下列关于该反应的说法正确的是( )
A.作氧化剂
B.发生氧化反应
C.反应过程中各元素的化合价都发生变化
D.中N元素被氧化
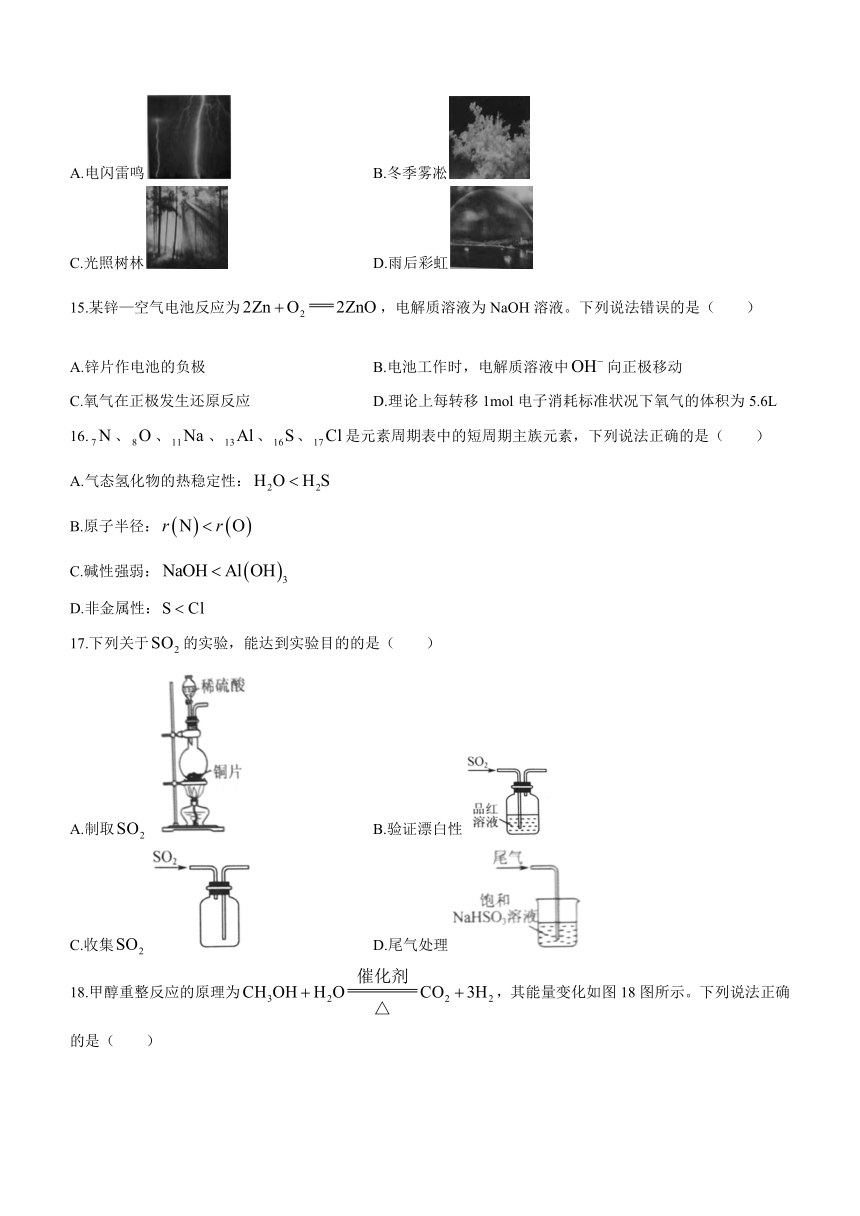
14.下列自然现象属于丁达尔效应的是( )
A.电闪雷鸣 B.冬季雾凇
C.光照树林 D.雨后彩虹
15.某锌—空气电池反应为,电解质溶液为NaOH溶液。下列说法错误的是( )
A.锌片作电池的负极 B.电池工作时,电解质溶液中向正极移动
C.氧气在正极发生还原反应 D.理论上每转移1mol电子消耗标准状况下氧气的体积为5.6L
16.、、、、、是元素周期表中的短周期主族元素,下列说法正确的是( )
A.气态氢化物的热稳定性:
B.原子半径:
C.碱性强弱:
D.非金属性:
17.下列关于的实验,能达到实验目的的是( )
A.制取 B.验证漂白性
C.收集 D.尾气处理
18.甲醇重整反应的原理为,其能量变化如图18图所示。下列说法正确的是( )
A.该反应是一个吸收热量的过程
B.反应物的总能量小于生成物的总能量
C.由氢原子形成H—H键时放出能量
D.H—C键断裂时放出能量
19.NaCl被称为“化学工业之母”。下列说法不正确的是( )
A.“制钠”:电解熔融的NaCl可制备金属Na
B.“氯碱工业”:电解饱和食盐水可获得、NaOH和
C.“侯氏制碱”:将、通入他和食盐水中,析出碳酸钠晶体
D.“海水晒盐”过程主要发生物理变化
20.下列实验方案能达到目的的是( )
A.用排水集气法收集HCl气体
B.用加热的方法除去固体中少量的
C用带火星的木条检验和
D.用焰色反应鉴别和
21.下列反应的离子方程式书写正确提( )
A.铁与稀盐酸反应:
B.氢氧化钠溶液与氯化铜溶液反应:
C.碳酸钙与稀硝酸反应:
D.氢氧化钡溶液与稀硫酸反应:
阅读下列资料,完成22~26题:
氮元素在地球上含量丰富,是构成生命体的基本元素之一。大气中的氮是取之不尽的天然资源,它以氮气分子形式存在于自然界,通过化学方法可以将其转化为人类需要的各种含氮化合物。
22.下列选项中属于人工固氮的是( )
A.闪电 B.根瘤菌 C.合成氨车间 D.电解饱和食盐水车间
23.下列气体中,可溶于水的无色气体是( )
A. B.NO C. D.
24.下列有关氮及其化合物的性质与用途的对应关系正确的是( )
A.化学性质稳定,可作保护气
B.具有还原性,可作制冷剂
C.NO不与水反应,可氧化制得
D.浓具有酸性,可钝化金属铝
25.N和O都属于元素周期表第2周期元素,它们原子结构中相同的是( )
A.质子数 B.最外层电子数
C.核外电子数 D.电子层数
26.判断N的非金属性比C的强,可依据的事实是( )
A.氮气通常呈气体,碳单质呈固体
B.的热稳定性比的强
C.常温下在水中溶解度大于
D.亚硝酸的酸性比碳酸的酸性强
27.一定温度下,向某恒容密闭容器中充入和,在催化剂作用下发生反应:,下列说法正确的是( )
A.使用催化剂可实现的100%转化
B.以或浓度的变化均可表示反应速率,两者的数值相等
C.达到平衡状态时,与物质的量之比为
D.达到平衡状态时,的浓度不再发生变化
28.某兴趣小组利用菱镁矿(主要成分为,还含有少量、等杂质)设计制备氧化镁的实验流程如图所示。下列说法错误的是( )
A.步骤(Ⅰ)和步骤(Ⅱ)中一定要用到的玻璃仪器是漏斗、玻璃棒、烧杯
B.步骤(Ⅰ)获得的滤液X中含有的阳离子主要有、、
C.步骤(Ⅱ)中获得沉淀,说明不与NaOH溶液反应
D.步骤(Ⅲ)发生反应的化学方程式为
二、非选择题:本大题共2小题,共计16分。
29.(6分)是一种温室气体。一种吸收空气中的并催化加氢合成的流程如下:
(1)“吸收”步骤反应的化学方程式是________。
(2)“吸收”“热分解”两步的目的是________。
(3)甲醇()燃料电池是一种将化学能连续不断地转化为电能的可再生清洁能源,写出空气燃料电池碱性条件下正极的电极反应方程式________。
30.(10分)实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的实验流程如下:
(1)“溶解”时Cu发生反应的离子方程式为________。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是________。
(3)滤渣中的主要物质是________(填化学式)。
(4)“沉锌”时生成碱式碳酸锌,碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:加热至125℃、加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与的分解温度接近。
根据以上实现数据计算,确定中的值(写出计算过程)。
徐州市铜山区2022-2023学年高一下学期期中考试
化学(合格考)参考答案及评分标准
一、选择题:本大题共28小题,每小题3分,共计84分。在每小题的四个选项中,只有一个选项符合题目要求。
1.D 2.A 3.A 4.C 5.C 6.B 7.A 8.A 9.B 10.C 11.A 12.C 13.D 14.C 15.B 16.D 17.B
18.C 19.C 20.B 21.B 22.C 23.D 24.A 25.D 26.B 27.D 28.C
二、非选择题:本大题共2题,共计16分。
29.(6分)(1)(2分)
(2)捕集空气中的,实现的富集(2分)
(3)(2分)
30.(10分)
(1)(2分)
(2)盐酸受热易挥发,氧气的溶解度降低(2分)
(3)Cu(或Cu、Zn)(2分)
(4)(4分)
设碱式碳酸锌为1mol
则:
加热至350℃生成ZnO的物质的量:
化学试题(合格考)
注意事项:
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷包含选择题(第1题~第28题,共28题84分)、非选择题(第29题~第30题,共2题16分)共两部分。考生答题全部在答题卡上,答在本试卷上无效。本次考试时间75分钟。考试结束后,考生答题全部答在答题卡上,答在本试卷上无效。本次考试时间75分钟。考试结束后,请将本试卷和答题卡一并放在桌面,等待监考员收回。
2.答题前,请务必将自己的姓名、准考证号用书写黑色字迹的0.5毫米签字笔填写在本试卷及答题卡上。
3.请认真核对监考员在答题卡右上角所粘贴条形码上的姓名、准考证号是否与本人的相符合。
4.答选择题必须用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,请用橡皮擦干净后,再选涂其他答案。答非选择题必须用书写黑色字迹的0.5毫米签字笔写在答题卡上的指定位置,在其他位置答题一律无效。
本卷可能用到的相对原子质量:H-1 C-12 O-16 S-32 Zn-65
一、本大题共28小题,每小题3分,共计84分。在每小题的四个选项中,只有一个选项符合题目要求。
1.碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低;碳中和是指通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。有利于实现“碳达峰、碳中和”的是( )
A.石油裂化 B.粮食酿酒 C.燃煤脱硫 D.风能发电
2.许多化学物质在日常生活中有俗名,下列物质的俗名与化学式对应正确的是( )
A.烧碱—NaOH B.小苏打—
C.胆矾— D.水银—Ag
3.标准状况下,的质量约为( )
A.16g B.32g C.64g D.8g
4.Mo的一种核素为。该核素的中子数为( )
A.92 B.42 C.50 D.8
5.下列物质中,属于电解质的是( )
A. B. C.NaOH D.Ag
6.下列过程中发生化学变化的是( )
A.氨气液化 B.煤的干馏 C.干冰升华 D.石油分馏
7.实验室配制的NaCl溶液,不需要使用的仪器是( )
A.分液漏斗 B.烧杯 C.玻璃棒 D.容量瓶
8.下列物质中仅存在离子键不存在共价键的是( )
A.MgO B. C. D.HCl
9.在含有大量、、的溶液中,还可能大量存在的离子是( )
A. B. C. D.
10.反应可用于制取粗硅,该反应属于( )
A.化合反应 B.复分解反应 C.置换反应 D.分解反应
11.下列各组物质互为同位素的是( )
A.和 B.金刚石和石墨 C.和 D.和
12.反应可用于制备含氯消毒剂。下列化学用语表示正确的是( )
A.的结构示意图:
B.NaOH的电子式:
C.的结构式:H—O—H
D.NaClO的电离方程式:
13.氨的催化氧化是工业制硝酸的基础:。下列关于该反应的说法正确的是( )
A.作氧化剂
B.发生氧化反应
C.反应过程中各元素的化合价都发生变化
D.中N元素被氧化
14.下列自然现象属于丁达尔效应的是( )
A.电闪雷鸣 B.冬季雾凇
C.光照树林 D.雨后彩虹
15.某锌—空气电池反应为,电解质溶液为NaOH溶液。下列说法错误的是( )
A.锌片作电池的负极 B.电池工作时,电解质溶液中向正极移动
C.氧气在正极发生还原反应 D.理论上每转移1mol电子消耗标准状况下氧气的体积为5.6L
16.、、、、、是元素周期表中的短周期主族元素,下列说法正确的是( )
A.气态氢化物的热稳定性:
B.原子半径:
C.碱性强弱:
D.非金属性:
17.下列关于的实验,能达到实验目的的是( )
A.制取 B.验证漂白性
C.收集 D.尾气处理
18.甲醇重整反应的原理为,其能量变化如图18图所示。下列说法正确的是( )
A.该反应是一个吸收热量的过程
B.反应物的总能量小于生成物的总能量
C.由氢原子形成H—H键时放出能量
D.H—C键断裂时放出能量
19.NaCl被称为“化学工业之母”。下列说法不正确的是( )
A.“制钠”:电解熔融的NaCl可制备金属Na
B.“氯碱工业”:电解饱和食盐水可获得、NaOH和
C.“侯氏制碱”:将、通入他和食盐水中,析出碳酸钠晶体
D.“海水晒盐”过程主要发生物理变化
20.下列实验方案能达到目的的是( )
A.用排水集气法收集HCl气体
B.用加热的方法除去固体中少量的
C用带火星的木条检验和
D.用焰色反应鉴别和
21.下列反应的离子方程式书写正确提( )
A.铁与稀盐酸反应:
B.氢氧化钠溶液与氯化铜溶液反应:
C.碳酸钙与稀硝酸反应:
D.氢氧化钡溶液与稀硫酸反应:
阅读下列资料,完成22~26题:
氮元素在地球上含量丰富,是构成生命体的基本元素之一。大气中的氮是取之不尽的天然资源,它以氮气分子形式存在于自然界,通过化学方法可以将其转化为人类需要的各种含氮化合物。
22.下列选项中属于人工固氮的是( )
A.闪电 B.根瘤菌 C.合成氨车间 D.电解饱和食盐水车间
23.下列气体中,可溶于水的无色气体是( )
A. B.NO C. D.
24.下列有关氮及其化合物的性质与用途的对应关系正确的是( )
A.化学性质稳定,可作保护气
B.具有还原性,可作制冷剂
C.NO不与水反应,可氧化制得
D.浓具有酸性,可钝化金属铝
25.N和O都属于元素周期表第2周期元素,它们原子结构中相同的是( )
A.质子数 B.最外层电子数
C.核外电子数 D.电子层数
26.判断N的非金属性比C的强,可依据的事实是( )
A.氮气通常呈气体,碳单质呈固体
B.的热稳定性比的强
C.常温下在水中溶解度大于
D.亚硝酸的酸性比碳酸的酸性强
27.一定温度下,向某恒容密闭容器中充入和,在催化剂作用下发生反应:,下列说法正确的是( )
A.使用催化剂可实现的100%转化
B.以或浓度的变化均可表示反应速率,两者的数值相等
C.达到平衡状态时,与物质的量之比为
D.达到平衡状态时,的浓度不再发生变化
28.某兴趣小组利用菱镁矿(主要成分为,还含有少量、等杂质)设计制备氧化镁的实验流程如图所示。下列说法错误的是( )
A.步骤(Ⅰ)和步骤(Ⅱ)中一定要用到的玻璃仪器是漏斗、玻璃棒、烧杯
B.步骤(Ⅰ)获得的滤液X中含有的阳离子主要有、、
C.步骤(Ⅱ)中获得沉淀,说明不与NaOH溶液反应
D.步骤(Ⅲ)发生反应的化学方程式为
二、非选择题:本大题共2小题,共计16分。
29.(6分)是一种温室气体。一种吸收空气中的并催化加氢合成的流程如下:
(1)“吸收”步骤反应的化学方程式是________。
(2)“吸收”“热分解”两步的目的是________。
(3)甲醇()燃料电池是一种将化学能连续不断地转化为电能的可再生清洁能源,写出空气燃料电池碱性条件下正极的电极反应方程式________。
30.(10分)实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的实验流程如下:
(1)“溶解”时Cu发生反应的离子方程式为________。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是________。
(3)滤渣中的主要物质是________(填化学式)。
(4)“沉锌”时生成碱式碳酸锌,碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:加热至125℃、加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与的分解温度接近。
根据以上实现数据计算,确定中的值(写出计算过程)。
徐州市铜山区2022-2023学年高一下学期期中考试
化学(合格考)参考答案及评分标准
一、选择题:本大题共28小题,每小题3分,共计84分。在每小题的四个选项中,只有一个选项符合题目要求。
1.D 2.A 3.A 4.C 5.C 6.B 7.A 8.A 9.B 10.C 11.A 12.C 13.D 14.C 15.B 16.D 17.B
18.C 19.C 20.B 21.B 22.C 23.D 24.A 25.D 26.B 27.D 28.C
二、非选择题:本大题共2题,共计16分。
29.(6分)(1)(2分)
(2)捕集空气中的,实现的富集(2分)
(3)(2分)
30.(10分)
(1)(2分)
(2)盐酸受热易挥发,氧气的溶解度降低(2分)
(3)Cu(或Cu、Zn)(2分)
(4)(4分)
设碱式碳酸锌为1mol
则:
加热至350℃生成ZnO的物质的量:
同课章节目录
