江苏省徐州市铜山区2022-2023学年高一下学期期中考试化学(选择考)试题(含答案)
文档属性
| 名称 | 江苏省徐州市铜山区2022-2023学年高一下学期期中考试化学(选择考)试题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-17 00:00:00 | ||
图片预览


文档简介
徐州市铜山区2022-2023学年高一下学期期中考试
化学试题(选择考)
本卷可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 K—39 Mn—55 Fe 56
一、单项选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题意。
1.反应的产物主要用作有机硅的原料。下列说法正确的是( )
A.反应为加成反应 B.四种物质均含有共价键
C.的电子式为 D.、均具有正四面体空间结构
2.有机物在生产和生活中有广泛应用。下列有机物的性质与用途具有对应关系的是( )
A.苯具有可燃性,可用于制溴苯 B.乙醇有挥发性,可用于杀菌消毒
C.乙酸具有酸性,可用于制乙酸乙酯 D.葡萄糖能与银氨溶液反应,可用于制银镜
3.施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )
A.氮肥溶于水,其中的氮元素均以铵离子形式存在
B.是一种有机氮肥
C.储存碳酸氢铵时,应密封并置于阴凉通风处
D.铵态氮肥不能与碱性物质如草木灰等混合施用
4.近年来,利用半导体光催化实现还原氮气制备氨气引起全世界极大关注。下图是在半导体光催化的作用下,被光催化材料捕获进而被还原实现“”的转化示意图。下列说法错误的是( )
A.此方法属于人工固氮技术 B.由转化示意图可知氮气化学性质很活泼
C.该反应过程中有共价键的断裂和形成 D.氮气和氢气在催化剂表面发生反应
5.下列除杂方法正确的是( )
A.乙烷中混有少量乙烯,可通过溴水除去
B.乙烷中混有乙烯,可通入酸性高锰酸钾溶液洗气除去
C.乙醇中混有乙酸,可用蒸馏的方法除去
D.乙酸乙酯中混有乙酸,可加入足量的NaOH溶液,经分液除去
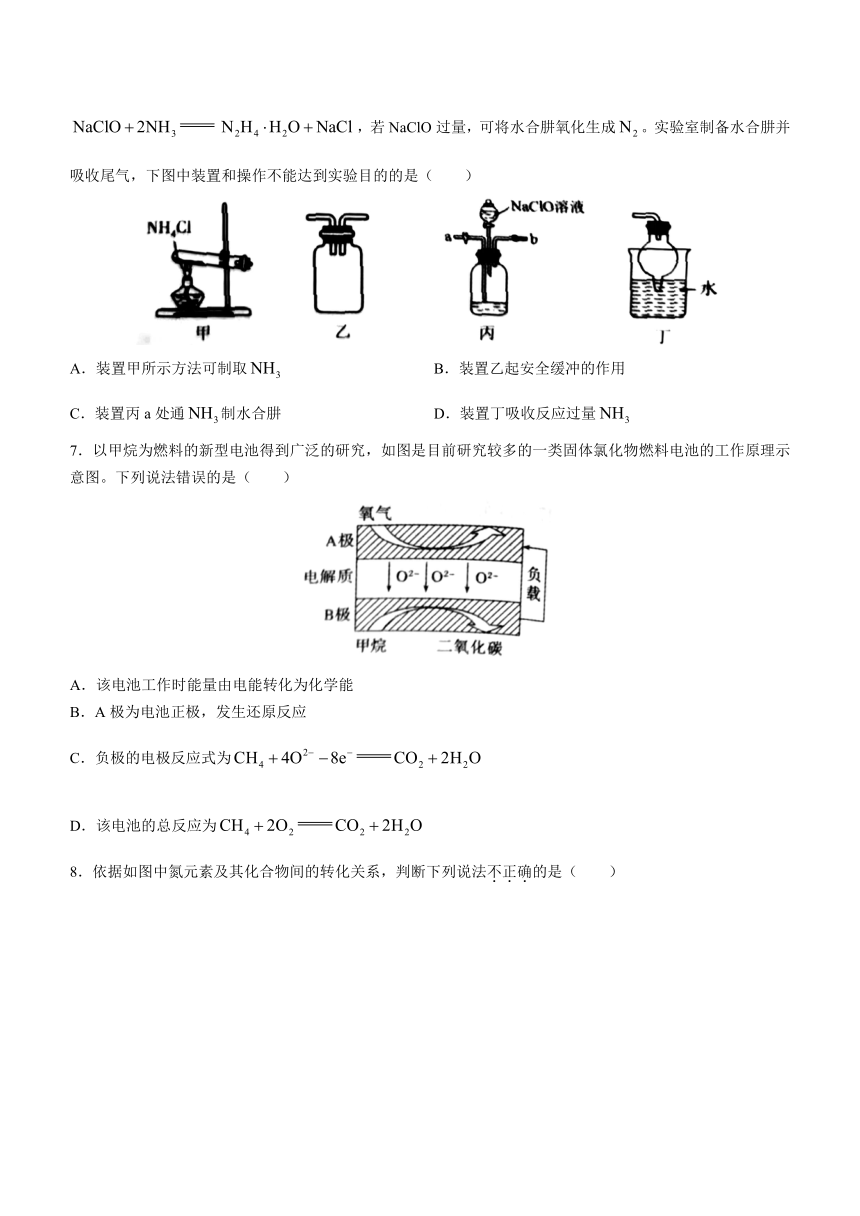
6.水合肼()在工业上常用作还原剂。制备水合肼的反应原理为,若NaClO过量,可将水合肼氧化生成。实验室制备水合肼并吸收尾气,下图中装置和操作不能达到实验目的的是( )
A.装置甲所示方法可制取 B.装置乙起安全缓冲的作用
C.装置丙a处通制水合肼 D.装置丁吸收反应过量
7.以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氯化物燃料电池的工作原理示意图。下列说法错误的是( )
A.该电池工作时能量由电能转化为化学能
B.A极为电池正极,发生还原反应
C.负极的电极反应式为
D.该电池的总反应为
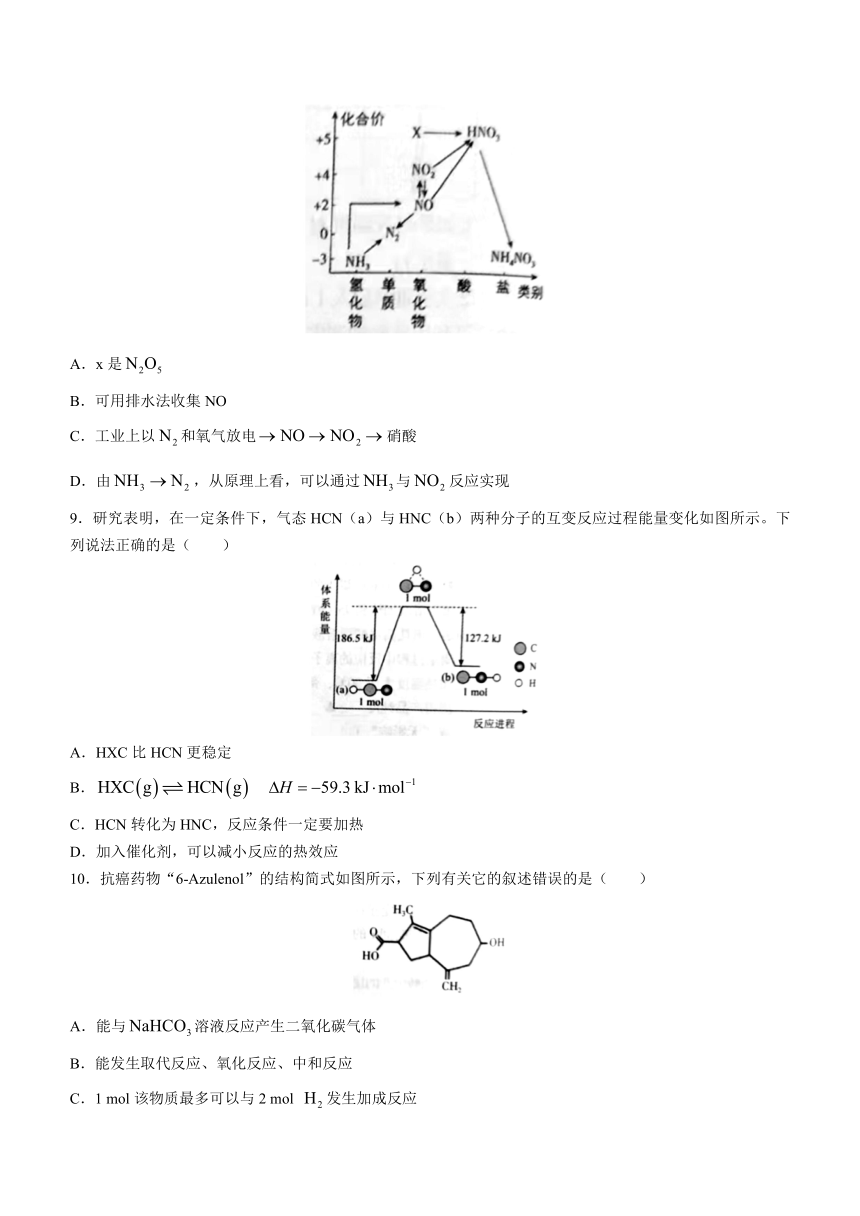
8.依据如图中氮元素及其化合物间的转化关系,判断下列说法不正确的是( )
A.x是
B.可用排水法收集NO
C.工业上以和氧气放电硝酸
D.由,从原理上看,可以通过与反应实现
9.研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是( )
A.HXC比HCN更稳定
B.
C.HCN转化为HNC,反应条件一定要加热
D.加入催化剂,可以减小反应的热效应
10.抗癌药物“6-Azulenol”的结构简式如图所示,下列有关它的叙述错误的是( )
A.能与溶液反应产生二氧化碳气体
B.能发生取代反应、氧化反应、中和反应
C.1 mol该物质最多可以与2 mol 发生加成反应
D.1 mol该物质与足量金属钠反应产生2 mol
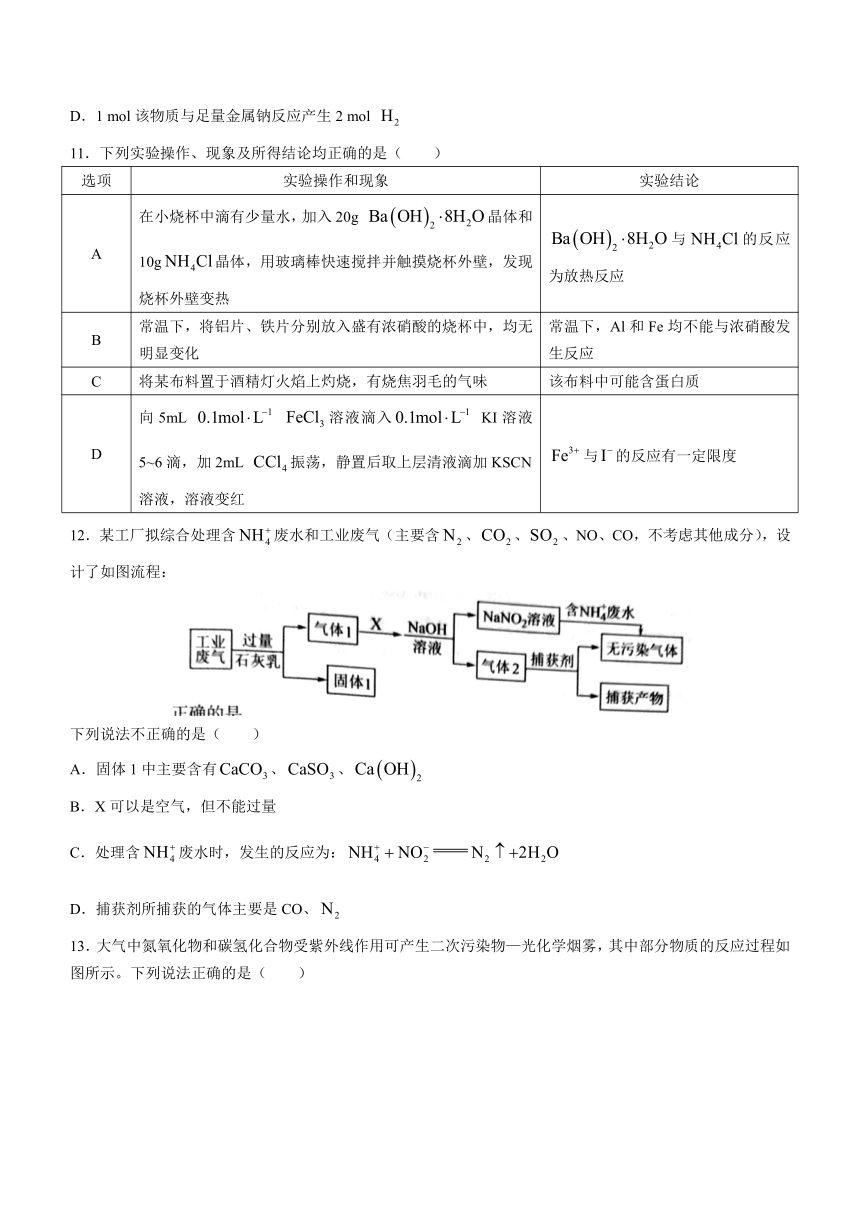
11.下列实验操作、现象及所得结论均正确的是( )
选项 实验操作和现象 实验结论
A 在小烧杯中滴有少量水,加入20g 晶体和10g晶体,用玻璃棒快速搅拌并触摸烧杯外壁,发现烧杯外壁变热 与的反应为放热反应
B 常温下,将铝片、铁片分别放入盛有浓硝酸的烧杯中,均无明显变化 常温下,Al和Fe均不能与浓硝酸发生反应
C 将某布料置于酒精灯火焰上灼烧,有烧焦羽毛的气味 该布料中可能含蛋白质
D 向5mL 溶液滴入 KI溶液5~6滴,加2mL 振荡,静置后取上层清液滴加KSCN溶液,溶液变红 与的反应有一定限度
12.某工厂拟综合处理含废水和工业废气(主要含、、、NO、CO,不考虑其他成分),设计了如图流程:
下列说法不正确的是( )
A.固体1中主要含有、、
B.X可以是空气,但不能过量
C.处理含废水时,发生的反应为:
D.捕获剂所捕获的气体主要是CO、
13.大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物—光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )
A.该过程中作催化剂
B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗
D.1 mol丙烯转化为1 mol甲醛和1 mol乙醛的过程中,转移的电子数为4 mol
14.把在空气中久置的铝片5.0 g投入盛有500mL 硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右图的坐标曲线来表示,下列推论错误的是( )
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→e段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中降低
二、非选择题(本部分4小题,共58分)
15.(14分)和均是洁净的能源和重要的化工原料。
Ⅰ.甲烷高温分解可制碳黑,设计成燃料电池可提高能量的利用效率。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64 kJ热量.则该条件下完全燃烧的热化学方程式为______。
(2)甲烷高温分解生成氧气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是______。
(3)已知某甲烷燃料电池的总反应为,则电池负极的电极反应为______,随着电池不断放电,负极附近溶液的pH______。(填“增大”、“减小”或“不变”)
Ⅱ.利用工业废气或大气捕获的制备甲醇(),可减轻对化石燃料的依赖。
实验室在体积为2L的密闭容器中充入1mol 和3mol 在催化剂作用下通过反应 制备甲醇,实验测得和的物质的量随时间的变化关系如图所示。
(1)由图可知,当反应进行到______(填“3min”或“10min”)时,正反应速率和逆反应速率恰好相等。
(2)下列情况能说明该反应达到化学平衡状态的是______(填字母)。
a.单位时间内消耗1mol 的同时生成1mol
b.与的物质的量之比不再发生变化
c.混合气体的密度不再发生变化
(3)若上述反应中生成水的总物质的量不变,但水为液态,则反应过程中放出的热量______(填“增多”“减少”或“不变”)。
16.(14分)乙烯的年产量是衡量—个国采石油化工发展水平的重要标志之一、以乙烯为原料合成部分化工产品的流程如下(部分反应条件已略去)
(1)B→F的反应类型为______,C中官能团的名称为______。
(2)物质x的结构简式为______。
(3)D的一种同分异构体属于酯类,写出该同分异构体的结构简式______。
(4)苯乙烯在一定条件下也能发生加聚反应,写出该反应的化学方程式:______。
(5)某兴趣小组制备一定量的乙酸乙酯,装置如下图所示。
①制备乙酸乙酯的化学方程式为______。
②图中的错误之处有______。
17.(14分)草酸与草酸钠在生产、科研中应用广泛。二者均可以被酸性高锰酸钾溶液氧化
(1)草酸与高锰酸钾在酸性条件下能够发生如下反应:(未配平)。用4mL 溶液与2mL 溶液反应,研究不同条件对化学反应速率的影响。改变的条件如表所示:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2 20 —
Ⅱ 2 30 —
Ⅲ 1 20 1mL蒸馏水
①如果研究温度对化学反应速率的影响,使用实验______和______(用Ⅰ~Ⅲ表示);
②实验Ⅲ中加入1 mL蒸馏水的目的是______。
(2)可利用草酸钠测定高锰酸钾产品纯度,步骤如下:
Ⅰ.称取31.6 g高锰酸钾产品,配成100 mL溶液。
Ⅱ.准确称取6.70g已烘干的,置于锥形瓶中,加入少量蒸馏水使其溶解
Ⅲ.将瓶中溶液加热到75~80℃,再加入少量硫酸酸化,趁热用Ⅰ中配制的高锰酸钾溶液滴定。消耗高锰酸钾溶液12.50 mL。
滴定过程中反应的离子方程式为______。
②加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度______。(填“偏高”、“偏低”或“无影响”)
③高锰酸钾的纯度为______。
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中的浓度随反应时间t的变化如右图,其原因可能为______。
18.(16分)硝酸生产的尾气中NO和等氮氧化物以及酸性废水中均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为
;
①吸收后的溶液经浓缩、结晶、过滤,得到晶体,该晶体中的主要杂质是______(填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是______(填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如右图所示。
NaClO溶液的初始pH越大,NO转化率越低。其原因是______。
(3)利用也能够还原氮氧化物()实现氮污染的治理。将硝酸尾气与的混合气体通入与的混合溶液中实现无害化处理,其转化过程如右图所示。
①时,参与的离子方程式为______。
②若该过程中,每转移3.6 mol电子消耗1 mol氮氧化物(),则x为______。
Ⅱ.酸性废水中的处理
(1)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的还原为,从而实现脱氨。量取三份50mL含的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中的残留率(残留率=)与反应时间的关系如左下图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是______。
(2)还可以利用原电池原理处理酸性废水中,废水中的在水处理剂表面的变化如右上图所示,该电池正极上的电极反应式为______。
徐州市铜山区2022-2023学年高一下学期期中考试
化学(选择考)试题参考答案和评分标准
说明:学生解答主观性试题时,使用与本答案不同的其它合理答案的也给分。
一、单项选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题意。
1.B 2.D 3.A 4.B 5.A 6.A 7.A 8.C 9.B 10.D 11.C 12.D 13.D 14.C
二、非选择题:本部分4小题,共58分。
15.(14分)
Ⅰ.(1)
(2)为甲烷分解提供高温(能量)
(3) 增多
Ⅱ.(1)10min (2)b (3)增多
16.(14分)
(1)取代(酯化)反应(1分) 醛基(1分)
(2)HCOOH(2分) (3)(2分)
(4)(3分)
(5)①(3分)
②导管插入液面以下;错用饱和NaOH溶液(2分)
17.(14分)
(1))①Ⅰ Ⅱ(一个空1分,共2分)
②确保所有实验中、和溶液的总体积相同(2分)
(2)①(3分)
②偏高(2分) ③80%(3分)
④生成的作催化剂,随着浓度增加,反应速率越来越快(2分)
18.(16分)
Ⅰ.(1)①(2分) ②NO(2分)
(2)溶液pH越大,溶液中HClO的浓度越小,氧化NO的能力越弱(2分)
(3)①(3分) ②1.8(2分)
Ⅱ.(1)铝铁合金在溶液中形成原电池,加快反应速率(2分)
(2)(3分)
化学试题(选择考)
本卷可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 K—39 Mn—55 Fe 56
一、单项选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题意。
1.反应的产物主要用作有机硅的原料。下列说法正确的是( )
A.反应为加成反应 B.四种物质均含有共价键
C.的电子式为 D.、均具有正四面体空间结构
2.有机物在生产和生活中有广泛应用。下列有机物的性质与用途具有对应关系的是( )
A.苯具有可燃性,可用于制溴苯 B.乙醇有挥发性,可用于杀菌消毒
C.乙酸具有酸性,可用于制乙酸乙酯 D.葡萄糖能与银氨溶液反应,可用于制银镜
3.施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )
A.氮肥溶于水,其中的氮元素均以铵离子形式存在
B.是一种有机氮肥
C.储存碳酸氢铵时,应密封并置于阴凉通风处
D.铵态氮肥不能与碱性物质如草木灰等混合施用
4.近年来,利用半导体光催化实现还原氮气制备氨气引起全世界极大关注。下图是在半导体光催化的作用下,被光催化材料捕获进而被还原实现“”的转化示意图。下列说法错误的是( )
A.此方法属于人工固氮技术 B.由转化示意图可知氮气化学性质很活泼
C.该反应过程中有共价键的断裂和形成 D.氮气和氢气在催化剂表面发生反应
5.下列除杂方法正确的是( )
A.乙烷中混有少量乙烯,可通过溴水除去
B.乙烷中混有乙烯,可通入酸性高锰酸钾溶液洗气除去
C.乙醇中混有乙酸,可用蒸馏的方法除去
D.乙酸乙酯中混有乙酸,可加入足量的NaOH溶液,经分液除去
6.水合肼()在工业上常用作还原剂。制备水合肼的反应原理为,若NaClO过量,可将水合肼氧化生成。实验室制备水合肼并吸收尾气,下图中装置和操作不能达到实验目的的是( )
A.装置甲所示方法可制取 B.装置乙起安全缓冲的作用
C.装置丙a处通制水合肼 D.装置丁吸收反应过量
7.以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氯化物燃料电池的工作原理示意图。下列说法错误的是( )
A.该电池工作时能量由电能转化为化学能
B.A极为电池正极,发生还原反应
C.负极的电极反应式为
D.该电池的总反应为
8.依据如图中氮元素及其化合物间的转化关系,判断下列说法不正确的是( )
A.x是
B.可用排水法收集NO
C.工业上以和氧气放电硝酸
D.由,从原理上看,可以通过与反应实现
9.研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是( )
A.HXC比HCN更稳定
B.
C.HCN转化为HNC,反应条件一定要加热
D.加入催化剂,可以减小反应的热效应
10.抗癌药物“6-Azulenol”的结构简式如图所示,下列有关它的叙述错误的是( )
A.能与溶液反应产生二氧化碳气体
B.能发生取代反应、氧化反应、中和反应
C.1 mol该物质最多可以与2 mol 发生加成反应
D.1 mol该物质与足量金属钠反应产生2 mol
11.下列实验操作、现象及所得结论均正确的是( )
选项 实验操作和现象 实验结论
A 在小烧杯中滴有少量水,加入20g 晶体和10g晶体,用玻璃棒快速搅拌并触摸烧杯外壁,发现烧杯外壁变热 与的反应为放热反应
B 常温下,将铝片、铁片分别放入盛有浓硝酸的烧杯中,均无明显变化 常温下,Al和Fe均不能与浓硝酸发生反应
C 将某布料置于酒精灯火焰上灼烧,有烧焦羽毛的气味 该布料中可能含蛋白质
D 向5mL 溶液滴入 KI溶液5~6滴,加2mL 振荡,静置后取上层清液滴加KSCN溶液,溶液变红 与的反应有一定限度
12.某工厂拟综合处理含废水和工业废气(主要含、、、NO、CO,不考虑其他成分),设计了如图流程:
下列说法不正确的是( )
A.固体1中主要含有、、
B.X可以是空气,但不能过量
C.处理含废水时,发生的反应为:
D.捕获剂所捕获的气体主要是CO、
13.大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物—光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )
A.该过程中作催化剂
B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗
D.1 mol丙烯转化为1 mol甲醛和1 mol乙醛的过程中,转移的电子数为4 mol
14.把在空气中久置的铝片5.0 g投入盛有500mL 硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右图的坐标曲线来表示,下列推论错误的是( )
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→e段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中降低
二、非选择题(本部分4小题,共58分)
15.(14分)和均是洁净的能源和重要的化工原料。
Ⅰ.甲烷高温分解可制碳黑,设计成燃料电池可提高能量的利用效率。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64 kJ热量.则该条件下完全燃烧的热化学方程式为______。
(2)甲烷高温分解生成氧气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是______。
(3)已知某甲烷燃料电池的总反应为,则电池负极的电极反应为______,随着电池不断放电,负极附近溶液的pH______。(填“增大”、“减小”或“不变”)
Ⅱ.利用工业废气或大气捕获的制备甲醇(),可减轻对化石燃料的依赖。
实验室在体积为2L的密闭容器中充入1mol 和3mol 在催化剂作用下通过反应 制备甲醇,实验测得和的物质的量随时间的变化关系如图所示。
(1)由图可知,当反应进行到______(填“3min”或“10min”)时,正反应速率和逆反应速率恰好相等。
(2)下列情况能说明该反应达到化学平衡状态的是______(填字母)。
a.单位时间内消耗1mol 的同时生成1mol
b.与的物质的量之比不再发生变化
c.混合气体的密度不再发生变化
(3)若上述反应中生成水的总物质的量不变,但水为液态,则反应过程中放出的热量______(填“增多”“减少”或“不变”)。
16.(14分)乙烯的年产量是衡量—个国采石油化工发展水平的重要标志之一、以乙烯为原料合成部分化工产品的流程如下(部分反应条件已略去)
(1)B→F的反应类型为______,C中官能团的名称为______。
(2)物质x的结构简式为______。
(3)D的一种同分异构体属于酯类,写出该同分异构体的结构简式______。
(4)苯乙烯在一定条件下也能发生加聚反应,写出该反应的化学方程式:______。
(5)某兴趣小组制备一定量的乙酸乙酯,装置如下图所示。
①制备乙酸乙酯的化学方程式为______。
②图中的错误之处有______。
17.(14分)草酸与草酸钠在生产、科研中应用广泛。二者均可以被酸性高锰酸钾溶液氧化
(1)草酸与高锰酸钾在酸性条件下能够发生如下反应:(未配平)。用4mL 溶液与2mL 溶液反应,研究不同条件对化学反应速率的影响。改变的条件如表所示:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2 20 —
Ⅱ 2 30 —
Ⅲ 1 20 1mL蒸馏水
①如果研究温度对化学反应速率的影响,使用实验______和______(用Ⅰ~Ⅲ表示);
②实验Ⅲ中加入1 mL蒸馏水的目的是______。
(2)可利用草酸钠测定高锰酸钾产品纯度,步骤如下:
Ⅰ.称取31.6 g高锰酸钾产品,配成100 mL溶液。
Ⅱ.准确称取6.70g已烘干的,置于锥形瓶中,加入少量蒸馏水使其溶解
Ⅲ.将瓶中溶液加热到75~80℃,再加入少量硫酸酸化,趁热用Ⅰ中配制的高锰酸钾溶液滴定。消耗高锰酸钾溶液12.50 mL。
滴定过程中反应的离子方程式为______。
②加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度______。(填“偏高”、“偏低”或“无影响”)
③高锰酸钾的纯度为______。
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中的浓度随反应时间t的变化如右图,其原因可能为______。
18.(16分)硝酸生产的尾气中NO和等氮氧化物以及酸性废水中均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为
;
①吸收后的溶液经浓缩、结晶、过滤,得到晶体,该晶体中的主要杂质是______(填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是______(填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如右图所示。
NaClO溶液的初始pH越大,NO转化率越低。其原因是______。
(3)利用也能够还原氮氧化物()实现氮污染的治理。将硝酸尾气与的混合气体通入与的混合溶液中实现无害化处理,其转化过程如右图所示。
①时,参与的离子方程式为______。
②若该过程中,每转移3.6 mol电子消耗1 mol氮氧化物(),则x为______。
Ⅱ.酸性废水中的处理
(1)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的还原为,从而实现脱氨。量取三份50mL含的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中的残留率(残留率=)与反应时间的关系如左下图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是______。
(2)还可以利用原电池原理处理酸性废水中,废水中的在水处理剂表面的变化如右上图所示,该电池正极上的电极反应式为______。
徐州市铜山区2022-2023学年高一下学期期中考试
化学(选择考)试题参考答案和评分标准
说明:学生解答主观性试题时,使用与本答案不同的其它合理答案的也给分。
一、单项选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题意。
1.B 2.D 3.A 4.B 5.A 6.A 7.A 8.C 9.B 10.D 11.C 12.D 13.D 14.C
二、非选择题:本部分4小题,共58分。
15.(14分)
Ⅰ.(1)
(2)为甲烷分解提供高温(能量)
(3) 增多
Ⅱ.(1)10min (2)b (3)增多
16.(14分)
(1)取代(酯化)反应(1分) 醛基(1分)
(2)HCOOH(2分) (3)(2分)
(4)(3分)
(5)①(3分)
②导管插入液面以下;错用饱和NaOH溶液(2分)
17.(14分)
(1))①Ⅰ Ⅱ(一个空1分,共2分)
②确保所有实验中、和溶液的总体积相同(2分)
(2)①(3分)
②偏高(2分) ③80%(3分)
④生成的作催化剂,随着浓度增加,反应速率越来越快(2分)
18.(16分)
Ⅰ.(1)①(2分) ②NO(2分)
(2)溶液pH越大,溶液中HClO的浓度越小,氧化NO的能力越弱(2分)
(3)①(3分) ②1.8(2分)
Ⅱ.(1)铝铁合金在溶液中形成原电池,加快反应速率(2分)
(2)(3分)
同课章节目录
