安徽省亳州市二完中2022-2023学年高一下学期期中教学质量检测化学试题(特培班)(含答案)
文档属性
| 名称 | 安徽省亳州市二完中2022-2023学年高一下学期期中教学质量检测化学试题(特培班)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 657.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-17 15:47:38 | ||
图片预览


文档简介
亳州市二完中2022-2023学年高一下学期期中教学质量检测
化学试题(A卷)
可能用到的相对原子质量:H:1 O:16 Mg:24 Al:27 Cu:64
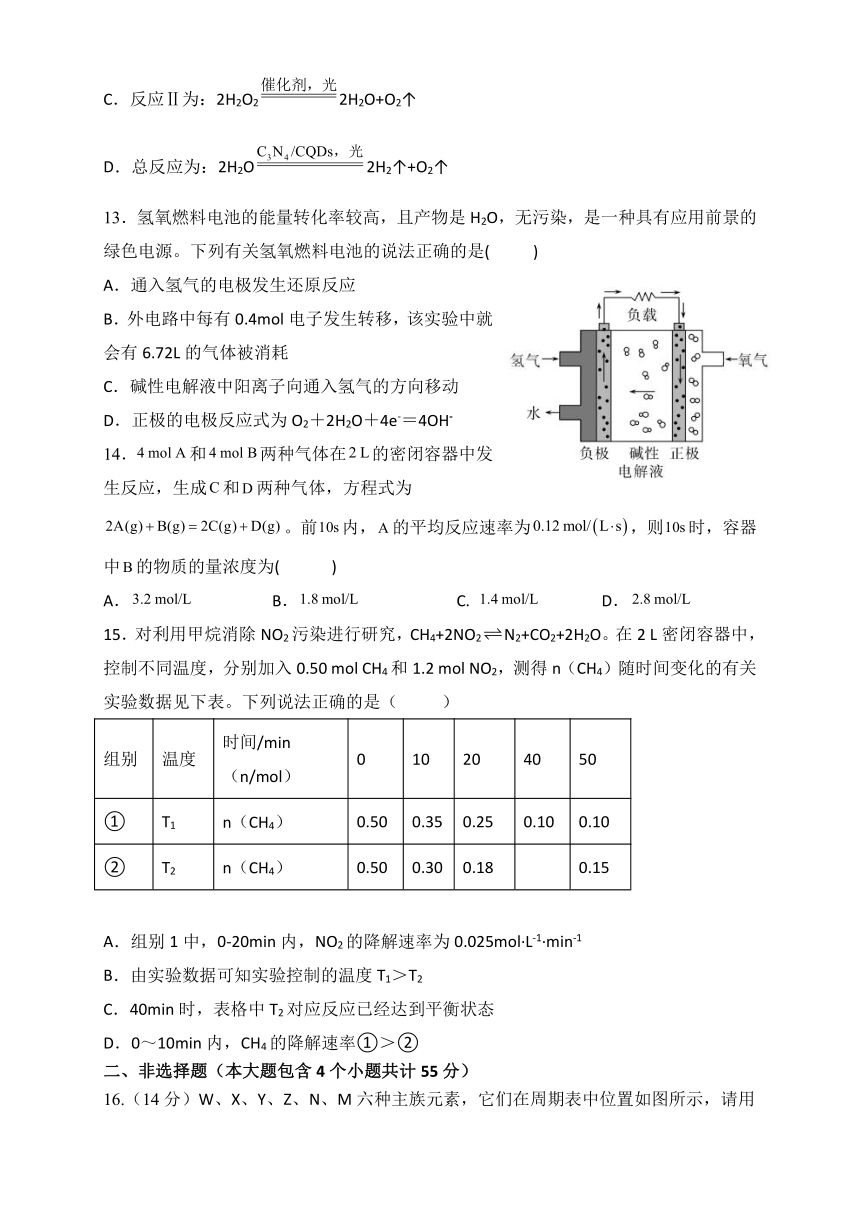
选择题(每小题只有一个最佳答案,每题3分,共45分)
1.化学与生活息息相关,下列关于生活中的化学,说法错误的是( )
A.近几年来,全球爆发了新型冠状病毒,从化学角度可用含氯的消毒剂、酒精、过氧化氢进行病毒的杀灭
B.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2
C.5G技术的应用离不开光缆,光缆的主要成分为单质硅
D.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露……”这种物质分离和提纯的方法是蒸馏
2. 世纪年代贵州省曾发行锑制的硬币,但因为锑很容易磨损,在流通过程中损耗严重。锑的原子结构示意图如图所示,下列有关的说法正确的是( )
A. 与互为同素异形体 B. 原子核内的中子数为
C. 相对原子质量约为 D. 位于元素周期表的第周期IA族
3.如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )
①X、Y的最高价氧化物的水化物酸性为Y>X;②Y、Z的气态氢化物的稳定性Y>Z;③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9。
A.只有③ B.①② C.①②③ D.③④
4.根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况判断,下列说法错误的是( )
A.N2(g)和O2(g)反应生成NO(g)是放热反应
B.2molO原子生成1molO2(g)时放出498kJ能量
C.2molNO(g)分子中的化学键断裂时需要吸收1264kJ能量
D.由N2和O2生成2molN(g)和2molO(g)吸收的总能量为1444kJ
5.原子序数为x的元素位于ⅡA族,则原子序数为x+1的元素不可能为( )
A.非金属 B.金属 C.最高正价+3 D.第ⅣA族
6.随着原子序数的递增,八种短周期元素(x~h)原子半径的相对大小、最高正价或最低负价的变化如下图所示。下列说法错误的是( )
A.h形成的最高价含氧酸的酸性比y形成的最高价含氧酸的酸性强,由此可以推出非金属性:h>y
B.d元素常见离子的半径大于f元素常见离子的半径
C.x、z元素组成ZX3共价化合物,其电子式可以表示为
D.g的最高价氧化物对应的水化物可以和f的单质、氧化物和氢氧化物反应
7.下列离子方程式错误的是( )
A.向NaOH溶液中通入过量的:
B.向氯水中通入少量:
C.将通入到饱和溶液中:SO2+H2O+HCO3-==SO42-+CO2+3H+
D.硅跟氢氧化钾溶液反应:Si+2OH-+H2O==SiO32-+2H2↑
8. 某学习小组按如下实验流程从海带中提取碘单质。
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,I2的沸点高于CCl4根据以上流程,判断下列说法正确的是( )
A.步骤X“分液”时,应打开旋塞,先将水层放出
B.加入H2SO4溶液后发生反应的离子方程式为: 5I-+IO+6H+=3I2+3H2O
C.方案甲采用蒸馏法时,碘蒸气先汽化冷凝,在锥形瓶中先得到I2
D.步骤Y中应加入过量的稀NaOH溶液
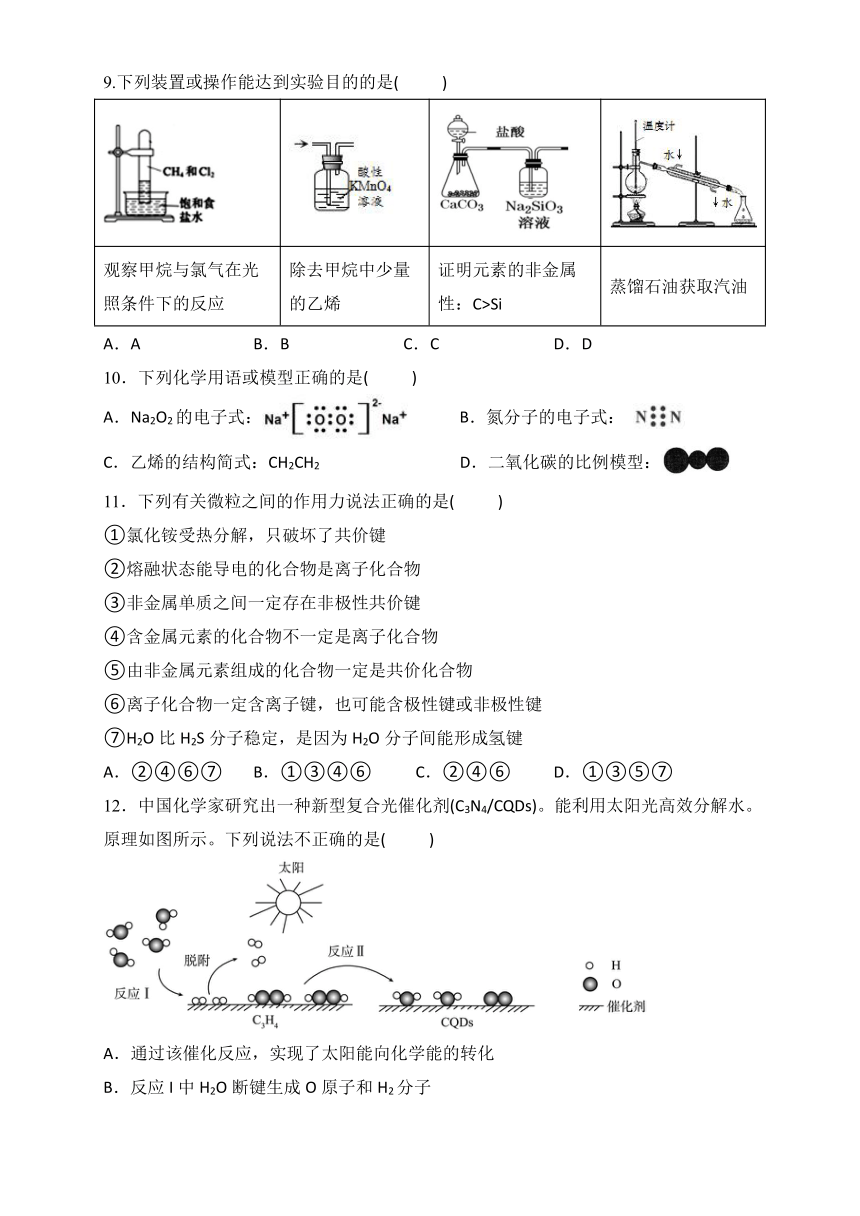
9.下列装置或操作能达到实验目的的是( )
观察甲烷与氯气在光照条件下的反应 除去甲烷中少量的乙烯 证明元素的非金属性:C>Si 蒸馏石油获取汽油
A.A B.B C.C D.D
10.下列化学用语或模型正确的是( )
A.Na2O2的电子式: B.氮分子的电子式:
C.乙烯的结构简式:CH2CH2 D.二氧化碳的比例模型:
11.下列有关微粒之间的作用力说法正确的是( )
①氯化铵受热分解,只破坏了共价键
②熔融状态能导电的化合物是离子化合物
③非金属单质之间一定存在非极性共价键
④含金属元素的化合物不一定是离子化合物
⑤由非金属元素组成的化合物一定是共价化合物
⑥离子化合物一定含离子键,也可能含极性键或非极性键
⑦H2O比H2S分子稳定,是因为H2O分子间能形成氢键
A.②④⑥⑦ B.①③④⑥ C.②④⑥ D.①③⑤⑦
12.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs)。能利用太阳光高效分解水。原理如图所示。下列说法不正确的是( )
A.通过该催化反应,实现了太阳能向化学能的转化
B.反应I中H2O断键生成O原子和H2分子
C.反应Ⅱ为:2H2O22H2O+O2↑
D.总反应为:2H2O2H2↑+O2↑
13.氢氧燃料电池的能量转化率较高,且产物是H2O,无污染,是一种具有应用前景的绿色电源。下列有关氢氧燃料电池的说法正确的是( )
A.通入氢气的电极发生还原反应
B.外电路中每有0.4mol电子发生转移,该实验中就会有6.72L的气体被消耗
C.碱性电解液中阳离子向通入氢气的方向移动
D.正极的电极反应式为O2+2H2O+4e-=4OH-
14.和两种气体在的密闭容器中发生反应,生成和两种气体,方程式为。前内,的平均反应速率为,则时,容器中的物质的量浓度为( )
A. B. C. D.
15.对利用甲烷消除NO2污染进行研究,CH4+2NO2N2+CO2+2H2O。在2 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。下列说法正确的是( )
组别 温度 时间/min(n/mol) 0 10 20 40 50
① T1 n(CH4) 0.50 0.35 0.25 0.10 0.10
② T2 n(CH4) 0.50 0.30 0.18 0.15
A.组别1中,0-20min内,NO2的降解速率为0.025mol·L-1·min-1
B.由实验数据可知实验控制的温度T1>T2
C.40min时,表格中T2对应反应已经达到平衡状态
D.0~10min内,CH4的降解速率①>②
非选择题(本大题包含4个小题共计55分)
16.(14分)W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,请用对应的的化学用语回答下列问题:
(1)N元素在周期表中的位置_______,根据周期表,推测N原子序数为_______
(2)比较Y、Z、W三种元素形成简单离子的半径由大到小的顺序_______(用元素符号表示)
(3)M最高价氧化物的水化物在水中的电离方程式:_______
(4)以下说法正确的是_______
A.单质的还原性:X>Y,可以用X与YM2溶液发生反应置换出Y来证明
B.Y与同周期的ⅢA元素的原子序数相差1
C.硅主要用于半导体器件的研制,目前用硅研发出的太阳能光伏电池,如我校的路灯
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可与氨水反应放出氢气
(5)由X、W元素构成的原子个数比为1:1的化合物所含化学键类型为_______,将一定量此化合物投入到足量的水中,产生2.24L气体(标准状况下),转移电子的物质的量为_______。
17.(15分)现代社会中,人类的活动都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。
(1)目前国际空间站处理的一个重要方法是,该反应中断裂1mol物质中的化学键吸收的能量、反应过程与能量变化的关系分别如图1、图2所示。
①写出的电子式:_______。
②形成1molC-H键放出的能量是_______
③从吸热放热角度分析,下列反应与的反应类型相同的是_______(填字母)。
晶体与晶体混合搅拌
乙醇在氧气中燃烧
C.锌与稀硫酸反应 D.氢氧化钠固体溶于水中
(2)常温下,某化学兴趣小组设计以下两套原电池装置图(假设不考虑浓硝酸变稀)。
①甲装置中电子移动方向是_______。
②乙装置中正极产生的电极反应式为_______。
③若甲、乙装置中的Cu、Al电极的质量均相等,一段时间后,甲装置中负极的质量比乙装置中负极的质量多21g,且正极产生气体的物质的量相等,则甲装置中溶液增加的质量是_______。
(3)已知碘在酒精中的溶解度比在水中大得多,能不能用酒精来萃取碘水中的碘?_______(填“能”或“不能”),其理由是_______。
18.(14分)用可以消除氮氧化物的污染,发生的反应为。将和通入恒容密闭容器中,在一定温度下发生上述反应,各组分的物质的量浓度随时间的变化曲线如图所示。
(1)_______。
(2)曲线②表示的是_______(填“NO”“”“”或“”)的浓度随时间的变化。
(3)图中达到平衡的点是_______(填“A”“B”“C”或“D”)。
(4)A点时,NO的转化率为_______(转化率是指已被转化的反应物的物质的量与其初始的物质的量之比)。
(5)10min末,其他条件不变,采用下列措施一定能加快上述反应速率的是_______(填字母)。
A.升高体系的温度 B.充入一定量的
C.将容器体积变为5L D.充入一定量氦气
(6)起始的压强与平衡时的压强之比为_______(用分数表示),平衡时,混合气体的平均摩尔质量是_______(保留两位小数)。
19.(12分)以菱镁矿(主要成分为,含少量,和)为原料制备高纯镁砂的工艺流程如下:
已知:浸出时产生的废渣中有,和。
回答下列问题:
(1)“沉镁”时发生反应的离子方程式为______。
(2)下图是Mg与卤素反应的能量变化(反应物和产物都是398K下的稳定状态)
①四种卤化物的热稳定由小到大顺序为_______。
②写出与反应的热化学方程式_______。
(3)Mg-电池可用于驱动无人驾驶的潜航器。该电池以海水(呈弱碱性)为电解质溶液,工作原理示意图如下。
该电池工作时,正极上的电极反应式为_______,Mg电极质量减少24g,理论上消耗______g。
(4)请设计“利用生产流程中产生的废渣、盐酸和NaOH溶液制取纯净”的实验方案。说明简要的实验步骤_______。
试卷第1页,共3页
亳州市二完中2022-2023学年高一下学期期中教学质量检测
化学试题(A卷)参考答案
选择题(本题包含15个小题,每小题只有一个最佳答案,每题3分,共45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C B A A D C C B A A C B D C C
填空题(本题包含4个小题,共55分)
16题 (每空2分,共14分)
第四周期ⅣA族 32 (2)S2->O2->Mg2+ (3) HClO4=H++ClO
(4) BC (5)离子键、非极性共价键 0.2mol
17题(除黑体字标注外,每空2分,共15分)
(1) ① ② ③ BC
(2) ① Al导线Cu ② ③ 24g
(3)不能(1分) 酒精与水互溶
18题:(每空2分,共14分)
(1)2L (2) (3)D (4)40% (5)AB (6) 23.40g/mol
19题:(每空2分,共12分)
(1)Mg2++2NH3·H2O=Mg(OH)2↓+2
(2) ①MgI2② MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) ΔH=-117kJ/mol
(3) H2O2+2e-=2OH- 34
(4)向废渣中加入过量的NaOH,过滤后将固体洗涤、干燥即得到Fe(OH)3。
化学试题(A卷)
可能用到的相对原子质量:H:1 O:16 Mg:24 Al:27 Cu:64
选择题(每小题只有一个最佳答案,每题3分,共45分)
1.化学与生活息息相关,下列关于生活中的化学,说法错误的是( )
A.近几年来,全球爆发了新型冠状病毒,从化学角度可用含氯的消毒剂、酒精、过氧化氢进行病毒的杀灭
B.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2
C.5G技术的应用离不开光缆,光缆的主要成分为单质硅
D.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露……”这种物质分离和提纯的方法是蒸馏
2. 世纪年代贵州省曾发行锑制的硬币,但因为锑很容易磨损,在流通过程中损耗严重。锑的原子结构示意图如图所示,下列有关的说法正确的是( )
A. 与互为同素异形体 B. 原子核内的中子数为
C. 相对原子质量约为 D. 位于元素周期表的第周期IA族
3.如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )
①X、Y的最高价氧化物的水化物酸性为Y>X;②Y、Z的气态氢化物的稳定性Y>Z;③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9。
A.只有③ B.①② C.①②③ D.③④
4.根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况判断,下列说法错误的是( )
A.N2(g)和O2(g)反应生成NO(g)是放热反应
B.2molO原子生成1molO2(g)时放出498kJ能量
C.2molNO(g)分子中的化学键断裂时需要吸收1264kJ能量
D.由N2和O2生成2molN(g)和2molO(g)吸收的总能量为1444kJ
5.原子序数为x的元素位于ⅡA族,则原子序数为x+1的元素不可能为( )
A.非金属 B.金属 C.最高正价+3 D.第ⅣA族
6.随着原子序数的递增,八种短周期元素(x~h)原子半径的相对大小、最高正价或最低负价的变化如下图所示。下列说法错误的是( )
A.h形成的最高价含氧酸的酸性比y形成的最高价含氧酸的酸性强,由此可以推出非金属性:h>y
B.d元素常见离子的半径大于f元素常见离子的半径
C.x、z元素组成ZX3共价化合物,其电子式可以表示为
D.g的最高价氧化物对应的水化物可以和f的单质、氧化物和氢氧化物反应
7.下列离子方程式错误的是( )
A.向NaOH溶液中通入过量的:
B.向氯水中通入少量:
C.将通入到饱和溶液中:SO2+H2O+HCO3-==SO42-+CO2+3H+
D.硅跟氢氧化钾溶液反应:Si+2OH-+H2O==SiO32-+2H2↑
8. 某学习小组按如下实验流程从海带中提取碘单质。
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,I2的沸点高于CCl4根据以上流程,判断下列说法正确的是( )
A.步骤X“分液”时,应打开旋塞,先将水层放出
B.加入H2SO4溶液后发生反应的离子方程式为: 5I-+IO+6H+=3I2+3H2O
C.方案甲采用蒸馏法时,碘蒸气先汽化冷凝,在锥形瓶中先得到I2
D.步骤Y中应加入过量的稀NaOH溶液
9.下列装置或操作能达到实验目的的是( )
观察甲烷与氯气在光照条件下的反应 除去甲烷中少量的乙烯 证明元素的非金属性:C>Si 蒸馏石油获取汽油
A.A B.B C.C D.D
10.下列化学用语或模型正确的是( )
A.Na2O2的电子式: B.氮分子的电子式:
C.乙烯的结构简式:CH2CH2 D.二氧化碳的比例模型:
11.下列有关微粒之间的作用力说法正确的是( )
①氯化铵受热分解,只破坏了共价键
②熔融状态能导电的化合物是离子化合物
③非金属单质之间一定存在非极性共价键
④含金属元素的化合物不一定是离子化合物
⑤由非金属元素组成的化合物一定是共价化合物
⑥离子化合物一定含离子键,也可能含极性键或非极性键
⑦H2O比H2S分子稳定,是因为H2O分子间能形成氢键
A.②④⑥⑦ B.①③④⑥ C.②④⑥ D.①③⑤⑦
12.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs)。能利用太阳光高效分解水。原理如图所示。下列说法不正确的是( )
A.通过该催化反应,实现了太阳能向化学能的转化
B.反应I中H2O断键生成O原子和H2分子
C.反应Ⅱ为:2H2O22H2O+O2↑
D.总反应为:2H2O2H2↑+O2↑
13.氢氧燃料电池的能量转化率较高,且产物是H2O,无污染,是一种具有应用前景的绿色电源。下列有关氢氧燃料电池的说法正确的是( )
A.通入氢气的电极发生还原反应
B.外电路中每有0.4mol电子发生转移,该实验中就会有6.72L的气体被消耗
C.碱性电解液中阳离子向通入氢气的方向移动
D.正极的电极反应式为O2+2H2O+4e-=4OH-
14.和两种气体在的密闭容器中发生反应,生成和两种气体,方程式为。前内,的平均反应速率为,则时,容器中的物质的量浓度为( )
A. B. C. D.
15.对利用甲烷消除NO2污染进行研究,CH4+2NO2N2+CO2+2H2O。在2 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。下列说法正确的是( )
组别 温度 时间/min(n/mol) 0 10 20 40 50
① T1 n(CH4) 0.50 0.35 0.25 0.10 0.10
② T2 n(CH4) 0.50 0.30 0.18 0.15
A.组别1中,0-20min内,NO2的降解速率为0.025mol·L-1·min-1
B.由实验数据可知实验控制的温度T1>T2
C.40min时,表格中T2对应反应已经达到平衡状态
D.0~10min内,CH4的降解速率①>②
非选择题(本大题包含4个小题共计55分)
16.(14分)W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,请用对应的的化学用语回答下列问题:
(1)N元素在周期表中的位置_______,根据周期表,推测N原子序数为_______
(2)比较Y、Z、W三种元素形成简单离子的半径由大到小的顺序_______(用元素符号表示)
(3)M最高价氧化物的水化物在水中的电离方程式:_______
(4)以下说法正确的是_______
A.单质的还原性:X>Y,可以用X与YM2溶液发生反应置换出Y来证明
B.Y与同周期的ⅢA元素的原子序数相差1
C.硅主要用于半导体器件的研制,目前用硅研发出的太阳能光伏电池,如我校的路灯
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可与氨水反应放出氢气
(5)由X、W元素构成的原子个数比为1:1的化合物所含化学键类型为_______,将一定量此化合物投入到足量的水中,产生2.24L气体(标准状况下),转移电子的物质的量为_______。
17.(15分)现代社会中,人类的活动都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。
(1)目前国际空间站处理的一个重要方法是,该反应中断裂1mol物质中的化学键吸收的能量、反应过程与能量变化的关系分别如图1、图2所示。
①写出的电子式:_______。
②形成1molC-H键放出的能量是_______
③从吸热放热角度分析,下列反应与的反应类型相同的是_______(填字母)。
晶体与晶体混合搅拌
乙醇在氧气中燃烧
C.锌与稀硫酸反应 D.氢氧化钠固体溶于水中
(2)常温下,某化学兴趣小组设计以下两套原电池装置图(假设不考虑浓硝酸变稀)。
①甲装置中电子移动方向是_______。
②乙装置中正极产生的电极反应式为_______。
③若甲、乙装置中的Cu、Al电极的质量均相等,一段时间后,甲装置中负极的质量比乙装置中负极的质量多21g,且正极产生气体的物质的量相等,则甲装置中溶液增加的质量是_______。
(3)已知碘在酒精中的溶解度比在水中大得多,能不能用酒精来萃取碘水中的碘?_______(填“能”或“不能”),其理由是_______。
18.(14分)用可以消除氮氧化物的污染,发生的反应为。将和通入恒容密闭容器中,在一定温度下发生上述反应,各组分的物质的量浓度随时间的变化曲线如图所示。
(1)_______。
(2)曲线②表示的是_______(填“NO”“”“”或“”)的浓度随时间的变化。
(3)图中达到平衡的点是_______(填“A”“B”“C”或“D”)。
(4)A点时,NO的转化率为_______(转化率是指已被转化的反应物的物质的量与其初始的物质的量之比)。
(5)10min末,其他条件不变,采用下列措施一定能加快上述反应速率的是_______(填字母)。
A.升高体系的温度 B.充入一定量的
C.将容器体积变为5L D.充入一定量氦气
(6)起始的压强与平衡时的压强之比为_______(用分数表示),平衡时,混合气体的平均摩尔质量是_______(保留两位小数)。
19.(12分)以菱镁矿(主要成分为,含少量,和)为原料制备高纯镁砂的工艺流程如下:
已知:浸出时产生的废渣中有,和。
回答下列问题:
(1)“沉镁”时发生反应的离子方程式为______。
(2)下图是Mg与卤素反应的能量变化(反应物和产物都是398K下的稳定状态)
①四种卤化物的热稳定由小到大顺序为_______。
②写出与反应的热化学方程式_______。
(3)Mg-电池可用于驱动无人驾驶的潜航器。该电池以海水(呈弱碱性)为电解质溶液,工作原理示意图如下。
该电池工作时,正极上的电极反应式为_______,Mg电极质量减少24g,理论上消耗______g。
(4)请设计“利用生产流程中产生的废渣、盐酸和NaOH溶液制取纯净”的实验方案。说明简要的实验步骤_______。
试卷第1页,共3页
亳州市二完中2022-2023学年高一下学期期中教学质量检测
化学试题(A卷)参考答案
选择题(本题包含15个小题,每小题只有一个最佳答案,每题3分,共45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C B A A D C C B A A C B D C C
填空题(本题包含4个小题,共55分)
16题 (每空2分,共14分)
第四周期ⅣA族 32 (2)S2->O2->Mg2+ (3) HClO4=H++ClO
(4) BC (5)离子键、非极性共价键 0.2mol
17题(除黑体字标注外,每空2分,共15分)
(1) ① ② ③ BC
(2) ① Al导线Cu ② ③ 24g
(3)不能(1分) 酒精与水互溶
18题:(每空2分,共14分)
(1)2L (2) (3)D (4)40% (5)AB (6) 23.40g/mol
19题:(每空2分,共12分)
(1)Mg2++2NH3·H2O=Mg(OH)2↓+2
(2) ①MgI2
(3) H2O2+2e-=2OH- 34
(4)向废渣中加入过量的NaOH,过滤后将固体洗涤、干燥即得到Fe(OH)3。
同课章节目录
