安徽省合肥市重点中学2022-2023学年高二下学期期中考试化学试题(含答案)
文档属性
| 名称 | 安徽省合肥市重点中学2022-2023学年高二下学期期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-17 15:55:50 | ||
图片预览

文档简介
合肥市重点中学2022-2023学年高二下学期期中考试
化学试卷
时长:75分钟 分值100分
可能用到的相对原子质量:H:1、Li:7、Cr:12、N:14、O:16、Na:23、Mg:24、S:32、C:35.5、Fe:56、Cu:64
一、单项选择题(本大题共16小题,每题3分,共48分)
1.生活中的化学无处不在,下列关于生活中的化学描述错误的是( )
A.可以用光谱分析的方法来确定太阳的组成元素是否含氮
B.壁虎在天花板上爬行自如是因为壁虎的脚与墙体之间有范德华力
C.碘易溶于四氯化碳,难溶于水,因为碘、四氯化碳都是非极性分子
D.“挑尽寒灯梦不成”所看到的灯光和原子核外电子跃迁无关
2.下列化学用语表示正确的是( )
A.中子数为18的氯原子:
B.碳的基态原子轨道表示式:
C.的空闻结构:(平面三角形)
D.HCl的形成过程:
3.下列各组物质的晶体类型相同的是( )
A.和 B.和NaCl C.和KCl D.和MgO
4.工业上电解熔融和冰晶石()的混合物可制得铝。下列说法正确的是( )
A.半径大小: B.电负性大小:
C.电离能大小: D.碱性强弱:
5.下列说法正确的是( )
A.、和的结构相似
B.的键能比的键能大,所以HF比HCl稳定,HF的稳定性与HF分子间存在氢键无关
C.干冰易升华,这与分子中键的键能大小有关
D.和的空间构型相似,和的化学键类型完全相同
6.氟元素的电负性最大,易与大多微非金属元素组成稳定化合物,如、、、等。下列说法正确的是( )
A.、中心原子的杂化方式相同 B.键长:
C.键角: D.、、、都是由极性键构成的非极性分子
7.关于性质的解释合理的是( )
选项 性质 解释
A 用蘸有浓盐酸的玻璃棒检验 生成了白雾
B 熔点高于 键的键能比大
C 能与以配位键结合 中氮原子有孤电子对
D 氨水中存在 是离子化合物
A.A B.B C.C D.D
8.用中子轰击原子产生啦子(即氨核)的核反应为:.已如元素Y在化合物中呈价。下列说法正确的是( )
A.可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是
C.X和氢元素形成离子化合物
D.和互为同素异形体
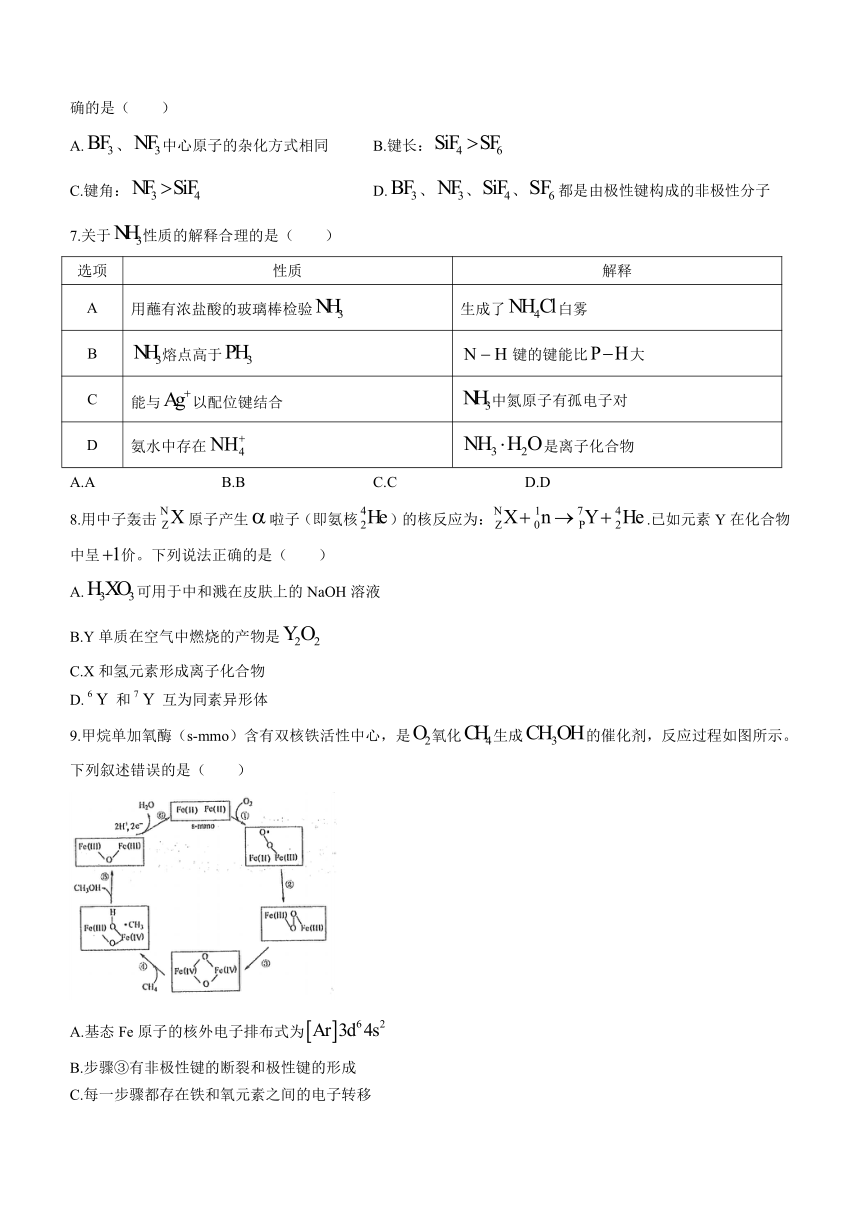
9.甲烷单加氧酶(s-mmo)含有双核铁活性中心,是氧化生成的催化剂,反应过程如图所示。下列叙述错误的是( )
A.基态Fe原子的核外电子排布式为
B.步骤③有非极性键的断裂和极性键的形成
C.每一步骤都存在铁和氧元素之间的电子转移
D.图中的总过程可表示为:
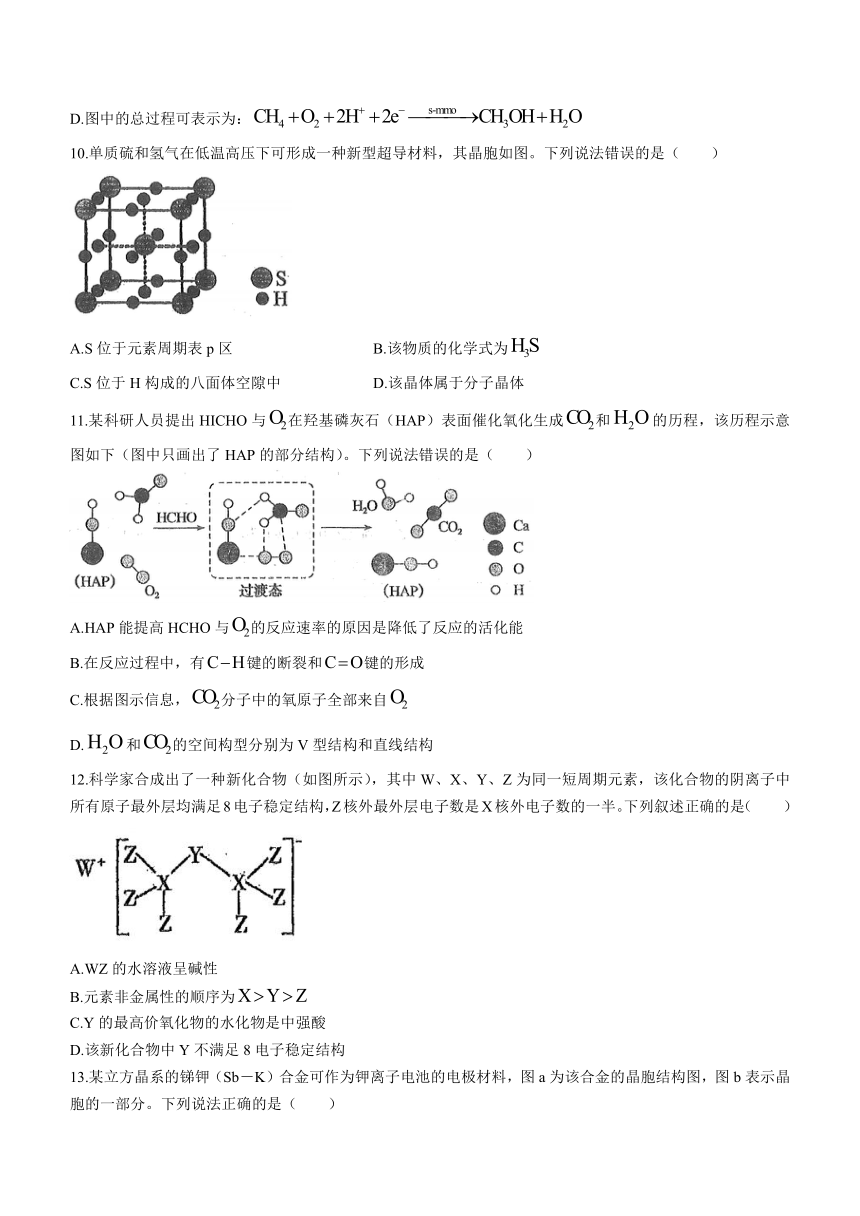
10.单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
A.S位于元素周期表p区 B.该物质的化学式为
C.S位于H构成的八面体空隙中 D.该晶体属于分子晶体
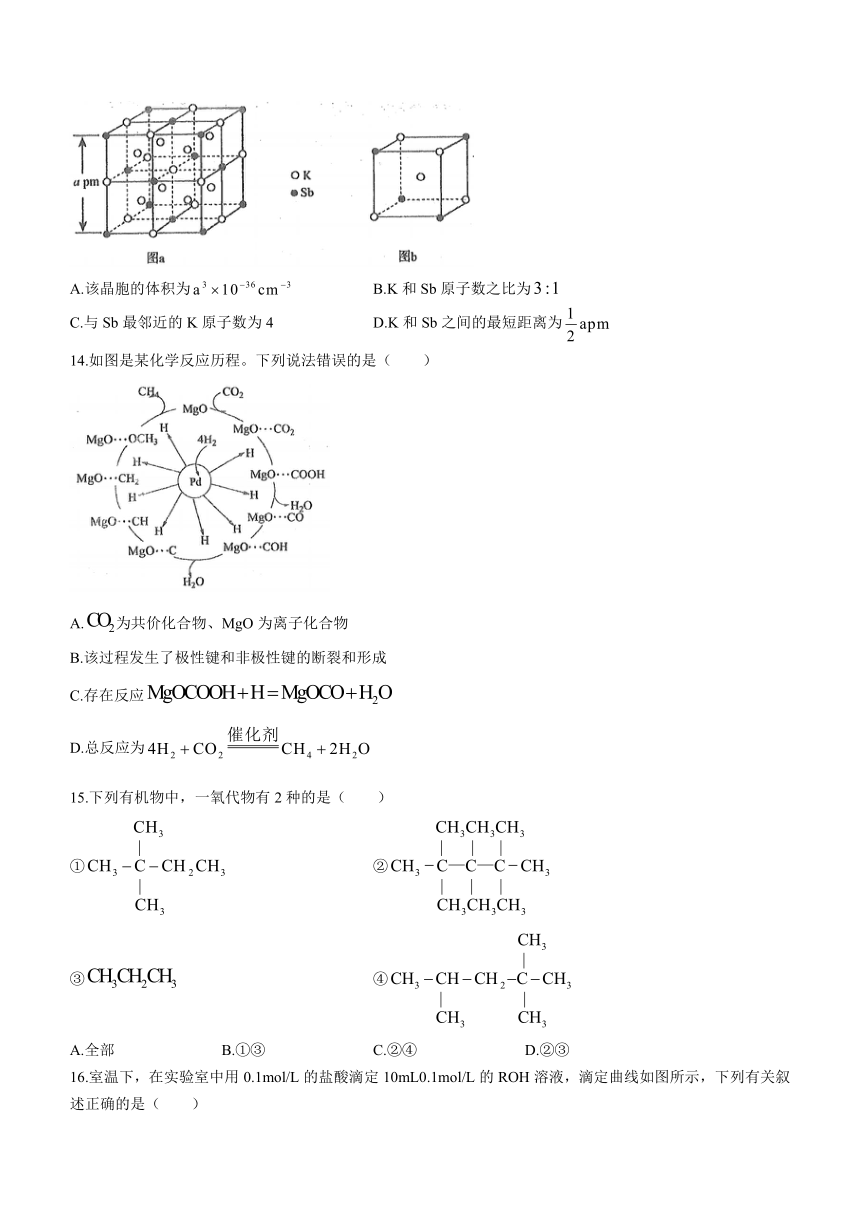
11.某科研人员提出HICHO与在羟基磷灰石(HAP)表面催化氧化生成和的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列说法错误的是( )
A.HAP能提高HCHO与的反应速率的原因是降低了反应的活化能
B.在反应过程中,有键的断裂和键的形成
C.根据图示信息,分子中的氧原子全部来自
D.和的空间构型分别为V型结构和直线结构
12.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,该化合物的阴离子中所有原子最外层均满足8电子稳定结构,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
13.某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
A.该晶胞的体积为 B.K和Sb原子数之比为
C.与Sb最邻近的K原子数为4 D.K和Sb之间的最短距离为
14.如图是某化学反应历程。下列说法错误的是( )
A.为共价化合物、MgO为离子化合物
B.该过程发生了极性键和非极性键的断裂和形成
C.存在反应
D.总反应为
15.下列有机物中,一氧代物有2种的是( )
① ②
③ ④
A.全部 B.①③ C.②④ D.②③
16.室温下,在实验室中用0.1mol/L的盐酸滴定10mL0.1mol/L的ROH溶液,滴定曲线如图所示,下列有关叙述正确的是( )
A.水的电离程度:①<③<④
B.的数量级为
C.点③对应的横坐标为10
D.点②对应溶液中:
二、填空题(本大题共3小题,共52分)
17.青蒿素是烃的含氧衍生物,为无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157℃,是高效的抗疟药。已知:乙醚的沸点为34.5℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。
Ⅰ.实验室用乙醚提取青蒿素的流程如图1所示。
(1)实验前要对青蒿进行粉碎,其目的是______。
(2)操作Ⅱ的名称是______。
(3)操作Ⅲ的主要过程可能是______。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
Ⅱ.用如图2所示的实验装置测定青蒿素实验式的方法如下:将28.2g青蒿素样品放在装置C的硬质玻璃管中,缓缓通入空气数分钟后,使其完全燃烧,精确测定装置D和B实验前后的质量,根据所测数据计算。
(4)装置A中盛放的物质是______,装置D中盛放的物质是______,装置B中盛放的物质是______。
(5)该实验装置可能会产生误差,造成测定含氧最偏低,改进方法是______。
(6)用合理改进后的装置进行实验,测得的数据如表所示:
装置 实验前/g 实验后/g
D 22.6 42.4
E 80.2 146.2
则青蒿素的实验式是______。
18.硅、硫元素是重要的非金属元素,在生产、生活中占有重要地位。如很多含巯基()的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为______.
(2)①硫单质的一种结构为,该晶体中存在的作用力______、______。
②、、键角由大到小的顺序是______(填离子符号)
(3)、、的沸点由高到低顺序为______。
(4)分子的空间结构(以为中心)为______,分子中氮原子的杂化轨道类型是______。
(5)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有______。
A.在Ⅰ中S原子采取条化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中键角是180°
D.在Ⅲ中存在离子键与共价键
(6)化合物Ⅰ的结构与甘油()相似,但是甘油在水中的溶解度更大,其原因可能是______。
(7)硫铁矿()是制备硫酸的原料,晶体的晶胞形状为立方体,边长为anm,结构如下图所示。
①距离最近的阴离子有______个。
②的摩尔质量为,阿伏加德罗常数为。
该晶体的密度为______。
19.氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)298K时,燃烧生成放热121kJ,蒸发吸热44KJ,表示燃烧热的热化学方程式为__________________.
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.
Ⅱ.
①下列操作中,能提高平衡转化率的是_____(填标号)。
A.增加用量 B.恒温恒压下通入情性气体
C.移除 D.加入催化剂
②恒温恒压条件下,和反应达平衡时,的转化率为α,的物质的量为bmol,则反应的平衡常数______(写出含有α、b的计算式;对于反应,,x为物质的量分数)。
(3)氢氧燃料电池中氢气在______(填“正”或“负”)极发生反应。
(4)在允许自由迁移的固体电解质然料电池中,放电的电极反应式为_____。
(5)甲醇然料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,一般而言,能垒越小,活化能越小,越容易进行,则最可行途径为a→_____(用b~j等代号表示)。
合肥市重点中学2022-2023学年高二下学期期中考试
化学试卷参考答案
一、选择题(本大题共16小题每题3分,共48分)
1-5 DCCAB 6-10 BCACD 11-16 CCBBDB
二、填空题(本大题共3小题,共52分)
17.【每空2分,共16分】
(1)增大青蒿与乙醚的接触面积,提高青蒿素的浸漫出速率
(2)蒸馏
(3)B
(4)NaOH溶液;;碱石灰
(5)装置E后连接一个防止空气中和进入E的装置
(6)
18.【共20分】
(1)(2分)
(2)①(非极性)共价键(1分)、范德华力(1分);②(2分)
(3)(2分)
(4)四面体(2分);(2分)
(5)AD(2分)
(6)甘油中所含的羟基数目多,更易与水形成氢键,更易溶于水(2分)
(7)(1)6(2分);(2)(2分)
19.【共16分】
(1) (3分)
(2)①(1)BC(2分);②(3分);
(3)负(2分)
(4)(3分)
(5)(3分)
化学试卷
时长:75分钟 分值100分
可能用到的相对原子质量:H:1、Li:7、Cr:12、N:14、O:16、Na:23、Mg:24、S:32、C:35.5、Fe:56、Cu:64
一、单项选择题(本大题共16小题,每题3分,共48分)
1.生活中的化学无处不在,下列关于生活中的化学描述错误的是( )
A.可以用光谱分析的方法来确定太阳的组成元素是否含氮
B.壁虎在天花板上爬行自如是因为壁虎的脚与墙体之间有范德华力
C.碘易溶于四氯化碳,难溶于水,因为碘、四氯化碳都是非极性分子
D.“挑尽寒灯梦不成”所看到的灯光和原子核外电子跃迁无关
2.下列化学用语表示正确的是( )
A.中子数为18的氯原子:
B.碳的基态原子轨道表示式:
C.的空闻结构:(平面三角形)
D.HCl的形成过程:
3.下列各组物质的晶体类型相同的是( )
A.和 B.和NaCl C.和KCl D.和MgO
4.工业上电解熔融和冰晶石()的混合物可制得铝。下列说法正确的是( )
A.半径大小: B.电负性大小:
C.电离能大小: D.碱性强弱:
5.下列说法正确的是( )
A.、和的结构相似
B.的键能比的键能大,所以HF比HCl稳定,HF的稳定性与HF分子间存在氢键无关
C.干冰易升华,这与分子中键的键能大小有关
D.和的空间构型相似,和的化学键类型完全相同
6.氟元素的电负性最大,易与大多微非金属元素组成稳定化合物,如、、、等。下列说法正确的是( )
A.、中心原子的杂化方式相同 B.键长:
C.键角: D.、、、都是由极性键构成的非极性分子
7.关于性质的解释合理的是( )
选项 性质 解释
A 用蘸有浓盐酸的玻璃棒检验 生成了白雾
B 熔点高于 键的键能比大
C 能与以配位键结合 中氮原子有孤电子对
D 氨水中存在 是离子化合物
A.A B.B C.C D.D
8.用中子轰击原子产生啦子(即氨核)的核反应为:.已如元素Y在化合物中呈价。下列说法正确的是( )
A.可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是
C.X和氢元素形成离子化合物
D.和互为同素异形体
9.甲烷单加氧酶(s-mmo)含有双核铁活性中心,是氧化生成的催化剂,反应过程如图所示。下列叙述错误的是( )
A.基态Fe原子的核外电子排布式为
B.步骤③有非极性键的断裂和极性键的形成
C.每一步骤都存在铁和氧元素之间的电子转移
D.图中的总过程可表示为:
10.单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
A.S位于元素周期表p区 B.该物质的化学式为
C.S位于H构成的八面体空隙中 D.该晶体属于分子晶体
11.某科研人员提出HICHO与在羟基磷灰石(HAP)表面催化氧化生成和的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列说法错误的是( )
A.HAP能提高HCHO与的反应速率的原因是降低了反应的活化能
B.在反应过程中,有键的断裂和键的形成
C.根据图示信息,分子中的氧原子全部来自
D.和的空间构型分别为V型结构和直线结构
12.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,该化合物的阴离子中所有原子最外层均满足8电子稳定结构,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
13.某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
A.该晶胞的体积为 B.K和Sb原子数之比为
C.与Sb最邻近的K原子数为4 D.K和Sb之间的最短距离为
14.如图是某化学反应历程。下列说法错误的是( )
A.为共价化合物、MgO为离子化合物
B.该过程发生了极性键和非极性键的断裂和形成
C.存在反应
D.总反应为
15.下列有机物中,一氧代物有2种的是( )
① ②
③ ④
A.全部 B.①③ C.②④ D.②③
16.室温下,在实验室中用0.1mol/L的盐酸滴定10mL0.1mol/L的ROH溶液,滴定曲线如图所示,下列有关叙述正确的是( )
A.水的电离程度:①<③<④
B.的数量级为
C.点③对应的横坐标为10
D.点②对应溶液中:
二、填空题(本大题共3小题,共52分)
17.青蒿素是烃的含氧衍生物,为无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157℃,是高效的抗疟药。已知:乙醚的沸点为34.5℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。
Ⅰ.实验室用乙醚提取青蒿素的流程如图1所示。
(1)实验前要对青蒿进行粉碎,其目的是______。
(2)操作Ⅱ的名称是______。
(3)操作Ⅲ的主要过程可能是______。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
Ⅱ.用如图2所示的实验装置测定青蒿素实验式的方法如下:将28.2g青蒿素样品放在装置C的硬质玻璃管中,缓缓通入空气数分钟后,使其完全燃烧,精确测定装置D和B实验前后的质量,根据所测数据计算。
(4)装置A中盛放的物质是______,装置D中盛放的物质是______,装置B中盛放的物质是______。
(5)该实验装置可能会产生误差,造成测定含氧最偏低,改进方法是______。
(6)用合理改进后的装置进行实验,测得的数据如表所示:
装置 实验前/g 实验后/g
D 22.6 42.4
E 80.2 146.2
则青蒿素的实验式是______。
18.硅、硫元素是重要的非金属元素,在生产、生活中占有重要地位。如很多含巯基()的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为______.
(2)①硫单质的一种结构为,该晶体中存在的作用力______、______。
②、、键角由大到小的顺序是______(填离子符号)
(3)、、的沸点由高到低顺序为______。
(4)分子的空间结构(以为中心)为______,分子中氮原子的杂化轨道类型是______。
(5)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有______。
A.在Ⅰ中S原子采取条化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中键角是180°
D.在Ⅲ中存在离子键与共价键
(6)化合物Ⅰ的结构与甘油()相似,但是甘油在水中的溶解度更大,其原因可能是______。
(7)硫铁矿()是制备硫酸的原料,晶体的晶胞形状为立方体,边长为anm,结构如下图所示。
①距离最近的阴离子有______个。
②的摩尔质量为,阿伏加德罗常数为。
该晶体的密度为______。
19.氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)298K时,燃烧生成放热121kJ,蒸发吸热44KJ,表示燃烧热的热化学方程式为__________________.
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.
Ⅱ.
①下列操作中,能提高平衡转化率的是_____(填标号)。
A.增加用量 B.恒温恒压下通入情性气体
C.移除 D.加入催化剂
②恒温恒压条件下,和反应达平衡时,的转化率为α,的物质的量为bmol,则反应的平衡常数______(写出含有α、b的计算式;对于反应,,x为物质的量分数)。
(3)氢氧燃料电池中氢气在______(填“正”或“负”)极发生反应。
(4)在允许自由迁移的固体电解质然料电池中,放电的电极反应式为_____。
(5)甲醇然料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,一般而言,能垒越小,活化能越小,越容易进行,则最可行途径为a→_____(用b~j等代号表示)。
合肥市重点中学2022-2023学年高二下学期期中考试
化学试卷参考答案
一、选择题(本大题共16小题每题3分,共48分)
1-5 DCCAB 6-10 BCACD 11-16 CCBBDB
二、填空题(本大题共3小题,共52分)
17.【每空2分,共16分】
(1)增大青蒿与乙醚的接触面积,提高青蒿素的浸漫出速率
(2)蒸馏
(3)B
(4)NaOH溶液;;碱石灰
(5)装置E后连接一个防止空气中和进入E的装置
(6)
18.【共20分】
(1)(2分)
(2)①(非极性)共价键(1分)、范德华力(1分);②(2分)
(3)(2分)
(4)四面体(2分);(2分)
(5)AD(2分)
(6)甘油中所含的羟基数目多,更易与水形成氢键,更易溶于水(2分)
(7)(1)6(2分);(2)(2分)
19.【共16分】
(1) (3分)
(2)①(1)BC(2分);②(3分);
(3)负(2分)
(4)(3分)
(5)(3分)
同课章节目录
