江苏省盐城市五校2022-2023学年高一下学期期中联考化学试题(含答案)
文档属性
| 名称 | 江苏省盐城市五校2022-2023学年高一下学期期中联考化学试题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 456.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-17 16:28:20 | ||
图片预览

文档简介
盐城市五校2022-2023学年高一下学期期中联考
化学学科试题
(分值:100分 时长:75分钟)
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-64 Ba-137
一、单项选择题:共14题,每题3分,共42分。每小题只有一个选项最符合题意。
1.化学和生活、生产息息相关。下列说法正确的是( )
A.火力发电厂将烟囱建得很高,可以减少对环境的污染
B.人体注射的新冠疫苗性质稳定,可以高温下运输、保存
C.“中国天眼”球面射电望远镜的钢铁“眼眶”属于金属材料
D.“天宫二号”的硅太阳能电池板的原料二氧化硅属于新型无机非金属材料
2.下列化学用语表示不正确的是( )
A.小苏打化学式:
B.中子数为18的氯原子:
C.的电离方程式:
D.铁在氯气中燃烧:
3.反应可应用于汽车尾气净化。下列关于该反应的说法正确的是( )
A.升高温度能加快反应速率
B.减小NO浓度能加快反应速率
C.使用恰当的催化剂,NO能100%转化为产物
D.达到化学平衡时,CO能100%转化为产物
4.下列变化属于放热反应的是( )
A.碘蒸汽凝华 B.浓硫酸稀释
C.盐酸与氢氧化钠溶液反应 D.石灰石分解的反应
5.下列有关反应的离子方程式正确的是( )
A.将过氧化钠投入水中:
B.向稀盐酸中加入铁粉:
C.用醋酸溶洗水壶中水垢:
D.溶液中滴入过量稀氨水:
6.通常情况下,下列变化通过一步反应不可以实现的是( )
A. B.
C. D.
7.下列有关物质的性质与用途具有对应关系的是( )
A.氧化铁粉末呈红色,可用于制取铁盐
B.Na具有强还原性,可用于冶炼稀有金属
C.受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于水的消毒
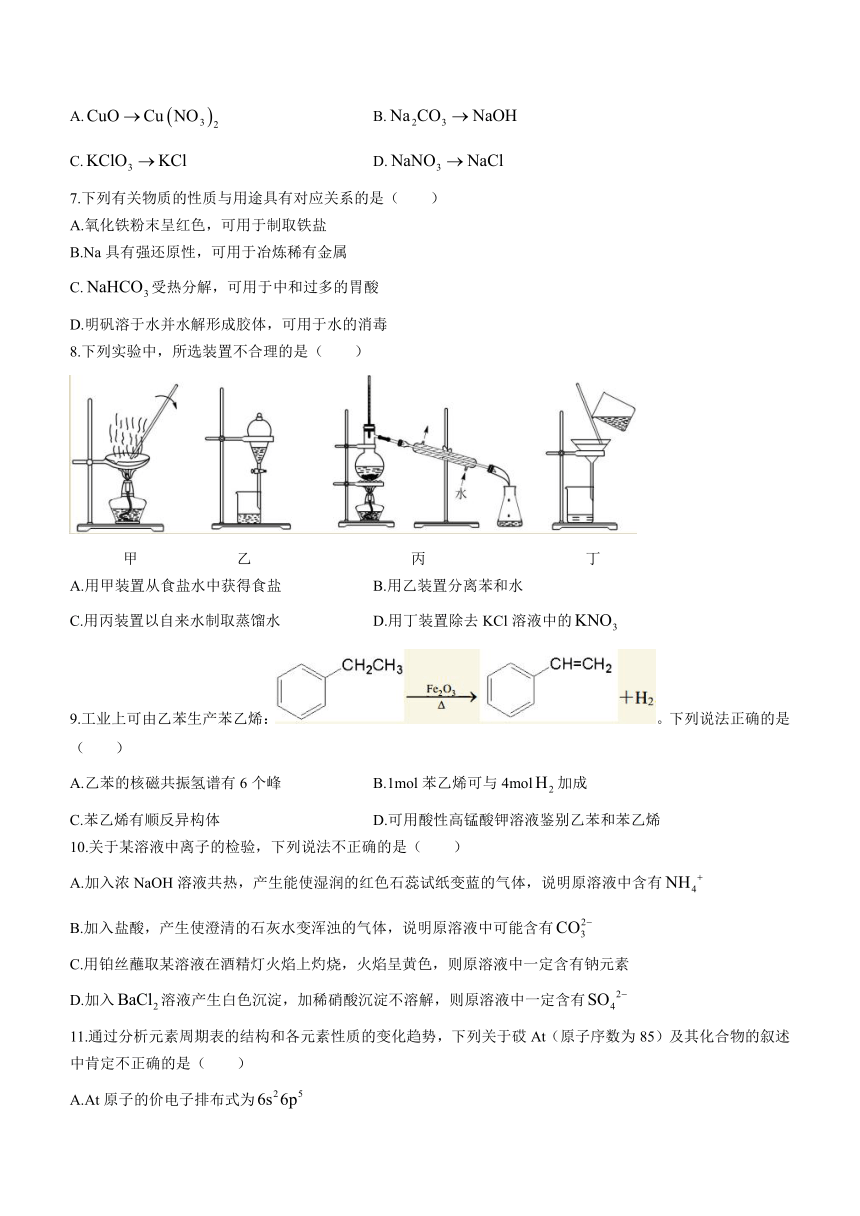
8.下列实验中,所选装置不合理的是( )
甲 乙 丙 丁
A.用甲装置从食盐水中获得食盐 B.用乙装置分离苯和水
C.用丙装置以自来水制取蒸馏水 D.用丁装置除去KCl溶液中的
9.工业上可由乙苯生产苯乙烯:。下列说法正确的是( )
A.乙苯的核磁共振氢谱有6个峰 B.1mol苯乙烯可与4mol加成
C.苯乙烯有顺反异构体 D.可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
10.关于某溶液中离子的检验,下列说法不正确的是( )
A.加入浓NaOH溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中含有
B.加入盐酸,产生使澄清的石灰水变浑浊的气体,说明原溶液中可能含有
C.用铂丝蘸取某溶液在酒精灯火焰上灼烧,火焰呈黄色,则原溶液中一定含有钠元素
D.加入溶液产生白色沉淀,加稀硝酸沉淀不溶解,则原溶液中一定含有
11.通过分析元素周期表的结构和各元素性质的变化趋势,下列关于砹At(原子序数为85)及其化合物的叙述中肯定不正确的是( )
A.At原子的价电子排布式为
B.相同条件下HAt的还原性比HI强
C.AgAt是一种可溶于水的化合物
D.由KAt的水溶液制备砹的化学方程式为
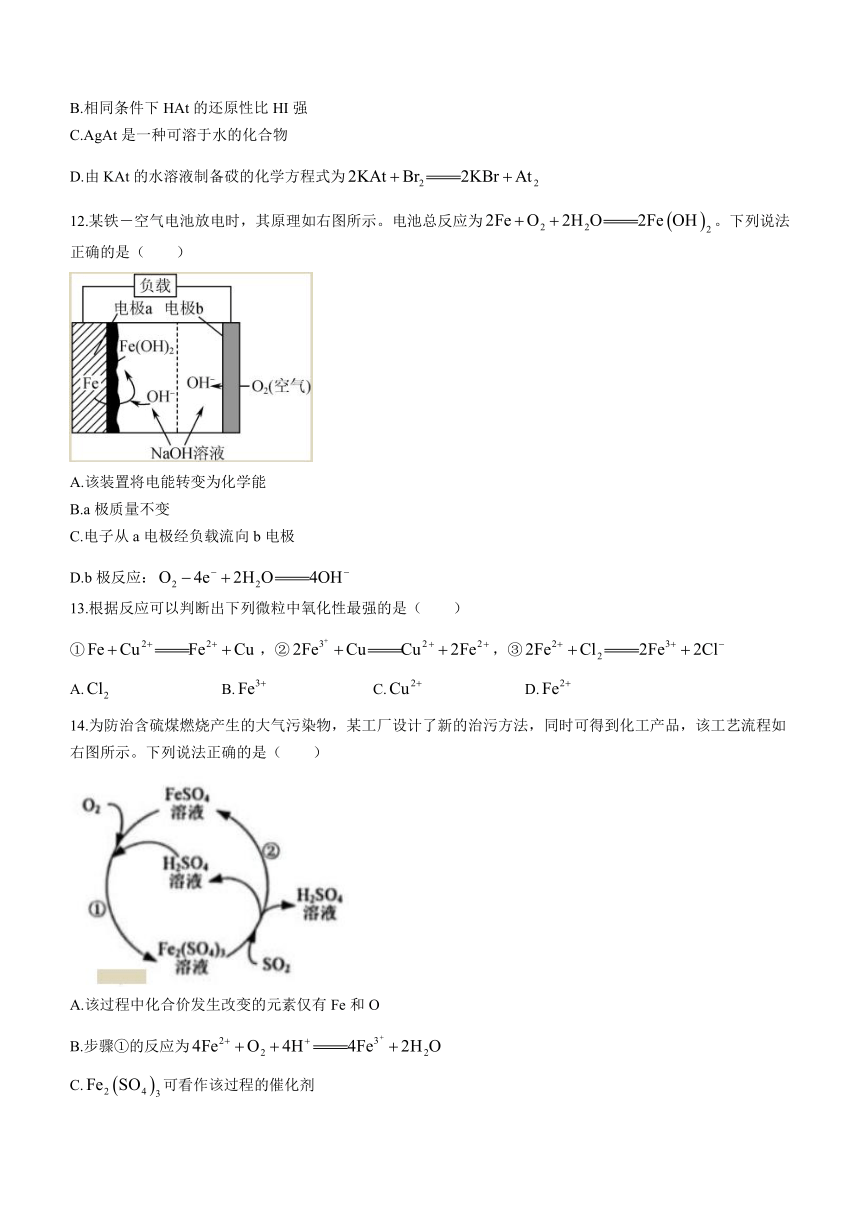
12.某铁-空气电池放电时,其原理如右图所示。电池总反应为。下列说法正确的是( )
A.该装置将电能转变为化学能
B.a极质量不变
C.电子从a电极经负载流向b电极
D.b极反应:
13.根据反应可以判断出下列微粒中氧化性最强的是( )
①,②,③
A. B. C. D.
14.为防治含硫煤燃烧产生的大气污染物,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如右图所示。下列说法正确的是( )
A.该过程中化合价发生改变的元素仅有Fe和O
B.步骤①的反应为
C.可看作该过程的催化剂
D.每参与反应,需消耗标准状况下
二、非选择题:共4题,共58分。
15.(13分)下图是以废铜屑制取硫酸铜晶体的流程。请按要求回答下列问题。
(1)溶液的作用是______。
(2)试剂X可选择两种方案。
方案Ⅰ 若试剂X是浓硫酸(加热),写出该反应的化学方程式:______。
方案Ⅱ 若试剂X是稀硫酸(通入加热),方案Ⅱ相比方案Ⅰ的优点是______。
(3)测定硫酸铜晶体()中结晶水x的数目可通过以下实验确定。
步骤Ⅰ 称取5.00g样品置于小烧杯中,加入适量水,加热溶解,边搅拌边滴加至沉淀完全。
步骤Ⅱ 过滤并洗涤沉淀。
步骤Ⅲ 将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到质量为4.66g。
计算中结晶水x的数目:______(请写出计算过程)。
16.(17分)已知A是一种气态烃,其密度在标准状况下是的14倍;下列关系图中部分产物可能略去。试回答下列问题。
已知反应:(R代表烃基,X代表卤素原子)。
(1)A物质的化学式为______;C分子的官能团的名称为______;聚苯乙烯的结构简式为______。
(2)反应①~⑥中属于加成反应的是______(填数字序号)。
(3)B物质可在Cu作催化剂下被空气中的氧气氧化,写出反应的化学方程式:______。
(4)下列涉及B物质的说法正确的是______(填数字序号)。
①B和F属于同系物
②D在一定条件下可能会和水反应生成B和C
③B物质能与水以任意比互溶,可由葡萄糖水解制得
(5)C与F以物质的量之比2∶1反应生成G,反应④的化学方程式为______。
17.(17分)含氯消毒剂可有效灭活新冠病毒,为阻断疫情做出了巨大贡献。
(1)人类最初用新制氯水漂白、杀菌、消毒。氯水使用起来不方便,效果也不理想的原因是______。
(2)常用的含氯漂白剂中二氧化氯()被联合国世界卫生组织(WHO)列为AⅠ级安全消毒剂,是一种易溶于水、难溶于有机溶剂的气体,易与碱液反应生成盐和水。其性质非常不稳定,温度过高或水溶液中的质量分数高于30%等均有可能引起爆炸,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。实验室可用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如下图所示。
①装置A中用来存放、添加浓盐酸的仪器名称是______;写出A中发生反应的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②装置C的作用为______。
③装置D中从实验开始到结束都要持续通入干燥氮气,其可能的原因是______;写出D中发生反应的化学方程式:______。
④装置E将产生的二氧化氯气体进行溶解、吸收、保存,吸收液最好使用______(填字母序号)。
a.80℃的温水 b.冰水 c.四氯化碳 d.NaOH溶液
18.(11分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)右图是N2(g)和H2(g)反应生成1mol(g)过程中能量的变化示意图。N2和H2反应的热化学方程式为______。
(2)已知下表数据,试根据右图、下表中数据计算N-H键的键能为________。
化学键 H-H N≡N
键能/ 435 943
(3)用催化还原可以消除氮氧化物的污染。
已知: ①
②
若将NO还原至,该反应过程中的反应热______(用含a、b的式子表示)。
(4)尿素是目前人类使用量最大的一种氮肥。
①尿素晶体熔点132.7℃,沸点196.6℃,其属于______晶体(填晶体类型)。
②工业上用加压并预热的氨气和压缩的二氧化碳在合成塔中反应生成尿素。氨气加压并预热的作用是______。
盐城市五校2022-2023学年高一下学期期中联考
化学学科试题参考答案
阅卷说明:
1.本试卷中每个化学方程式、离子方程式3分,反应物、生成物书写均正确得2分,未配平、未注明或写错反应条件、未注明或写错符号的等共扣1分
2.本卷中所有合理答案均参照给分
一、单项选择题:共14题,每题3分,共42分
1.C 2.A 3.A 4.C 5.A
6.D 7.B 8.D 9.B 10.D
11.C 12.C 13.A 14.B
二、非选择题:共4题,共58分
15.(13分)
(1)去除废铜屑表面油污(2分)
(2)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(3分)
提高硫酸的利用率,不产生SO2污染性气体(3分;任意答出一点得2分)
(3)BaSO4 ~ CuSO4·xH2O (1分)
233 160+18x
4.66g 5.00g (2分)
x=5(2分)
16.(17分)
(1)C2H4(2分) 羧基(2分) (2分)
(2)①②(2分;任意答出一点得1分,错选不得分)
(3)(3分)
(4)②(3分)
(5)2CH3COOH+HOCH2CH2OHCH3COOCH2CH2OOCCH3+2H2O(3分)
17.(17分)
(1)氯气的溶解度不大,生成的HClO浓度小;HClO不稳定,难保存(3分;任意答出一点得2分)
(2)①分液漏斗(2分) (3分)
②干燥氯气(或除去氯气中的H2O)(2分)
③降低二氧化氯的浓度,减小其爆炸的可能性(使二氧化氯更完全地被E中液体吸收)(2分) 2NaClO2+Cl22NaCl+2ClO2(3分)
④b(2分)
18.(11分)
(1)N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1(3分)
(2)390(2分)
(3)(2分)
(4)①分子(2分)
②提供更多的NH3,并加快生成尿素的反应速率(2分)
化学学科试题
(分值:100分 时长:75分钟)
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-64 Ba-137
一、单项选择题:共14题,每题3分,共42分。每小题只有一个选项最符合题意。
1.化学和生活、生产息息相关。下列说法正确的是( )
A.火力发电厂将烟囱建得很高,可以减少对环境的污染
B.人体注射的新冠疫苗性质稳定,可以高温下运输、保存
C.“中国天眼”球面射电望远镜的钢铁“眼眶”属于金属材料
D.“天宫二号”的硅太阳能电池板的原料二氧化硅属于新型无机非金属材料
2.下列化学用语表示不正确的是( )
A.小苏打化学式:
B.中子数为18的氯原子:
C.的电离方程式:
D.铁在氯气中燃烧:
3.反应可应用于汽车尾气净化。下列关于该反应的说法正确的是( )
A.升高温度能加快反应速率
B.减小NO浓度能加快反应速率
C.使用恰当的催化剂,NO能100%转化为产物
D.达到化学平衡时,CO能100%转化为产物
4.下列变化属于放热反应的是( )
A.碘蒸汽凝华 B.浓硫酸稀释
C.盐酸与氢氧化钠溶液反应 D.石灰石分解的反应
5.下列有关反应的离子方程式正确的是( )
A.将过氧化钠投入水中:
B.向稀盐酸中加入铁粉:
C.用醋酸溶洗水壶中水垢:
D.溶液中滴入过量稀氨水:
6.通常情况下,下列变化通过一步反应不可以实现的是( )
A. B.
C. D.
7.下列有关物质的性质与用途具有对应关系的是( )
A.氧化铁粉末呈红色,可用于制取铁盐
B.Na具有强还原性,可用于冶炼稀有金属
C.受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于水的消毒
8.下列实验中,所选装置不合理的是( )
甲 乙 丙 丁
A.用甲装置从食盐水中获得食盐 B.用乙装置分离苯和水
C.用丙装置以自来水制取蒸馏水 D.用丁装置除去KCl溶液中的
9.工业上可由乙苯生产苯乙烯:。下列说法正确的是( )
A.乙苯的核磁共振氢谱有6个峰 B.1mol苯乙烯可与4mol加成
C.苯乙烯有顺反异构体 D.可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
10.关于某溶液中离子的检验,下列说法不正确的是( )
A.加入浓NaOH溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中含有
B.加入盐酸,产生使澄清的石灰水变浑浊的气体,说明原溶液中可能含有
C.用铂丝蘸取某溶液在酒精灯火焰上灼烧,火焰呈黄色,则原溶液中一定含有钠元素
D.加入溶液产生白色沉淀,加稀硝酸沉淀不溶解,则原溶液中一定含有
11.通过分析元素周期表的结构和各元素性质的变化趋势,下列关于砹At(原子序数为85)及其化合物的叙述中肯定不正确的是( )
A.At原子的价电子排布式为
B.相同条件下HAt的还原性比HI强
C.AgAt是一种可溶于水的化合物
D.由KAt的水溶液制备砹的化学方程式为
12.某铁-空气电池放电时,其原理如右图所示。电池总反应为。下列说法正确的是( )
A.该装置将电能转变为化学能
B.a极质量不变
C.电子从a电极经负载流向b电极
D.b极反应:
13.根据反应可以判断出下列微粒中氧化性最强的是( )
①,②,③
A. B. C. D.
14.为防治含硫煤燃烧产生的大气污染物,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如右图所示。下列说法正确的是( )
A.该过程中化合价发生改变的元素仅有Fe和O
B.步骤①的反应为
C.可看作该过程的催化剂
D.每参与反应,需消耗标准状况下
二、非选择题:共4题,共58分。
15.(13分)下图是以废铜屑制取硫酸铜晶体的流程。请按要求回答下列问题。
(1)溶液的作用是______。
(2)试剂X可选择两种方案。
方案Ⅰ 若试剂X是浓硫酸(加热),写出该反应的化学方程式:______。
方案Ⅱ 若试剂X是稀硫酸(通入加热),方案Ⅱ相比方案Ⅰ的优点是______。
(3)测定硫酸铜晶体()中结晶水x的数目可通过以下实验确定。
步骤Ⅰ 称取5.00g样品置于小烧杯中,加入适量水,加热溶解,边搅拌边滴加至沉淀完全。
步骤Ⅱ 过滤并洗涤沉淀。
步骤Ⅲ 将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到质量为4.66g。
计算中结晶水x的数目:______(请写出计算过程)。
16.(17分)已知A是一种气态烃,其密度在标准状况下是的14倍;下列关系图中部分产物可能略去。试回答下列问题。
已知反应:(R代表烃基,X代表卤素原子)。
(1)A物质的化学式为______;C分子的官能团的名称为______;聚苯乙烯的结构简式为______。
(2)反应①~⑥中属于加成反应的是______(填数字序号)。
(3)B物质可在Cu作催化剂下被空气中的氧气氧化,写出反应的化学方程式:______。
(4)下列涉及B物质的说法正确的是______(填数字序号)。
①B和F属于同系物
②D在一定条件下可能会和水反应生成B和C
③B物质能与水以任意比互溶,可由葡萄糖水解制得
(5)C与F以物质的量之比2∶1反应生成G,反应④的化学方程式为______。
17.(17分)含氯消毒剂可有效灭活新冠病毒,为阻断疫情做出了巨大贡献。
(1)人类最初用新制氯水漂白、杀菌、消毒。氯水使用起来不方便,效果也不理想的原因是______。
(2)常用的含氯漂白剂中二氧化氯()被联合国世界卫生组织(WHO)列为AⅠ级安全消毒剂,是一种易溶于水、难溶于有机溶剂的气体,易与碱液反应生成盐和水。其性质非常不稳定,温度过高或水溶液中的质量分数高于30%等均有可能引起爆炸,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。实验室可用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如下图所示。
①装置A中用来存放、添加浓盐酸的仪器名称是______;写出A中发生反应的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②装置C的作用为______。
③装置D中从实验开始到结束都要持续通入干燥氮气,其可能的原因是______;写出D中发生反应的化学方程式:______。
④装置E将产生的二氧化氯气体进行溶解、吸收、保存,吸收液最好使用______(填字母序号)。
a.80℃的温水 b.冰水 c.四氯化碳 d.NaOH溶液
18.(11分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)右图是N2(g)和H2(g)反应生成1mol(g)过程中能量的变化示意图。N2和H2反应的热化学方程式为______。
(2)已知下表数据,试根据右图、下表中数据计算N-H键的键能为________。
化学键 H-H N≡N
键能/ 435 943
(3)用催化还原可以消除氮氧化物的污染。
已知: ①
②
若将NO还原至,该反应过程中的反应热______(用含a、b的式子表示)。
(4)尿素是目前人类使用量最大的一种氮肥。
①尿素晶体熔点132.7℃,沸点196.6℃,其属于______晶体(填晶体类型)。
②工业上用加压并预热的氨气和压缩的二氧化碳在合成塔中反应生成尿素。氨气加压并预热的作用是______。
盐城市五校2022-2023学年高一下学期期中联考
化学学科试题参考答案
阅卷说明:
1.本试卷中每个化学方程式、离子方程式3分,反应物、生成物书写均正确得2分,未配平、未注明或写错反应条件、未注明或写错符号的等共扣1分
2.本卷中所有合理答案均参照给分
一、单项选择题:共14题,每题3分,共42分
1.C 2.A 3.A 4.C 5.A
6.D 7.B 8.D 9.B 10.D
11.C 12.C 13.A 14.B
二、非选择题:共4题,共58分
15.(13分)
(1)去除废铜屑表面油污(2分)
(2)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(3分)
提高硫酸的利用率,不产生SO2污染性气体(3分;任意答出一点得2分)
(3)BaSO4 ~ CuSO4·xH2O (1分)
233 160+18x
4.66g 5.00g (2分)
x=5(2分)
16.(17分)
(1)C2H4(2分) 羧基(2分) (2分)
(2)①②(2分;任意答出一点得1分,错选不得分)
(3)(3分)
(4)②(3分)
(5)2CH3COOH+HOCH2CH2OHCH3COOCH2CH2OOCCH3+2H2O(3分)
17.(17分)
(1)氯气的溶解度不大,生成的HClO浓度小;HClO不稳定,难保存(3分;任意答出一点得2分)
(2)①分液漏斗(2分) (3分)
②干燥氯气(或除去氯气中的H2O)(2分)
③降低二氧化氯的浓度,减小其爆炸的可能性(使二氧化氯更完全地被E中液体吸收)(2分) 2NaClO2+Cl22NaCl+2ClO2(3分)
④b(2分)
18.(11分)
(1)N2(g)+3H2(g)2NH3(g) ΔH=-92kJ·mol-1(3分)
(2)390(2分)
(3)(2分)
(4)①分子(2分)
②提供更多的NH3,并加快生成尿素的反应速率(2分)
同课章节目录
