辽宁省凌源市2022-2023学年高二下学期期中联考化学试题(含答案)
文档属性
| 名称 | 辽宁省凌源市2022-2023学年高二下学期期中联考化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 743.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-17 16:34:52 | ||
图片预览

文档简介
凌源市2022-2023学年高二下学期期中联考
化学考试卷
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版必修第一册、必修第二册、选择性必修1、选择性必修2、选择性必修3第一章至第二章。
5.可能用到的相对原子质量:H1 C12 O16 S32 Fe56 Sr88 W184
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活、生产、科技、环境等密切相关,下列说法正确的是( )
A.聚氯乙烯塑料的主要成分属于烃类
B.天舟五号使用的氮化硅陶瓷属于传统硅酸盐材料
C.Q355C钢板属于金属材料
D.辽河大桥铁护栏粉刷含锌粉的油漆,该防护法称为外加电流法
2.诗词是中华民族灿烂文化的瑰宝,下列诗句包含氧化还原反应的是( )
A.南朝四百八十寺,多少楼台烟雨中 B.云销雨霁,彩彻区明
C.一道残阳铺水中,半江瑟瑟半江红 D.野火烧不尽,春风吹又生
3.下列化学用语或说法正确的是( )
A.水解的离子方程式:
B.过量的通入氨水中反应的离子方程式:
C.NaClO的电子式:
D.的VSEPR模型名称:平面三角形
4.有机物A的实验式为CHO,则该有机物可能是( )
A. B.乙二醛 C. D.丙酸
5.设为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,40 g 中含有的原子总数为
B.1 mol 在足量水中完全水解,生成的胶体粒子数为
C.28 g铁粉与足量水蒸气在高温条件下充分反应,转移的电子数为
D.50℃时,100 mL 的NaOH溶液中含有的数目为
6.煤、石油和天然气是人类目前使用的主要能源,下列有关说法正确的是( )
A.煤中含有大量的芳香族化合物,可以通过干馏的物理方法分离出芳香族化合物
B.往煤中添加熟石灰可以显著减少温室气体的排放量
C.石油分馏是指利用石油中各组分沸点的不同进行分离的过程
D.煤和石油属于混合物,天然气属于纯净物
7.《本草纲目拾遗》记载:“石髓出泉州安溪长潭石罅间,接骨如神。”石髓的主要成分为碳酸钙,下列说法正确的是( )
A.的空间结构为三角锥形
B.可以对石髓进行X射线衍射来确定其是否为晶体
C.碳酸钙含有非极性共价键
D.中所有原子均不含有孤电子对
8.下列混合物能通过分液进行分离的是( )
A.和水 B.苯和液溴
C.碳酸钙固体和氯化钠溶液 D.乙醇和乙酸
9.下表列出了某短周期金属元素R的各级电离能数据(用、……表示),有关R元素的说法中,正确的是( )
元素 电离能/(kJ·mol)
……
578 1817 2745 11577 ……
A.R元素的最高正化合价为+2价
B.R元素的第一电离能高于同周期相邻元素的
C.R的氧化物为两性氧化物
D.R元素形成的单质熔点远高于其氧化物
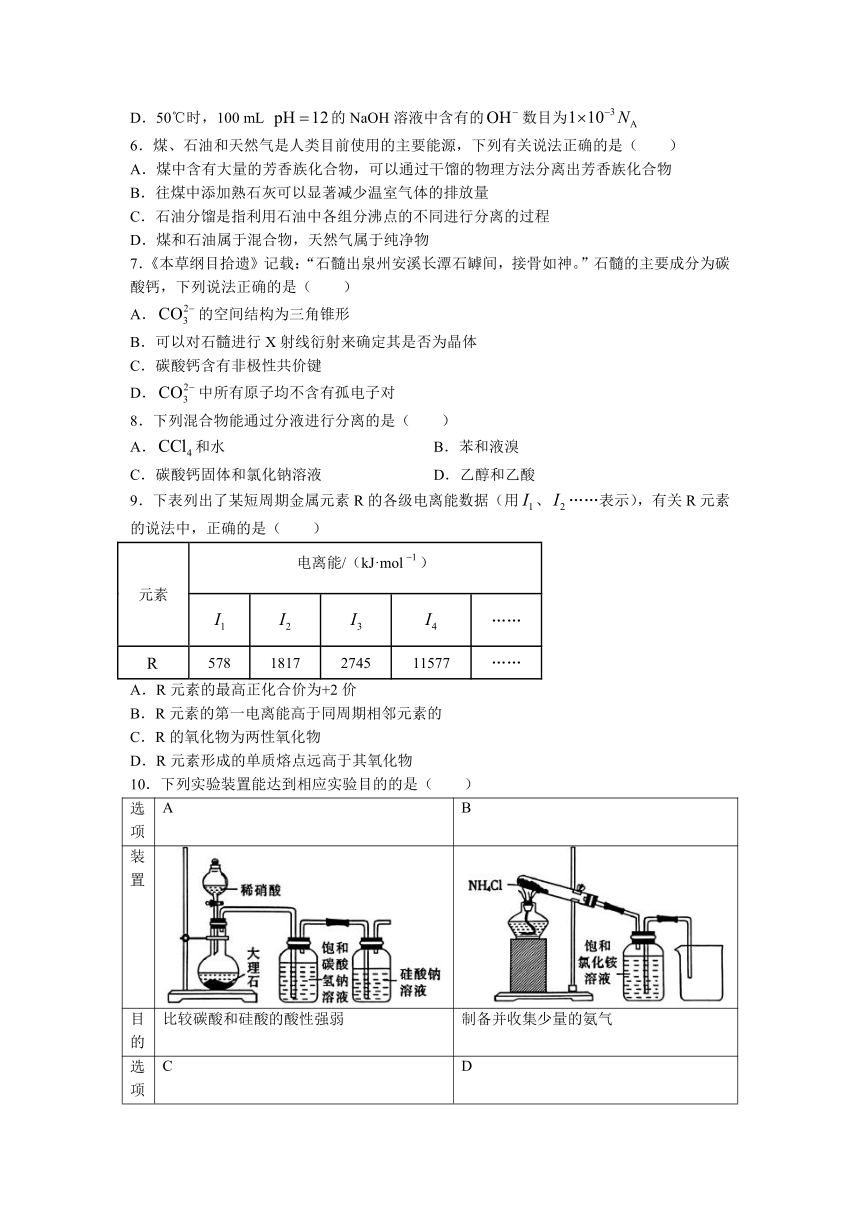
10.下列实验装置能达到相应实验目的的是( )
选项 A B
装置
目的 比较碳酸和硅酸的酸性强弱 制备并收集少量的氨气
选项 C D
装置
目的 验证苯与液溴发生了取代反应 制备并收集少量的乙炔
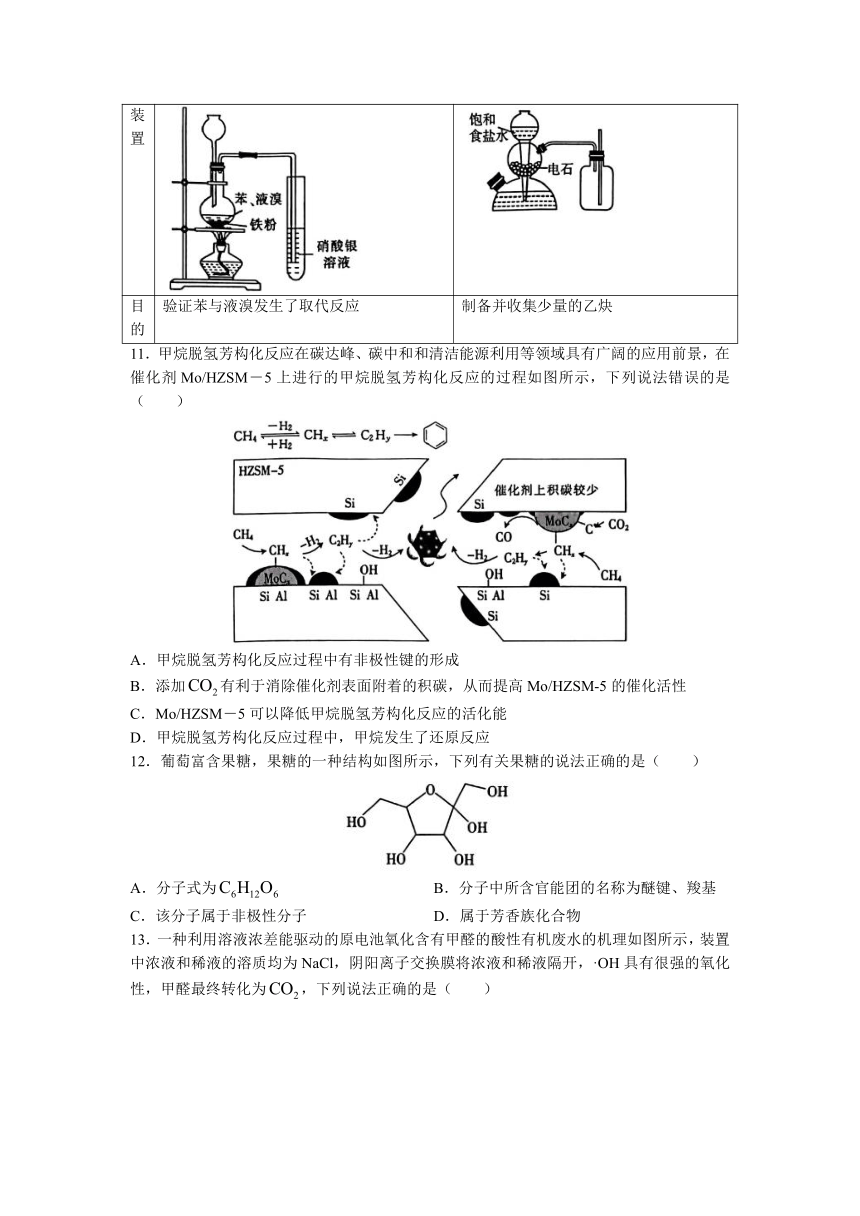
11.甲烷脱氢芳构化反应在碳达峰、碳中和和清洁能源利用等领域具有广阔的应用前景,在催化剂Mo/HZSM―5上进行的甲烷脱氢芳构化反应的过程如图所示,下列说法错误的是( )
A.甲烷脱氢芳构化反应过程中有非极性键的形成
B.添加有利于消除催化剂表面附着的积碳,从而提高Mo/HZSM-5的催化活性
C.Mo/HZSM―5可以降低甲烷脱氢芳构化反应的活化能
D.甲烷脱氢芳构化反应过程中,甲烷发生了还原反应
12.葡萄富含果糖,果糖的一种结构如图所示,下列有关果糖的说法正确的是( )
A.分子式为 B.分子中所含官能团的名称为醚键、羧基
C.该分子属于非极性分子 D.属于芳香族化合物
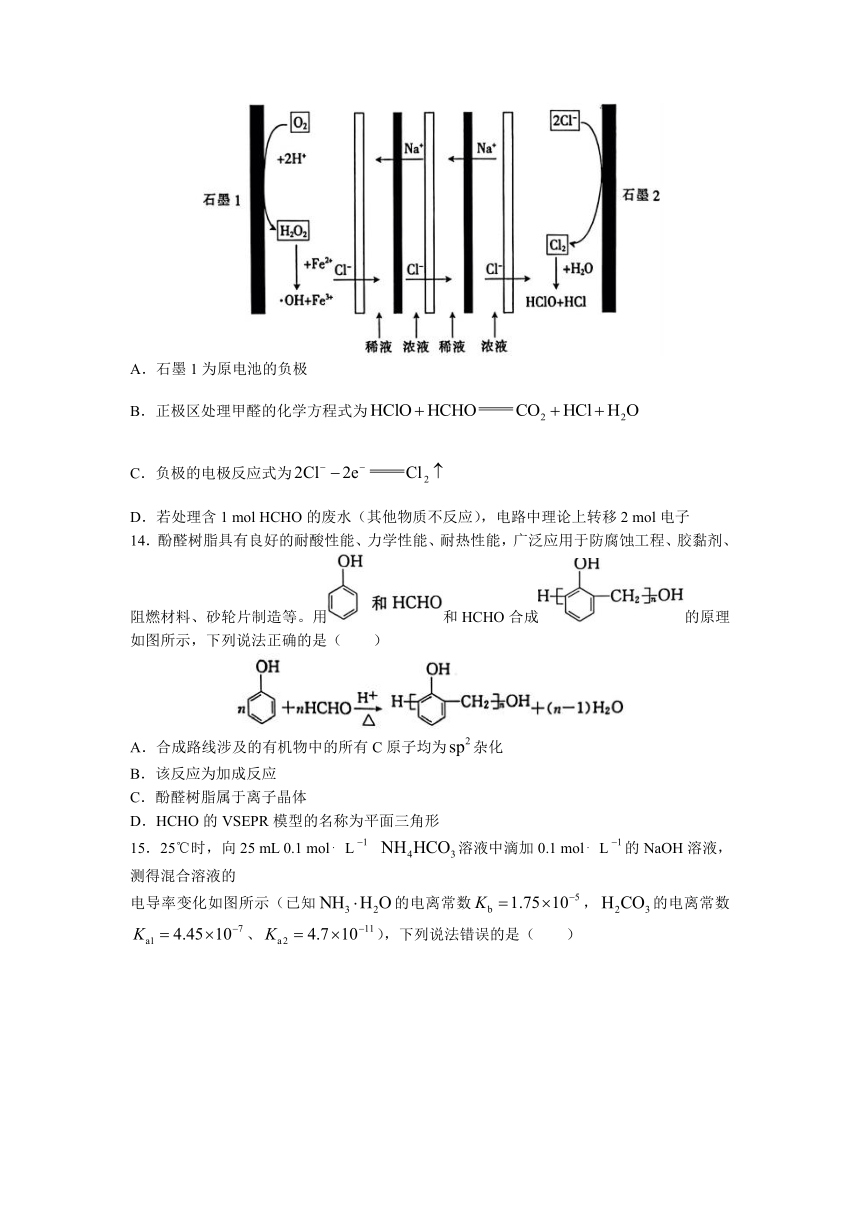
13.一种利用溶液浓差能驱动的原电池氧化含有甲醛的酸性有机废水的机理如图所示,装置中浓液和稀液的溶质均为NaCl,阴阳离子交换膜将浓液和稀液隔开,·OH具有很强的氧化性,甲醛最终转化为,下列说法正确的是( )
A.石墨1为原电池的负极
B.正极区处理甲醛的化学方程式为
C.负极的电极反应式为
D.若处理含1 mol HCHO的废水(其他物质不反应),电路中理论上转移2 mol电子
14.酚醛树脂具有良好的耐酸性能、力学性能、耐热性能,广泛应用于防腐蚀工程、胶黏剂、阻燃材料、砂轮片制造等。用和HCHO合成的原理如图所示,下列说法正确的是( )
A.合成路线涉及的有机物中的所有C原子均为杂化
B.该反应为加成反应
C.酚醛树脂属于离子晶体
D.HCHO的VSEPR模型的名称为平面三角形
15.25℃时,向25 mL 0.1 mol L 溶液中滴加0.1 mol L的NaOH溶液,测得混合溶液的
电导率变化如图所示(已知的电离常数,的电离常数、),下列说法错误的是( )
A.25℃时,溶液中存在关系:
B.混合溶液中:aC.当加入的NaOH溶液体积为25 mL时,存在关系:
D.25℃时,0.1 mol L的溶液
二、非选择题:本题共4小题,共55分。
16.(13分)a、b、c、d、e、f、g是原子序数依次增大的前四周期主族元素,a、c可以形成两种在常温下均为液体的化合物,b的一种同位素可用于测定一些文物的年代,d在短周期主族元素中半径最大,e与f处于相邻主族,且e在常温下为黄色固体,g的最内层电子数等于其最外层电子数的2倍。请回答下列问题:
(1)元素g为______(填元素符号),在元素周期表中的位置为________________________。
(2)a、c形成的化合物中,含有非极性共价键的物质的电子式为______________________________。
(3)非金属性:b_____(填“>”或“<”)e,请设计实验说明该推论:____________________________________
___________________。
(4)与反应的化学方程式为________________________________________________,
写出利用该反应原理的的用途:__________________________________________。
(5)e、f的最简单氢化物的稳定性:e____________(填“>”或“<”)f,标准状况下,等体积的上述两种最简单氢化物的原子个数之比为____________。
17.(14分)化学实验中常用燃烧法确定有机物的组成。用燃烧法确定有机物化学式常用的装置如图所示,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成,燃烧法确定有机物R的组成装置如图。
已知:①有机物R在电炉中反应时被完全氧化;
②实验结束后,测得反应前后装置D中共增重7.2 g,装置E、F二者共增重13.2 g;
③有机物R含有C、H,可能含有O,不含有其他元素,开始时加入的有机物R的质量为6.0 g。
回答下列问题:
(1)若a中的液体为双氧水,锥形瓶内固体为,则锥形瓶内发生反应的化学方程式为__________________________________________。
(2)装置E中盛装碱石灰的仪器名称为____________,装置G的作用为____________,该有机物的分子式为____________。
(3)该有机物的核磁共振氢谱图如图所示(峰面积比为1∶2∶2∶3),则该有机物的结构简式为____________,该有机物官能团的名称为____________。
(4)相对分子质量比R大28且与R互为同系物的同分异构体有____________种,其中只含有三种环境的氢原子的有机物的结构简式为____________。
18.(14分)世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)和制甲醇,有利于减少温室气体二氧化碳的排放。一般通过如下步骤来实现:
反应ⅰ.
反应ⅱ.
反应ⅲ.
①查阅资料可知,,在____________(填“高温”、“低温”或“任意温度”)下有利于反应ⅰ自发进行。
②____________(用含、的代数式表示)。
(2)和合成也是资源化利用的重要方法。
对于反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得的转化率随温度的变化如图所示。
①温度高于360℃,在催化剂Ⅰ作用下,转化率略有下降,其原因可能为____________。
②一定温度下,向一恒容密闭容器中充入0.1 mol 和0.4 mol ,仅发生反应,初始时压强为p,反应达到平衡后,测得的物质的量分数为25%,则该反应的平衡常数______(分压=总压×物质的量分数)。
③对于反应,下列说法正确的是____________(填标号)。
A.当混合气体的总质量不再随时间而改变时,该反应达到平衡状态
B.每生成1 mol H—O的同时生成1 mol H—H,则该反应达到平衡状态
C.当混合气体的密度不再随时间而改变时,该反应达到平衡状态
D.当混合气体的平均相对分子质量不再随时间而改变时,该反应达到平衡状态
(3)利用太阳能电池将转化为乙烯、丙烯等有机化工原料,其工作原理如图所示(M、N电极均为惰性电极)。
①N电极上生成乙烯的电极反应式为____________________________________。
②0.5 mol丙烯分子中含有的σ键与π键总数为______。
③电路中每转移0.2 mol电子,同时生成的的体积为____________L(标准状况下)。
19.(14分)钨酸锶是一种功能性材料,在光致发光、发光二极管、闪质子交换膜烁材料、磁性材料、湿度传感器和催化剂等领域有着广泛的应用,从而备受人们关注,其晶胞结构如图1所示,晶胞棱边夹角均为90°,Sr原子和W原子沿x轴投影如图2所示。
(1)基态氧原子最高能级理论上具有的轨道数为____________,原子中运动的电子有两种相反的自旋状态,若有一种自旋状态用表示,则与之相反的用表示,称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为____________。
(2)Sr的原子序数为38,其位于元素周期表的____________(填“s”、“p”、“d”或“ds”)区,SrO的熔点比MgO____________(填“高”或“低”),原因是_______________________________________。
(3)钨酸锶的化学式为____________,晶胞中W原子沿y轴投影所形成的投影图为__________________(填标号),设为阿伏加德罗常数的值,则该晶体的密度为_______g·cm。
高二年级化学考试卷参考答案
1.D 2.B 3.A 4.D 5.D 6.A 7.B8.C9.D10.B 11.C 12.B 13.A 14.C 15.B
16.(1)①⑤(2分);①④(2分)
(2)(2分);羧基(2分)
(3)(2分);
(2分)
17.(1)分液(1分);检验是否漏液(2分)
(2)B(2分);(2分);石炭酸(1分)
(3)过滤(2分);洗涤(2分);C H O (2分)
18.(1)球形冷凝管(1分);a(1分)
(2)(2分);便于控制反应温度或反应过程中无明火加热,更加安全(答案合理即可,2分)
(3)浓硝酸受热分解生成的溶解在粗产品中(或其他合理答案,2分);硝酸、硫酸和(答对一种物质给1分,答对两种即给满分,2分);蒸馏(2分)
(4)除去挥发出来的硝酸和等,防止污染环境(2分)
19.(1)碳氟键(1分);(2分)
(2)取代反应(1分);(2分)
(3)(2分);(或其他合理答案,2分)
(4)或(2分)
(5)(或其他合理答案,一步1分,3分)
化学考试卷
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版必修第一册、必修第二册、选择性必修1、选择性必修2、选择性必修3第一章至第二章。
5.可能用到的相对原子质量:H1 C12 O16 S32 Fe56 Sr88 W184
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活、生产、科技、环境等密切相关,下列说法正确的是( )
A.聚氯乙烯塑料的主要成分属于烃类
B.天舟五号使用的氮化硅陶瓷属于传统硅酸盐材料
C.Q355C钢板属于金属材料
D.辽河大桥铁护栏粉刷含锌粉的油漆,该防护法称为外加电流法
2.诗词是中华民族灿烂文化的瑰宝,下列诗句包含氧化还原反应的是( )
A.南朝四百八十寺,多少楼台烟雨中 B.云销雨霁,彩彻区明
C.一道残阳铺水中,半江瑟瑟半江红 D.野火烧不尽,春风吹又生
3.下列化学用语或说法正确的是( )
A.水解的离子方程式:
B.过量的通入氨水中反应的离子方程式:
C.NaClO的电子式:
D.的VSEPR模型名称:平面三角形
4.有机物A的实验式为CHO,则该有机物可能是( )
A. B.乙二醛 C. D.丙酸
5.设为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,40 g 中含有的原子总数为
B.1 mol 在足量水中完全水解,生成的胶体粒子数为
C.28 g铁粉与足量水蒸气在高温条件下充分反应,转移的电子数为
D.50℃时,100 mL 的NaOH溶液中含有的数目为
6.煤、石油和天然气是人类目前使用的主要能源,下列有关说法正确的是( )
A.煤中含有大量的芳香族化合物,可以通过干馏的物理方法分离出芳香族化合物
B.往煤中添加熟石灰可以显著减少温室气体的排放量
C.石油分馏是指利用石油中各组分沸点的不同进行分离的过程
D.煤和石油属于混合物,天然气属于纯净物
7.《本草纲目拾遗》记载:“石髓出泉州安溪长潭石罅间,接骨如神。”石髓的主要成分为碳酸钙,下列说法正确的是( )
A.的空间结构为三角锥形
B.可以对石髓进行X射线衍射来确定其是否为晶体
C.碳酸钙含有非极性共价键
D.中所有原子均不含有孤电子对
8.下列混合物能通过分液进行分离的是( )
A.和水 B.苯和液溴
C.碳酸钙固体和氯化钠溶液 D.乙醇和乙酸
9.下表列出了某短周期金属元素R的各级电离能数据(用、……表示),有关R元素的说法中,正确的是( )
元素 电离能/(kJ·mol)
……
578 1817 2745 11577 ……
A.R元素的最高正化合价为+2价
B.R元素的第一电离能高于同周期相邻元素的
C.R的氧化物为两性氧化物
D.R元素形成的单质熔点远高于其氧化物
10.下列实验装置能达到相应实验目的的是( )
选项 A B
装置
目的 比较碳酸和硅酸的酸性强弱 制备并收集少量的氨气
选项 C D
装置
目的 验证苯与液溴发生了取代反应 制备并收集少量的乙炔
11.甲烷脱氢芳构化反应在碳达峰、碳中和和清洁能源利用等领域具有广阔的应用前景,在催化剂Mo/HZSM―5上进行的甲烷脱氢芳构化反应的过程如图所示,下列说法错误的是( )
A.甲烷脱氢芳构化反应过程中有非极性键的形成
B.添加有利于消除催化剂表面附着的积碳,从而提高Mo/HZSM-5的催化活性
C.Mo/HZSM―5可以降低甲烷脱氢芳构化反应的活化能
D.甲烷脱氢芳构化反应过程中,甲烷发生了还原反应
12.葡萄富含果糖,果糖的一种结构如图所示,下列有关果糖的说法正确的是( )
A.分子式为 B.分子中所含官能团的名称为醚键、羧基
C.该分子属于非极性分子 D.属于芳香族化合物
13.一种利用溶液浓差能驱动的原电池氧化含有甲醛的酸性有机废水的机理如图所示,装置中浓液和稀液的溶质均为NaCl,阴阳离子交换膜将浓液和稀液隔开,·OH具有很强的氧化性,甲醛最终转化为,下列说法正确的是( )
A.石墨1为原电池的负极
B.正极区处理甲醛的化学方程式为
C.负极的电极反应式为
D.若处理含1 mol HCHO的废水(其他物质不反应),电路中理论上转移2 mol电子
14.酚醛树脂具有良好的耐酸性能、力学性能、耐热性能,广泛应用于防腐蚀工程、胶黏剂、阻燃材料、砂轮片制造等。用和HCHO合成的原理如图所示,下列说法正确的是( )
A.合成路线涉及的有机物中的所有C原子均为杂化
B.该反应为加成反应
C.酚醛树脂属于离子晶体
D.HCHO的VSEPR模型的名称为平面三角形
15.25℃时,向25 mL 0.1 mol L 溶液中滴加0.1 mol L的NaOH溶液,测得混合溶液的
电导率变化如图所示(已知的电离常数,的电离常数、),下列说法错误的是( )
A.25℃时,溶液中存在关系:
B.混合溶液中:a
D.25℃时,0.1 mol L的溶液
二、非选择题:本题共4小题,共55分。
16.(13分)a、b、c、d、e、f、g是原子序数依次增大的前四周期主族元素,a、c可以形成两种在常温下均为液体的化合物,b的一种同位素可用于测定一些文物的年代,d在短周期主族元素中半径最大,e与f处于相邻主族,且e在常温下为黄色固体,g的最内层电子数等于其最外层电子数的2倍。请回答下列问题:
(1)元素g为______(填元素符号),在元素周期表中的位置为________________________。
(2)a、c形成的化合物中,含有非极性共价键的物质的电子式为______________________________。
(3)非金属性:b_____(填“>”或“<”)e,请设计实验说明该推论:____________________________________
___________________。
(4)与反应的化学方程式为________________________________________________,
写出利用该反应原理的的用途:__________________________________________。
(5)e、f的最简单氢化物的稳定性:e____________(填“>”或“<”)f,标准状况下,等体积的上述两种最简单氢化物的原子个数之比为____________。
17.(14分)化学实验中常用燃烧法确定有机物的组成。用燃烧法确定有机物化学式常用的装置如图所示,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成,燃烧法确定有机物R的组成装置如图。
已知:①有机物R在电炉中反应时被完全氧化;
②实验结束后,测得反应前后装置D中共增重7.2 g,装置E、F二者共增重13.2 g;
③有机物R含有C、H,可能含有O,不含有其他元素,开始时加入的有机物R的质量为6.0 g。
回答下列问题:
(1)若a中的液体为双氧水,锥形瓶内固体为,则锥形瓶内发生反应的化学方程式为__________________________________________。
(2)装置E中盛装碱石灰的仪器名称为____________,装置G的作用为____________,该有机物的分子式为____________。
(3)该有机物的核磁共振氢谱图如图所示(峰面积比为1∶2∶2∶3),则该有机物的结构简式为____________,该有机物官能团的名称为____________。
(4)相对分子质量比R大28且与R互为同系物的同分异构体有____________种,其中只含有三种环境的氢原子的有机物的结构简式为____________。
18.(14分)世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)和制甲醇,有利于减少温室气体二氧化碳的排放。一般通过如下步骤来实现:
反应ⅰ.
反应ⅱ.
反应ⅲ.
①查阅资料可知,,在____________(填“高温”、“低温”或“任意温度”)下有利于反应ⅰ自发进行。
②____________(用含、的代数式表示)。
(2)和合成也是资源化利用的重要方法。
对于反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得的转化率随温度的变化如图所示。
①温度高于360℃,在催化剂Ⅰ作用下,转化率略有下降,其原因可能为____________。
②一定温度下,向一恒容密闭容器中充入0.1 mol 和0.4 mol ,仅发生反应,初始时压强为p,反应达到平衡后,测得的物质的量分数为25%,则该反应的平衡常数______(分压=总压×物质的量分数)。
③对于反应,下列说法正确的是____________(填标号)。
A.当混合气体的总质量不再随时间而改变时,该反应达到平衡状态
B.每生成1 mol H—O的同时生成1 mol H—H,则该反应达到平衡状态
C.当混合气体的密度不再随时间而改变时,该反应达到平衡状态
D.当混合气体的平均相对分子质量不再随时间而改变时,该反应达到平衡状态
(3)利用太阳能电池将转化为乙烯、丙烯等有机化工原料,其工作原理如图所示(M、N电极均为惰性电极)。
①N电极上生成乙烯的电极反应式为____________________________________。
②0.5 mol丙烯分子中含有的σ键与π键总数为______。
③电路中每转移0.2 mol电子,同时生成的的体积为____________L(标准状况下)。
19.(14分)钨酸锶是一种功能性材料,在光致发光、发光二极管、闪质子交换膜烁材料、磁性材料、湿度传感器和催化剂等领域有着广泛的应用,从而备受人们关注,其晶胞结构如图1所示,晶胞棱边夹角均为90°,Sr原子和W原子沿x轴投影如图2所示。
(1)基态氧原子最高能级理论上具有的轨道数为____________,原子中运动的电子有两种相反的自旋状态,若有一种自旋状态用表示,则与之相反的用表示,称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为____________。
(2)Sr的原子序数为38,其位于元素周期表的____________(填“s”、“p”、“d”或“ds”)区,SrO的熔点比MgO____________(填“高”或“低”),原因是_______________________________________。
(3)钨酸锶的化学式为____________,晶胞中W原子沿y轴投影所形成的投影图为__________________(填标号),设为阿伏加德罗常数的值,则该晶体的密度为_______g·cm。
高二年级化学考试卷参考答案
1.D 2.B 3.A 4.D 5.D 6.A 7.B8.C9.D10.B 11.C 12.B 13.A 14.C 15.B
16.(1)①⑤(2分);①④(2分)
(2)(2分);羧基(2分)
(3)(2分);
(2分)
17.(1)分液(1分);检验是否漏液(2分)
(2)B(2分);(2分);石炭酸(1分)
(3)过滤(2分);洗涤(2分);C H O (2分)
18.(1)球形冷凝管(1分);a(1分)
(2)(2分);便于控制反应温度或反应过程中无明火加热,更加安全(答案合理即可,2分)
(3)浓硝酸受热分解生成的溶解在粗产品中(或其他合理答案,2分);硝酸、硫酸和(答对一种物质给1分,答对两种即给满分,2分);蒸馏(2分)
(4)除去挥发出来的硝酸和等,防止污染环境(2分)
19.(1)碳氟键(1分);(2分)
(2)取代反应(1分);(2分)
(3)(2分);(或其他合理答案,2分)
(4)或(2分)
(5)(或其他合理答案,一步1分,3分)
同课章节目录
