人教版(2019)高中化学必修第二册 《乙醇》能力提升练习(含解析)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《乙醇》能力提升练习(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 397.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-18 08:12:17 | ||
图片预览




文档简介
7.3.1乙醇(练好题)原卷版
能力提升
1下列有关乙醇的表述正确的是( )
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为[OH]-
D.乙醇分子的空间充填模型为
2.下列说法不正确的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.75%(体积分数)的乙醇溶液常用于医疗消毒
C.乙醇能与金属钠反应生成氢气
D.乙烯与水加成可生成乙醇,可用于制食用白酒
3.乙醇分子中的化学键如图所示,则乙醇在催化氧化时,化学键断裂的位置是( )
A.②③ B.①② C.③④ D.①③
4.向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面之下
B.钠块熔化成小球
C.钠块在乙醇的液面上游动
D.向烧杯中滴入几滴酚酞溶液变红色
5.已知C4H10的同分异构体有两种:CH3CH2CH2CH3、,则C4H9OH属于醇类的同分异构体共有( )
A.1种 B.2种
C.3种 D.4种
6.某化学反应过程如图所示,由如图得出的下列判断错误的是( )
A.乙醇发生了还原反应
B.反应中有“红→黑→红”颜色交替变化的现象
C.铜是此反应的催化剂
D.生成物是乙醛
7.在探究乙醇的有关实验中,得出的结论正确的是( )
选项 实验步骤及现象 实验结论
A 在酒精试样中加入少量CuSO4·5H2O,搅拌,试管底部有蓝色晶体 酒精试样中一定含有水
B 在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁有水珠出现,另罩一内壁涂有澄清石灰水的烧杯,内壁出现白色沉淀 乙醇由C、H、O三种元素组成
C 将灼烧后表面变黑的螺旋状铜丝伸入约50 ℃的乙醇中,铜丝能保持红热一段时间 乙醇催化氧化反应是放热反应
D 在0.01 mol金属钠中加入过量的乙醇充分反应,收集到标准状况下气体112 mL 乙醇分子中有1个氢原子与氧原子相连,其余与碳原子相连
8.乙醇能发生如下反应:
①CH3CH2OH+3O22CO2+3H2O;
②2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+H2O+Cu。
由以上反应不能得出的结论是( )
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
9.A、B、C三种醇分别与足量的金属钠完全反应,在相同条件下产生相同体积的H2,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中所含羟基的个数之比为( )
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
10.关于有机化合物HO—CH2—CH==CH—CH2OH,下列说法不正确的是( )
A.分子式为C4H8O2,1 mol该物质充分燃烧需消耗氧气为5 mol
B.能发生取代反应、加成反应、氧化反应、加聚反应
C.1 mol该物质和足量的金属钠反应,产生22.4 L的氢气
D.该物质能使溴水及酸性KMnO4溶液褪色
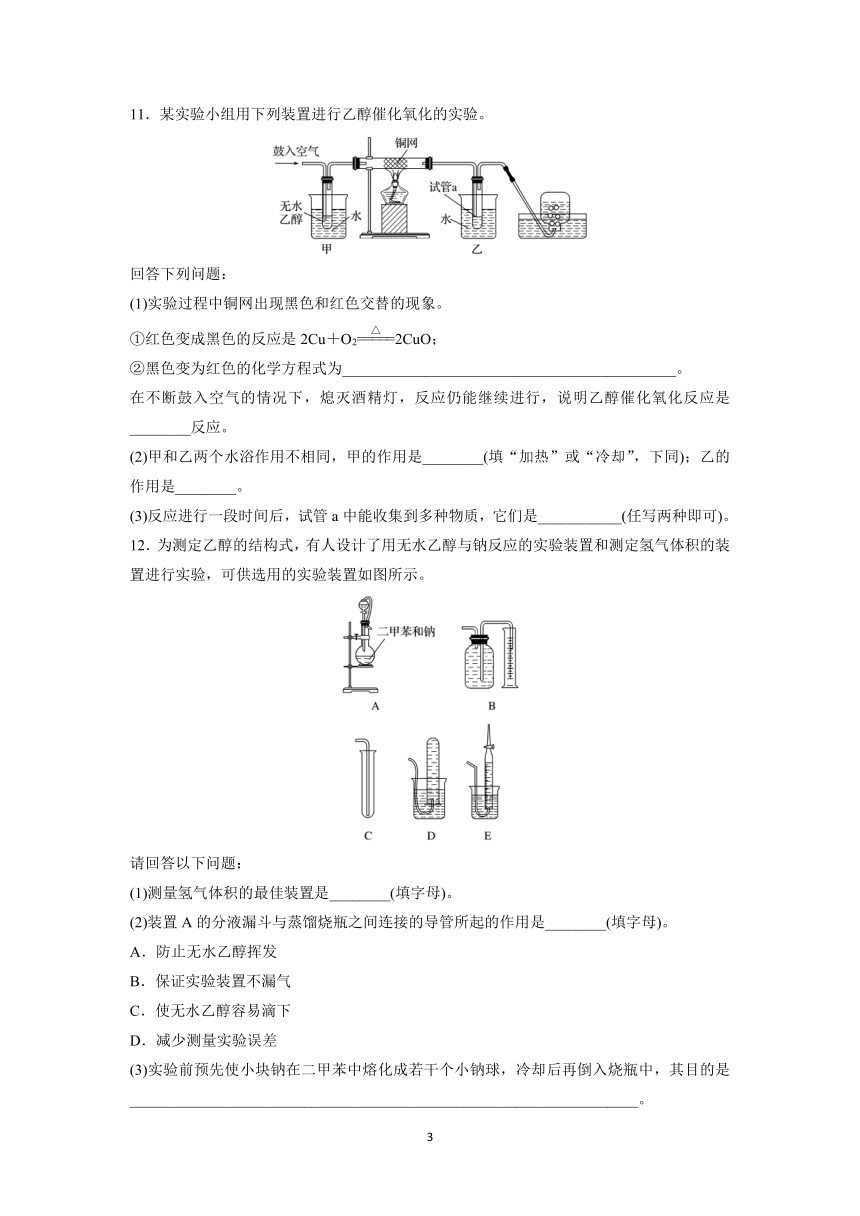
11.某实验小组用下列装置进行乙醇催化氧化的实验。
回答下列问题:
(1)实验过程中铜网出现黑色和红色交替的现象。
①红色变成黑色的反应是2Cu+O22CuO;
②黑色变为红色的化学方程式为____________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是________反应。
(2)甲和乙两个水浴作用不相同,甲的作用是________(填“加热”或“冷却”,下同);乙的作用是________。
(3)反应进行一段时间后,试管a中能收集到多种物质,它们是___________(任写两种即可)。
12.为测定乙醇的结构式,有人设计了用无水乙醇与钠反应的实验装置和测定氢气体积的装置进行实验,可供选用的实验装置如图所示。
请回答以下问题:
(1)测量氢气体积的最佳装置是________(填字母)。
(2)装置A的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填字母)。
A.防止无水乙醇挥发
B.保证实验装置不漏气
C.使无水乙醇容易滴下
D.减少测量实验误差
(3)实验前预先使小块钠在二甲苯中熔化成若干个小钠球,冷却后再倒入烧瓶中,其目的是___________________________________________________________________。
(4)已知无水乙醇的密度为0.789 g·cm-3,移取2.0 mL乙醇,反应完全后(钠过量),收集到390 mL(已折算为标准状况)气体。则一个乙醇分子中能被钠置换的氢原子数为________,由此可确定乙醇的结构式为________,而不是________。
7.3.1乙醇(练好题)解析版
能力提升
1下列有关乙醇的表述正确的是( )
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为[OH]-
D.乙醇分子的空间充填模型为
【答案】 D
【解析】 甲基的电子式为,A项错误;乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;羟基的电子式为,为中性基团,C错误。
2.下列说法不正确的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.75%(体积分数)的乙醇溶液常用于医疗消毒
C.乙醇能与金属钠反应生成氢气
D.乙烯与水加成可生成乙醇,可用于制食用白酒
【答案】 D
【解析】 乙醇调制的酒可以饮用,也可以用作厨房调味品,食醋的主要成分为乙酸,A正确;常用于医疗消毒的酒精是75%(体积分数)的乙醇溶液,B正确;乙醇分子中含—OH,能与Na发生置换反应生成氢气,C正确;乙烯与水加成可生成乙醇,工业上利用乙烯直接水化法制得的乙醇中往往含有对人体有害的杂质,不能用于制食用白酒,D错误。
3.乙醇分子中的化学键如图所示,则乙醇在催化氧化时,化学键断裂的位置是( )
A.②③ B.①② C.③④ D.①③
【答案】 B
【解析】 乙醇的催化氧化,“去氢”的位置是羟基氢及与羟基直接相连的碳原子上的氢原子。
4.向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面之下
B.钠块熔化成小球
C.钠块在乙醇的液面上游动
D.向烧杯中滴入几滴酚酞溶液变红色
【答案】 A
【解析】 钠的密度比乙醇的大,故A正确、C错误;钠与乙醇反应产生氢气比较缓慢,放出的热量不足以使钠熔化,故B错误;烧杯中无OH-产生,酚酞不变红色,故D错误。
5.已知C4H10的同分异构体有两种:CH3CH2CH2CH3、,则C4H9OH属于醇类的同分异构体共有( )
A.1种 B.2种
C.3种 D.4种
【答案】 D
【解析】 所给的两种同分异构体各含有两种不同的氢原子,如下:C3—C2—CH2—CH3、,所以羟基取代这些氢原子共得到4种属于醇类的同分异构体。
6.某化学反应过程如图所示,由如图得出的下列判断错误的是( )
A.乙醇发生了还原反应
B.反应中有“红→黑→红”颜色交替变化的现象
C.铜是此反应的催化剂
D.生成物是乙醛
【答案】 A
【解析】 乙醇被氧化成乙醛,发生了氧化反应,A错误;在反应中铜(红色)被氧气氧化为氧化铜(黑色),然后氧化铜又被乙醇还原为铜,因此反应中有“红→黑→红”颜色交替变化的现象,B正确;根据以上分析可判断铜是此反应的催化剂,C正确;根据以上分析可判断生成物是乙醛,D正确。
7.在探究乙醇的有关实验中,得出的结论正确的是( )
选项 实验步骤及现象 实验结论
A 在酒精试样中加入少量CuSO4·5H2O,搅拌,试管底部有蓝色晶体 酒精试样中一定含有水
B 在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁有水珠出现,另罩一内壁涂有澄清石灰水的烧杯,内壁出现白色沉淀 乙醇由C、H、O三种元素组成
C 将灼烧后表面变黑的螺旋状铜丝伸入约50 ℃的乙醇中,铜丝能保持红热一段时间 乙醇催化氧化反应是放热反应
D 在0.01 mol金属钠中加入过量的乙醇充分反应,收集到标准状况下气体112 mL 乙醇分子中有1个氢原子与氧原子相连,其余与碳原子相连
【答案】 C
【解析】 CuSO4·5H2O不能再结合水,加入后无现象,故无法证明酒精中是否含水,A错误;由现象知,乙醇燃烧生成CO2和H2O,可以说明乙醇中含有C和H元素,但不能确定是否含有氧元素,B错误;由现象“铜丝能保持红热一段时间”,可以说明反应为放热反应,C正确;0.01 mol Na和过量乙醇生成标准状况下112 mL氢气,但因为乙醇过量,无法确定就是一个H与O相连,D错误。
8.乙醇能发生如下反应:
①CH3CH2OH+3O22CO2+3H2O;
②2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+H2O+Cu。
由以上反应不能得出的结论是( )
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
【答案】 D
【解析】 由反应①可知,乙醇在氧气中燃烧生成CO2和H2O,由反应②可知乙醇与O2在铜作催化剂的条件下反应生成CH3CHO和H2O,条件不同,乙醇与O2反应的产物不同,故A正确;由反应②可知,Cu参与反应,但在反应前后质量和化学性质不变,是催化剂,故B正确;由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂,故C正确;由反应②可知,乙醇氧化为乙醛时,断开了氢氧键、碳氢键,故D错误。
9.A、B、C三种醇分别与足量的金属钠完全反应,在相同条件下产生相同体积的H2,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中所含羟基的个数之比为( )
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
【答案】 D
【解析】 相同条件下,题述三种醇与足量的钠反应产生相同体积的氢气,说明三种醇提供的羟基数相同,则三种醇分子中所含羟基的个数之比为∶∶=2∶1∶3。
10.关于有机化合物HO—CH2—CH==CH—CH2OH,下列说法不正确的是( )
A.分子式为C4H8O2,1 mol该物质充分燃烧需消耗氧气为5 mol
B.能发生取代反应、加成反应、氧化反应、加聚反应
C.1 mol该物质和足量的金属钠反应,产生22.4 L的氢气
D.该物质能使溴水及酸性KMnO4溶液褪色
【答案】 C
【解析】 根据结构简式知,分子式为C4H8O2,可写成C4H4(H2O)2,只有C4H4消耗氧气,故1 mol物质充分燃烧消耗O2为5 mol,A正确;分子含有羟基和碳碳双键,因此可以发生取代反应、加成反应、氧化反应和加聚反应,B正确;1 mol该物质和足量钠反应会生成1 mol H2,在标准状况下为22.4 L,但没有说明条件,故C错误;分子中含有醇羟基和碳碳双键,能和Br2发生加成反应,也能被酸性KMnO4氧化,故D正确。
11.某实验小组用下列装置进行乙醇催化氧化的实验。
回答下列问题:
(1)实验过程中铜网出现黑色和红色交替的现象。
①红色变成黑色的反应是2Cu+O22CuO;
②黑色变为红色的化学方程式为____________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是________反应。
(2)甲和乙两个水浴作用不相同,甲的作用是________(填“加热”或“冷却”,下同);乙的作用是________。
(3)反应进行一段时间后,试管a中能收集到多种物质,它们是___________(任写两种即可)。
【答案】 (1)②CH3CH2OH+CuOCH3CHO+Cu+H2O 放热
(2)加热 冷却 (3)乙醛、乙醇、水、乙酸等(任选其中两种)
【解析】 乙醇易挥发,在甲中水浴加热下,同空气一同进入反应管内,在反应管中,乙醇与空气在铜的催化作用下发生氧化反应生成乙醛,乙中试管在冷水冷却下用于收集乙醛,该反应不能充分进行,还可收集到乙醇、水等。
(1)黑色变为红色是因为发生反应:CH3CH2OH+CuOCH3CHO+Cu+H2O,该反应是乙醇的催化氧化反应,铜在反应中作催化剂;熄灭酒精灯,反应仍能继续进行,说明该反应是一个放热反应。
(2)根据反应流程可知:在甲处用热水浴加热使乙醇挥发,与空气中的氧气混合,有利于下一步反应的进行;乙处用冷水浴降低温度,使生成的乙醛冷凝为液体,聚集在试管的底部。
(3)乙醇的催化氧化实验中乙醇、乙醛和水的沸点相差不大,且乙醛可部分被氧化生成乙酸,在试管a中能收集到这些不同的物质。
12.为测定乙醇的结构式,有人设计了用无水乙醇与钠反应的实验装置和测定氢气体积的装置进行实验,可供选用的实验装置如图所示。
请回答以下问题:
(1)测量氢气体积的最佳装置是________(填字母)。
(2)装置A的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填字母)。
A.防止无水乙醇挥发
B.保证实验装置不漏气
C.使无水乙醇容易滴下
D.减少测量实验误差
(3)实验前预先使小块钠在二甲苯中熔化成若干个小钠球,冷却后再倒入烧瓶中,其目的是___________________________________________________________________。
(4)已知无水乙醇的密度为0.789 g·cm-3,移取2.0 mL乙醇,反应完全后(钠过量),收集到390 mL(已折算为标准状况)气体。则一个乙醇分子中能被钠置换的氢原子数为________,由此可确定乙醇的结构式为________,而不是________。
【答案】 (1)B
(2)CD
(3)防止钠与空气反应干扰实验,同时增大无水乙醇与钠的接触面积,加快反应速率
(4)1
【解析】 (1)氢气不溶于水,可用排水法测量氢气的体积。C装置无法测量氢气的体积,D装置中试管无刻度,E装置测量最准确,但容积受限。(3)要准确测定乙醇和钠反应生成的氢气的量与乙醇的量之间的关系,钠必须过量。又因为钠的化学性质很活泼,容易与空气中的氧气、水蒸气发生反应,故实验时应预先使小块钠在二甲苯中熔化成若干个小钠球,从而防止钠与空气反应干扰实验,且可增大乙醇与钠的接触面积,加快反应速率。(4)由题意知,n(乙醇)= mol≈0.034 3 mol,n(H)=×2 mol≈0.034 8 mol,则n(乙醇)∶n(H)≈1∶1,则一个乙醇分子中能被钠置换的氢原子数为1,由此得出乙醇的结构式应为,而不是。
PAGE
1
能力提升
1下列有关乙醇的表述正确的是( )
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为[OH]-
D.乙醇分子的空间充填模型为
2.下列说法不正确的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.75%(体积分数)的乙醇溶液常用于医疗消毒
C.乙醇能与金属钠反应生成氢气
D.乙烯与水加成可生成乙醇,可用于制食用白酒
3.乙醇分子中的化学键如图所示,则乙醇在催化氧化时,化学键断裂的位置是( )
A.②③ B.①② C.③④ D.①③
4.向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面之下
B.钠块熔化成小球
C.钠块在乙醇的液面上游动
D.向烧杯中滴入几滴酚酞溶液变红色
5.已知C4H10的同分异构体有两种:CH3CH2CH2CH3、,则C4H9OH属于醇类的同分异构体共有( )
A.1种 B.2种
C.3种 D.4种
6.某化学反应过程如图所示,由如图得出的下列判断错误的是( )
A.乙醇发生了还原反应
B.反应中有“红→黑→红”颜色交替变化的现象
C.铜是此反应的催化剂
D.生成物是乙醛
7.在探究乙醇的有关实验中,得出的结论正确的是( )
选项 实验步骤及现象 实验结论
A 在酒精试样中加入少量CuSO4·5H2O,搅拌,试管底部有蓝色晶体 酒精试样中一定含有水
B 在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁有水珠出现,另罩一内壁涂有澄清石灰水的烧杯,内壁出现白色沉淀 乙醇由C、H、O三种元素组成
C 将灼烧后表面变黑的螺旋状铜丝伸入约50 ℃的乙醇中,铜丝能保持红热一段时间 乙醇催化氧化反应是放热反应
D 在0.01 mol金属钠中加入过量的乙醇充分反应,收集到标准状况下气体112 mL 乙醇分子中有1个氢原子与氧原子相连,其余与碳原子相连
8.乙醇能发生如下反应:
①CH3CH2OH+3O22CO2+3H2O;
②2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+H2O+Cu。
由以上反应不能得出的结论是( )
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
9.A、B、C三种醇分别与足量的金属钠完全反应,在相同条件下产生相同体积的H2,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中所含羟基的个数之比为( )
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
10.关于有机化合物HO—CH2—CH==CH—CH2OH,下列说法不正确的是( )
A.分子式为C4H8O2,1 mol该物质充分燃烧需消耗氧气为5 mol
B.能发生取代反应、加成反应、氧化反应、加聚反应
C.1 mol该物质和足量的金属钠反应,产生22.4 L的氢气
D.该物质能使溴水及酸性KMnO4溶液褪色
11.某实验小组用下列装置进行乙醇催化氧化的实验。
回答下列问题:
(1)实验过程中铜网出现黑色和红色交替的现象。
①红色变成黑色的反应是2Cu+O22CuO;
②黑色变为红色的化学方程式为____________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是________反应。
(2)甲和乙两个水浴作用不相同,甲的作用是________(填“加热”或“冷却”,下同);乙的作用是________。
(3)反应进行一段时间后,试管a中能收集到多种物质,它们是___________(任写两种即可)。
12.为测定乙醇的结构式,有人设计了用无水乙醇与钠反应的实验装置和测定氢气体积的装置进行实验,可供选用的实验装置如图所示。
请回答以下问题:
(1)测量氢气体积的最佳装置是________(填字母)。
(2)装置A的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填字母)。
A.防止无水乙醇挥发
B.保证实验装置不漏气
C.使无水乙醇容易滴下
D.减少测量实验误差
(3)实验前预先使小块钠在二甲苯中熔化成若干个小钠球,冷却后再倒入烧瓶中,其目的是___________________________________________________________________。
(4)已知无水乙醇的密度为0.789 g·cm-3,移取2.0 mL乙醇,反应完全后(钠过量),收集到390 mL(已折算为标准状况)气体。则一个乙醇分子中能被钠置换的氢原子数为________,由此可确定乙醇的结构式为________,而不是________。
7.3.1乙醇(练好题)解析版
能力提升
1下列有关乙醇的表述正确的是( )
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为[OH]-
D.乙醇分子的空间充填模型为
【答案】 D
【解析】 甲基的电子式为,A项错误;乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;羟基的电子式为,为中性基团,C错误。
2.下列说法不正确的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.75%(体积分数)的乙醇溶液常用于医疗消毒
C.乙醇能与金属钠反应生成氢气
D.乙烯与水加成可生成乙醇,可用于制食用白酒
【答案】 D
【解析】 乙醇调制的酒可以饮用,也可以用作厨房调味品,食醋的主要成分为乙酸,A正确;常用于医疗消毒的酒精是75%(体积分数)的乙醇溶液,B正确;乙醇分子中含—OH,能与Na发生置换反应生成氢气,C正确;乙烯与水加成可生成乙醇,工业上利用乙烯直接水化法制得的乙醇中往往含有对人体有害的杂质,不能用于制食用白酒,D错误。
3.乙醇分子中的化学键如图所示,则乙醇在催化氧化时,化学键断裂的位置是( )
A.②③ B.①② C.③④ D.①③
【答案】 B
【解析】 乙醇的催化氧化,“去氢”的位置是羟基氢及与羟基直接相连的碳原子上的氢原子。
4.向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面之下
B.钠块熔化成小球
C.钠块在乙醇的液面上游动
D.向烧杯中滴入几滴酚酞溶液变红色
【答案】 A
【解析】 钠的密度比乙醇的大,故A正确、C错误;钠与乙醇反应产生氢气比较缓慢,放出的热量不足以使钠熔化,故B错误;烧杯中无OH-产生,酚酞不变红色,故D错误。
5.已知C4H10的同分异构体有两种:CH3CH2CH2CH3、,则C4H9OH属于醇类的同分异构体共有( )
A.1种 B.2种
C.3种 D.4种
【答案】 D
【解析】 所给的两种同分异构体各含有两种不同的氢原子,如下:C3—C2—CH2—CH3、,所以羟基取代这些氢原子共得到4种属于醇类的同分异构体。
6.某化学反应过程如图所示,由如图得出的下列判断错误的是( )
A.乙醇发生了还原反应
B.反应中有“红→黑→红”颜色交替变化的现象
C.铜是此反应的催化剂
D.生成物是乙醛
【答案】 A
【解析】 乙醇被氧化成乙醛,发生了氧化反应,A错误;在反应中铜(红色)被氧气氧化为氧化铜(黑色),然后氧化铜又被乙醇还原为铜,因此反应中有“红→黑→红”颜色交替变化的现象,B正确;根据以上分析可判断铜是此反应的催化剂,C正确;根据以上分析可判断生成物是乙醛,D正确。
7.在探究乙醇的有关实验中,得出的结论正确的是( )
选项 实验步骤及现象 实验结论
A 在酒精试样中加入少量CuSO4·5H2O,搅拌,试管底部有蓝色晶体 酒精试样中一定含有水
B 在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁有水珠出现,另罩一内壁涂有澄清石灰水的烧杯,内壁出现白色沉淀 乙醇由C、H、O三种元素组成
C 将灼烧后表面变黑的螺旋状铜丝伸入约50 ℃的乙醇中,铜丝能保持红热一段时间 乙醇催化氧化反应是放热反应
D 在0.01 mol金属钠中加入过量的乙醇充分反应,收集到标准状况下气体112 mL 乙醇分子中有1个氢原子与氧原子相连,其余与碳原子相连
【答案】 C
【解析】 CuSO4·5H2O不能再结合水,加入后无现象,故无法证明酒精中是否含水,A错误;由现象知,乙醇燃烧生成CO2和H2O,可以说明乙醇中含有C和H元素,但不能确定是否含有氧元素,B错误;由现象“铜丝能保持红热一段时间”,可以说明反应为放热反应,C正确;0.01 mol Na和过量乙醇生成标准状况下112 mL氢气,但因为乙醇过量,无法确定就是一个H与O相连,D错误。
8.乙醇能发生如下反应:
①CH3CH2OH+3O22CO2+3H2O;
②2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+H2O+Cu。
由以上反应不能得出的结论是( )
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
【答案】 D
【解析】 由反应①可知,乙醇在氧气中燃烧生成CO2和H2O,由反应②可知乙醇与O2在铜作催化剂的条件下反应生成CH3CHO和H2O,条件不同,乙醇与O2反应的产物不同,故A正确;由反应②可知,Cu参与反应,但在反应前后质量和化学性质不变,是催化剂,故B正确;由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂,故C正确;由反应②可知,乙醇氧化为乙醛时,断开了氢氧键、碳氢键,故D错误。
9.A、B、C三种醇分别与足量的金属钠完全反应,在相同条件下产生相同体积的H2,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中所含羟基的个数之比为( )
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
【答案】 D
【解析】 相同条件下,题述三种醇与足量的钠反应产生相同体积的氢气,说明三种醇提供的羟基数相同,则三种醇分子中所含羟基的个数之比为∶∶=2∶1∶3。
10.关于有机化合物HO—CH2—CH==CH—CH2OH,下列说法不正确的是( )
A.分子式为C4H8O2,1 mol该物质充分燃烧需消耗氧气为5 mol
B.能发生取代反应、加成反应、氧化反应、加聚反应
C.1 mol该物质和足量的金属钠反应,产生22.4 L的氢气
D.该物质能使溴水及酸性KMnO4溶液褪色
【答案】 C
【解析】 根据结构简式知,分子式为C4H8O2,可写成C4H4(H2O)2,只有C4H4消耗氧气,故1 mol物质充分燃烧消耗O2为5 mol,A正确;分子含有羟基和碳碳双键,因此可以发生取代反应、加成反应、氧化反应和加聚反应,B正确;1 mol该物质和足量钠反应会生成1 mol H2,在标准状况下为22.4 L,但没有说明条件,故C错误;分子中含有醇羟基和碳碳双键,能和Br2发生加成反应,也能被酸性KMnO4氧化,故D正确。
11.某实验小组用下列装置进行乙醇催化氧化的实验。
回答下列问题:
(1)实验过程中铜网出现黑色和红色交替的现象。
①红色变成黑色的反应是2Cu+O22CuO;
②黑色变为红色的化学方程式为____________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是________反应。
(2)甲和乙两个水浴作用不相同,甲的作用是________(填“加热”或“冷却”,下同);乙的作用是________。
(3)反应进行一段时间后,试管a中能收集到多种物质,它们是___________(任写两种即可)。
【答案】 (1)②CH3CH2OH+CuOCH3CHO+Cu+H2O 放热
(2)加热 冷却 (3)乙醛、乙醇、水、乙酸等(任选其中两种)
【解析】 乙醇易挥发,在甲中水浴加热下,同空气一同进入反应管内,在反应管中,乙醇与空气在铜的催化作用下发生氧化反应生成乙醛,乙中试管在冷水冷却下用于收集乙醛,该反应不能充分进行,还可收集到乙醇、水等。
(1)黑色变为红色是因为发生反应:CH3CH2OH+CuOCH3CHO+Cu+H2O,该反应是乙醇的催化氧化反应,铜在反应中作催化剂;熄灭酒精灯,反应仍能继续进行,说明该反应是一个放热反应。
(2)根据反应流程可知:在甲处用热水浴加热使乙醇挥发,与空气中的氧气混合,有利于下一步反应的进行;乙处用冷水浴降低温度,使生成的乙醛冷凝为液体,聚集在试管的底部。
(3)乙醇的催化氧化实验中乙醇、乙醛和水的沸点相差不大,且乙醛可部分被氧化生成乙酸,在试管a中能收集到这些不同的物质。
12.为测定乙醇的结构式,有人设计了用无水乙醇与钠反应的实验装置和测定氢气体积的装置进行实验,可供选用的实验装置如图所示。
请回答以下问题:
(1)测量氢气体积的最佳装置是________(填字母)。
(2)装置A的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填字母)。
A.防止无水乙醇挥发
B.保证实验装置不漏气
C.使无水乙醇容易滴下
D.减少测量实验误差
(3)实验前预先使小块钠在二甲苯中熔化成若干个小钠球,冷却后再倒入烧瓶中,其目的是___________________________________________________________________。
(4)已知无水乙醇的密度为0.789 g·cm-3,移取2.0 mL乙醇,反应完全后(钠过量),收集到390 mL(已折算为标准状况)气体。则一个乙醇分子中能被钠置换的氢原子数为________,由此可确定乙醇的结构式为________,而不是________。
【答案】 (1)B
(2)CD
(3)防止钠与空气反应干扰实验,同时增大无水乙醇与钠的接触面积,加快反应速率
(4)1
【解析】 (1)氢气不溶于水,可用排水法测量氢气的体积。C装置无法测量氢气的体积,D装置中试管无刻度,E装置测量最准确,但容积受限。(3)要准确测定乙醇和钠反应生成的氢气的量与乙醇的量之间的关系,钠必须过量。又因为钠的化学性质很活泼,容易与空气中的氧气、水蒸气发生反应,故实验时应预先使小块钠在二甲苯中熔化成若干个小钠球,从而防止钠与空气反应干扰实验,且可增大乙醇与钠的接触面积,加快反应速率。(4)由题意知,n(乙醇)= mol≈0.034 3 mol,n(H)=×2 mol≈0.034 8 mol,则n(乙醇)∶n(H)≈1∶1,则一个乙醇分子中能被钠置换的氢原子数为1,由此得出乙醇的结构式应为,而不是。
PAGE
1
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
