人教版(2019)高中化学必修第二册 《第1课时 乙醇》拔高练习(含解析)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《第1课时 乙醇》拔高练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 212.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-18 08:25:33 | ||
图片预览



文档简介
第三节 乙醇与乙酸
第1课时 乙醇
夯实基础轻松达标
1.下列性质中,不能说明乙醇宜作燃料的是( )
A.燃烧时发生氧化还原反应
B.充分燃烧的产物不污染环境
C.乙醇是一种可再生能源
D.燃烧时放出大量的热
2.比较乙烷和乙醇的分子结构,下列说法错误的是( )
A.两个碳原子以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
3.下列有关乙醇的物理性质的应用的说法不正确的是 ( )
A.由于乙醇的密度比水小,所以乙醇中混有的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.从化学学科角度看,俗语“酒香不怕巷子深”中包含乙醇容易挥发的性质
4.已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇、乙二醇()、丙三醇()分别与足量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3
C.3∶2∶1 D.4∶3∶2
5.下列醇不能发生催化氧化的是( )
A.CH3OH B.
C. D.
6.结合乙烯和乙醇的结构与性质,推测丙烯醇(CH2CH—CH2OH)不能发生的化学反应有( )
A.加成反应
B.氧化反应
C.与Na反应
D.与Na2CO3溶液反应放出CO2
7.如图是A分子的球棍模型和B分子的空间填充模型,回答下列问题:
(1)A和B的关系是 。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式: 。
(3)写出B分子和金属钠反应的化学方程式: 。
(4)B在加热条件下能够与HBr发生反应生成溴乙烷,该反应类型是 。
提升能力跨越等级
1.“环保油”又称醇基液体材料(主要成分是甲醇)。近几年成为部分中小餐馆的主要燃料。但其挥发性大,吸入一定量的蒸气就会视力模糊,对人体健康有害。下列说法不正确的是( )
A.甲醇的结构简式为CH3OH,所以甲醇是一种有机物
B.工业酒精中含有甲醇,饮用工业酒精对人体有害
C.甲醇遇到明火易燃易爆炸,所以存在很大安全隐患
D.甲醇在不完全燃烧时会吸收热量
2.在100 ℃、常压下,将乙醇汽化为蒸气,然后与乙烯以任意比例混合,混合气体的体积为V L。使该混合气体完全燃烧,需消耗相同条件下的氧气的体积是( )
A.2V L B.2.5V L
C.3V L D.无法计算
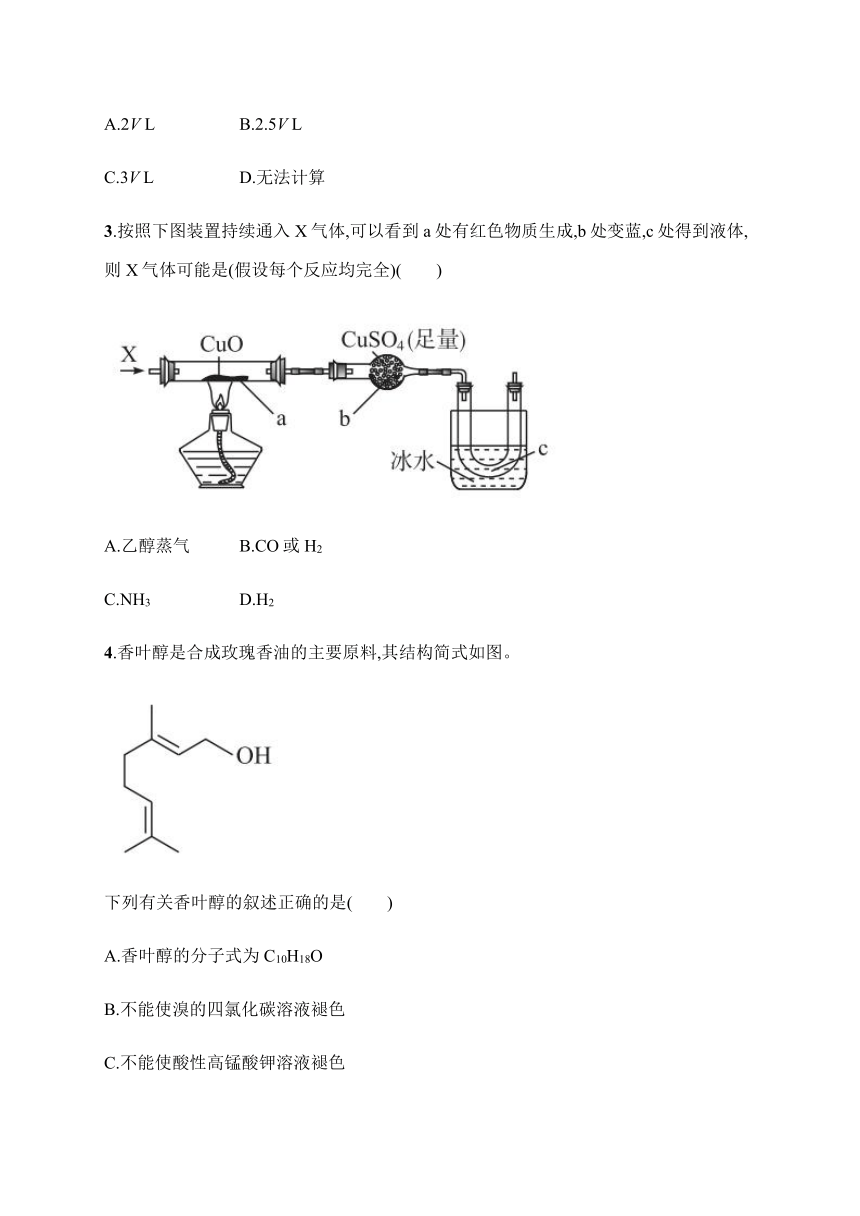
3.按照下图装置持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是(假设每个反应均完全)( )
A.乙醇蒸气 B.CO或H2
C.NH3 D.H2
4.香叶醇是合成玫瑰香油的主要原料,其结构简式如图。
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应,不能发生取代反应
5.分子式为C4H10O并能与金属钠反应放出氢气的有机物有(不含立体异构)( )
A.3种 B.4种 C.5种 D.6种
6.乙二醇的结构简式:HOCH2—CH2OH。
(1)乙二醇被足量氧气在铜作催化剂条件下氧化成醛的化学方程式: 。
(2)乙二醇与足量Na反应的化学方程式为 。
(3)已知:2CH3CH2OHCH3CH2OCH2CH3+H2O,请写出两分子乙二醇在浓硫酸、加热的条件下发生取代反应生成六元环的化学方程式: 。
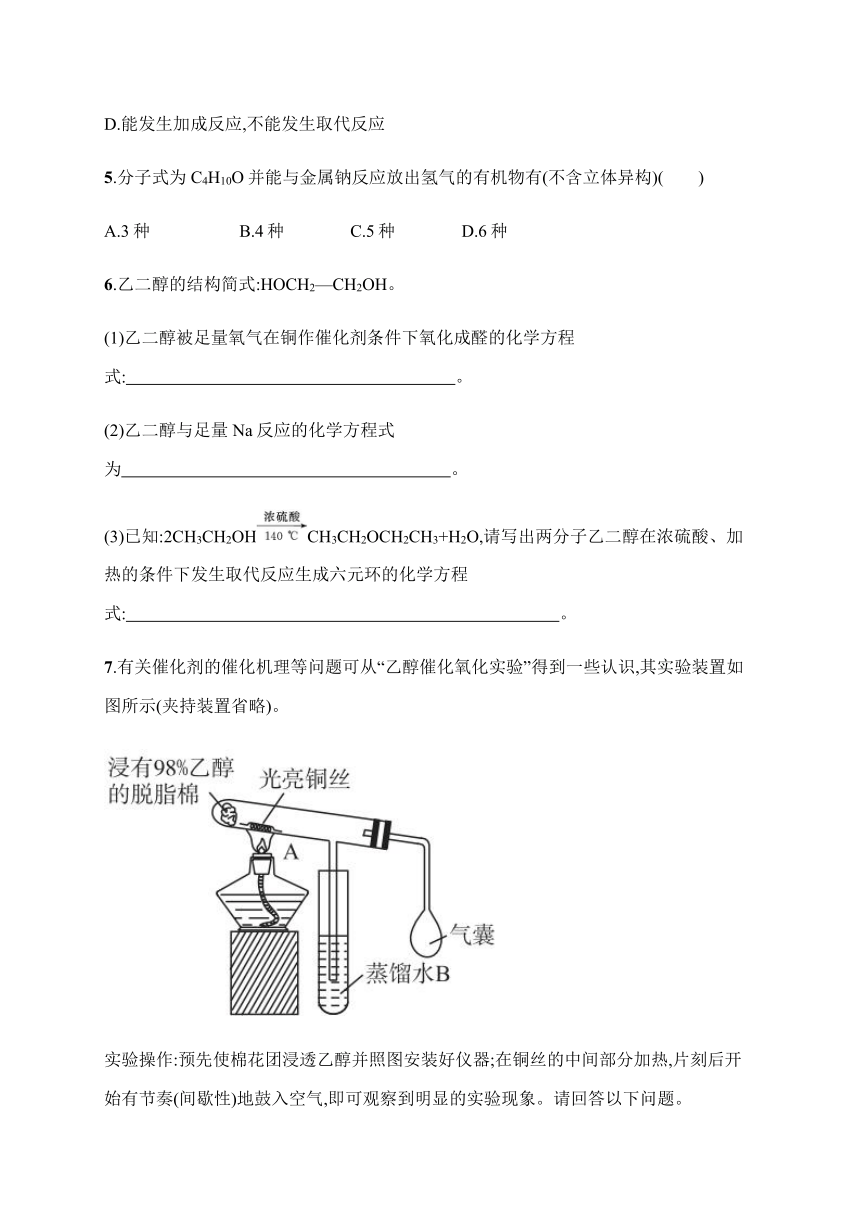
7.有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示(夹持装置省略)。
实验操作:预先使棉花团浸透乙醇并照图安装好仪器;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。请回答以下问题。
(1)被加热的铜丝处发生反应的化学方程式为 。
(2)A管中可观察到 现象,从中可认识到在该实验过程中催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时往往需要一定的 。
(3)实验一段时间后,如果撤掉酒精灯,反应 (填“能”或“不能”)继续进行。原受热的铜丝处的现象是 ,原因是 。
贴近生活拓展创新
乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式: 。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号) 。
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(4)装置③的作用是 ;装置①中所盛的是 ,作用是 。
(5)装置④中所盛的固体药品是 ,它可以验证的产物是 。
(6)尾气应如何处理 。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是 。
参考答案
夯实基础轻松达标
1.答案A
解析乙醇完全燃烧产生二氧化碳和水,不产生污染物,并且原料易得,燃烧过程中放出大量的热,属于可再生资源。
2.答案B
解析乙烷和乙醇的结构简式分别为CH3CH3和CH3CH2OH,乙醇分子中有3种等效氢原子,所以B选项错误。
3.答案A
解析乙醇与水能以任意比混溶,无法用分液法将乙醇中混有的水除去。
4.答案A
解析醇分子中羟基个数与被置换的氢原子个数之比为1∶1。三种醇与钠反应放出等量的氢气,则三种醇提供的羟基数相同,因此三种醇的物质的量之比为1∶=6∶3∶2。
5.答案C
解析醇的催化氧化断裂的化学键是O—H键和连接羟基的碳原子上的C—H键。C项中连接羟基的碳原子上没有C—H键,故不能发生催化氧化。
6.答案D
解析丙烯醇分子中含碳碳双键,具有烯烃的性质,能发生加成反应和氧化反应;含有醇羟基,具有醇的性质,能发生氧化反应,能与钠反应,但不具有酸性,不能与Na2CO3溶液反应放出CO2。
7.答案(1)同系物
(2)2CH3OH+O22HCHO+2H2O
(3)2CH3CH2OH+2Na2CH3CH2ONa+H2↑
(4)取代反应
解析根据成键原则,可以判断A和B的结构简式分别是CH3OH(甲醇)和CH3CH2OH,它们结构相似,互称为同系物;它们都含—OH,甲醇和乙醇性质相似,能被氧化成相应的醛,能够与金属钠反应;根据B在加热条件下能与HBr发生反应生成溴乙烷的特点可知,该反应为取代反应。
提升能力跨越等级
1.答案D
解析甲醇的结构简式为CH3OH,含碳、氢、氧元素,属于有机物,A正确;工业酒精中含有甲醇,甲醇有毒,饮用工业酒精对人体有害,B正确;甲醇为易燃液体,遇到明火易燃易爆炸,所以存在很大安全隐患,C正确;甲醇在不完全燃烧时会放出热量,D错误。
2.答案C
解析乙烯的分子式为C2H4,乙醇的分子式为C2H6O,将其变形为C2H4·H2O;又因C2H4+3O22CO2+2H2O、C2H6O+3O22CO2+3H2O,即无论V L乙烯和乙醇的混合气体中二者比例如何,耗氧量均不变,即消耗相同条件下氧气的体积为混合气体体积的3倍。
3.答案A
解析选项中气体均可还原CuO,但本题的关键点是所得产物冷凝后得到液体,该液体不可能是水(干燥管中盛有足量CuSO4),但可以是乙醛,故X气体可能为乙醇蒸气。
4.答案A
解析A项,由香叶醇的结构简式可得其分子式为C10H18O。B项,分子结构中含有碳碳双键,能与溴发生加成反应,从而使溴的CCl4溶液褪色。C项,分子结构中含有碳碳双键,能被酸性高锰酸钾溶液氧化,使溶液紫色褪去。D项,分子结构中含有碳碳双键可发生加成反应,含有醇羟基可发生取代反应。
5.答案B
解析分子式为C4H10O且能与金属Na发生反应放出氢气,则该有机物是醇。该醇可看作是由羟基(—OH)连在丁基上形成的,丁基有4种结构,则该醇也有4种,B正确。
6.答案(1)HOCH2—CH2OH+O2OHC—CHO+2H2O
(2)HOCH2—CH2OH+2NaNaOCH2—CH2ONa+H2↑
(3)2HOCH2—CH2OH+2H2O
解析(1)乙二醇被氧气在铜作催化剂条件下氧化生成乙二醛和水,化学方程式为HOCH2—CH2OH+O2OHC—CHO+2H2O。
(2)乙二醇与足量Na反应的化学方程式为HOCH2—CH2OH+2NaNaOCH2—CH2ONa+H2↑。
(3)两分子乙二醇在浓硫酸、加热的条件下发生分子间脱水的取代反应生成六元环,化学方程式为2HOCH2—CH2OH+2H2O。
7.答案(1)2CH3CH2OH+O22CH3CHO+2H2O
(2)受热部分的铜丝随间歇性地鼓入空气而交替出现变黑、变亮红色 温度
(3)能 交替出现变黑、变亮红色 该反应是放热反应
贴近生活拓展创新
答案(1)C2H5OH+3O22CO2+3H2O
(2)④②③①
(3)验证CO2的存在 除去混合气体中的CO2 检验CO2是否被除尽
(4)将CO氧化成CO2 澄清石灰水 检验由CO与CuO反应所生成的CO2,从而确定CO气体的存在
(5)无水硫酸铜 H2O
(6)点燃
(7)甲烷
第1课时 乙醇
夯实基础轻松达标
1.下列性质中,不能说明乙醇宜作燃料的是( )
A.燃烧时发生氧化还原反应
B.充分燃烧的产物不污染环境
C.乙醇是一种可再生能源
D.燃烧时放出大量的热
2.比较乙烷和乙醇的分子结构,下列说法错误的是( )
A.两个碳原子以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
3.下列有关乙醇的物理性质的应用的说法不正确的是 ( )
A.由于乙醇的密度比水小,所以乙醇中混有的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.从化学学科角度看,俗语“酒香不怕巷子深”中包含乙醇容易挥发的性质
4.已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇、乙二醇()、丙三醇()分别与足量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3
C.3∶2∶1 D.4∶3∶2
5.下列醇不能发生催化氧化的是( )
A.CH3OH B.
C. D.
6.结合乙烯和乙醇的结构与性质,推测丙烯醇(CH2CH—CH2OH)不能发生的化学反应有( )
A.加成反应
B.氧化反应
C.与Na反应
D.与Na2CO3溶液反应放出CO2
7.如图是A分子的球棍模型和B分子的空间填充模型,回答下列问题:
(1)A和B的关系是 。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式: 。
(3)写出B分子和金属钠反应的化学方程式: 。
(4)B在加热条件下能够与HBr发生反应生成溴乙烷,该反应类型是 。
提升能力跨越等级
1.“环保油”又称醇基液体材料(主要成分是甲醇)。近几年成为部分中小餐馆的主要燃料。但其挥发性大,吸入一定量的蒸气就会视力模糊,对人体健康有害。下列说法不正确的是( )
A.甲醇的结构简式为CH3OH,所以甲醇是一种有机物
B.工业酒精中含有甲醇,饮用工业酒精对人体有害
C.甲醇遇到明火易燃易爆炸,所以存在很大安全隐患
D.甲醇在不完全燃烧时会吸收热量
2.在100 ℃、常压下,将乙醇汽化为蒸气,然后与乙烯以任意比例混合,混合气体的体积为V L。使该混合气体完全燃烧,需消耗相同条件下的氧气的体积是( )
A.2V L B.2.5V L
C.3V L D.无法计算
3.按照下图装置持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体可能是(假设每个反应均完全)( )
A.乙醇蒸气 B.CO或H2
C.NH3 D.H2
4.香叶醇是合成玫瑰香油的主要原料,其结构简式如图。
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应,不能发生取代反应
5.分子式为C4H10O并能与金属钠反应放出氢气的有机物有(不含立体异构)( )
A.3种 B.4种 C.5种 D.6种
6.乙二醇的结构简式:HOCH2—CH2OH。
(1)乙二醇被足量氧气在铜作催化剂条件下氧化成醛的化学方程式: 。
(2)乙二醇与足量Na反应的化学方程式为 。
(3)已知:2CH3CH2OHCH3CH2OCH2CH3+H2O,请写出两分子乙二醇在浓硫酸、加热的条件下发生取代反应生成六元环的化学方程式: 。
7.有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示(夹持装置省略)。
实验操作:预先使棉花团浸透乙醇并照图安装好仪器;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。请回答以下问题。
(1)被加热的铜丝处发生反应的化学方程式为 。
(2)A管中可观察到 现象,从中可认识到在该实验过程中催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时往往需要一定的 。
(3)实验一段时间后,如果撤掉酒精灯,反应 (填“能”或“不能”)继续进行。原受热的铜丝处的现象是 ,原因是 。
贴近生活拓展创新
乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式: 。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号) 。
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(4)装置③的作用是 ;装置①中所盛的是 ,作用是 。
(5)装置④中所盛的固体药品是 ,它可以验证的产物是 。
(6)尾气应如何处理 。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是 。
参考答案
夯实基础轻松达标
1.答案A
解析乙醇完全燃烧产生二氧化碳和水,不产生污染物,并且原料易得,燃烧过程中放出大量的热,属于可再生资源。
2.答案B
解析乙烷和乙醇的结构简式分别为CH3CH3和CH3CH2OH,乙醇分子中有3种等效氢原子,所以B选项错误。
3.答案A
解析乙醇与水能以任意比混溶,无法用分液法将乙醇中混有的水除去。
4.答案A
解析醇分子中羟基个数与被置换的氢原子个数之比为1∶1。三种醇与钠反应放出等量的氢气,则三种醇提供的羟基数相同,因此三种醇的物质的量之比为1∶=6∶3∶2。
5.答案C
解析醇的催化氧化断裂的化学键是O—H键和连接羟基的碳原子上的C—H键。C项中连接羟基的碳原子上没有C—H键,故不能发生催化氧化。
6.答案D
解析丙烯醇分子中含碳碳双键,具有烯烃的性质,能发生加成反应和氧化反应;含有醇羟基,具有醇的性质,能发生氧化反应,能与钠反应,但不具有酸性,不能与Na2CO3溶液反应放出CO2。
7.答案(1)同系物
(2)2CH3OH+O22HCHO+2H2O
(3)2CH3CH2OH+2Na2CH3CH2ONa+H2↑
(4)取代反应
解析根据成键原则,可以判断A和B的结构简式分别是CH3OH(甲醇)和CH3CH2OH,它们结构相似,互称为同系物;它们都含—OH,甲醇和乙醇性质相似,能被氧化成相应的醛,能够与金属钠反应;根据B在加热条件下能与HBr发生反应生成溴乙烷的特点可知,该反应为取代反应。
提升能力跨越等级
1.答案D
解析甲醇的结构简式为CH3OH,含碳、氢、氧元素,属于有机物,A正确;工业酒精中含有甲醇,甲醇有毒,饮用工业酒精对人体有害,B正确;甲醇为易燃液体,遇到明火易燃易爆炸,所以存在很大安全隐患,C正确;甲醇在不完全燃烧时会放出热量,D错误。
2.答案C
解析乙烯的分子式为C2H4,乙醇的分子式为C2H6O,将其变形为C2H4·H2O;又因C2H4+3O22CO2+2H2O、C2H6O+3O22CO2+3H2O,即无论V L乙烯和乙醇的混合气体中二者比例如何,耗氧量均不变,即消耗相同条件下氧气的体积为混合气体体积的3倍。
3.答案A
解析选项中气体均可还原CuO,但本题的关键点是所得产物冷凝后得到液体,该液体不可能是水(干燥管中盛有足量CuSO4),但可以是乙醛,故X气体可能为乙醇蒸气。
4.答案A
解析A项,由香叶醇的结构简式可得其分子式为C10H18O。B项,分子结构中含有碳碳双键,能与溴发生加成反应,从而使溴的CCl4溶液褪色。C项,分子结构中含有碳碳双键,能被酸性高锰酸钾溶液氧化,使溶液紫色褪去。D项,分子结构中含有碳碳双键可发生加成反应,含有醇羟基可发生取代反应。
5.答案B
解析分子式为C4H10O且能与金属Na发生反应放出氢气,则该有机物是醇。该醇可看作是由羟基(—OH)连在丁基上形成的,丁基有4种结构,则该醇也有4种,B正确。
6.答案(1)HOCH2—CH2OH+O2OHC—CHO+2H2O
(2)HOCH2—CH2OH+2NaNaOCH2—CH2ONa+H2↑
(3)2HOCH2—CH2OH+2H2O
解析(1)乙二醇被氧气在铜作催化剂条件下氧化生成乙二醛和水,化学方程式为HOCH2—CH2OH+O2OHC—CHO+2H2O。
(2)乙二醇与足量Na反应的化学方程式为HOCH2—CH2OH+2NaNaOCH2—CH2ONa+H2↑。
(3)两分子乙二醇在浓硫酸、加热的条件下发生分子间脱水的取代反应生成六元环,化学方程式为2HOCH2—CH2OH+2H2O。
7.答案(1)2CH3CH2OH+O22CH3CHO+2H2O
(2)受热部分的铜丝随间歇性地鼓入空气而交替出现变黑、变亮红色 温度
(3)能 交替出现变黑、变亮红色 该反应是放热反应
贴近生活拓展创新
答案(1)C2H5OH+3O22CO2+3H2O
(2)④②③①
(3)验证CO2的存在 除去混合气体中的CO2 检验CO2是否被除尽
(4)将CO氧化成CO2 澄清石灰水 检验由CO与CuO反应所生成的CO2,从而确定CO气体的存在
(5)无水硫酸铜 H2O
(6)点燃
(7)甲烷
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
