人教版(2019)高中化学必修第二册 《7.3.1 乙醇》名师课件(20张)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《7.3.1 乙醇》名师课件(20张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-18 00:00:00 | ||
图片预览





文档简介
(共20张PPT)
高中化学人教版必修第二册
第七章 第三节 第一课时
《乙醇》
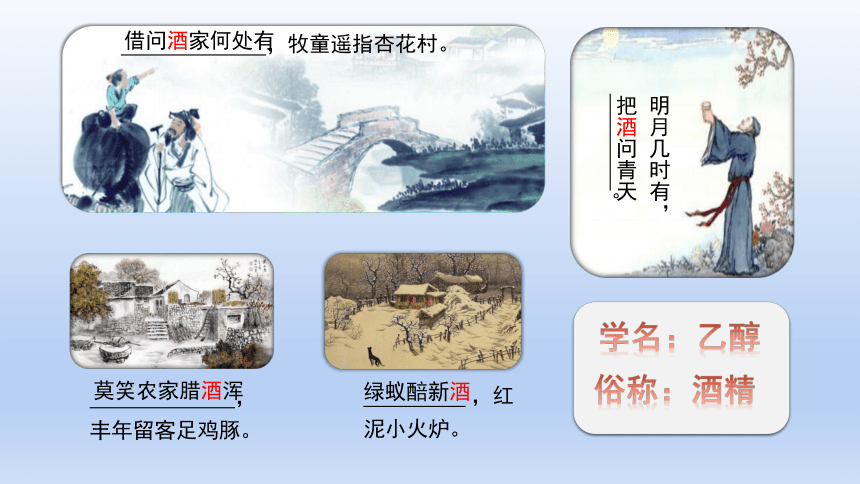
学名:乙醇
俗称:酒精
莫笑农家腊酒浑
绿蚁醅新酒
,丰年留客足鸡豚。
,红泥小火炉。
借问酒家何处有
,牧童遥指杏花村。
。
明月几时有,
把酒问青天
乙醇的组成与结构
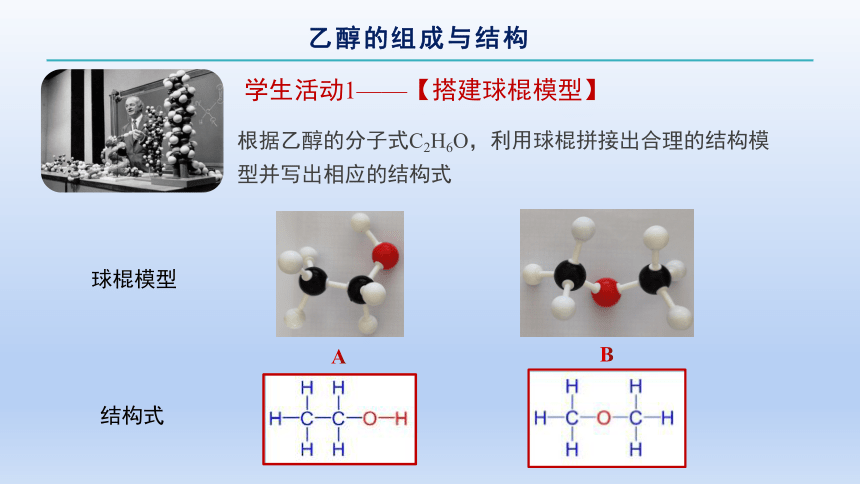
学生活动1——【搭建球棍模型】
A
B
球棍模型
结构式
根据乙醇的分子式C2H6O,利用球棍拼接出合理的结构模型并写出相应的结构式
乙醇的结构
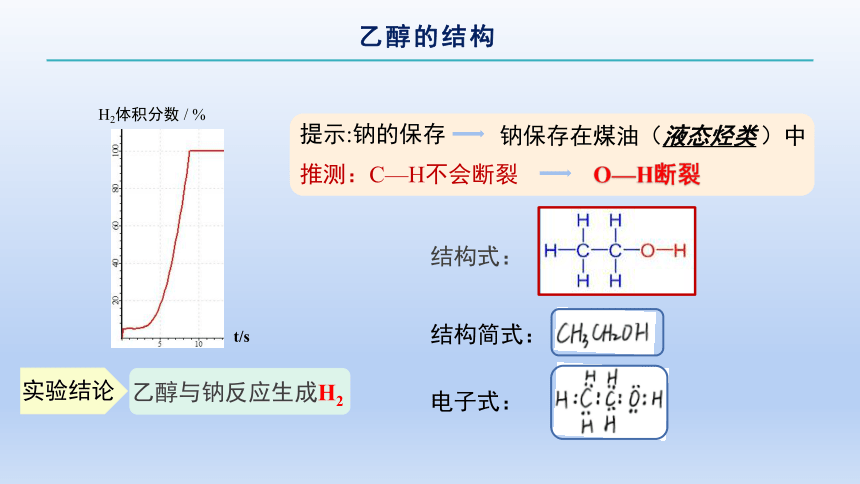
学生活动2——【实验探究】:乙醇与钠反应
钠沉于试管底部又上浮,未熔化,同时大量气泡冒出,电脑上显示的数字由0增至100%
实验操作
在盛有少量无水乙醇的试管中加一小块钠,并将氢气传感器置于试管口
实验现象
乙醇的结构
提示:钠的保存
O—H断裂
推测:C—H不会断裂
结构式:
钠保存在煤油(液态烃类 )中
结构简式:
t/s
H2体积分数 / %
乙醇与钠反应生成H2
电子式:
实验结论
烃的衍生物和官能团
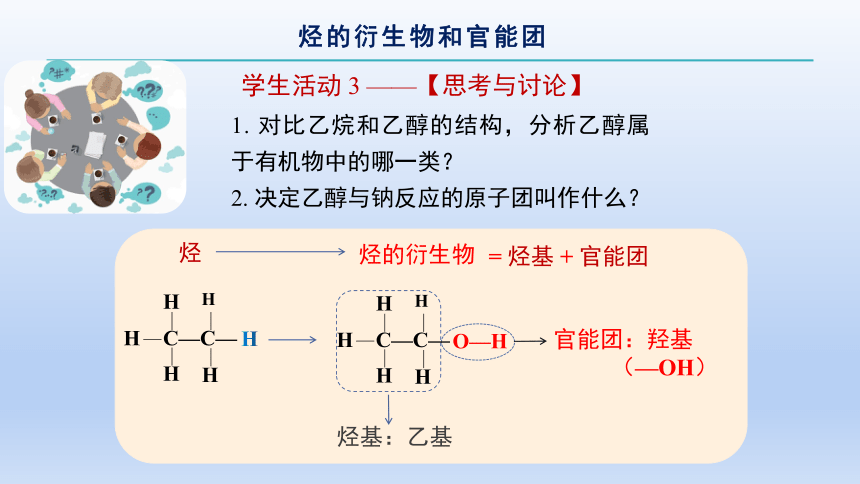
1. 对比乙烷和乙醇的结构,分析乙醇属于有机物中的哪一类?
2. 决定乙醇与钠反应的原子团叫作什么?
烃的衍生物
C—C—
H
H
H
H
H
烃基:乙基
官能团:羟基
(—OH)
学生活动 3 ——【思考与讨论】
O—H
H
C—C—
H
H
H
H
H
烃
= 烃基 + 官能团
1.置换反应
化学方程式:_______________________________________
反应类型:____________
比较钠与乙醇和水反应的剧烈程度,并说明原因:__________________________________________
____________________________
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
置换反应
钠与乙醇反应缓和一些,因为乙醇羟基中的氢原子不如水中的氢原子活泼
学生活动 4 ——【归纳与总结】
乙醇的化学性质
2. 氧化反应
(1)燃烧反应
化学方程式:_____________________________
现象:_________________________________
C2H5OH + 3O2 → 2CO2 + 3H2O
点燃
产生淡蓝色火焰,同时放出大量热
乙醇的化学性质
如何使铜制品焊接处光亮如初?
向试管中加入少量乙醇,将铜丝在酒精灯上灼烧后插入乙醇,反复几次。
学生活动 5 ——【实验探究】
实验操作
乙醇的化学性质
加热
插入乙醇
实验现象
红色铜丝
又变红,产生刺激性气味
变黑
实验结论
2Cu + O2 === 2CuO
△
C2H5OH+CuO CH3CHO+H2O+Cu
△
乙醇的化学性质
乙醇的化学性质
O2
Cu
CuO
+ H2O
CH3—C—O—H
H
H
CH3—C—H
O
催化剂
2
2
2
Cu或Ag
乙醇在人体内的变化
乙醛脱氢酶
肝酶代谢
CO2+H2O
乙酸
乙醛
酒精
乙醇脱氢酶
喝酒的危害
酒精性肝病、肝硬化、血管硬化
神经功能受损、中枢神经抑制
酒精过敏、中毒
CH3CH2OH
KMnO4(H+) 或
K2Cr2O7 (H+)
CH3COOH(乙酸)
2. 氧化反应
(3)乙醇与强氧化剂反应
乙醇的化学性质
电化学酒精测试仪
燃料电池装置 + 电化学传感器
CH3CH2OH
Cr3+
K2Cr2O7 (H+)
生活中的乙醇
小结
与水互溶飘清香、钠粒投入放氢气、
氧化成醛铜帮忙、橙红遇酒显灰绿
课堂检测
2.决定乙醇主要化学性质的原子或原子团是( )
A.羟基 B.乙基(—CH2CH3)
C.氢氧根离子 D.氢离子
1. 下列方法中可以证明乙醇分子中羟基上的氢原子与其他氢原子不同的是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以制饮料
C.1 mol乙醇跟足量的Na作用得0.5 mol H2
D.1 mol乙醇可生成1 mol乙醛
3. 如图所示装置,持续通入X气体,可以看到a处有红色物质生成,b处变成蓝色,c处得到液体,则X气体是( )
A.H2 B.CO和H2
C.NH3 D.CH3CH2OH(气)
4. 交警检查司机是否饮酒的原理:橙色的酸性K2Cr2O7溶液遇到呼出的乙醇蒸气时迅速变绿(Cr3+)。下列对乙醇的描述与此原理有关的是( )
①乙醇易挥发 ②乙醇的密度比水的小 ③乙醇具有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
课堂检测
5. CH3CH2OH的官能团是—OH,含有—OH的物质具有与乙醇相似的化学性质,在Cu或Ag的催化下,下列物质不能与O2发生催化氧化反应的是( )
A.CH3CH2CH2OH B.CH3OH
C. D.
课堂检测
参考答案:C A D C D
高中化学人教版必修第二册
第七章 第三节 第一课时
《乙醇》
学名:乙醇
俗称:酒精
莫笑农家腊酒浑
绿蚁醅新酒
,丰年留客足鸡豚。
,红泥小火炉。
借问酒家何处有
,牧童遥指杏花村。
。
明月几时有,
把酒问青天
乙醇的组成与结构
学生活动1——【搭建球棍模型】
A
B
球棍模型
结构式
根据乙醇的分子式C2H6O,利用球棍拼接出合理的结构模型并写出相应的结构式
乙醇的结构
学生活动2——【实验探究】:乙醇与钠反应
钠沉于试管底部又上浮,未熔化,同时大量气泡冒出,电脑上显示的数字由0增至100%
实验操作
在盛有少量无水乙醇的试管中加一小块钠,并将氢气传感器置于试管口
实验现象
乙醇的结构
提示:钠的保存
O—H断裂
推测:C—H不会断裂
结构式:
钠保存在煤油(液态烃类 )中
结构简式:
t/s
H2体积分数 / %
乙醇与钠反应生成H2
电子式:
实验结论
烃的衍生物和官能团
1. 对比乙烷和乙醇的结构,分析乙醇属于有机物中的哪一类?
2. 决定乙醇与钠反应的原子团叫作什么?
烃的衍生物
C—C—
H
H
H
H
H
烃基:乙基
官能团:羟基
(—OH)
学生活动 3 ——【思考与讨论】
O—H
H
C—C—
H
H
H
H
H
烃
= 烃基 + 官能团
1.置换反应
化学方程式:_______________________________________
反应类型:____________
比较钠与乙醇和水反应的剧烈程度,并说明原因:__________________________________________
____________________________
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
置换反应
钠与乙醇反应缓和一些,因为乙醇羟基中的氢原子不如水中的氢原子活泼
学生活动 4 ——【归纳与总结】
乙醇的化学性质
2. 氧化反应
(1)燃烧反应
化学方程式:_____________________________
现象:_________________________________
C2H5OH + 3O2 → 2CO2 + 3H2O
点燃
产生淡蓝色火焰,同时放出大量热
乙醇的化学性质
如何使铜制品焊接处光亮如初?
向试管中加入少量乙醇,将铜丝在酒精灯上灼烧后插入乙醇,反复几次。
学生活动 5 ——【实验探究】
实验操作
乙醇的化学性质
加热
插入乙醇
实验现象
红色铜丝
又变红,产生刺激性气味
变黑
实验结论
2Cu + O2 === 2CuO
△
C2H5OH+CuO CH3CHO+H2O+Cu
△
乙醇的化学性质
乙醇的化学性质
O2
Cu
CuO
+ H2O
CH3—C—O—H
H
H
CH3—C—H
O
催化剂
2
2
2
Cu或Ag
乙醇在人体内的变化
乙醛脱氢酶
肝酶代谢
CO2+H2O
乙酸
乙醛
酒精
乙醇脱氢酶
喝酒的危害
酒精性肝病、肝硬化、血管硬化
神经功能受损、中枢神经抑制
酒精过敏、中毒
CH3CH2OH
KMnO4(H+) 或
K2Cr2O7 (H+)
CH3COOH(乙酸)
2. 氧化反应
(3)乙醇与强氧化剂反应
乙醇的化学性质
电化学酒精测试仪
燃料电池装置 + 电化学传感器
CH3CH2OH
Cr3+
K2Cr2O7 (H+)
生活中的乙醇
小结
与水互溶飘清香、钠粒投入放氢气、
氧化成醛铜帮忙、橙红遇酒显灰绿
课堂检测
2.决定乙醇主要化学性质的原子或原子团是( )
A.羟基 B.乙基(—CH2CH3)
C.氢氧根离子 D.氢离子
1. 下列方法中可以证明乙醇分子中羟基上的氢原子与其他氢原子不同的是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以制饮料
C.1 mol乙醇跟足量的Na作用得0.5 mol H2
D.1 mol乙醇可生成1 mol乙醛
3. 如图所示装置,持续通入X气体,可以看到a处有红色物质生成,b处变成蓝色,c处得到液体,则X气体是( )
A.H2 B.CO和H2
C.NH3 D.CH3CH2OH(气)
4. 交警检查司机是否饮酒的原理:橙色的酸性K2Cr2O7溶液遇到呼出的乙醇蒸气时迅速变绿(Cr3+)。下列对乙醇的描述与此原理有关的是( )
①乙醇易挥发 ②乙醇的密度比水的小 ③乙醇具有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
课堂检测
5. CH3CH2OH的官能团是—OH,含有—OH的物质具有与乙醇相似的化学性质,在Cu或Ag的催化下,下列物质不能与O2发生催化氧化反应的是( )
A.CH3CH2CH2OH B.CH3OH
C. D.
课堂检测
参考答案:C A D C D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
