鲁科版(2019)必修第二册 3.1.1认识有机化合物的一般性质 碳原子的成键特点课件(共90张PPT)
文档属性
| 名称 | 鲁科版(2019)必修第二册 3.1.1认识有机化合物的一般性质 碳原子的成键特点课件(共90张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 840.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-18 08:30:00 | ||
图片预览











文档简介
(共90张PPT)
第3章 简单的有机化合物
第1节 认识有机化合物
第1课时 认识有机化合物的一般性质
碳原子的成键特点
一、认识有机化合物的一般性质
1.定义:大多数含有_______的化合物。
碳元素
【做一做】
下列化合物中属于有机物的是_________;属于无机物
的是_____。
①甲烷;②聚氯乙烯;③淀粉;④碳酸钙;⑤醋酸;
⑥纯碱。
①②③⑤
④⑥
2.性质
(1)一般共性
①大多数熔点较低,常温下为液态或固态。
②大多数难溶于水,易溶于有机溶剂。
③大多数受热易分解,而且易燃烧。
(2)差异
①挥发性:如乙醇、苯等易挥发,而甘油等难挥发。
②溶解性:大多数难溶于水,但乙醇、乙酸等易溶于水。
③热稳定性:大多数受热易分解,但酚醛树脂等具有较强的热稳定性。
④特征性质:许多有机化合物具有一定的特性,如乙醇能使酸性KMnO4溶液褪色。
【巧判断】
(1)含有碳元素的物质一定是有机物。 ( )
提示:×。碳单质、碳的氧化物和碳酸盐等都不属于有机物。
(2)大多数有机物的熔沸点较低。 ( )
提示:√。大多数有机物都是由分子构成,熔沸点比较低。
(3)有机物都不溶于水。 ( )
提示:×。多数有机物水溶性较差,但是部分有机物(如乙醇、乙酸等)易溶于水。
【微思考】
有机物只能从动植物等有机体中获得吗
提示:不一定。早先人们已知的有机物都从动植物等有机体中取得,后来科学家们先后用无机物人工合成许多有机物,如尿素[CO(NH2)2]、醋酸(CH3COOH)、脂肪等,随着有机化学的发展,大量的有机物被合成出来。
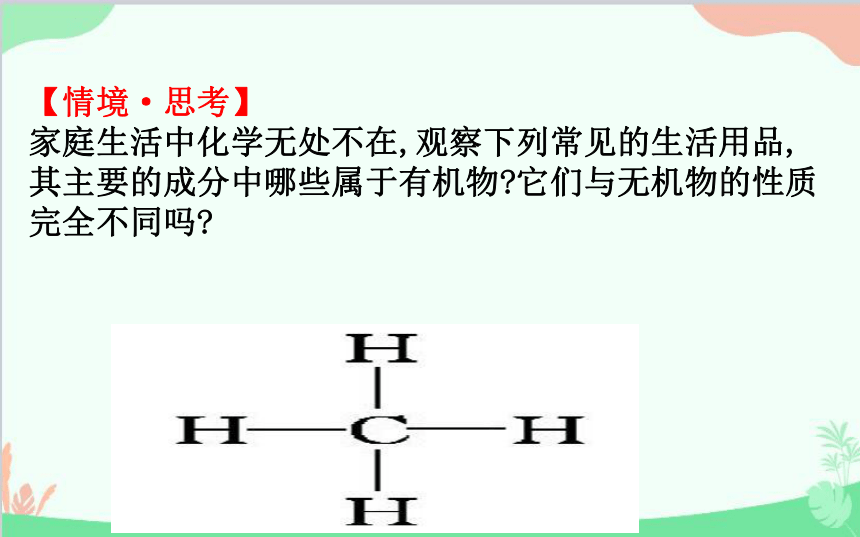
【情境·思考】
家庭生活中化学无处不在,观察下列常见的生活用品,其主要的成分中哪些属于有机物 它们与无机物的性质完全不同吗
提示:医用酒精中的乙醇、食醋中的醋酸以及花生油都属于有机物,医用酒精和食醋中的水以及纯碱属于无机物。有机物与无机物的性质既有相同点也有不同点,如乙醇、醋酸与纯碱都易溶于水,但是花生油难溶于水;乙醇、花生油容易燃烧,而纯碱不能燃烧。
二、认识有机化合物的结构特点
1.有机化合物中碳原子的成键特点
(1)烃:
仅由___、___两种元素组成的有机化合物,又叫
___________。___是组成最简单的烃。
碳
氢
碳氢化合物
CH4
(2)几种烃的组成和结构
甲烷 乙烯 乙炔
结构式
H—C≡C—H
结构简式 CH4 CH2=CH2 CH≡CH
官能团 碳碳双键 碳碳三键
甲烷 乙烯 乙炔
球棍模型
填充模型
分子构型 正四面体 平面形 直线形
2.有机化合物的结构特点
碳原子成键特点 碳原子连接方式的多样性
成键原子的多样性 成键个数的多样性 成键方式的多样性
碳原子除与碳
原子之间成键
外也可以与
_____________
等其他元素原
子形成共价键 每个碳
原子形
成__个
共价键 单键
(_________)
双键
(_________)
三键
(—C≡C—) 碳原子之
间可以构
成_____
或_____
卤素、氧、氮
4
碳链
碳环
【想一想】分析下列化学式及结构式中原子间的成键情况是否合理。
提示:(1)合理。因为C、N、H原子均符合成键情况,C形成4个共价键,N形成3个共价键,H形成1个共价键。
(2)不合理。因为C、Si属于同主族元素,均应形成4个共价键。
(3)合理。因为C、O、S、H原子均符合成键情况,C形成4个共价键,O、S均形成2个共价键,H形成1个共价键。
(4)合理。因为C、S、H原子均符合成键情况,C形成4个共价键,S形成2个共价键,H形成1个共价键。
3.同系物
(1)概念:_____相似,在分子组成上相差一个或若干个
___原子团的有机化合物互称为同系物。
(2)实例:碳原子个数不同的烷烃互为同系物,如CH4与
____、C3H8等互为同系物。
结构
CH2
C2H6
4.烷烃
(1)概念:碳原子之间都以_____结合成_____,碳原子
的剩余价键均与_______结合,这样的烃称为烷烃,
也叫作饱和链烃。
(2)分子通式:_____________________。
单键
碳链
氢原子
CnH2n+2(n≥1且n为整数)
【巧判断】
(1)含有碳、氢元素的有机物一定是烃。 ( )
提示:×。只含有碳、氢两种元素的有机物属于烃。
(2)分子式为C4H10的有机物属于烷烃。 ( )
提示:√。分子组成符合CnH2n+2的烃一定是烷烃。
知识点一 有机化合物和无机化合物性质的比较
【重点释疑】
有机化合物 无机化合物
结构 大多数有机化合物只含共价键 有些含离子键,有些含共价键或同时含离子键和共价键
溶解
性 多数不溶于水,易溶于汽油、酒精等有机溶剂 多数溶于水,而难溶于有机溶剂
有机化合物 无机化合物
耐热性 多数不耐热,熔点较低(一般低于400 ℃) 多数耐热,熔点较高
可燃性 多数能燃烧 多数不能燃烧
化合物
类型 多数为共价化合物,多数属于非电解质 有离子化合物,也有共价化合物,多数(如酸、碱、盐等)属于电解质
有机化合物 无机化合物
反应
特点 一般比较复杂,副反应多,反应速率慢,方程式一般用“→”连接 一般比较简单,副反应少,反应速率快,方程式一般用“====”连接
【易错提醒】有机物中的“大多数”
有机化合物的性质是指大多数有机物的性质,并不是绝对的。
(1)大多数有机物难溶于水,但乙醇、乙酸(醋酸)等易溶于水。
(2)大多数有机物可以燃烧,但CCl4却能灭火。
(3)大多数有机物为非电解质,但醋酸及其盐在溶液中能够发生电离。
(4)大多数有机反应进行得很慢,但一些有机炸药爆炸是在瞬间完成的。
【思考·讨论】
(1)书写有机化学方程式时用“→”,是因为有机化学反应不遵循质量守恒定律吗
提示:不是。有机化学方程式不用“====”而用“→”,是因为一般有机反应副反应多,反应慢,但仍遵循质量守恒定律。
(2)有机物易溶于有机溶剂,易溶于有机溶剂的物质一定是有机物吗
提示:不一定。一些物质(如单质溴、单质碘等)也易溶于有机溶剂,但它们都不属于有机物。
【案例示范】
【典例】(2019·滁州高一检测)下列关于有机物的说法正确的是 ( )
A.有机物大多数易溶于水
B.有机物只含有碳、氢两种元素
C.含碳元素的化合物不一定属于有机物
D.有机物都易燃烧
【解题指南】解答本题时应注意以下两点:
(1)有机化合物一定含有碳元素,但是有些无机物也含有碳元素。
(2)有机化合物的一般通性中有很多特例。
【解析】选C。大多数有机物难溶于水,A错误;有机物除含有碳元素外,还可能含有氢、氧、氮、硫等元素,B错误;含碳元素的还有单质、碳的氧化物等,这些物质不属于有机物,C正确;有的有机物是灭火剂,如CCl4,D错误。
【迁移·应用】
(2019·北师大附中高一检测)下列有关有机物的说法中,正确的是 ( )
A.有机物都是从有机体中分离出来的物质
B.有机物都是共价化合物
C.有机物不一定都难溶于水
D.有机物不具备无机物的性质
【解析】选C。很多有机物可以合成出来,A不正确;有机物分子中各原子大都以共价键结合,为共价化合物,但也有形成离子键的离子化合物,如CH3COONa、CH3COONH4等,B不正确;有机物大多数不溶于水,但也有易溶于水的,如乙醇、乙酸、葡萄糖等,C正确;有机物与无机物性质差别较大,但有些有机物具有某些无机物的性质,如乙酸(CH3COOH)具有酸性等,D不正确。
知识点二 有机化合物组成和结构的表示方法
【要点释疑】
种类 实 例 含 义 应用范围
分子式 C2H6 用元素符号表示物质分子组成的式子,可反映出一个分子中原子的种类和数目 多用于研究物质组成
种类 实 例 含 义 应用范围
最简式
(实验式) CH3 表示组成物质的各元素原子最简整数比的式子 有共同组成的物质
电子式 用“·”或“×”表示原子最外层电子成键情况的式子 多用于表示离子型、共价型的物质
种类 实 例 含 义 应用范围
结构式 ①用短线“—”表示原子所形成的共价键,能反映物质的结构
②能表示分子中原子的结构或排列顺序,但不能表示空间构型 ①多用于研究有机物的性质
②由于能反映有机物的结构,有机反应常用结构式表示
种类 实 例 含 义 应用范围
结构
简式 CH3—CH3 结构式中省略部分短线“—”,着重突出结构特点 同“结构式”
球棍
模型
小球表示原子,短棍表示共价键 表示分子内各原子在空间的相对位置和立体构型
种类 实 例 含 义 应用范围
填充
模型 用不同体积的小球表示不同原子的大小 能表示分子内各成键原子的相对大小和结合顺序
【规律方法】
正确认识有机化合物组成和结构的表示方法
(1)注意区分电子式和结构式之间的关系。电子式是书写结构式的基础,只有会书写电子式才会书写结构式。
(2)注意结构式和结构简式的关系。结构简式是在结构式的基础之上省略部分价键或者将所有价键均省略的情况。
(3)分子式的最简整数比即为最简式。
(4)填充模型(比例模型)最能体现分子的真实结构。
【思考·讨论】
(1)根据甲烷结构式 可确定甲烷分子中C—H键的夹角为90°吗 为什么
提示:不能。有机物的结构简式只能表明原子间的成键方式,与空间构型无关,甲烷分子为空间正四面体结构,而不是平面正方形结构。
(2)结构式只能表示有机物吗
提示:不一定。无机物也可以用结构式来表示,如二氧化碳:O=C=O。
【案例示范】
【典例】(2019·嘉兴高一检测)下列各项中,表达正确的是 ( )
A.乙烯的结构简式:CH2CH2
B.C2H2分子的结构式:CH≡CH
C.乙烷的最简式:CH3
D. 甲烷为平面正方形结构,其结构式为
【解题指南】解答本题注意以下两点:
(1)结构式并不能表示其真实的结构;
(2)书写结构简式时双键或三键不能省略。
【解析】选C。书写结构简式时,碳碳双键和碳碳三键不能省略,A错;书写结构式时要把所有的化学键都写出来,B错;乙烷的分子式为C2H6,因此其最简式为CH3,C正确;甲烷为正四面体结构,D错。
【母题追问】(1) 与
是否为同一种物质
提示:二者是同一种物质。因为甲烷为正四面体结构,分子中的任意两个顶点均处于相邻位置,因此两者是同一种物质。
(2)CH2Cl2的分子构型是否为正四面体结构
提示:否。由于氢原子和氯原子的半径不同,因此CH2Cl2为四面体结构,但不是正四面体结构。
【迁移·应用】
1.(2019·泰安高一检测)下列化学用语正确的
是 ( )
A.甲烷的结构式:CH4
B.乙烷的结构简式:CH3CH3
C.四氯化碳的电子式:
D.丙烷的结构简式:C3H8
【解析】选B。甲烷的结构式应为 ,A项错误;
乙烷的结构简式为CH3CH3,B项正确;CCl4的电子式应
为 ,C项错误;丙烷的结构简式应为
CH3CH2CH3,D项错误。
2.如图是CH4、CCl4、CH3Cl的分子球棍模型图。下列说法正确的是 世纪金榜导学号( )
A.CH4、CCl4和CH3Cl都是正四面体结构
B.CH4、CCl4都是正四面体结构
C.CH4和CCl4中的化学键完全相同
D.CH4、CCl4的结构相同,性质也相同
【解析】选B。甲烷、四氯化碳中各自的键的长度相等,故为正四面体,一氯甲烷中“C—H”和“C—Cl”键的长度不等,故CH3Cl不是正四面体结构。
【补偿训练】
(2019·贵港高一检测)(1)下列各图均能表示甲烷的分子结构,按要求回答下列问题:
①上述哪一种更能反映其真实存在状况________(填字母,下同)。
a.Ⅰ b.Ⅱ c.Ⅲ d.Ⅳ
②下列事实能证明甲烷分子是正四面体结构的是______。
a.CH3Cl只代表一种物质
b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质
d.CCl4只代表一种物质
(2)烃分子中的碳原子与氢原子结合的方式是________。
a.形成4对共用电子对 b.通过1个共价键
c.通过2个共价键 d.通过离子键和共价键
【解析】(1) ①这几种形式中,结构示意图、球棍模型
及填充模型均能反映甲烷分子的空间构型,但其中填充
模型更能形象地表达出H、C的位置及所占比例,电子式
只反映原子的最外层电子的成键情况。②如果甲烷是
平面正方形结构,则CH3Cl、CHCl3、CCl4都只有一种结
构,但CH2Cl2却有两种结构,一种是两个氯原子相邻,另
一种是两个氯原子处于对角关系。如果甲烷是正四面
体结构,其4个顶点的位置完全相同,它的一氯代物(CH3Cl)、二氯代物(CH2Cl2)、三氯代物(CHCl3)、四氯代物(CCl4)都只有一种结构。所以,CH2Cl2只有一种结构,可以判断CH4应为正四面体结构,而不是平面正方形结构。
(2)烃分子中碳原子与氢原子间只能形成一对共用电子对,即一个共价键。
答案:(1)①d ②b (2)b
知识点三 甲烷的取代反应
【重点释疑】
1.甲烷与氯气的取代反应
反应条件 光照时,甲烷与氯气发生平静的取代反应;若在强光直射下,两者则可能发生爆炸
反应物 甲烷能与氯气单质反应,但不能与氯水反应
反应特点 (1)“一上一下,取而代之”,用一个卤素原子代替一个氢原子,下来的氢原子与卤素原子形成卤化氢。
(2)该反应为连锁反应,即使甲烷与氯气按1∶1混合反应,得到的有机产物也不是只有一氯甲烷,而是CH3Cl、CH2Cl2、CHCl3、CCl4的混合物
反应产物 不论如何控制反应物的用量,反应产物都是CH3Cl、CH2Cl2、CHCl3和CCl4四种有机物与HCl形成的混合物,五种产物中HCl最多
物质的量
的关系 参加反应的Cl2的物质的量=生成的HCl的物质的量=有机产物中氯原子的物质的量
2.取代反应和置换反应的比较
类别 取代反应 置换反应
定义 有机物分子里的原子(或原子团)被其他原子(或原子团)所替代的反应 一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应
反应物 一种有机物和另一种化合物或单质 一种单质和一种化合物
类别 取代反应 置换反应
生成物 一般生成两种新化合物 一种化合物和一种单质
副反应 通常有副反应发生 通常没有副反应发生
反应条件 反应受催化剂、温度、光照等外界条件影响 反应一般遵循氧化还原反应的强弱规律等
实例 CH4+Cl2 CH3Cl+HCl Zn+H2SO4====ZnSO4+H2↑
光照
【思考·讨论】
(1)CH4与Cl2反应共有几种产物 根据取代反应的原理,思考能否用CH4和Cl2按1∶1的体积比混合来制取纯净的CH3Cl
提示:CH4和Cl2的反应是连锁反应,不可能只发生第一步取代反应,生成物为混合物,即CH3Cl、CH2Cl2、CHCl3和CCl4四种有机物与氯化氢形成的混合物,CH3Cl的产率低。因此不能用CH4和Cl2按1∶1的体积比混合来制取纯净的CH3Cl。
(2)CH4和Cl2取代反应的产物中物质的量最多的是什么 它与Cl2在物质的量上有什么关系
提示:因为在CH4和Cl2的取代反应中,每一步都有HCl生成,故产物中物质的量最多的是HCl。根据化学方程式可知,每生成1 mol HCl则消耗1 mol Cl2,故反应生成的HCl与反应消耗的Cl2的物质的量相等。
【案例示范】
【典例】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如图所示:
请思考:
(1)写出甲烷与氯气反应的化学方程式,并判断反应的类型。(宏观辨识与微观探析)
提示:CH4和Cl2在漫射光条件下发生如下反应:
CH4+Cl2 CH3Cl+HCl;CH4+2Cl2 CH2Cl2+2HCl;
CH4+3Cl2 CHCl3+3HCl;CH4+4Cl2 CCl4+4HCl。
反应的类型为取代反应。
光
光
光
光
(2)理论上欲获得最多的氯化氢,Cl2与CH4的体积比应控制为多少 (证据推理与模型认知)
提示:根据取代反应的特点,取代甲烷分子中的1个氢原子需要1个Cl2,因此要获得最大量的HCl,需要将甲烷分子中的所有氢原子全部取代,故Cl2与CH4的体积比应大于等于4。
(3)分析上述实验装置中B和E的作用。(科学探究与创新意识)
提示:装置B中盛有浓硫酸,因此其作用有①干燥甲烷和氯气,并使二者混合均匀;②通过观察气泡的速度可以控制甲烷和氯气的流速,以调节二者的体积比。装置中盛有水,故用于吸收反应生成的HCl气体,其中的干燥管能起到防止倒吸的作用。
(4)若D装置的石棉中均匀混有KI粉末,用化学方程式表示其作用。(科学探究与创新意识)
提示:过量的氯气进入D装置,发生反应:Cl2+2KI
====2KCl+I2,所以D装置可以吸收过量的Cl2。
【母题追问】(1)实验完成后E装置中除生成盐酸外,还含有一定量的有机物,写出此有机物的结构简式和名称,并简述怎样分离得到盐酸。(科学探究与创新意识)
提示:进入装置E的气体有HCl和CH3Cl(一氯甲烷),而CH3Cl不溶于水,与盐酸不互溶,故可用分液法将二者分离,其中的水层即为盐酸。
(2)分析此装置的缺点,并进行改进。(科学探究与创新意识)
提示:此装置没有进行尾气处理,其中尾气成分是多余的CH4和产物CH3Cl。可以在装置D与E之间增加一盛有有机溶剂的洗气瓶吸收CH4和CH3Cl。
【规律总结】与光有关的化学反应
(1)HClO见光分解:2HClO 2HCl+O2↑
(2)浓硝酸见光分解:4HNO3 4NO2↑+O2↑+2H2O
(3)氢气和氯气混合气体见光发生爆炸:
Cl2+H2 2HCl
光照
光照
光照
(4)甲烷和氯气光照时发生取代反应:
CH4+Cl2 CH3Cl+HCl
CH3Cl+Cl2 CH2Cl2+HCl
CH2Cl2+Cl2 CHCl3+HCl
CHCl3+Cl2 CCl4+HCl
光照
光照
光照
光照
【迁移·应用】
(2019·南阳高一检测)下列关于甲烷与Cl2的取代反应所得产物的说法正确的是 ( )
A.都是有机物
B.都不溶于水
C.有一种气态物质,其余均是液体
D.除一种外均是四面体结构
【解析】选D。甲烷与Cl2反应的产物中HCl不是有机物,产物中CH3Cl、HCl是气态物质,除HCl外,其余产物均为四面体结构。
【补偿训练】
(2019·济南高一检测)关于取代反应和置换反应的下列说法中,正确的是 ( )
A.取代反应和置换反应中一定都有单质生成
B.取代反应和置换反应一定都属于氧化还原反应
C.取代反应大多是可逆的,反应速率慢,而置换反应一般是单向进行的,反应速率快
D.取代反应和置换反应的产物都是唯一的,不会有多种产物并存的现象
【解析】选C。取代反应不一定有单质生成,也不一定是氧化还原反应,产物会存在多种产物并存的现象。
【课堂回眸】
第3章 简单的有机化合物
第1节 认识有机化合物
第1课时 认识有机化合物的一般性质
碳原子的成键特点
一、认识有机化合物的一般性质
1.定义:大多数含有_______的化合物。
碳元素
【做一做】
下列化合物中属于有机物的是_________;属于无机物
的是_____。
①甲烷;②聚氯乙烯;③淀粉;④碳酸钙;⑤醋酸;
⑥纯碱。
①②③⑤
④⑥
2.性质
(1)一般共性
①大多数熔点较低,常温下为液态或固态。
②大多数难溶于水,易溶于有机溶剂。
③大多数受热易分解,而且易燃烧。
(2)差异
①挥发性:如乙醇、苯等易挥发,而甘油等难挥发。
②溶解性:大多数难溶于水,但乙醇、乙酸等易溶于水。
③热稳定性:大多数受热易分解,但酚醛树脂等具有较强的热稳定性。
④特征性质:许多有机化合物具有一定的特性,如乙醇能使酸性KMnO4溶液褪色。
【巧判断】
(1)含有碳元素的物质一定是有机物。 ( )
提示:×。碳单质、碳的氧化物和碳酸盐等都不属于有机物。
(2)大多数有机物的熔沸点较低。 ( )
提示:√。大多数有机物都是由分子构成,熔沸点比较低。
(3)有机物都不溶于水。 ( )
提示:×。多数有机物水溶性较差,但是部分有机物(如乙醇、乙酸等)易溶于水。
【微思考】
有机物只能从动植物等有机体中获得吗
提示:不一定。早先人们已知的有机物都从动植物等有机体中取得,后来科学家们先后用无机物人工合成许多有机物,如尿素[CO(NH2)2]、醋酸(CH3COOH)、脂肪等,随着有机化学的发展,大量的有机物被合成出来。
【情境·思考】
家庭生活中化学无处不在,观察下列常见的生活用品,其主要的成分中哪些属于有机物 它们与无机物的性质完全不同吗
提示:医用酒精中的乙醇、食醋中的醋酸以及花生油都属于有机物,医用酒精和食醋中的水以及纯碱属于无机物。有机物与无机物的性质既有相同点也有不同点,如乙醇、醋酸与纯碱都易溶于水,但是花生油难溶于水;乙醇、花生油容易燃烧,而纯碱不能燃烧。
二、认识有机化合物的结构特点
1.有机化合物中碳原子的成键特点
(1)烃:
仅由___、___两种元素组成的有机化合物,又叫
___________。___是组成最简单的烃。
碳
氢
碳氢化合物
CH4
(2)几种烃的组成和结构
甲烷 乙烯 乙炔
结构式
H—C≡C—H
结构简式 CH4 CH2=CH2 CH≡CH
官能团 碳碳双键 碳碳三键
甲烷 乙烯 乙炔
球棍模型
填充模型
分子构型 正四面体 平面形 直线形
2.有机化合物的结构特点
碳原子成键特点 碳原子连接方式的多样性
成键原子的多样性 成键个数的多样性 成键方式的多样性
碳原子除与碳
原子之间成键
外也可以与
_____________
等其他元素原
子形成共价键 每个碳
原子形
成__个
共价键 单键
(_________)
双键
(_________)
三键
(—C≡C—) 碳原子之
间可以构
成_____
或_____
卤素、氧、氮
4
碳链
碳环
【想一想】分析下列化学式及结构式中原子间的成键情况是否合理。
提示:(1)合理。因为C、N、H原子均符合成键情况,C形成4个共价键,N形成3个共价键,H形成1个共价键。
(2)不合理。因为C、Si属于同主族元素,均应形成4个共价键。
(3)合理。因为C、O、S、H原子均符合成键情况,C形成4个共价键,O、S均形成2个共价键,H形成1个共价键。
(4)合理。因为C、S、H原子均符合成键情况,C形成4个共价键,S形成2个共价键,H形成1个共价键。
3.同系物
(1)概念:_____相似,在分子组成上相差一个或若干个
___原子团的有机化合物互称为同系物。
(2)实例:碳原子个数不同的烷烃互为同系物,如CH4与
____、C3H8等互为同系物。
结构
CH2
C2H6
4.烷烃
(1)概念:碳原子之间都以_____结合成_____,碳原子
的剩余价键均与_______结合,这样的烃称为烷烃,
也叫作饱和链烃。
(2)分子通式:_____________________。
单键
碳链
氢原子
CnH2n+2(n≥1且n为整数)
【巧判断】
(1)含有碳、氢元素的有机物一定是烃。 ( )
提示:×。只含有碳、氢两种元素的有机物属于烃。
(2)分子式为C4H10的有机物属于烷烃。 ( )
提示:√。分子组成符合CnH2n+2的烃一定是烷烃。
知识点一 有机化合物和无机化合物性质的比较
【重点释疑】
有机化合物 无机化合物
结构 大多数有机化合物只含共价键 有些含离子键,有些含共价键或同时含离子键和共价键
溶解
性 多数不溶于水,易溶于汽油、酒精等有机溶剂 多数溶于水,而难溶于有机溶剂
有机化合物 无机化合物
耐热性 多数不耐热,熔点较低(一般低于400 ℃) 多数耐热,熔点较高
可燃性 多数能燃烧 多数不能燃烧
化合物
类型 多数为共价化合物,多数属于非电解质 有离子化合物,也有共价化合物,多数(如酸、碱、盐等)属于电解质
有机化合物 无机化合物
反应
特点 一般比较复杂,副反应多,反应速率慢,方程式一般用“→”连接 一般比较简单,副反应少,反应速率快,方程式一般用“====”连接
【易错提醒】有机物中的“大多数”
有机化合物的性质是指大多数有机物的性质,并不是绝对的。
(1)大多数有机物难溶于水,但乙醇、乙酸(醋酸)等易溶于水。
(2)大多数有机物可以燃烧,但CCl4却能灭火。
(3)大多数有机物为非电解质,但醋酸及其盐在溶液中能够发生电离。
(4)大多数有机反应进行得很慢,但一些有机炸药爆炸是在瞬间完成的。
【思考·讨论】
(1)书写有机化学方程式时用“→”,是因为有机化学反应不遵循质量守恒定律吗
提示:不是。有机化学方程式不用“====”而用“→”,是因为一般有机反应副反应多,反应慢,但仍遵循质量守恒定律。
(2)有机物易溶于有机溶剂,易溶于有机溶剂的物质一定是有机物吗
提示:不一定。一些物质(如单质溴、单质碘等)也易溶于有机溶剂,但它们都不属于有机物。
【案例示范】
【典例】(2019·滁州高一检测)下列关于有机物的说法正确的是 ( )
A.有机物大多数易溶于水
B.有机物只含有碳、氢两种元素
C.含碳元素的化合物不一定属于有机物
D.有机物都易燃烧
【解题指南】解答本题时应注意以下两点:
(1)有机化合物一定含有碳元素,但是有些无机物也含有碳元素。
(2)有机化合物的一般通性中有很多特例。
【解析】选C。大多数有机物难溶于水,A错误;有机物除含有碳元素外,还可能含有氢、氧、氮、硫等元素,B错误;含碳元素的还有单质、碳的氧化物等,这些物质不属于有机物,C正确;有的有机物是灭火剂,如CCl4,D错误。
【迁移·应用】
(2019·北师大附中高一检测)下列有关有机物的说法中,正确的是 ( )
A.有机物都是从有机体中分离出来的物质
B.有机物都是共价化合物
C.有机物不一定都难溶于水
D.有机物不具备无机物的性质
【解析】选C。很多有机物可以合成出来,A不正确;有机物分子中各原子大都以共价键结合,为共价化合物,但也有形成离子键的离子化合物,如CH3COONa、CH3COONH4等,B不正确;有机物大多数不溶于水,但也有易溶于水的,如乙醇、乙酸、葡萄糖等,C正确;有机物与无机物性质差别较大,但有些有机物具有某些无机物的性质,如乙酸(CH3COOH)具有酸性等,D不正确。
知识点二 有机化合物组成和结构的表示方法
【要点释疑】
种类 实 例 含 义 应用范围
分子式 C2H6 用元素符号表示物质分子组成的式子,可反映出一个分子中原子的种类和数目 多用于研究物质组成
种类 实 例 含 义 应用范围
最简式
(实验式) CH3 表示组成物质的各元素原子最简整数比的式子 有共同组成的物质
电子式 用“·”或“×”表示原子最外层电子成键情况的式子 多用于表示离子型、共价型的物质
种类 实 例 含 义 应用范围
结构式 ①用短线“—”表示原子所形成的共价键,能反映物质的结构
②能表示分子中原子的结构或排列顺序,但不能表示空间构型 ①多用于研究有机物的性质
②由于能反映有机物的结构,有机反应常用结构式表示
种类 实 例 含 义 应用范围
结构
简式 CH3—CH3 结构式中省略部分短线“—”,着重突出结构特点 同“结构式”
球棍
模型
小球表示原子,短棍表示共价键 表示分子内各原子在空间的相对位置和立体构型
种类 实 例 含 义 应用范围
填充
模型 用不同体积的小球表示不同原子的大小 能表示分子内各成键原子的相对大小和结合顺序
【规律方法】
正确认识有机化合物组成和结构的表示方法
(1)注意区分电子式和结构式之间的关系。电子式是书写结构式的基础,只有会书写电子式才会书写结构式。
(2)注意结构式和结构简式的关系。结构简式是在结构式的基础之上省略部分价键或者将所有价键均省略的情况。
(3)分子式的最简整数比即为最简式。
(4)填充模型(比例模型)最能体现分子的真实结构。
【思考·讨论】
(1)根据甲烷结构式 可确定甲烷分子中C—H键的夹角为90°吗 为什么
提示:不能。有机物的结构简式只能表明原子间的成键方式,与空间构型无关,甲烷分子为空间正四面体结构,而不是平面正方形结构。
(2)结构式只能表示有机物吗
提示:不一定。无机物也可以用结构式来表示,如二氧化碳:O=C=O。
【案例示范】
【典例】(2019·嘉兴高一检测)下列各项中,表达正确的是 ( )
A.乙烯的结构简式:CH2CH2
B.C2H2分子的结构式:CH≡CH
C.乙烷的最简式:CH3
D. 甲烷为平面正方形结构,其结构式为
【解题指南】解答本题注意以下两点:
(1)结构式并不能表示其真实的结构;
(2)书写结构简式时双键或三键不能省略。
【解析】选C。书写结构简式时,碳碳双键和碳碳三键不能省略,A错;书写结构式时要把所有的化学键都写出来,B错;乙烷的分子式为C2H6,因此其最简式为CH3,C正确;甲烷为正四面体结构,D错。
【母题追问】(1) 与
是否为同一种物质
提示:二者是同一种物质。因为甲烷为正四面体结构,分子中的任意两个顶点均处于相邻位置,因此两者是同一种物质。
(2)CH2Cl2的分子构型是否为正四面体结构
提示:否。由于氢原子和氯原子的半径不同,因此CH2Cl2为四面体结构,但不是正四面体结构。
【迁移·应用】
1.(2019·泰安高一检测)下列化学用语正确的
是 ( )
A.甲烷的结构式:CH4
B.乙烷的结构简式:CH3CH3
C.四氯化碳的电子式:
D.丙烷的结构简式:C3H8
【解析】选B。甲烷的结构式应为 ,A项错误;
乙烷的结构简式为CH3CH3,B项正确;CCl4的电子式应
为 ,C项错误;丙烷的结构简式应为
CH3CH2CH3,D项错误。
2.如图是CH4、CCl4、CH3Cl的分子球棍模型图。下列说法正确的是 世纪金榜导学号( )
A.CH4、CCl4和CH3Cl都是正四面体结构
B.CH4、CCl4都是正四面体结构
C.CH4和CCl4中的化学键完全相同
D.CH4、CCl4的结构相同,性质也相同
【解析】选B。甲烷、四氯化碳中各自的键的长度相等,故为正四面体,一氯甲烷中“C—H”和“C—Cl”键的长度不等,故CH3Cl不是正四面体结构。
【补偿训练】
(2019·贵港高一检测)(1)下列各图均能表示甲烷的分子结构,按要求回答下列问题:
①上述哪一种更能反映其真实存在状况________(填字母,下同)。
a.Ⅰ b.Ⅱ c.Ⅲ d.Ⅳ
②下列事实能证明甲烷分子是正四面体结构的是______。
a.CH3Cl只代表一种物质
b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质
d.CCl4只代表一种物质
(2)烃分子中的碳原子与氢原子结合的方式是________。
a.形成4对共用电子对 b.通过1个共价键
c.通过2个共价键 d.通过离子键和共价键
【解析】(1) ①这几种形式中,结构示意图、球棍模型
及填充模型均能反映甲烷分子的空间构型,但其中填充
模型更能形象地表达出H、C的位置及所占比例,电子式
只反映原子的最外层电子的成键情况。②如果甲烷是
平面正方形结构,则CH3Cl、CHCl3、CCl4都只有一种结
构,但CH2Cl2却有两种结构,一种是两个氯原子相邻,另
一种是两个氯原子处于对角关系。如果甲烷是正四面
体结构,其4个顶点的位置完全相同,它的一氯代物(CH3Cl)、二氯代物(CH2Cl2)、三氯代物(CHCl3)、四氯代物(CCl4)都只有一种结构。所以,CH2Cl2只有一种结构,可以判断CH4应为正四面体结构,而不是平面正方形结构。
(2)烃分子中碳原子与氢原子间只能形成一对共用电子对,即一个共价键。
答案:(1)①d ②b (2)b
知识点三 甲烷的取代反应
【重点释疑】
1.甲烷与氯气的取代反应
反应条件 光照时,甲烷与氯气发生平静的取代反应;若在强光直射下,两者则可能发生爆炸
反应物 甲烷能与氯气单质反应,但不能与氯水反应
反应特点 (1)“一上一下,取而代之”,用一个卤素原子代替一个氢原子,下来的氢原子与卤素原子形成卤化氢。
(2)该反应为连锁反应,即使甲烷与氯气按1∶1混合反应,得到的有机产物也不是只有一氯甲烷,而是CH3Cl、CH2Cl2、CHCl3、CCl4的混合物
反应产物 不论如何控制反应物的用量,反应产物都是CH3Cl、CH2Cl2、CHCl3和CCl4四种有机物与HCl形成的混合物,五种产物中HCl最多
物质的量
的关系 参加反应的Cl2的物质的量=生成的HCl的物质的量=有机产物中氯原子的物质的量
2.取代反应和置换反应的比较
类别 取代反应 置换反应
定义 有机物分子里的原子(或原子团)被其他原子(或原子团)所替代的反应 一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应
反应物 一种有机物和另一种化合物或单质 一种单质和一种化合物
类别 取代反应 置换反应
生成物 一般生成两种新化合物 一种化合物和一种单质
副反应 通常有副反应发生 通常没有副反应发生
反应条件 反应受催化剂、温度、光照等外界条件影响 反应一般遵循氧化还原反应的强弱规律等
实例 CH4+Cl2 CH3Cl+HCl Zn+H2SO4====ZnSO4+H2↑
光照
【思考·讨论】
(1)CH4与Cl2反应共有几种产物 根据取代反应的原理,思考能否用CH4和Cl2按1∶1的体积比混合来制取纯净的CH3Cl
提示:CH4和Cl2的反应是连锁反应,不可能只发生第一步取代反应,生成物为混合物,即CH3Cl、CH2Cl2、CHCl3和CCl4四种有机物与氯化氢形成的混合物,CH3Cl的产率低。因此不能用CH4和Cl2按1∶1的体积比混合来制取纯净的CH3Cl。
(2)CH4和Cl2取代反应的产物中物质的量最多的是什么 它与Cl2在物质的量上有什么关系
提示:因为在CH4和Cl2的取代反应中,每一步都有HCl生成,故产物中物质的量最多的是HCl。根据化学方程式可知,每生成1 mol HCl则消耗1 mol Cl2,故反应生成的HCl与反应消耗的Cl2的物质的量相等。
【案例示范】
【典例】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如图所示:
请思考:
(1)写出甲烷与氯气反应的化学方程式,并判断反应的类型。(宏观辨识与微观探析)
提示:CH4和Cl2在漫射光条件下发生如下反应:
CH4+Cl2 CH3Cl+HCl;CH4+2Cl2 CH2Cl2+2HCl;
CH4+3Cl2 CHCl3+3HCl;CH4+4Cl2 CCl4+4HCl。
反应的类型为取代反应。
光
光
光
光
(2)理论上欲获得最多的氯化氢,Cl2与CH4的体积比应控制为多少 (证据推理与模型认知)
提示:根据取代反应的特点,取代甲烷分子中的1个氢原子需要1个Cl2,因此要获得最大量的HCl,需要将甲烷分子中的所有氢原子全部取代,故Cl2与CH4的体积比应大于等于4。
(3)分析上述实验装置中B和E的作用。(科学探究与创新意识)
提示:装置B中盛有浓硫酸,因此其作用有①干燥甲烷和氯气,并使二者混合均匀;②通过观察气泡的速度可以控制甲烷和氯气的流速,以调节二者的体积比。装置中盛有水,故用于吸收反应生成的HCl气体,其中的干燥管能起到防止倒吸的作用。
(4)若D装置的石棉中均匀混有KI粉末,用化学方程式表示其作用。(科学探究与创新意识)
提示:过量的氯气进入D装置,发生反应:Cl2+2KI
====2KCl+I2,所以D装置可以吸收过量的Cl2。
【母题追问】(1)实验完成后E装置中除生成盐酸外,还含有一定量的有机物,写出此有机物的结构简式和名称,并简述怎样分离得到盐酸。(科学探究与创新意识)
提示:进入装置E的气体有HCl和CH3Cl(一氯甲烷),而CH3Cl不溶于水,与盐酸不互溶,故可用分液法将二者分离,其中的水层即为盐酸。
(2)分析此装置的缺点,并进行改进。(科学探究与创新意识)
提示:此装置没有进行尾气处理,其中尾气成分是多余的CH4和产物CH3Cl。可以在装置D与E之间增加一盛有有机溶剂的洗气瓶吸收CH4和CH3Cl。
【规律总结】与光有关的化学反应
(1)HClO见光分解:2HClO 2HCl+O2↑
(2)浓硝酸见光分解:4HNO3 4NO2↑+O2↑+2H2O
(3)氢气和氯气混合气体见光发生爆炸:
Cl2+H2 2HCl
光照
光照
光照
(4)甲烷和氯气光照时发生取代反应:
CH4+Cl2 CH3Cl+HCl
CH3Cl+Cl2 CH2Cl2+HCl
CH2Cl2+Cl2 CHCl3+HCl
CHCl3+Cl2 CCl4+HCl
光照
光照
光照
光照
【迁移·应用】
(2019·南阳高一检测)下列关于甲烷与Cl2的取代反应所得产物的说法正确的是 ( )
A.都是有机物
B.都不溶于水
C.有一种气态物质,其余均是液体
D.除一种外均是四面体结构
【解析】选D。甲烷与Cl2反应的产物中HCl不是有机物,产物中CH3Cl、HCl是气态物质,除HCl外,其余产物均为四面体结构。
【补偿训练】
(2019·济南高一检测)关于取代反应和置换反应的下列说法中,正确的是 ( )
A.取代反应和置换反应中一定都有单质生成
B.取代反应和置换反应一定都属于氧化还原反应
C.取代反应大多是可逆的,反应速率慢,而置换反应一般是单向进行的,反应速率快
D.取代反应和置换反应的产物都是唯一的,不会有多种产物并存的现象
【解析】选C。取代反应不一定有单质生成,也不一定是氧化还原反应,产物会存在多种产物并存的现象。
【课堂回眸】
