【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第一章 第一节 第1课时 化学反应与能量变化(37张PPT)
文档属性
| 名称 | 【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第一章 第一节 第1课时 化学反应与能量变化(37张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-07-29 00:00:00 | ||
图片预览











文档简介
课件37张PPT。第一章 化学反应与能量
第一节 化学反应与能量的变化
第1课时 化学反应与能量变化
栏目链接1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化,同时了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义并能正确书写热化学方程式。
4.认识化学反应过程中同时存在着物质和能量的变化,能量的多少取决于反应物和生成物的质量,反应过程中能量守恒。 栏目链接 栏目链接要点一 焓变、反应热
1.焓
焓是与物质的_______有关的物理量。符号:_______。
2.焓变
(1)定义:________物与________物的焓值差。
(2)符号:________。
(3)常用单位:________(或________)。内能 H生成反应ΔHkJ/molkJ·mol-1 栏目链接(4)与反应热的关系:
________条件下,反应的热效应等于________。因此,我们常用________表示反应热。
(5)焓变(ΔH)的正负与吸热、放热反应的关系:
若为放热反应,ΔH________0(填“>”或“<”),即ΔH为________(填“+”或“-”)。
若为吸热反应,ΔH________0(填“>”或“<”),即ΔH为________(填“+”或“-”)。
恒压焓变 ΔH <->+ 栏目链接3.放热、吸热反应
(1)放热反应:反应完成时,生成物释放的总能量________反应物吸收的总能量的反应。由于反应后放出热量(释放给环境)能使反应体系的能量________,故ΔH____0(填“<”或“>”),即ΔH为________(填“+”或“-”)。
(2)吸热反应:反应完成时,生成物释放的总能量________反应物吸收的总能量的反应。由于反应时吸收环境能量而使反应体系的能量________,故ΔH________0(填“<”或“>”),即ΔH为________(填“+”或“-”)。大于降低< - 小于升高>+ 栏目链接应用
思考1.浓硫酸溶于水放出热量,是放热反应吗?NH4NO3晶体溶于水吸收热量,是吸热反应吗?提示:放热(吸热)反应是指放出(吸收)热量的化学反应,而浓H2SO4溶于水是浓溶液的稀释过程,NH4NO3溶于水是溶解过程,没有新物质生成,都不是化学反应,故浓硫酸溶于水不是放热反应,NH4NO3晶体溶于水不是吸热反应。 栏目链接2.任何化学反应都有反应热吗?为什么?提示:任何化学反应都有反应热。这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。 栏目链接综合
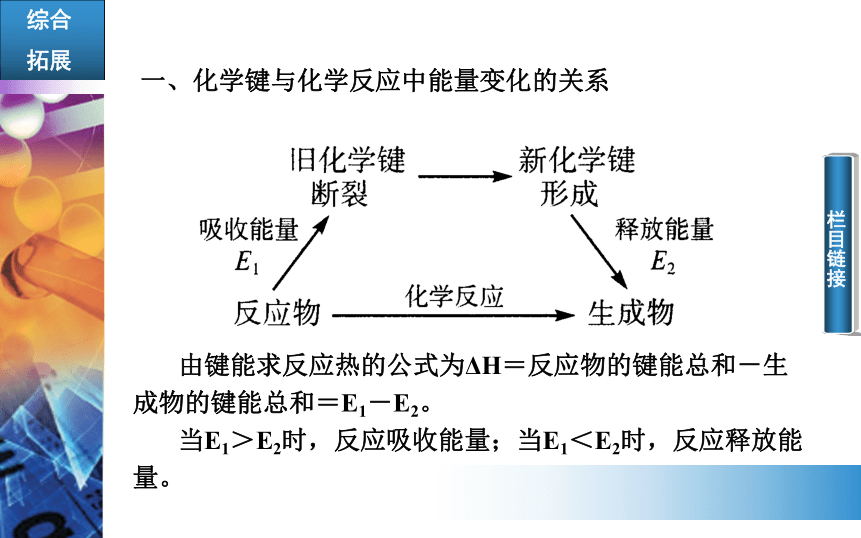
拓展一、化学键与化学反应中能量变化的关系
由键能求反应热的公式为ΔH=反应物的键能总和-生成物的键能总和=E1-E2。
当E1>E2时,反应吸收能量;当E1<E2时,反应释放能量。
栏目链接二、放热反应与吸热反应比较 栏目链接 ?特别提示:①化学反应表现为吸热或放热与反应开始是否需要加热无关,需要加热的反应不一定是吸热反应(如
C+O2====CO2),不需要加热的反应也不一定是放热反应。
②浓硫酸稀释、NaOH固体溶于水放热;NH4NO3溶于水吸热。因不是化学反应,其放出或吸收的热量不是反应热。
③通过反应放热或吸热,可比较反应物和生成物的相对稳定性。 栏目链接点燃尝试
应用1.(2014·珠海高二期末考)下列属于吸热反应的是( )
A.铝粉与氧化铁粉末反应
B.乙醇燃烧
C.碳酸钙受热分解
D.氧化钙溶于水
解析:铝粉与氧化铁粉末反应(铝热反应)、乙醇燃烧、氧化钙溶于水都属于放热反应,而碳酸钙受热分解属于吸热反应,故选C项。
答案:C 栏目链接要点二 热化学方程式1.概念
能表示 ________ 和________的关系的化学方程式。
2.特点(与化学方程式比较)
(1)指明了反应时的________和________,若在 ________ 时进行的反应,可不注明。
(2)在化学方程式右边注明ΔH的 ________ 。
(3)所有反应物和生成物都用括号注明了它们在反应时的________。常用________分别表示固体、液体和气体。参加反应物质的量反应热温度压强25°C、101 kPa“+”、“-”和单位状态s、l、g 栏目链接 3.意义
热化学方程式不仅表示化学反应中的________变化,也表明了________变化。物质 能量 栏目链接3.在热化学方程式中为什么要注明物质的状态?
应用
思考提示:物质有三态变化,固态→液态→气态,转化过程需吸收热量。反之,需放出热量,所以同一物质处于不同状态时能量是不同的。化学反应中物质的状态不同,能量变化不同。 栏目链接综合
拓展三、书写热化学方程式四“注意”
1.注意ΔH
ΔH只能写在热化学方程式的右边,且中间留空格。若为放热反应,ΔH为“-”;若为吸热反应,ΔH为“+”。即“吸+”“放-”,ΔH的单位一般为kJ/mol或kJ·mol-1。
2.注意测定条件
反应热ΔH与测定条件(温度、压强等)有关,因此书写热化学方程式时应注意ΔH的测定条件。对于在25°C、101 kPa下测定的ΔH,可不注明温度和压强。 栏目链接3.注意物质的聚集状态
反应物和产物的聚集状态不同,反应热ΔH也不同。因此,书写热化学方程式必须注明物质的聚集状态。气体用“g”,液体用“l”,固体用“s”,水溶液中的溶质用“aq”。热化学方程式中不用标“↑”和“↓”。
4.注意化学计量数
由于ΔH与反应完成的物质的量有关,所以方程式中化学式前面的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。 栏目链接例如:已知
H2(g)+O2(g)===H2O(l)
ΔH=-285.8 kJ/mol,
则:H2O(l)===H2(g)+O2(g)
ΔH=+285.8 kJ/mol,
2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ/mol。 栏目链接?特别提示:“五看”法判断热化学方程式正误:
①看方程式是否配平;
②看各物质的聚集状态是否正确;
③看ΔH变化的“+”、“-”是否正确;
④看反应热的单位是否为 kJ·mol-1;
⑤看反应热的数值与化学计量数是否相对应。 栏目链接尝试
应用2.甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是________________________________________________________________________。
答案:SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)
ΔH=-1427.2 kJ/mol 栏目链接 栏目链接一、焓变、反应热概念的理解例1下列说法正确的是( )
A.焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+” 栏目链接解析:焓变单位中的kJ·mol-1,是指每摩尔具体的反应,不一定指参加反应的物质,A错;在反应中物质所具有的总能量减少,反应就放热,反之就吸热,C对;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量,成键时放热,所以D错。
答案:C 栏目链接变式
应用1.(双选题)下列关于ΔH(焓变)的说法正确的是( )
A.在任何条件下,化学反应的焓变都等于化学反应的反应热
B.ΔH>0时,反应吸收热量;ΔH<0时,反应放出热量
C.热化学方程式中ΔH的值与物质前的化学计量数无关
D.ΔH的值可以通过实验测得
栏目链接解析:等压条件下的反应热在不做其他功的情况下,才等于焓变,故A错;反应热可以用量热计实验测定,故D对;ΔH单位中的mol-1表明参加反应的各物质的量与化学方程式中各物质的化学式的系数相同,ΔH值与化学计量数有关,故C错。ΔH>0为吸热反应,ΔH<0为放热,故B对。
答案:BD 栏目链接例2已知在25°C、101 kPa下,1 g C8H18(辛烷)燃烧生成CO2和液态水时放热48.40 kJ。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g)
ΔH=-5518 kJ/mol
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5518 kJ/mol二、热化学方程式的书写及正误判断 栏目链接C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=+5518 kJ/mol
D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-48.40 kJ/mol
解析:1 mol辛烷燃烧生成 CO2和液态水时放出的热量为:48.40 kJ×114=5518 kJ,选项C、D均不正确;由于液态水转变成气态水时需吸收能量,因此,1 mol C8H18燃烧生成气态水时释放的能量少于5518 kJ,选项A错误,选项B正确。
答案:B 栏目链接名师点睛:热化学方程式的正误判断主要从下列方面入手:①物质状态;②ΔH的正负及单位;③物质的量与ΔH的大小是否对应。 栏目链接变式
应用2.已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ的热量,下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+1/2O2(g)
ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l)
ΔH=-484 kJ·mol-1
C.H2(g)+1/2O2(g)===H2O(g)
ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g)
ΔH=+484 kJ·mol-1 栏目链接解析:热化学方程式的书写要求与普通化学方程式的区别:①一定要标明各物质的状态。②化学计量数可用分数表示其实际物质的量,与热量成正比。③用ΔH表示其热效应时,吸热,其值为正;放热,其值为负。B项中水为液态,排除;H2与O2反应生成水蒸气是放热反应,ΔH应为负值,而其逆反应ΔH则为正值,排除C、D两项;故答案为A项。
答案:A 栏目链接例3 (双选题)在同温同压下,下列各组热化学方程式中,ΔH1>ΔH2的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH1
2H2(g)+O2(g)===2H2O(l) ΔH2
B.S(g)+O2(g)===SO2(g) ΔH1
S(s)+O2(g)===SO2(g) ΔH2
三、ΔH大小的比较 栏目链接C.C(s)+O2(g)===CO(g) ΔH1
C(s)+O2(g)===CO2(g) ΔH2
D.H2(g)+Cl2(g)===2HCl(g) ΔH1
栏目链接解析:A选项,H2O(g)→H2O(l)还要放热,故ΔH1>ΔH2;B选项,反应物S(s)→S(g)需吸热,故ΔH1<ΔH2;C选项,CO+O2→CO2的反应放热,故ΔH1>ΔH2;D选项,后一反应的化学计量数为前一反应对应物质的一半,故ΔH1<ΔH2。
答案:AC
名师点睛:在比较ΔH时,要注意ΔH是包含正或负的符号的。 栏目链接变式
应用3.已知31 g白磷变成31 g红磷放出18.39 kJ热量,下列两个反应中:
4P(白磷,s)+5O2(g)===2P2O5(s) ΔH= -Q1 kJ/mol
4P(红磷,s)+5O2(g)===2P2O5(s) ΔH= -Q2 kJ/mol
Q1和Q2的关系为( )
A.Q1>Q2 B.Q1=Q2
C.Q1<Q2 D.无法确定 栏目链接解析:由题设条件可知,白磷燃烧放出的热量应更大一些,Q1>Q2。
答案:A 栏目链接
第一节 化学反应与能量的变化
第1课时 化学反应与能量变化
栏目链接1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化,同时了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义并能正确书写热化学方程式。
4.认识化学反应过程中同时存在着物质和能量的变化,能量的多少取决于反应物和生成物的质量,反应过程中能量守恒。 栏目链接 栏目链接要点一 焓变、反应热
1.焓
焓是与物质的_______有关的物理量。符号:_______。
2.焓变
(1)定义:________物与________物的焓值差。
(2)符号:________。
(3)常用单位:________(或________)。内能 H生成反应ΔHkJ/molkJ·mol-1 栏目链接(4)与反应热的关系:
________条件下,反应的热效应等于________。因此,我们常用________表示反应热。
(5)焓变(ΔH)的正负与吸热、放热反应的关系:
若为放热反应,ΔH________0(填“>”或“<”),即ΔH为________(填“+”或“-”)。
若为吸热反应,ΔH________0(填“>”或“<”),即ΔH为________(填“+”或“-”)。
恒压焓变 ΔH <->+ 栏目链接3.放热、吸热反应
(1)放热反应:反应完成时,生成物释放的总能量________反应物吸收的总能量的反应。由于反应后放出热量(释放给环境)能使反应体系的能量________,故ΔH____0(填“<”或“>”),即ΔH为________(填“+”或“-”)。
(2)吸热反应:反应完成时,生成物释放的总能量________反应物吸收的总能量的反应。由于反应时吸收环境能量而使反应体系的能量________,故ΔH________0(填“<”或“>”),即ΔH为________(填“+”或“-”)。大于降低< - 小于升高>+ 栏目链接应用
思考1.浓硫酸溶于水放出热量,是放热反应吗?NH4NO3晶体溶于水吸收热量,是吸热反应吗?提示:放热(吸热)反应是指放出(吸收)热量的化学反应,而浓H2SO4溶于水是浓溶液的稀释过程,NH4NO3溶于水是溶解过程,没有新物质生成,都不是化学反应,故浓硫酸溶于水不是放热反应,NH4NO3晶体溶于水不是吸热反应。 栏目链接2.任何化学反应都有反应热吗?为什么?提示:任何化学反应都有反应热。这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。 栏目链接综合
拓展一、化学键与化学反应中能量变化的关系
由键能求反应热的公式为ΔH=反应物的键能总和-生成物的键能总和=E1-E2。
当E1>E2时,反应吸收能量;当E1<E2时,反应释放能量。
栏目链接二、放热反应与吸热反应比较 栏目链接 ?特别提示:①化学反应表现为吸热或放热与反应开始是否需要加热无关,需要加热的反应不一定是吸热反应(如
C+O2====CO2),不需要加热的反应也不一定是放热反应。
②浓硫酸稀释、NaOH固体溶于水放热;NH4NO3溶于水吸热。因不是化学反应,其放出或吸收的热量不是反应热。
③通过反应放热或吸热,可比较反应物和生成物的相对稳定性。 栏目链接点燃尝试
应用1.(2014·珠海高二期末考)下列属于吸热反应的是( )
A.铝粉与氧化铁粉末反应
B.乙醇燃烧
C.碳酸钙受热分解
D.氧化钙溶于水
解析:铝粉与氧化铁粉末反应(铝热反应)、乙醇燃烧、氧化钙溶于水都属于放热反应,而碳酸钙受热分解属于吸热反应,故选C项。
答案:C 栏目链接要点二 热化学方程式1.概念
能表示 ________ 和________的关系的化学方程式。
2.特点(与化学方程式比较)
(1)指明了反应时的________和________,若在 ________ 时进行的反应,可不注明。
(2)在化学方程式右边注明ΔH的 ________ 。
(3)所有反应物和生成物都用括号注明了它们在反应时的________。常用________分别表示固体、液体和气体。参加反应物质的量反应热温度压强25°C、101 kPa“+”、“-”和单位状态s、l、g 栏目链接 3.意义
热化学方程式不仅表示化学反应中的________变化,也表明了________变化。物质 能量 栏目链接3.在热化学方程式中为什么要注明物质的状态?
应用
思考提示:物质有三态变化,固态→液态→气态,转化过程需吸收热量。反之,需放出热量,所以同一物质处于不同状态时能量是不同的。化学反应中物质的状态不同,能量变化不同。 栏目链接综合
拓展三、书写热化学方程式四“注意”
1.注意ΔH
ΔH只能写在热化学方程式的右边,且中间留空格。若为放热反应,ΔH为“-”;若为吸热反应,ΔH为“+”。即“吸+”“放-”,ΔH的单位一般为kJ/mol或kJ·mol-1。
2.注意测定条件
反应热ΔH与测定条件(温度、压强等)有关,因此书写热化学方程式时应注意ΔH的测定条件。对于在25°C、101 kPa下测定的ΔH,可不注明温度和压强。 栏目链接3.注意物质的聚集状态
反应物和产物的聚集状态不同,反应热ΔH也不同。因此,书写热化学方程式必须注明物质的聚集状态。气体用“g”,液体用“l”,固体用“s”,水溶液中的溶质用“aq”。热化学方程式中不用标“↑”和“↓”。
4.注意化学计量数
由于ΔH与反应完成的物质的量有关,所以方程式中化学式前面的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。 栏目链接例如:已知
H2(g)+O2(g)===H2O(l)
ΔH=-285.8 kJ/mol,
则:H2O(l)===H2(g)+O2(g)
ΔH=+285.8 kJ/mol,
2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ/mol。 栏目链接?特别提示:“五看”法判断热化学方程式正误:
①看方程式是否配平;
②看各物质的聚集状态是否正确;
③看ΔH变化的“+”、“-”是否正确;
④看反应热的单位是否为 kJ·mol-1;
⑤看反应热的数值与化学计量数是否相对应。 栏目链接尝试
应用2.甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是________________________________________________________________________。
答案:SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)
ΔH=-1427.2 kJ/mol 栏目链接 栏目链接一、焓变、反应热概念的理解例1下列说法正确的是( )
A.焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+” 栏目链接解析:焓变单位中的kJ·mol-1,是指每摩尔具体的反应,不一定指参加反应的物质,A错;在反应中物质所具有的总能量减少,反应就放热,反之就吸热,C对;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量,成键时放热,所以D错。
答案:C 栏目链接变式
应用1.(双选题)下列关于ΔH(焓变)的说法正确的是( )
A.在任何条件下,化学反应的焓变都等于化学反应的反应热
B.ΔH>0时,反应吸收热量;ΔH<0时,反应放出热量
C.热化学方程式中ΔH的值与物质前的化学计量数无关
D.ΔH的值可以通过实验测得
栏目链接解析:等压条件下的反应热在不做其他功的情况下,才等于焓变,故A错;反应热可以用量热计实验测定,故D对;ΔH单位中的mol-1表明参加反应的各物质的量与化学方程式中各物质的化学式的系数相同,ΔH值与化学计量数有关,故C错。ΔH>0为吸热反应,ΔH<0为放热,故B对。
答案:BD 栏目链接例2已知在25°C、101 kPa下,1 g C8H18(辛烷)燃烧生成CO2和液态水时放热48.40 kJ。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g)
ΔH=-5518 kJ/mol
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5518 kJ/mol二、热化学方程式的书写及正误判断 栏目链接C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=+5518 kJ/mol
D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-48.40 kJ/mol
解析:1 mol辛烷燃烧生成 CO2和液态水时放出的热量为:48.40 kJ×114=5518 kJ,选项C、D均不正确;由于液态水转变成气态水时需吸收能量,因此,1 mol C8H18燃烧生成气态水时释放的能量少于5518 kJ,选项A错误,选项B正确。
答案:B 栏目链接名师点睛:热化学方程式的正误判断主要从下列方面入手:①物质状态;②ΔH的正负及单位;③物质的量与ΔH的大小是否对应。 栏目链接变式
应用2.已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ的热量,下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+1/2O2(g)
ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l)
ΔH=-484 kJ·mol-1
C.H2(g)+1/2O2(g)===H2O(g)
ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g)
ΔH=+484 kJ·mol-1 栏目链接解析:热化学方程式的书写要求与普通化学方程式的区别:①一定要标明各物质的状态。②化学计量数可用分数表示其实际物质的量,与热量成正比。③用ΔH表示其热效应时,吸热,其值为正;放热,其值为负。B项中水为液态,排除;H2与O2反应生成水蒸气是放热反应,ΔH应为负值,而其逆反应ΔH则为正值,排除C、D两项;故答案为A项。
答案:A 栏目链接例3 (双选题)在同温同压下,下列各组热化学方程式中,ΔH1>ΔH2的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH1
2H2(g)+O2(g)===2H2O(l) ΔH2
B.S(g)+O2(g)===SO2(g) ΔH1
S(s)+O2(g)===SO2(g) ΔH2
三、ΔH大小的比较 栏目链接C.C(s)+O2(g)===CO(g) ΔH1
C(s)+O2(g)===CO2(g) ΔH2
D.H2(g)+Cl2(g)===2HCl(g) ΔH1
栏目链接解析:A选项,H2O(g)→H2O(l)还要放热,故ΔH1>ΔH2;B选项,反应物S(s)→S(g)需吸热,故ΔH1<ΔH2;C选项,CO+O2→CO2的反应放热,故ΔH1>ΔH2;D选项,后一反应的化学计量数为前一反应对应物质的一半,故ΔH1<ΔH2。
答案:AC
名师点睛:在比较ΔH时,要注意ΔH是包含正或负的符号的。 栏目链接变式
应用3.已知31 g白磷变成31 g红磷放出18.39 kJ热量,下列两个反应中:
4P(白磷,s)+5O2(g)===2P2O5(s) ΔH= -Q1 kJ/mol
4P(红磷,s)+5O2(g)===2P2O5(s) ΔH= -Q2 kJ/mol
Q1和Q2的关系为( )
A.Q1>Q2 B.Q1=Q2
C.Q1<Q2 D.无法确定 栏目链接解析:由题设条件可知,白磷燃烧放出的热量应更大一些,Q1>Q2。
答案:A 栏目链接
