【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第二章 第三节 第2课时 影响化学平衡状态的因素(32张PPT)
文档属性
| 名称 | 【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第二章 第三节 第2课时 影响化学平衡状态的因素(32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-07-29 21:45:48 | ||
图片预览











文档简介
课件32张PPT。第二章 化学反应速率和化学平衡
第三节 化学平衡
第2课时 影响化学平衡状态的因素 栏目链接1.理解外界条件?浓度、温度、压强、催化剂等?对化学平衡的影响。
2.认识外界条件对化学平衡影响的一般规律。
栏目链接 栏目链接1.含义
在一定条件下,可逆反应达到化学平衡状态,如果改变影响平衡的条件(如________、________、________等),化学平衡状态被破坏(正、逆反应速率不再相等),直至正、逆反应速率再次________,在新的条件下达到新的化学平衡状态。这种现象称作平衡状态的移动,简称平衡移动。
要点一 化学平衡的移动
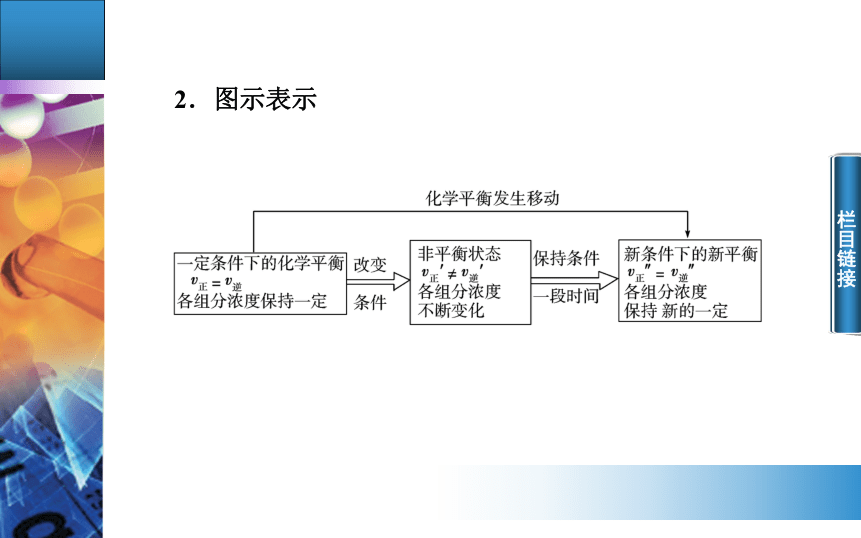
浓度 压强温度相等 栏目链接2.图示表示
栏目链接3.平衡移动方向与速率改变后的大小的关系
(1)v正′>v逆′,平衡________移动;
(2)v正′<v逆′,平衡________移动;
(3)v正′=v逆′,平衡________移动。
正向逆向不 栏目链接应用
思考1.某一可逆反应,一定条件下达到了平衡,若化学反应速率改变,化学平衡是否一定发生移动?若平衡发生移动,化学反应速率是否一定发生改变?
提示:平衡不一定移动,若速率改变后v正=v逆,平衡不移动,若v正≠v逆,则平衡发生移动。反之若平衡发生移动,说明v正≠v逆,即化学反应速率一定发生改变。
栏目链接要点二 外界条件对化学
平衡的影响如下 栏目链接2.增加固体或纯液体的量,对化学平衡状态有无影响?
提示:增加固体或纯液体的量,由于浓度不变,所以化学平衡不移动。例如可逆反应C(s)+H2O(g)?? CO(g)+H2(g)在某温度达到平衡后,增加或移去一部分C固体,化学平衡不移动。
应用
思考
栏目链接3.在容积不变的密闭容器中,气体反应已达到平衡,若向该容器中充入一种不能发生化学反应的气体,化学平衡是否移动?提示:化学平衡不移动,原因是气态反应物,生成物的浓度未变化。例如可逆反应2SO2(g)+O2(g)??2SO3(g),达到平衡后,在温度和气体体积不变的条件下充入Ar,因c(SO2)、c(O2)、c(SO3)均未发生变化,故化学平衡不移动。 栏目链接 4.在容积可变的恒压容器中,充入一种不反应的气体,化学平衡是否 移动?提示:此时虽然总压强不变,但各气态物质的浓度减小,相当于减压,化学平衡向气体体积增大的方向移动。 栏目链接综合
拓展加深外界条件的改变对化学平衡影响的理解
以mA(g)+nB(g)?? pC(g) ΔH<0(m+n<p)为例:
表格链接 栏目链接?特别提示:化学平衡移动的实质是因为外界条件改变时,正、逆反应速率变化程度不同而导致v正≠v逆,从而破坏了平衡状态,使平衡发生移动,分析时应注意条件改变的瞬间及以后的速率变化趋势,从而确定平衡移动的方向。若改变条件,对正逆反应的速率影响相同,则平衡不发生移动。
栏目链接对已达化学平衡的下列反应2X(g)+Y(g)??2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动尝试
应用 栏目链接 解析:本题考查了影响化学平衡的因素。减小压强,体积增大,反应物和生成物的浓度均降低,则正、逆反应速率都减小,平衡向体积增大的方向移动,即平衡向逆反应方向移动,则v逆>v正,趋势相同,但减小程度不同。
答案:C
栏目链接 栏目链接以上过程可用下图表示:
栏目链接例1 下列事实,不能用勒夏特列原理解释的是( )
A.反应CO+NO2??CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
B.合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C.溴水中存在平衡:Br2+H2O??HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D.对2HI(g)??H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深一、外界条件对化学平衡的影响 栏目链接
解析:选项A的正反应为放热反应,升高温度,平衡向逆反应方向移动;选项B合成氨的反应是放热反应,理论上采取低温有利于反应向正反应方向进行,但需同时考虑温度对反应速率的影响;选项C中加入Ag+,Ag+与Br-反应生成AgBr沉淀,降低了Br-浓度,平衡向正反应方向移动,溶液颜色变浅;选项D因2HI(g)?? H2(g)+I2(g),方程式两边气体分子数相等,压缩体系的体积,增大压强,平衡不发生移动,但由于体积缩小引起各组分的浓度增大,导致颜色变深。综上所述,只要平衡移动的结果与实际相符,则符合勒夏特列原理。
答案:D
栏目链接 栏目链接变式
应用1.(2013·广西卷)反应X(g)+Y(g)??2Z(g);ΔH<0,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
栏目链接解析:该反应为前后体积不变的反应,因此改变压强对该反应无影响,A项错误;催化剂只能降低反应的活化能,增大反应速率,但不能改变平衡状态,产率不变,B项错误;增大一种反应物会增大另一反应物的转化率,但本身的转化率是下降的,C项错误;降低温度后,平衡向着放热方向移动,即向右移动,因此Y的转化率增大,D项正确。
答案:D 栏目链接
二、有关图像题
例2 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下图所示的变化规律(图中p表示压强,T表示温度,n表示物质的量):
栏目链接 栏目链接根据以上规律判断 ,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2D.反应Ⅳ:ΔH<0,T2>T1 栏目链接 栏目链接名师点睛:图象分析题也是近年来高考常考的重点题型,它主要考查观察、分析、综合运用的能力,综合性较强。解题关键是弄清坐标轴的含义,理解“三点一势”(起点、终点、转折点和变化趋势)的意义。
栏目链接变式
应用2.现有可逆反应A(g)+B(g)??3C(g),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混合物中的百分含量(C%)和反应时间的关系:
栏目链接(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则________________曲线是表示有催化剂时的情况。
(2)若图乙中的a曲线表示200℃,b曲线表示100℃时的情况,则此可逆反应的正反应是________热反应。
(3)若图丙中两条曲线分别表示不同压强下的情况,则________曲线是表示压强较大的情况。 栏目链接解析:(1)催化剂只加快反应速率,但不改变平衡状态。(2)曲线a对应的温度高于曲线b对应的温度,由下往上看,随着温度的升高,C%增大,反应向正反应方向进行。(3)曲线a对应的压强小于曲线b对应的压强,由下往上看,压强减小,C%增大,反应向正反应方向进行。
答案:(1)a (2)吸 (3)b 栏目链接
第三节 化学平衡
第2课时 影响化学平衡状态的因素 栏目链接1.理解外界条件?浓度、温度、压强、催化剂等?对化学平衡的影响。
2.认识外界条件对化学平衡影响的一般规律。
栏目链接 栏目链接1.含义
在一定条件下,可逆反应达到化学平衡状态,如果改变影响平衡的条件(如________、________、________等),化学平衡状态被破坏(正、逆反应速率不再相等),直至正、逆反应速率再次________,在新的条件下达到新的化学平衡状态。这种现象称作平衡状态的移动,简称平衡移动。
要点一 化学平衡的移动
浓度 压强温度相等 栏目链接2.图示表示
栏目链接3.平衡移动方向与速率改变后的大小的关系
(1)v正′>v逆′,平衡________移动;
(2)v正′<v逆′,平衡________移动;
(3)v正′=v逆′,平衡________移动。
正向逆向不 栏目链接应用
思考1.某一可逆反应,一定条件下达到了平衡,若化学反应速率改变,化学平衡是否一定发生移动?若平衡发生移动,化学反应速率是否一定发生改变?
提示:平衡不一定移动,若速率改变后v正=v逆,平衡不移动,若v正≠v逆,则平衡发生移动。反之若平衡发生移动,说明v正≠v逆,即化学反应速率一定发生改变。
栏目链接要点二 外界条件对化学
平衡的影响如下 栏目链接2.增加固体或纯液体的量,对化学平衡状态有无影响?
提示:增加固体或纯液体的量,由于浓度不变,所以化学平衡不移动。例如可逆反应C(s)+H2O(g)?? CO(g)+H2(g)在某温度达到平衡后,增加或移去一部分C固体,化学平衡不移动。
应用
思考
栏目链接3.在容积不变的密闭容器中,气体反应已达到平衡,若向该容器中充入一种不能发生化学反应的气体,化学平衡是否移动?提示:化学平衡不移动,原因是气态反应物,生成物的浓度未变化。例如可逆反应2SO2(g)+O2(g)??2SO3(g),达到平衡后,在温度和气体体积不变的条件下充入Ar,因c(SO2)、c(O2)、c(SO3)均未发生变化,故化学平衡不移动。 栏目链接 4.在容积可变的恒压容器中,充入一种不反应的气体,化学平衡是否 移动?提示:此时虽然总压强不变,但各气态物质的浓度减小,相当于减压,化学平衡向气体体积增大的方向移动。 栏目链接综合
拓展加深外界条件的改变对化学平衡影响的理解
以mA(g)+nB(g)?? pC(g) ΔH<0(m+n<p)为例:
表格链接 栏目链接?特别提示:化学平衡移动的实质是因为外界条件改变时,正、逆反应速率变化程度不同而导致v正≠v逆,从而破坏了平衡状态,使平衡发生移动,分析时应注意条件改变的瞬间及以后的速率变化趋势,从而确定平衡移动的方向。若改变条件,对正逆反应的速率影响相同,则平衡不发生移动。
栏目链接对已达化学平衡的下列反应2X(g)+Y(g)??2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动尝试
应用 栏目链接 解析:本题考查了影响化学平衡的因素。减小压强,体积增大,反应物和生成物的浓度均降低,则正、逆反应速率都减小,平衡向体积增大的方向移动,即平衡向逆反应方向移动,则v逆>v正,趋势相同,但减小程度不同。
答案:C
栏目链接 栏目链接以上过程可用下图表示:
栏目链接例1 下列事实,不能用勒夏特列原理解释的是( )
A.反应CO+NO2??CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
B.合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C.溴水中存在平衡:Br2+H2O??HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D.对2HI(g)??H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深一、外界条件对化学平衡的影响 栏目链接
解析:选项A的正反应为放热反应,升高温度,平衡向逆反应方向移动;选项B合成氨的反应是放热反应,理论上采取低温有利于反应向正反应方向进行,但需同时考虑温度对反应速率的影响;选项C中加入Ag+,Ag+与Br-反应生成AgBr沉淀,降低了Br-浓度,平衡向正反应方向移动,溶液颜色变浅;选项D因2HI(g)?? H2(g)+I2(g),方程式两边气体分子数相等,压缩体系的体积,增大压强,平衡不发生移动,但由于体积缩小引起各组分的浓度增大,导致颜色变深。综上所述,只要平衡移动的结果与实际相符,则符合勒夏特列原理。
答案:D
栏目链接 栏目链接变式
应用1.(2013·广西卷)反应X(g)+Y(g)??2Z(g);ΔH<0,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
栏目链接解析:该反应为前后体积不变的反应,因此改变压强对该反应无影响,A项错误;催化剂只能降低反应的活化能,增大反应速率,但不能改变平衡状态,产率不变,B项错误;增大一种反应物会增大另一反应物的转化率,但本身的转化率是下降的,C项错误;降低温度后,平衡向着放热方向移动,即向右移动,因此Y的转化率增大,D项正确。
答案:D 栏目链接
二、有关图像题
例2 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下图所示的变化规律(图中p表示压强,T表示温度,n表示物质的量):
栏目链接 栏目链接根据以上规律判断 ,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2
栏目链接变式
应用2.现有可逆反应A(g)+B(g)??3C(g),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混合物中的百分含量(C%)和反应时间的关系:
栏目链接(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则________________曲线是表示有催化剂时的情况。
(2)若图乙中的a曲线表示200℃,b曲线表示100℃时的情况,则此可逆反应的正反应是________热反应。
(3)若图丙中两条曲线分别表示不同压强下的情况,则________曲线是表示压强较大的情况。 栏目链接解析:(1)催化剂只加快反应速率,但不改变平衡状态。(2)曲线a对应的温度高于曲线b对应的温度,由下往上看,随着温度的升高,C%增大,反应向正反应方向进行。(3)曲线a对应的压强小于曲线b对应的压强,由下往上看,压强减小,C%增大,反应向正反应方向进行。
答案:(1)a (2)吸 (3)b 栏目链接
