【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第三章 第一节 第2课时 弱电解质的电离(36张PPT)
文档属性
| 名称 | 【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第三章 第一节 第2课时 弱电解质的电离(36张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-07-29 22:01:44 | ||
图片预览










文档简介
课件36张PPT。第三章 水溶液中的离子平衡第一节 第一节 弱电解质的电离
第2课时 弱电解质的电离 栏目链接1.掌握弱电解质的电离平衡。
2.了解影响电离平衡的因素。
3.了解电离常数的意义。
栏目链接 栏目链接1.概念
在一定条件(如温度、浓度一定)下,弱电解质在溶液中__________的速率和 __________ 的速率相等,电离过程就达到了平衡状态。
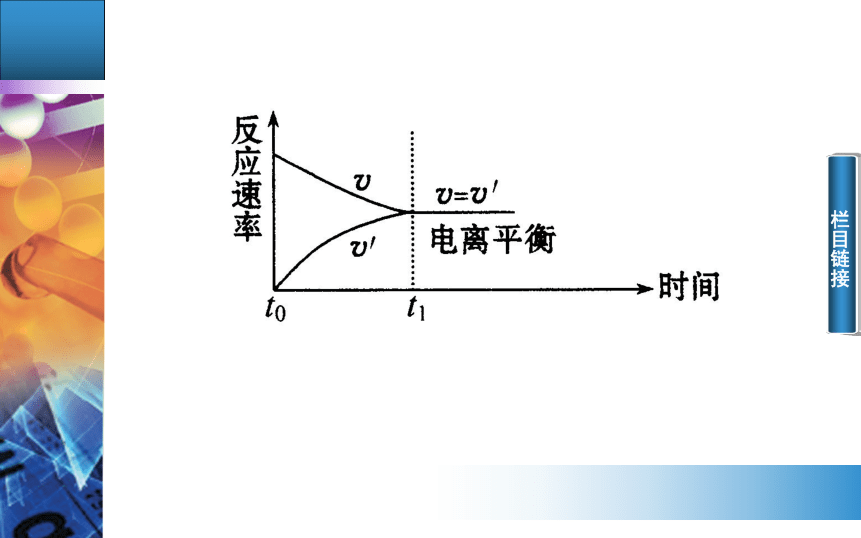
2.电离平衡的建立过程(用vt图象描述)
用v表示弱电解质分子电离成离子的速率,用v′表示离子结合成弱电解质分子的速率。
要点一 弱电解质的电离平衡
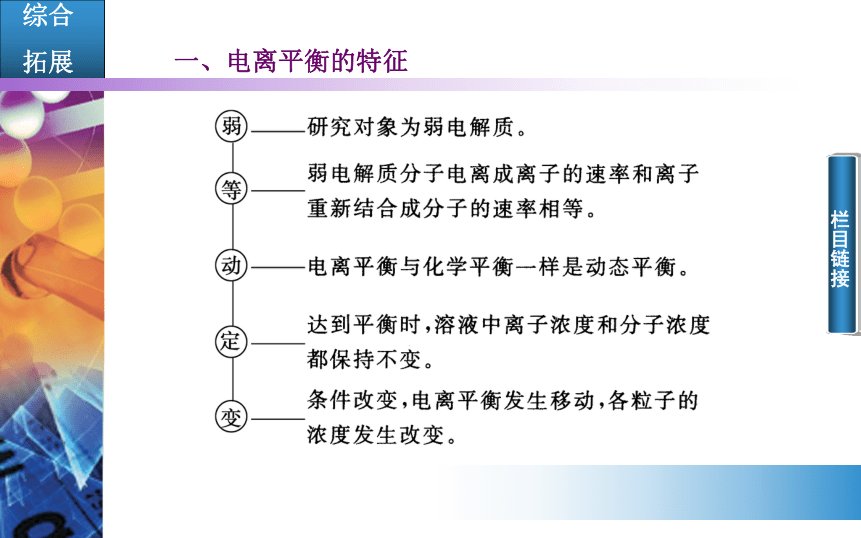
电离成离子离子结合成分子 栏目链接 栏目链接3.电离平衡的特征
(1)电离过程是__热的。
(2)____、____共存。
(3)电离都是______。一般来说已电离的分子是____数的,绝大多数以____形式存在。如0.1 mol/L的CH3COOH溶液中,c(H+)大约在10-3mol/L左右。
(4)多元弱酸____电离,电离程度逐步____。
吸分子 离子微弱的 极少分子分步减弱 栏目链接应用
思考1.弱电解质达到电离平衡后,还会继续电离吗?
提示:一定条件下,弱电解质达到电离平衡后,还会继续电离,只是电离成离子的速率和离子结合成分子的速率相等。
栏目链接 2.0.1 mol/L醋酸溶液中存在平衡:CH3COOH??CH3COO-+H+,当改变条件时(见下表),CH3COOH的电离程度,c(H+)会发生怎样的变化?请完成下表。
栏目链接提示:向弱酸中加水稀释时,虽然弱酸电离程度增大,促进电离,但c(H+)减小。其他的可类似地进行分析。
栏目链接综合
拓展一、电离平衡的特征
栏目链接?特别提示:电离平衡是化学平衡的一种,因此可用化学平衡理论来理解分析电离平衡的建立、电离平衡的状态、电离平衡的移动?影响因素?和电离常数等,同时要注意电离平衡的特点。 栏目链接二、电离平衡的影响因素
电离达平衡状态时溶液里电解质离子的浓度和分子的浓度保持不变,但当影响电离平衡状态的条件(如温度、浓度等)改变时,电离平衡就会从原来的平衡状态变化为新条件下新的电离平衡状态。各因素对电离平衡的影响如下表所示: 栏目链接 栏目链接?特别提示:弱电解质的电离平衡同化学平衡类似,故可应用勒夏特列原理解释有关电离平衡移动的问题。 栏目链接1.根据某浓度氨水溶液中存在的电离平衡NH3·H2O??NH+OH-,填写下表中各项的变化情况:
尝试
应用 栏目链接 栏目链接答案: 栏目链接1.表示方法
对于AB??A++B-,__________________
2.K的意义
表征了弱电解质的____能力。一定温度下,K值越大,弱电解质的电离程度____。多元弱酸只考虑__________。
3.影响因素
K只与电解质的____和____有关,对同一弱电解质,温度一定,电离常数____;温度升高时,电离常数____。
要点二 电离常数
电离越大第一步电离性质温度一定增大 栏目链接3.在“尝试应用”第1题中条件的改变对电离常数各有什么影响?
应用
思考 提示:除降低温度,电离常数会减小外,其余均不影响电离常数,即电离常数不变。 栏目链接多元弱酸的电离是分步进行的,每步各有电离常数,通常用K1、K2、K3等级来分别表示(如下图)。例如:
综合
拓展三、多元弱酸的电离常数
栏目链接
多元弱酸各步电离常数大小的比较为K1?K2?K3,因此多元弱酸的酸性主要由第一步电离所决定(八字诀:分步进行,一步定性)。
四、一元强酸与一元弱酸的比较 栏目链接?特别提示:判断一种酸是强酸还是弱酸时,实质是看它在水溶液中的电离程度,完全电离即为强酸,不完全电离即为弱酸。
栏目链接五、设计实验验证时注意等物质的量浓度和等pH的两种酸的性质差异。
实验设计思路:以证明某酸(HA)
是弱酸为例 栏目链接尝试
应用2.常温下,下列有关酸HA的叙述中,不能说明HA是弱酸的是( )
①取0.1 mol/L HA溶液,其溶液pH为2 ②测0.01 mol/L NaA溶液,其溶液pH大于7 ③用HA溶液做导电性实验,灯泡发光很暗 ④等体积pH=4的盐酸和HA酸稀释到pH=5,HA酸加水量多 ⑤相同体积,相同pH的盐酸和HA酸分别和足量锌反应,盐酸产生氢气量少
A.①③④ B.②③④
C.①②④⑤ D.③ 栏目链接解析:①取0.1 mol/L的HA溶液,其溶液的pH为2,则HA不完全电离,能说明HA是弱酸,故不选;②测0.01 mol/L的NaA溶液,其溶液的pH大于7,说明NaA是强碱弱酸盐,所以能说明HA是弱酸,故不选;③用HA溶液做导电性实验,灯泡发光很暗,只能说明溶液中氢离子浓度较小,不能说明该酸的电离程度,所以不能说明该酸是弱酸,故选;④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多,则HA在水溶液里不完全电离,所以说明HA是弱酸,故不选;⑤相同体积,相同pH的盐酸和HA分别和足量锌反应,盐酸产生的氢气的量少,则盐酸的物质的量小于HA,所以说明HA是弱酸,故不选。本题答案为D。
答案:D 栏目链接 栏目链接例1 (双选题)已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH??CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A.加少量醋酸钠溶液 B.升高温度
C.加少量冰醋酸 D.加水一、弱电解质的电离平衡移动
栏目链接解析:c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),加少量醋酸钠溶液,上述平衡逆向进行,n(H+)减小,n(CH3COOH)增大,c(H+)/c(CH3COOH)减小;升高温度上述平衡正向进行,n(H+)增大,n(CH3COOH)减小,c(H+)/c(CH3COOH)增大;加少量冰醋酸相当于增大浓度,醋酸的电离程度减小,c(H+)/c(CH3COOH)减小;加水稀释,醋酸的电离程度增大,c(H+)/c(CH3COOH)增大;故选择B、D。
答案:BD
名师点睛:弱电解质在溶液中存在电离平衡,其规律完全符合勒夏特列原理。
栏目链接变式
应用1.(2014·广东执信中学高二期中考)氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A.1 mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10 mL 1 mol/L HCN恰好与10 mL 1 mol/L NaOH溶液完全反应
D.HCN溶液的导电性比HCl溶液的弱
栏目链接解析:证明电解质是弱电解质的方法可以从以下三个角度考虑:(1)看其电离程度,(2)看是否存在电离平衡,(3)测其盐溶液的pH;A.氢氰酸为一元弱pH约为3,电离生成的氢离子约为10-3 mol/L<1 mol/L,电离不完全,正确;B.不能利用物质的溶解性来判断是否为弱电解质,即溶解性与电解质的强弱无关,错误;C.10 mL 1mol/L HCN恰好与10 mL 1 mol/L NaOH溶液完全反应,只能说明HCN为一元酸,不能说明其电离的程度,错误;D.溶液的导电性取决于溶液中的离子浓度大小,与酸性强弱无关,HCN溶液的导电性比强酸溶液的弱,不能说明HCN电离不完全,错误。
答案:A 栏目链接 例2 对室温下,c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两种溶液的c(H+)均减小
B.使温度升高20 ℃后,两溶液的c(H+)均不变
C.加水稀释2倍后,两溶液的c(H+)均增大
D.加足量的锌充分反应后,两溶液中产生的氢气一样多二、一元强酸和一元弱酸的比较 栏目链接解析:加入适量NaAc后,盐酸中H++CH3COO-===CH3COOH,c(H+)减小,醋酸中平衡(CH3COOH??H++CH3COO-)左移,c(H+)减小,A项正确;温度升高20℃,醋酸的电离平衡右移,c(H+)增大,B错误;酸溶液加水稀释后c(H+)减小,C错误;加入足量的锌,醋酸产生的H2多,D错误。
答案:A
栏目链接变式
应用2.下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两种溶液中c(H+)相同
B.100 mL 0.1 mol/L的两种溶液能中和等物质的量的氢氧化钠
C.c(H+)=10-3 mol/L的两种溶液稀释100倍,c(H+)都为10-5 mol/L
D.两种溶液中分别加入少量对应的钠盐,c(H+)均明显减小 栏目链接解析:相同浓度时,盐酸中c(H+)大于醋酸中的c(H+),故A错;c(H+)=10-3mol·L-1的HCl和CH3COOH溶液,稀释100倍,盐酸中c(H+)=10-5 mol·L-1,醋酸中c(H+)大于10-5 mol·L-1,因为加水稀释,CH3COOH??CH3COO-+H+,平衡右移,故C错;加入少量对应的钠盐时,对盐酸无影响,CH3COOH电离平衡左移,c(H+)减小,故D错。
答案:B 栏目链接
第2课时 弱电解质的电离 栏目链接1.掌握弱电解质的电离平衡。
2.了解影响电离平衡的因素。
3.了解电离常数的意义。
栏目链接 栏目链接1.概念
在一定条件(如温度、浓度一定)下,弱电解质在溶液中__________的速率和 __________ 的速率相等,电离过程就达到了平衡状态。
2.电离平衡的建立过程(用vt图象描述)
用v表示弱电解质分子电离成离子的速率,用v′表示离子结合成弱电解质分子的速率。
要点一 弱电解质的电离平衡
电离成离子离子结合成分子 栏目链接 栏目链接3.电离平衡的特征
(1)电离过程是__热的。
(2)____、____共存。
(3)电离都是______。一般来说已电离的分子是____数的,绝大多数以____形式存在。如0.1 mol/L的CH3COOH溶液中,c(H+)大约在10-3mol/L左右。
(4)多元弱酸____电离,电离程度逐步____。
吸分子 离子微弱的 极少分子分步减弱 栏目链接应用
思考1.弱电解质达到电离平衡后,还会继续电离吗?
提示:一定条件下,弱电解质达到电离平衡后,还会继续电离,只是电离成离子的速率和离子结合成分子的速率相等。
栏目链接 2.0.1 mol/L醋酸溶液中存在平衡:CH3COOH??CH3COO-+H+,当改变条件时(见下表),CH3COOH的电离程度,c(H+)会发生怎样的变化?请完成下表。
栏目链接提示:向弱酸中加水稀释时,虽然弱酸电离程度增大,促进电离,但c(H+)减小。其他的可类似地进行分析。
栏目链接综合
拓展一、电离平衡的特征
栏目链接?特别提示:电离平衡是化学平衡的一种,因此可用化学平衡理论来理解分析电离平衡的建立、电离平衡的状态、电离平衡的移动?影响因素?和电离常数等,同时要注意电离平衡的特点。 栏目链接二、电离平衡的影响因素
电离达平衡状态时溶液里电解质离子的浓度和分子的浓度保持不变,但当影响电离平衡状态的条件(如温度、浓度等)改变时,电离平衡就会从原来的平衡状态变化为新条件下新的电离平衡状态。各因素对电离平衡的影响如下表所示: 栏目链接 栏目链接?特别提示:弱电解质的电离平衡同化学平衡类似,故可应用勒夏特列原理解释有关电离平衡移动的问题。 栏目链接1.根据某浓度氨水溶液中存在的电离平衡NH3·H2O??NH+OH-,填写下表中各项的变化情况:
尝试
应用 栏目链接 栏目链接答案: 栏目链接1.表示方法
对于AB??A++B-,__________________
2.K的意义
表征了弱电解质的____能力。一定温度下,K值越大,弱电解质的电离程度____。多元弱酸只考虑__________。
3.影响因素
K只与电解质的____和____有关,对同一弱电解质,温度一定,电离常数____;温度升高时,电离常数____。
要点二 电离常数
电离越大第一步电离性质温度一定增大 栏目链接3.在“尝试应用”第1题中条件的改变对电离常数各有什么影响?
应用
思考 提示:除降低温度,电离常数会减小外,其余均不影响电离常数,即电离常数不变。 栏目链接多元弱酸的电离是分步进行的,每步各有电离常数,通常用K1、K2、K3等级来分别表示(如下图)。例如:
综合
拓展三、多元弱酸的电离常数
栏目链接
多元弱酸各步电离常数大小的比较为K1?K2?K3,因此多元弱酸的酸性主要由第一步电离所决定(八字诀:分步进行,一步定性)。
四、一元强酸与一元弱酸的比较 栏目链接?特别提示:判断一种酸是强酸还是弱酸时,实质是看它在水溶液中的电离程度,完全电离即为强酸,不完全电离即为弱酸。
栏目链接五、设计实验验证时注意等物质的量浓度和等pH的两种酸的性质差异。
实验设计思路:以证明某酸(HA)
是弱酸为例 栏目链接尝试
应用2.常温下,下列有关酸HA的叙述中,不能说明HA是弱酸的是( )
①取0.1 mol/L HA溶液,其溶液pH为2 ②测0.01 mol/L NaA溶液,其溶液pH大于7 ③用HA溶液做导电性实验,灯泡发光很暗 ④等体积pH=4的盐酸和HA酸稀释到pH=5,HA酸加水量多 ⑤相同体积,相同pH的盐酸和HA酸分别和足量锌反应,盐酸产生氢气量少
A.①③④ B.②③④
C.①②④⑤ D.③ 栏目链接解析:①取0.1 mol/L的HA溶液,其溶液的pH为2,则HA不完全电离,能说明HA是弱酸,故不选;②测0.01 mol/L的NaA溶液,其溶液的pH大于7,说明NaA是强碱弱酸盐,所以能说明HA是弱酸,故不选;③用HA溶液做导电性实验,灯泡发光很暗,只能说明溶液中氢离子浓度较小,不能说明该酸的电离程度,所以不能说明该酸是弱酸,故选;④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多,则HA在水溶液里不完全电离,所以说明HA是弱酸,故不选;⑤相同体积,相同pH的盐酸和HA分别和足量锌反应,盐酸产生的氢气的量少,则盐酸的物质的量小于HA,所以说明HA是弱酸,故不选。本题答案为D。
答案:D 栏目链接 栏目链接例1 (双选题)已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH??CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A.加少量醋酸钠溶液 B.升高温度
C.加少量冰醋酸 D.加水一、弱电解质的电离平衡移动
栏目链接解析:c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),加少量醋酸钠溶液,上述平衡逆向进行,n(H+)减小,n(CH3COOH)增大,c(H+)/c(CH3COOH)减小;升高温度上述平衡正向进行,n(H+)增大,n(CH3COOH)减小,c(H+)/c(CH3COOH)增大;加少量冰醋酸相当于增大浓度,醋酸的电离程度减小,c(H+)/c(CH3COOH)减小;加水稀释,醋酸的电离程度增大,c(H+)/c(CH3COOH)增大;故选择B、D。
答案:BD
名师点睛:弱电解质在溶液中存在电离平衡,其规律完全符合勒夏特列原理。
栏目链接变式
应用1.(2014·广东执信中学高二期中考)氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A.1 mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10 mL 1 mol/L HCN恰好与10 mL 1 mol/L NaOH溶液完全反应
D.HCN溶液的导电性比HCl溶液的弱
栏目链接解析:证明电解质是弱电解质的方法可以从以下三个角度考虑:(1)看其电离程度,(2)看是否存在电离平衡,(3)测其盐溶液的pH;A.氢氰酸为一元弱pH约为3,电离生成的氢离子约为10-3 mol/L<1 mol/L,电离不完全,正确;B.不能利用物质的溶解性来判断是否为弱电解质,即溶解性与电解质的强弱无关,错误;C.10 mL 1mol/L HCN恰好与10 mL 1 mol/L NaOH溶液完全反应,只能说明HCN为一元酸,不能说明其电离的程度,错误;D.溶液的导电性取决于溶液中的离子浓度大小,与酸性强弱无关,HCN溶液的导电性比强酸溶液的弱,不能说明HCN电离不完全,错误。
答案:A 栏目链接 例2 对室温下,c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两种溶液的c(H+)均减小
B.使温度升高20 ℃后,两溶液的c(H+)均不变
C.加水稀释2倍后,两溶液的c(H+)均增大
D.加足量的锌充分反应后,两溶液中产生的氢气一样多二、一元强酸和一元弱酸的比较 栏目链接解析:加入适量NaAc后,盐酸中H++CH3COO-===CH3COOH,c(H+)减小,醋酸中平衡(CH3COOH??H++CH3COO-)左移,c(H+)减小,A项正确;温度升高20℃,醋酸的电离平衡右移,c(H+)增大,B错误;酸溶液加水稀释后c(H+)减小,C错误;加入足量的锌,醋酸产生的H2多,D错误。
答案:A
栏目链接变式
应用2.下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两种溶液中c(H+)相同
B.100 mL 0.1 mol/L的两种溶液能中和等物质的量的氢氧化钠
C.c(H+)=10-3 mol/L的两种溶液稀释100倍,c(H+)都为10-5 mol/L
D.两种溶液中分别加入少量对应的钠盐,c(H+)均明显减小 栏目链接解析:相同浓度时,盐酸中c(H+)大于醋酸中的c(H+),故A错;c(H+)=10-3mol·L-1的HCl和CH3COOH溶液,稀释100倍,盐酸中c(H+)=10-5 mol·L-1,醋酸中c(H+)大于10-5 mol·L-1,因为加水稀释,CH3COOH??CH3COO-+H+,平衡右移,故C错;加入少量对应的钠盐时,对盐酸无影响,CH3COOH电离平衡左移,c(H+)减小,故D错。
答案:B 栏目链接
