【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第三章 第二节 第1课时 水的电离和溶液的酸碱性(34张PPT)
文档属性
| 名称 | 【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第三章 第二节 第1课时 水的电离和溶液的酸碱性(34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-07-30 06:20:39 | ||
图片预览











文档简介
课件34张PPT。第三章 水溶液中的离子平衡
第二节 水的电离和溶液的酸碱性
第1课时 水的电离和溶液的酸碱性 栏目链接1.了解水的电离。
2.了解水的离子积常数。
3.了解溶液的酸碱性与pH的定义
栏目链接 栏目链接1.水的电离
水是一种极弱的电解质。电离方程式为____________________,也可以简写为 ____________ 。
2.水的离子积常数
(1)水的电离常数:K电离=__________。
(2)水的离子积常数:
Kw=______________。在室温下,纯水中的c(H+)=c(OH-)=______ mol/L,Kw=__________。
要点一 水的电离
栏目链接H2O+H2O??H3O++OH-H2O??H++OH-c(H+)·c(OH-)10-71.0×10-14 (3)影响因素:
水的离子积Kw,只受____的影响,温度升高,Kw____。
(4)适用范围:
Kw不仅适用于纯水,也适用于________________________________________________________________________。 栏目链接温度增大稀的电解质水溶液应用
思考1.离子积表达式Kw=c(H+)·c(OH-)中的c(H+)和c(OH-)一定是水电离出的c(H+)和c(OH-)吗?
提示:表达式中的c(H+)和c(OH-)均表示整个溶液中的c(H+)和c(OH-),不一定只是水电离出的c(H+)和c(OH-)。
栏目链接综合
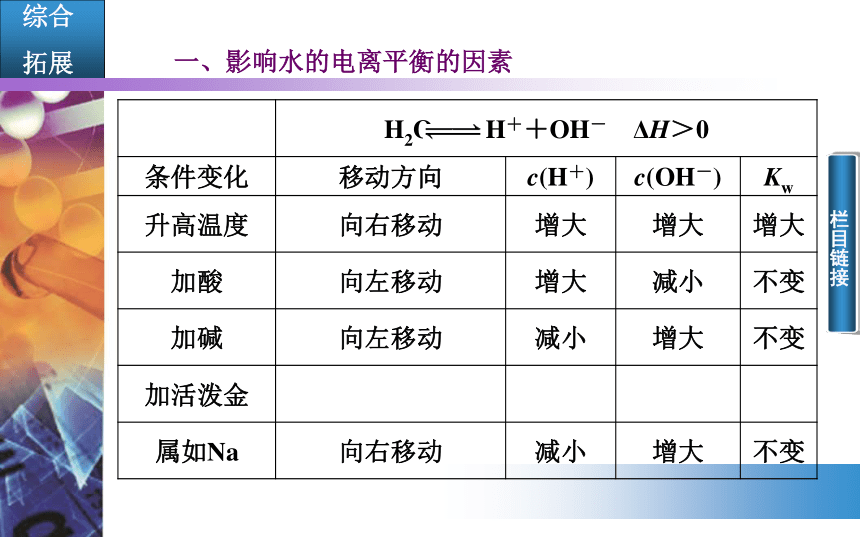
拓展一、影响水的电离平衡的因素
栏目链接 ?特别提示:(1)不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等,判断溶液中水的电离程度时,酸溶液看c(OH-),碱溶液看c(H+)。
(2)促进水的电离平衡的因素有升温、加活泼金属、加入含弱酸(或碱)离子的盐(后边学习);抑制水的电离平衡因素有降温、加入酸(或强酸的酸式盐)、加入碱。
(3)水的离子积常数Kw仅仅是温度的函数,温度升高,Kw增大,温度不变,Kw不变,此时若c(H+)增大,则c(OH-)必减小,反之亦然。 栏目链接1.在某温度时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为( )
A.2.4×10-7mol/L B.0.1×10-7mol/L
C.mol/L D.c(OH-)无法确定
尝试
应用解析:纯水中c(H+)=c(OH-)。
答案:A 栏目链接要点二 溶液的酸碱性与pH
1.溶液的酸碱性与c(H+)和c(OH-)的关系
溶液的酸碱性取决于c(H+)和c(OH-)的________。
(1)酸性溶液:c(H+)________c(OH-);
(2)中性溶液:c(H+)________c(OH-);
(3)碱性溶液:c(H+)________c(OH-)。
栏目链接相对大小>= <2.溶液酸碱性与pH
(1)pH。
①定义:用 ________ 表示溶液酸碱性的强弱。
②表达式:pH=________。
③意义:pH越大,溶液碱性越____,每增大1个单位,c(OH-)变为原来的______倍;pH越小,酸性越______,每减小1个单位,c(H+)变为原来的______倍。
④适用范围:1×10-14 mol/L≤c(H+)≤1×100 mol/L的溶液。
栏目链接H+的物质的量浓度的负对数-lgc(H+)强10强10(2)溶液的酸碱性与pH的关系。
室温下:
酸性溶液 c(H+)__c(OH-),pH__7,
pH越小,溶液的酸性越__;
中性溶液 c(H+)__c(OH-),pH__7,
碱性溶液 c(H+)__c(OH-),pH__7,
pH越大,溶液的碱性越____。
栏目链接>< 强== <>强3.溶液pH的测定方法
(1)溶液pH的测定方法有 ______ 法、______法、pH计法。
(2)pH试纸的使用方法:__________________________________________________
,试纸变色后,马上与标准比色卡比较来确定溶液的pH(简记为“放、蘸、点、比”)。
栏目链接酸碱指示剂pH试纸把小块pH试纸放在玻璃片(或表面皿)上,用蘸有待测液的玻璃棒点在试纸的中央2.pH=7的溶液一定呈中性吗?
应用
思考提示:不一定。25℃时,pH=7的溶液呈中性,温度高于25℃时,由于水的电离程度增大,Kw>1.0×10-14,此时pH=7呈碱性。判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH的大小,因此只有满足c(H+)=c(OH-)的溶液才一定呈中性。
栏目链接3.pH试纸使用前能否用蒸馏水湿润,若湿润是否一定产生误差?提示:使用pH试纸前不能用蒸馏水湿润,湿润后相当于稀释了溶液,若是酸性溶液,则湿润后测得pH偏大,若为碱性溶液,湿润后测得pH偏小,若为中性溶液,则无影响。 栏目链接1.区别
酸、碱的强弱是以电解质的电离程度来区分的。强酸、强碱在溶液中完全电离,弱酸、弱碱在溶液中部分电离。
2.联系
(1)强酸溶液的酸性不一定比弱酸溶液的酸性强。
(2)酸性强的溶液不一定是强酸溶液。
(3)酸性相同的溶液弱酸浓度大,中和能力强。
例如:c(H+)=1 mol/L的醋酸溶液和盐酸溶液,体积均为1 L时,醋酸溶液中和能力更强。
综合
拓展二、溶液的酸碱性与酸碱强弱的关系
栏目链接 (4)中和能力相同的酸,其提供H+的能力相同。
例如:1 L 0.1 mol/L的CH3COOH和1 L 0.1 mol/L的盐酸,均可提供0.1 mol的H+。
三、pH的测定方法
1.利用酸碱指示剂测定。这种方法只能测出某一范围的pH,而不能得出具体的数值。下表列出了常用酸碱指示剂的变色范围。
常用酸碱指示剂的变色范围 栏目链接 栏目链接2.用pH试纸测定:pH试纸一般呈黄色,由多种指示剂的混合液浸制而成。 栏目链接 ?特别提示:pH试纸只能粗略地测定溶液酸碱性强弱?广泛pH试纸读数只能整数?。尝试
应用2.下列说法正确的是( )
A.强碱的水溶液中不存在H+
B.pH=0的溶液是酸性最强的溶液
C.在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大
D.某温度下,纯水中c(H+)=2×10-7 mol/L,其呈酸性 栏目链接解析:在酸性或碱性水溶液中均存在H+和OH-,故A错;pH=0的溶液中c(H+)=1.0 mol/L,并不是酸性最强的溶液,只是c(H+)>1.0 mol/L的溶液用pH表示酸性强弱不再方便,故B错;在温度一定时,c(H+)·c(OH-)=Kw是一个定值,故二者不能同时增大,故C对;纯水中,c(H+)=c(OH-),呈中性,故D错误。
答案:C 栏目链接 栏目链接例1 常温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+的浓度为( )
A.1×10-4 mol/L B.1×10-8 mol/L
C.1×10-11 mol/L D.1×10-10 mol/L一、水的电离及其影响因素
栏目链接解析:H2SO4加入溶液中,抑制了水的电离,水电离的H+浓度降低,溶液中的H+主要来自H2SO4,而OH-只由水提供,所以要求出H2SO4溶液中水电离的H+浓度应先求出溶液中的OH-浓度。由此推断在酸、碱溶液中均有:
c(H+)H2O=c(OH-)H2O,稀释后H2SO4溶液中c(H+)=10-4 mol/L,c(OH-)=1×10-10 mol/L,则c(OH-)=c(H+)H2O=1×10-10 mol/L。
答案:D
栏目链接名师点睛:酸、碱溶液之所以呈酸、碱性是由于水的电离被抑制了,虽然溶液中的总H+与OH-的浓度不等,但是其中由水电离出的c(H+)和c(OH-)是相等的,即酸溶液中水电离的c(H+)等于溶液中的c(OH-)浓度:c(H+)H2O=c(OH-)溶液;碱溶液中水电离的OH-浓度等于溶液中的H+浓度:c(OH-)H2O=c(H+)溶液。
栏目链接变式
应用1.(2013·上海卷)374 ℃、22.1 Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水 ( )
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
栏目链接解析:超临界水仍然呈中性,但含有较多的H+和OH-,pH小等于7,故A、C项错误;又超临界水具有很强的溶解有机物的能力,根据相似相容的原理可以知道B正确(有机物大多数是非极性分子),D错误;答案选B。
答案:B 栏目链接变式
应用 例2下列溶液肯定是酸性的是( )
A.含H+的溶液
B.由水电离出的c(OH-)=10-12 mol/L
C. pH<7的溶液
D.c(OH-)<c(H+)的溶液二、溶液酸性与pH的关系
栏目链接
解析:酸性、中性、碱性溶液中都含有H+,选项A错误;由水电离出的c(OH-)=10-12 mol·L-1,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,选项B错误;在温度未知的情况下,pH<7的溶液不一定显酸性,选项C错误;c(OH-)<c(H+)的溶液则一定显酸性,选项D正确。
答案:D
栏目链接名师点睛:溶液酸碱性与pH间的关系比较如下:
溶液呈中性的关键是看c(H+)=c(OH-)是否成立。 栏目链接变式
应用2.(双选题)在约100℃的温度下,NaCl稀溶液中c(H+)为1×10-6 mol/L。下列说法中正确的是( )
A.该NaCl溶液显酸性
B.该NaCl溶液显中性
C.该NaCl溶液中Kw=1×10-14
D.该NaCl溶液中Kw=1×10-12 栏目链接解析:在NaCl溶液中,Na+、Cl-对H2O?? H++OH-无影响。c(H+)为1×10-6 mol/L,c(OH-)也为1×10-6 mol/L。因此,该NaCl溶液显中性,Kw=1×10-6×1×10-6=1×10-12。
答案:BD 栏目链接
第二节 水的电离和溶液的酸碱性
第1课时 水的电离和溶液的酸碱性 栏目链接1.了解水的电离。
2.了解水的离子积常数。
3.了解溶液的酸碱性与pH的定义
栏目链接 栏目链接1.水的电离
水是一种极弱的电解质。电离方程式为____________________,也可以简写为 ____________ 。
2.水的离子积常数
(1)水的电离常数:K电离=__________。
(2)水的离子积常数:
Kw=______________。在室温下,纯水中的c(H+)=c(OH-)=______ mol/L,Kw=__________。
要点一 水的电离
栏目链接H2O+H2O??H3O++OH-H2O??H++OH-c(H+)·c(OH-)10-71.0×10-14 (3)影响因素:
水的离子积Kw,只受____的影响,温度升高,Kw____。
(4)适用范围:
Kw不仅适用于纯水,也适用于________________________________________________________________________。 栏目链接温度增大稀的电解质水溶液应用
思考1.离子积表达式Kw=c(H+)·c(OH-)中的c(H+)和c(OH-)一定是水电离出的c(H+)和c(OH-)吗?
提示:表达式中的c(H+)和c(OH-)均表示整个溶液中的c(H+)和c(OH-),不一定只是水电离出的c(H+)和c(OH-)。
栏目链接综合
拓展一、影响水的电离平衡的因素
栏目链接 ?特别提示:(1)不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等,判断溶液中水的电离程度时,酸溶液看c(OH-),碱溶液看c(H+)。
(2)促进水的电离平衡的因素有升温、加活泼金属、加入含弱酸(或碱)离子的盐(后边学习);抑制水的电离平衡因素有降温、加入酸(或强酸的酸式盐)、加入碱。
(3)水的离子积常数Kw仅仅是温度的函数,温度升高,Kw增大,温度不变,Kw不变,此时若c(H+)增大,则c(OH-)必减小,反之亦然。 栏目链接1.在某温度时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为( )
A.2.4×10-7mol/L B.0.1×10-7mol/L
C.mol/L D.c(OH-)无法确定
尝试
应用解析:纯水中c(H+)=c(OH-)。
答案:A 栏目链接要点二 溶液的酸碱性与pH
1.溶液的酸碱性与c(H+)和c(OH-)的关系
溶液的酸碱性取决于c(H+)和c(OH-)的________。
(1)酸性溶液:c(H+)________c(OH-);
(2)中性溶液:c(H+)________c(OH-);
(3)碱性溶液:c(H+)________c(OH-)。
栏目链接相对大小>= <2.溶液酸碱性与pH
(1)pH。
①定义:用 ________ 表示溶液酸碱性的强弱。
②表达式:pH=________。
③意义:pH越大,溶液碱性越____,每增大1个单位,c(OH-)变为原来的______倍;pH越小,酸性越______,每减小1个单位,c(H+)变为原来的______倍。
④适用范围:1×10-14 mol/L≤c(H+)≤1×100 mol/L的溶液。
栏目链接H+的物质的量浓度的负对数-lgc(H+)强10强10(2)溶液的酸碱性与pH的关系。
室温下:
酸性溶液 c(H+)__c(OH-),pH__7,
pH越小,溶液的酸性越__;
中性溶液 c(H+)__c(OH-),pH__7,
碱性溶液 c(H+)__c(OH-),pH__7,
pH越大,溶液的碱性越____。
栏目链接>< 强== <>强3.溶液pH的测定方法
(1)溶液pH的测定方法有 ______ 法、______法、pH计法。
(2)pH试纸的使用方法:__________________________________________________
,试纸变色后,马上与标准比色卡比较来确定溶液的pH(简记为“放、蘸、点、比”)。
栏目链接酸碱指示剂pH试纸把小块pH试纸放在玻璃片(或表面皿)上,用蘸有待测液的玻璃棒点在试纸的中央2.pH=7的溶液一定呈中性吗?
应用
思考提示:不一定。25℃时,pH=7的溶液呈中性,温度高于25℃时,由于水的电离程度增大,Kw>1.0×10-14,此时pH=7呈碱性。判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH的大小,因此只有满足c(H+)=c(OH-)的溶液才一定呈中性。
栏目链接3.pH试纸使用前能否用蒸馏水湿润,若湿润是否一定产生误差?提示:使用pH试纸前不能用蒸馏水湿润,湿润后相当于稀释了溶液,若是酸性溶液,则湿润后测得pH偏大,若为碱性溶液,湿润后测得pH偏小,若为中性溶液,则无影响。 栏目链接1.区别
酸、碱的强弱是以电解质的电离程度来区分的。强酸、强碱在溶液中完全电离,弱酸、弱碱在溶液中部分电离。
2.联系
(1)强酸溶液的酸性不一定比弱酸溶液的酸性强。
(2)酸性强的溶液不一定是强酸溶液。
(3)酸性相同的溶液弱酸浓度大,中和能力强。
例如:c(H+)=1 mol/L的醋酸溶液和盐酸溶液,体积均为1 L时,醋酸溶液中和能力更强。
综合
拓展二、溶液的酸碱性与酸碱强弱的关系
栏目链接 (4)中和能力相同的酸,其提供H+的能力相同。
例如:1 L 0.1 mol/L的CH3COOH和1 L 0.1 mol/L的盐酸,均可提供0.1 mol的H+。
三、pH的测定方法
1.利用酸碱指示剂测定。这种方法只能测出某一范围的pH,而不能得出具体的数值。下表列出了常用酸碱指示剂的变色范围。
常用酸碱指示剂的变色范围 栏目链接 栏目链接2.用pH试纸测定:pH试纸一般呈黄色,由多种指示剂的混合液浸制而成。 栏目链接 ?特别提示:pH试纸只能粗略地测定溶液酸碱性强弱?广泛pH试纸读数只能整数?。尝试
应用2.下列说法正确的是( )
A.强碱的水溶液中不存在H+
B.pH=0的溶液是酸性最强的溶液
C.在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大
D.某温度下,纯水中c(H+)=2×10-7 mol/L,其呈酸性 栏目链接解析:在酸性或碱性水溶液中均存在H+和OH-,故A错;pH=0的溶液中c(H+)=1.0 mol/L,并不是酸性最强的溶液,只是c(H+)>1.0 mol/L的溶液用pH表示酸性强弱不再方便,故B错;在温度一定时,c(H+)·c(OH-)=Kw是一个定值,故二者不能同时增大,故C对;纯水中,c(H+)=c(OH-),呈中性,故D错误。
答案:C 栏目链接 栏目链接例1 常温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+的浓度为( )
A.1×10-4 mol/L B.1×10-8 mol/L
C.1×10-11 mol/L D.1×10-10 mol/L一、水的电离及其影响因素
栏目链接解析:H2SO4加入溶液中,抑制了水的电离,水电离的H+浓度降低,溶液中的H+主要来自H2SO4,而OH-只由水提供,所以要求出H2SO4溶液中水电离的H+浓度应先求出溶液中的OH-浓度。由此推断在酸、碱溶液中均有:
c(H+)H2O=c(OH-)H2O,稀释后H2SO4溶液中c(H+)=10-4 mol/L,c(OH-)=1×10-10 mol/L,则c(OH-)=c(H+)H2O=1×10-10 mol/L。
答案:D
栏目链接名师点睛:酸、碱溶液之所以呈酸、碱性是由于水的电离被抑制了,虽然溶液中的总H+与OH-的浓度不等,但是其中由水电离出的c(H+)和c(OH-)是相等的,即酸溶液中水电离的c(H+)等于溶液中的c(OH-)浓度:c(H+)H2O=c(OH-)溶液;碱溶液中水电离的OH-浓度等于溶液中的H+浓度:c(OH-)H2O=c(H+)溶液。
栏目链接变式
应用1.(2013·上海卷)374 ℃、22.1 Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水 ( )
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
栏目链接解析:超临界水仍然呈中性,但含有较多的H+和OH-,pH小等于7,故A、C项错误;又超临界水具有很强的溶解有机物的能力,根据相似相容的原理可以知道B正确(有机物大多数是非极性分子),D错误;答案选B。
答案:B 栏目链接变式
应用 例2下列溶液肯定是酸性的是( )
A.含H+的溶液
B.由水电离出的c(OH-)=10-12 mol/L
C. pH<7的溶液
D.c(OH-)<c(H+)的溶液二、溶液酸性与pH的关系
栏目链接
解析:酸性、中性、碱性溶液中都含有H+,选项A错误;由水电离出的c(OH-)=10-12 mol·L-1,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,选项B错误;在温度未知的情况下,pH<7的溶液不一定显酸性,选项C错误;c(OH-)<c(H+)的溶液则一定显酸性,选项D正确。
答案:D
栏目链接名师点睛:溶液酸碱性与pH间的关系比较如下:
溶液呈中性的关键是看c(H+)=c(OH-)是否成立。 栏目链接变式
应用2.(双选题)在约100℃的温度下,NaCl稀溶液中c(H+)为1×10-6 mol/L。下列说法中正确的是( )
A.该NaCl溶液显酸性
B.该NaCl溶液显中性
C.该NaCl溶液中Kw=1×10-14
D.该NaCl溶液中Kw=1×10-12 栏目链接解析:在NaCl溶液中,Na+、Cl-对H2O?? H++OH-无影响。c(H+)为1×10-6 mol/L,c(OH-)也为1×10-6 mol/L。因此,该NaCl溶液显中性,Kw=1×10-6×1×10-6=1×10-12。
答案:BD 栏目链接
