【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第三章 第二节 第2课时 溶液pH值的计算习题课(38张PPT)
文档属性
| 名称 | 【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第三章 第二节 第2课时 溶液pH值的计算习题课(38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-07-30 00:00:00 | ||
图片预览











文档简介
课件38张PPT。第三章 水溶液中的离子平衡
第二节 水的电离和溶液的酸碱性
第2课时 溶液pH值的计算(习题课) 栏目链接1.掌握pH的简单计算。
2.了解各类混合溶液pH的计算。
3.了解溶液稀释时pH的变化规律。
栏目链接 栏目链接要点 单一溶液pH的计算
栏目链接2.酸溶液的pH计算
(1)强酸。
如HnA,设浓度为c mol/L,则
c(H+)=________,pH=-lgc(H+)=-________。
(2)一元弱酸(以浓度为c mol/L的HA为例)。
HA??H++A-
由于弱酸不完全电离,所以c(H+)<c mol/L,故pH>-lgc。若已知该酸的电离平衡常数为Ka。则该溶液的pH计算过程如下: 栏目链接nc mol/Llg(nc) 栏目链接3.碱溶液的pH计算
(1)强碱[以c mol/L的B(OH)n为例]。
c(OH-)=nc mol/L
c(H+)=________―→pH=-lgc(H+)=________。
(2)一元弱碱(以浓度为c mol/L的BOH为例)。
BOH??B++OH-
由于弱碱不完全电离,故c(OH-)<c mol/L,则c(H+)> mol/L,pH<14+lgc,若已知该碱的电离平衡常数为Kb,则该溶液的pH计算过程如下: 栏目链接10-14/nc14+lg(nc) 栏目链接14+lg4.强酸(弱酸),强碱(弱碱)加水稀释后的pH变化规律
(1)强酸,pH=a,加水稀释10n倍,则pH=______;
(2)弱酸,pH=a,加水稀释10n倍,则pH<______;
(3)强碱,pH=b,加水稀释10n倍,则pH=______;
(4)弱碱, pH=b,加水稀释10n倍,则pH_______;
(5)酸碱无限稀释,pH只能______7,酸不可能____于7,碱不可能____于7。
栏目链接a+na+nb-n>b-n接近于大小应用
思考 物质的量浓度相同的HCl和CH3COOH相比,哪个pH大?若二者的pH相同,则哪个物质的量浓度大?
提示:HCl为强酸,CH3COOH为弱酸,因此物质的量浓度相同的HCl和CH3COOH相比,后者c(H+)小,pH大,若二者pH相同,则CH3COOH的物质的量浓度大。
栏目链接综合
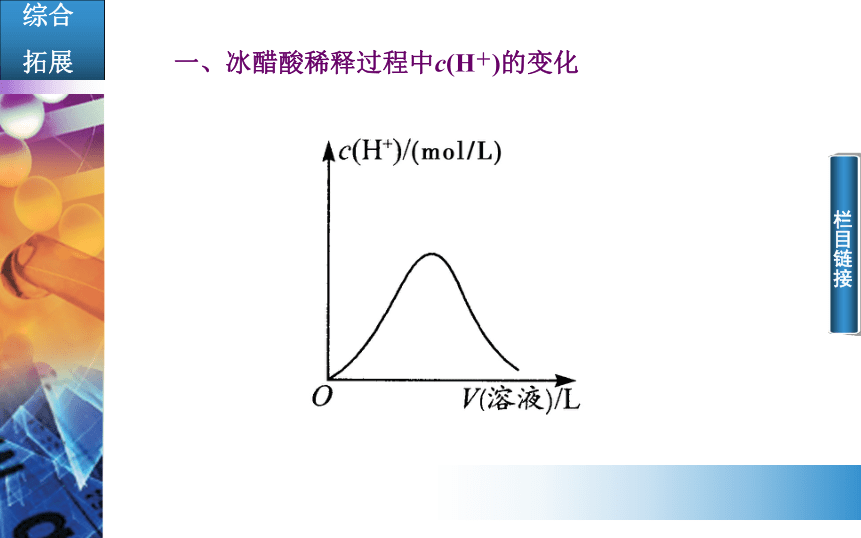
拓展一、冰醋酸稀释过程中c(H+)的变化
栏目链接在向醋酸中加水之前,醋酸分子尚未电离,c(H+)=0。在加水稀释之后,醋酸的电离开始,随着水的逐渐加入,电离平衡逐渐向生成CH3COO-和H+的方向移动。在此过程中V(液)和n(H+)都逐渐增大。那么c(H+)是增大、减小还是不变呢?对此可以这样分析:H+是从0开始增加,自然c(H+)也是从0开始增加,再以极限的观点来看,当加水至醋酸浓度非常小时,c(H+)又非常接近于0。从两端看中间,c(H+)变化的全过程是:小(0)→大→小(近于0)。对c(H+)变化的过程,还可用图像近似地表示出来(见上图)。
栏目链接二、稀释后溶液pH的变化规律的图象分析
1.pH=a的酸加水稀释过程中pH变化如图1所示
2.pH=b的碱加水稀释过程中pH变化如图2所示 栏目链接 ?特别提示:弱酸、弱碱在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH的范围。
栏目链接三、几种等体积混合溶液pH的计算问题
1.两强酸混合
栏目链接3.强酸、强碱溶液两两等体积混合后溶液的pH计算
栏目链接?特别提示:以上结果为近似计算值,要求酸与酸、碱与碱溶液混合时,两溶液的pH须相差2个单位以上。 栏目链接―→c(H+)混合―→pH 栏目链接四、pH计算口诀
酸按酸(H+),碱按碱(OH-),酸碱混合看过量,无限稀释7为限。
栏目链接1.甲溶液的pH是4,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为( )
A.10∶1 B.1∶10
C.2∶1 D.1∶2
尝试
应用解析:甲中c(H+)甲=10-4,乙中c(H+)乙=10-5,故c(H+)甲∶c(H+)乙=10-4∶10-5=10∶1。
答案:A 栏目链接2.(1)pH=2的HCl溶液稀释1 000倍,所得溶液pH=____________。
(2)pH=11的NaOH溶液稀释100倍,所得溶液pH=____________。
答案:5 9 栏目链接 栏目链接例1 两种浓度不同的NaOH溶液,c(H+)分别为1.0×10-14 mol/L和1.0×10-12 mol/L,将这两种溶液等体积混合后,所得溶液的c(H+)约为( )
A.0.5×(10-14+10-12) mol/L
B.5×(10-15+10-11) mol/L
C.2.0×10-1 mol/L
D.2.0×10-14 mol/L一、有关pH的计算
栏目链接解析:在c(H+)=1×10-14 mol/L的NaOH溶液中,
c(OH-)=1 mol/L;在c(H+)=1.0×10-12 mol/L的NaOH溶液中,c(OH-)=1.0×10-2 mol/L。两种溶液混合后,c(OH-)=(1+1.0×10-2)≈0.5 mol/L,所以c(H+)==2.0×10-14 mol/L。
答案:D
栏目链接名师点睛:碱溶液混合时,H+来自水电离,由于c(H+)很小,在溶液混合时,由于OH-浓度的变化而引起水的电离平衡发生移动,若按c(H+)浓度直接计算,数值变化极大, 通常应先求c(OH-)浓度,再换算成c(H+),切忌舍本逐末。
栏目链接变式
应用1.将pH=6的盐酸与pH=4的盐酸等体积混合后,溶液中c(OH-)最接近于( )
A.0.5×(10-8+10-10) mol/L
B.(10-8+10-10) mol/L
C.(1×10-5-5×10-14) mol/L
D.2×10-10 mol/L
栏目链接解析:不同浓度的酸混合时,一定要先计算混合后溶液中的c(H+),再根据水的离子积计算溶液中的c(OH-)。计算时若无温度说明,取25℃,且忽略混合时溶液体积的变化,得c(H+)= mol/L≈5×10-5 mol/L,则c(OH-)=2×10-10 mol/L。
答案:D 栏目链接例2 常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=11,则强碱与强酸的体积比为( )
A.11∶1 B.9∶1
C.1∶11 D.1∶9 栏目链接 栏目链接变式
应用2.取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01 mol/L B.0.017 mol/L
C.0.05 mol/L D.0.50 mol/L
栏目链接解析:设原溶液物质的量浓度为c,V(NaOH)=3 L,V(HCl)=2 L,二者混合后反应,混合溶液体积为5 L,所得溶液pH=12,则c(OH-)=10-2 mol/L,3 L×c-2 L×c=10-2 mol/L×5 L,则c=0.05 mol/L。
答案:C 栏目链接二、酸、碱溶液稀释后溶液的pH变化
例2 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如下图所示。据图判断正确的是( )
栏目链接A.Ⅱ为盐酸稀释时的pH变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
栏目链接 栏目链接解析:本题考查了强酸和弱酸的稀释规律,解题时要注意弱酸在稀释时还会继续电离。pH相同的盐酸(强酸)和醋酸(弱酸),稀释相同的倍数时,因醋酸在稀释时仍不断地电离,故盐酸的pH增大的多,故曲线Ⅰ代表盐酸稀释时pH变化曲线,A错误;不断加水稀释时,溶液中c(H+)不断减小,导电性减弱,B正确;因为Kw仅仅是温度的函数,因为是在相同的温度下,故a点Kw与c点Kw的数值相同,C错误;因盐酸和醋酸的pH相同,则c(醋酸)>c(盐酸),稀释相同的倍数,由于醋酸存在电离平衡,故仍有c(醋酸)>c(盐酸),D错误。
答案:B
栏目链接
3.pH相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的 m倍和n倍,稀释后两溶液pH仍相同,则 m和n的关系是( )
A.m=n B.m>n
C.m<n D.无法判断 栏目链接变式
应用 栏目链接解析:加水稀释CH3COOH?? CH3COO-+H+ 平衡右移, m>n。
答案:B 栏目链接
第二节 水的电离和溶液的酸碱性
第2课时 溶液pH值的计算(习题课) 栏目链接1.掌握pH的简单计算。
2.了解各类混合溶液pH的计算。
3.了解溶液稀释时pH的变化规律。
栏目链接 栏目链接要点 单一溶液pH的计算
栏目链接2.酸溶液的pH计算
(1)强酸。
如HnA,设浓度为c mol/L,则
c(H+)=________,pH=-lgc(H+)=-________。
(2)一元弱酸(以浓度为c mol/L的HA为例)。
HA??H++A-
由于弱酸不完全电离,所以c(H+)<c mol/L,故pH>-lgc。若已知该酸的电离平衡常数为Ka。则该溶液的pH计算过程如下: 栏目链接nc mol/Llg(nc) 栏目链接3.碱溶液的pH计算
(1)强碱[以c mol/L的B(OH)n为例]。
c(OH-)=nc mol/L
c(H+)=________―→pH=-lgc(H+)=________。
(2)一元弱碱(以浓度为c mol/L的BOH为例)。
BOH??B++OH-
由于弱碱不完全电离,故c(OH-)<c mol/L,则c(H+)> mol/L,pH<14+lgc,若已知该碱的电离平衡常数为Kb,则该溶液的pH计算过程如下: 栏目链接10-14/nc14+lg(nc) 栏目链接14+lg4.强酸(弱酸),强碱(弱碱)加水稀释后的pH变化规律
(1)强酸,pH=a,加水稀释10n倍,则pH=______;
(2)弱酸,pH=a,加水稀释10n倍,则pH<______;
(3)强碱,pH=b,加水稀释10n倍,则pH=______;
(4)弱碱, pH=b,加水稀释10n倍,则pH_______;
(5)酸碱无限稀释,pH只能______7,酸不可能____于7,碱不可能____于7。
栏目链接a+na+nb-n>b-n接近于大小应用
思考 物质的量浓度相同的HCl和CH3COOH相比,哪个pH大?若二者的pH相同,则哪个物质的量浓度大?
提示:HCl为强酸,CH3COOH为弱酸,因此物质的量浓度相同的HCl和CH3COOH相比,后者c(H+)小,pH大,若二者pH相同,则CH3COOH的物质的量浓度大。
栏目链接综合
拓展一、冰醋酸稀释过程中c(H+)的变化
栏目链接在向醋酸中加水之前,醋酸分子尚未电离,c(H+)=0。在加水稀释之后,醋酸的电离开始,随着水的逐渐加入,电离平衡逐渐向生成CH3COO-和H+的方向移动。在此过程中V(液)和n(H+)都逐渐增大。那么c(H+)是增大、减小还是不变呢?对此可以这样分析:H+是从0开始增加,自然c(H+)也是从0开始增加,再以极限的观点来看,当加水至醋酸浓度非常小时,c(H+)又非常接近于0。从两端看中间,c(H+)变化的全过程是:小(0)→大→小(近于0)。对c(H+)变化的过程,还可用图像近似地表示出来(见上图)。
栏目链接二、稀释后溶液pH的变化规律的图象分析
1.pH=a的酸加水稀释过程中pH变化如图1所示
2.pH=b的碱加水稀释过程中pH变化如图2所示 栏目链接 ?特别提示:弱酸、弱碱在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH的范围。
栏目链接三、几种等体积混合溶液pH的计算问题
1.两强酸混合
栏目链接3.强酸、强碱溶液两两等体积混合后溶液的pH计算
栏目链接?特别提示:以上结果为近似计算值,要求酸与酸、碱与碱溶液混合时,两溶液的pH须相差2个单位以上。 栏目链接―→c(H+)混合―→pH 栏目链接四、pH计算口诀
酸按酸(H+),碱按碱(OH-),酸碱混合看过量,无限稀释7为限。
栏目链接1.甲溶液的pH是4,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为( )
A.10∶1 B.1∶10
C.2∶1 D.1∶2
尝试
应用解析:甲中c(H+)甲=10-4,乙中c(H+)乙=10-5,故c(H+)甲∶c(H+)乙=10-4∶10-5=10∶1。
答案:A 栏目链接2.(1)pH=2的HCl溶液稀释1 000倍,所得溶液pH=____________。
(2)pH=11的NaOH溶液稀释100倍,所得溶液pH=____________。
答案:5 9 栏目链接 栏目链接例1 两种浓度不同的NaOH溶液,c(H+)分别为1.0×10-14 mol/L和1.0×10-12 mol/L,将这两种溶液等体积混合后,所得溶液的c(H+)约为( )
A.0.5×(10-14+10-12) mol/L
B.5×(10-15+10-11) mol/L
C.2.0×10-1 mol/L
D.2.0×10-14 mol/L一、有关pH的计算
栏目链接解析:在c(H+)=1×10-14 mol/L的NaOH溶液中,
c(OH-)=1 mol/L;在c(H+)=1.0×10-12 mol/L的NaOH溶液中,c(OH-)=1.0×10-2 mol/L。两种溶液混合后,c(OH-)=(1+1.0×10-2)≈0.5 mol/L,所以c(H+)==2.0×10-14 mol/L。
答案:D
栏目链接名师点睛:碱溶液混合时,H+来自水电离,由于c(H+)很小,在溶液混合时,由于OH-浓度的变化而引起水的电离平衡发生移动,若按c(H+)浓度直接计算,数值变化极大, 通常应先求c(OH-)浓度,再换算成c(H+),切忌舍本逐末。
栏目链接变式
应用1.将pH=6的盐酸与pH=4的盐酸等体积混合后,溶液中c(OH-)最接近于( )
A.0.5×(10-8+10-10) mol/L
B.(10-8+10-10) mol/L
C.(1×10-5-5×10-14) mol/L
D.2×10-10 mol/L
栏目链接解析:不同浓度的酸混合时,一定要先计算混合后溶液中的c(H+),再根据水的离子积计算溶液中的c(OH-)。计算时若无温度说明,取25℃,且忽略混合时溶液体积的变化,得c(H+)= mol/L≈5×10-5 mol/L,则c(OH-)=2×10-10 mol/L。
答案:D 栏目链接例2 常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=11,则强碱与强酸的体积比为( )
A.11∶1 B.9∶1
C.1∶11 D.1∶9 栏目链接 栏目链接变式
应用2.取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01 mol/L B.0.017 mol/L
C.0.05 mol/L D.0.50 mol/L
栏目链接解析:设原溶液物质的量浓度为c,V(NaOH)=3 L,V(HCl)=2 L,二者混合后反应,混合溶液体积为5 L,所得溶液pH=12,则c(OH-)=10-2 mol/L,3 L×c-2 L×c=10-2 mol/L×5 L,则c=0.05 mol/L。
答案:C 栏目链接二、酸、碱溶液稀释后溶液的pH变化
例2 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如下图所示。据图判断正确的是( )
栏目链接A.Ⅱ为盐酸稀释时的pH变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
栏目链接 栏目链接解析:本题考查了强酸和弱酸的稀释规律,解题时要注意弱酸在稀释时还会继续电离。pH相同的盐酸(强酸)和醋酸(弱酸),稀释相同的倍数时,因醋酸在稀释时仍不断地电离,故盐酸的pH增大的多,故曲线Ⅰ代表盐酸稀释时pH变化曲线,A错误;不断加水稀释时,溶液中c(H+)不断减小,导电性减弱,B正确;因为Kw仅仅是温度的函数,因为是在相同的温度下,故a点Kw与c点Kw的数值相同,C错误;因盐酸和醋酸的pH相同,则c(醋酸)>c(盐酸),稀释相同的倍数,由于醋酸存在电离平衡,故仍有c(醋酸)>c(盐酸),D错误。
答案:B
栏目链接
3.pH相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的 m倍和n倍,稀释后两溶液pH仍相同,则 m和n的关系是( )
A.m=n B.m>n
C.m<n D.无法判断 栏目链接变式
应用 栏目链接解析:加水稀释CH3COOH?? CH3COO-+H+ 平衡右移, m>n。
答案:B 栏目链接
