【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第三章 第三节 第2课时 影响盐类水解的主要因素和盐类水解的利用(32张PPT)
文档属性
| 名称 | 【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第三章 第三节 第2课时 影响盐类水解的主要因素和盐类水解的利用(32张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-07-30 00:00:00 | ||
图片预览











文档简介
课件32张PPT。第三章 水溶液中的离子平衡
第三节 盐类的水解
第2课时 影响盐类水解的主要因素和盐类水解的利用 栏目链接1.了解影响盐类水解平衡的因素。
2.了解盐类水解在生产、生活、化学实验和科学研究中的应用。
栏目链接 栏目链接要点一 影响因素
1.盐的分类(按生成盐的酸、碱的强弱划分)
大 促进 促进 抑制促进 大 栏目链接综合
拓展1.氯化铵水解平衡移动
NH+H2O?? NH3·H2O+H+(正反应为吸热反应)
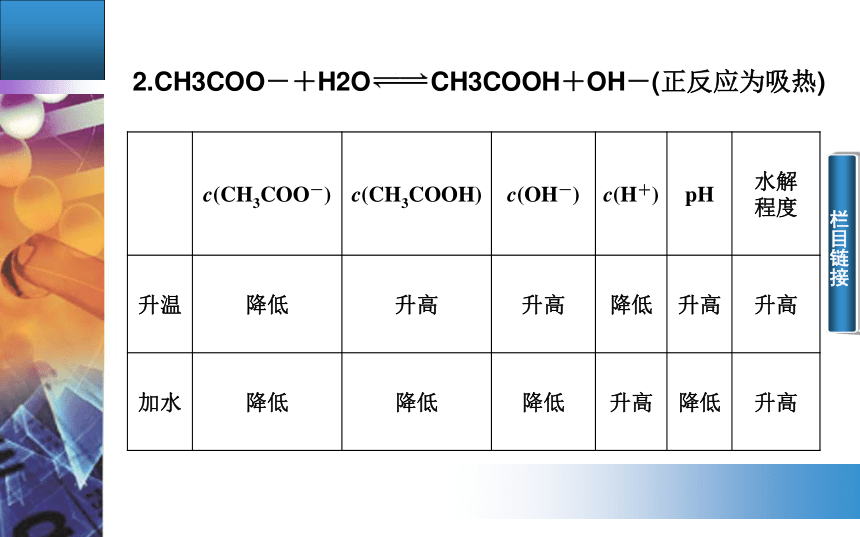
栏目链接 栏目链接 栏目链接2.CH3COO-+H2O?? CH3COOH+OH-(正反应为吸热) 栏目链接 栏目链接3.水解平衡常数
水解反应的平衡常数叫做水解平衡常数或水解常数,用Kh表示。
Kh=Kw·或Kh=Kw·;
K数值越大,水解趋势越大。
= 栏目链接1.向三份0.1 mol/L的CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
尝试
应用解析:题中涉及的离子水解方程式如下:
CH3COO-+H2O??CH3COOH+OH-,NH+H2O??NH3·H2O+H+,SO+H2O??HSO+OH-,Fe3++3H2O??Fe(OH)3+3H+。由上述方程式可知NH、Fe3+能促进CH3COO-的水解,CH3COO-浓度减小,SO抑制CH3COO-的水解,CH3COO-浓度增大,故选A。
答案:A 栏目链接 栏目链接要点二 盐类水解在生产、生活中的应用
1.用纯碱溶液清洗油污时,加热可____去污能力
2.化肥的施用
例如:草木灰与铵态氮肥不能混合施用,否则会使肥效____,这是两种盐发生水解相互____反应放出____的缘故。
3.盐溶液的配制
例如:配制FeCl3、SnCl2溶液时应加入少量____,目的是 ________________ ,防止________。
增强损耗促进 氨气盐酸溶液浑浊抑制Fe3+、Sn2+的水解 栏目链接4.用盐做净水剂
例如:利用FeCl3、明矾在水溶液中发生水解产生的____,能吸附水中悬浮的杂质,起到净水的作用。写出明矾净水的离子方程式:________________________________________________________________________。
5.泡沫灭火器原理
Al2(SO4)3溶液与小苏打溶液发生水解相互促进反应,产生大量泡沫,将燃烧物质与空气隔离开来。离子方程式为________________________________________________________________________。
6.利用水解反应来制纳米材料(氢氧化物可变成氧化物)
如制取TiO2:
胶体Al3++3H2O?? Al(OH)3(胶体)+3H+Al3++3HCO===Al(OH)3↓+3CO2↑ 栏目链接TiCl4+(x+2)H2O(过量)??TiO2·xH2O↓+4HCl;
栏目链接应用
思考2.实验室配制FeCl2溶液时,通常将FeCl2固体先溶解在盐酸中,再加水稀释至所需浓度,同时还加入少量铁屑,为什么?
提示:先溶解在盐酸中的目的是为了抑制Fe2+的水解,而加入铁屑的作用是为了防止Fe2+被氧化。
栏目链接3.配制FeCl3溶液时,能加少量硝酸抑制Fe3+水解吗?
提示:不能。因为引入杂质离子NO。 栏目链接二、利用盐类水解设计实验证明弱酸和弱碱
如证明Cu(OH)2为弱碱时,可用CuCl2溶液能使蓝色石蕊试纸变红(显酸性)证之。
三、弱酸、弱碱参与的中和消定实验中指示剂选择
指示剂选择的总原则是,所选择指示剂的变色范围应该与滴定后所得盐溶液的pH值范围相一致。即强酸与弱碱互滴时应选择甲基橙;弱酸与强碱互滴时应选择酚酞。
四、用潮湿的pH试纸测盐溶液pH值的误差分析
测定盐溶液pH时,试纸不能湿润,若中性溶液,测得pH不变仍为7,若强酸弱碱盐溶液,测得pH比实际偏大,若强碱弱酸盐溶液,测得pH比实际偏小。
综合
拓展 栏目链接五、加热蒸发和浓缩盐溶液时,最后残留物的判断
加热浓缩不水解的盐溶液时一般得原物质;加热浓缩Na2CO3型的盐溶液一般得原物质;加热浓缩FeCl3 型的盐溶液.最后得到Fe(OH)3,灼烧得Fe2O3 ;加热蒸干(NH4)2CO3或NH4HCO3型的盐溶液时,得不到固体;加热蒸干Ca(HCO3)2型的盐溶液时,最后得相应的正盐;加热Mg(HCO3)2、MgCO3 溶液最后得到Mg(OH)2 固体;加热Na2SO3型盐溶液,最后被空气氧化为Na2SO4。 栏目链接尝试
应用2.在氯化铁溶液中存在下列平衡:
FeCl3+3H2O??Fe(OH)3+3HCl ΔH>0。
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体。向这种液体中加入MgCl2溶液,产生的现象为________。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是________。
(3)在配制FeCl3溶液时,为防止浑浊,应加入______。
(4)向FeCl3溶液中加入少量NaClO溶液,预计可能看到的现象是________。 栏目链接解析:(1)加热FeCl3溶液,得到红褐色透明液体是Fe(OH)3胶体,遇到电解质MgCl2发生聚沉,得到Fe(OH)3沉淀。(2)加热促进FeCl3的水解,得到的HCl挥发,可使水解反应最终进行到底,得到Fe(OH)3沉淀,灼烧后分解产生Fe2O3。(3)为抑制FeCl3水解,应加入浓盐酸。(4)因为Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO,所以得到红褐色沉淀。
答案:(1)生成红褐色沉淀 (2)Fe2O3 (3)少许浓盐酸 (4)生成红褐色沉淀 栏目链接 栏目链接例1 在一定条件下,Na2CO3溶液中存在水解平衡:CO+H2O??HCO+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大,即盐的水解反应的化学平衡常数增大
B.通入CO2,平衡向正反应方向移动
C.升高温度,减小
D.加入NaOH固体,溶液pH减小一、影响水解平衡的因素
栏目链接解析:化学平衡常数只受温度的影响,A错误;通入的CO2与OH-反应,使平衡向正反应方向移动;B正确;温度升高,CO的水解程度增大,c(HCO)增大,c(CO)减小;C错误;加入NaOH固体,溶液的pH增大,D错误。
答案:B
名师点睛:分析化学平衡移动的方向应注意两点:一要明确改变了什么条件;二要明确该条件改变时,化学平衡状态的变量相应地如何变化。
栏目链接1.(双选题)为使Na2S溶液中c(Na+)/c(S2-)的值减小,可加入的物质是( )
A.盐酸 B.适量的NaOH溶液
C.适量的KOH溶液 D.适量KHS溶液
变式
应用 栏目链接解析:在Na2S溶液中存在S2-+H2O??HS-+OH-,HS-+H2O??H2S+OH-。A项,加入盐酸时,H++OH-===H2O,水解平衡右移,c(S2-)减小,c(Na+)/c(S2-)的值增大;B项,加入适量的NaOH溶液,c(OH-)增大,使平衡左移,c(S2-)增大,而c(Na+)增大的更多,故c(Na+)/c(S2-)的值增大;C项,加入适量的KOH溶液,c(OH-)增大,平衡左移,c(S2-)增大,而c(Na+)不变,故c(Na+)/c(S2-)的值减小;D项,加入适量的KHS溶液,c(HS-)增大,平衡左移,c(S2-)增大,而c(Na+)不变,故c(Na+)/c(S2-)的值减小。
答案:CD 栏目链接例2 下列浓度关系正确的是( )
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠溶液与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO)>c(OH-)>
c(HCO)>c(H+)二、粒子浓度的比较
栏目链接解析:氯水中存在的平衡关系有:Cl2+H2O??HClO+Cl-+H+,HClO??H++ClO-,H2O??H++OH-,由此可知氯水中氯元素的存在的形式有Cl2、Cl-、ClO-、HClO,由于HClO部分电离,故c(H+)>c(Cl-)>c(ClO-)>c(OH-),A、B均不正确;由于CH3COO-水解生成CH3COOH,使得c(Na+)>c(CH3COO-),C项错误;Na2CO3溶液存在两种水解平衡:CO+H2O??HCO+OH-,HCO+H2O??H2CO3+OH-,溶液呈碱性,D项正确。
答案:D
栏目链接名师点睛:解决此类问题时,首先分析考查离子浓度大小的关系是相等还是不等。(1)若使用的是“>”或“<”,应主要考虑“电离”和“水解”;(2)若用“=”连接,应根据“守恒”原理,视不同情况,从下列几个方面思考:若等号一端全部是阴离子或阳离子应首先考虑电荷守恒;若等号一端各项中都含有同一种元素时,首先考虑这种元素的原子守恒;若等号一端为c(H+)或c(OH-)时,首先考虑是否符合水的电离守恒。
关于“离子浓度大小的比较规律”见章末知识热点专题探究“二”。
栏目链接变式
应用2.(2014·揭阳市高三学业水平测试)常温下有0.1 mol·L-1的NaHC2O4溶液,其pH=4,下列说法正确的是( )
栏目链接 栏目链接 栏目链接
第三节 盐类的水解
第2课时 影响盐类水解的主要因素和盐类水解的利用 栏目链接1.了解影响盐类水解平衡的因素。
2.了解盐类水解在生产、生活、化学实验和科学研究中的应用。
栏目链接 栏目链接要点一 影响因素
1.盐的分类(按生成盐的酸、碱的强弱划分)
大 促进 促进 抑制促进 大 栏目链接综合
拓展1.氯化铵水解平衡移动
NH+H2O?? NH3·H2O+H+(正反应为吸热反应)
栏目链接 栏目链接 栏目链接2.CH3COO-+H2O?? CH3COOH+OH-(正反应为吸热) 栏目链接 栏目链接3.水解平衡常数
水解反应的平衡常数叫做水解平衡常数或水解常数,用Kh表示。
Kh=Kw·或Kh=Kw·;
K数值越大,水解趋势越大。
= 栏目链接1.向三份0.1 mol/L的CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
尝试
应用解析:题中涉及的离子水解方程式如下:
CH3COO-+H2O??CH3COOH+OH-,NH+H2O??NH3·H2O+H+,SO+H2O??HSO+OH-,Fe3++3H2O??Fe(OH)3+3H+。由上述方程式可知NH、Fe3+能促进CH3COO-的水解,CH3COO-浓度减小,SO抑制CH3COO-的水解,CH3COO-浓度增大,故选A。
答案:A 栏目链接 栏目链接要点二 盐类水解在生产、生活中的应用
1.用纯碱溶液清洗油污时,加热可____去污能力
2.化肥的施用
例如:草木灰与铵态氮肥不能混合施用,否则会使肥效____,这是两种盐发生水解相互____反应放出____的缘故。
3.盐溶液的配制
例如:配制FeCl3、SnCl2溶液时应加入少量____,目的是 ________________ ,防止________。
增强损耗促进 氨气盐酸溶液浑浊抑制Fe3+、Sn2+的水解 栏目链接4.用盐做净水剂
例如:利用FeCl3、明矾在水溶液中发生水解产生的____,能吸附水中悬浮的杂质,起到净水的作用。写出明矾净水的离子方程式:________________________________________________________________________。
5.泡沫灭火器原理
Al2(SO4)3溶液与小苏打溶液发生水解相互促进反应,产生大量泡沫,将燃烧物质与空气隔离开来。离子方程式为________________________________________________________________________。
6.利用水解反应来制纳米材料(氢氧化物可变成氧化物)
如制取TiO2:
胶体Al3++3H2O?? Al(OH)3(胶体)+3H+Al3++3HCO===Al(OH)3↓+3CO2↑ 栏目链接TiCl4+(x+2)H2O(过量)??TiO2·xH2O↓+4HCl;
栏目链接应用
思考2.实验室配制FeCl2溶液时,通常将FeCl2固体先溶解在盐酸中,再加水稀释至所需浓度,同时还加入少量铁屑,为什么?
提示:先溶解在盐酸中的目的是为了抑制Fe2+的水解,而加入铁屑的作用是为了防止Fe2+被氧化。
栏目链接3.配制FeCl3溶液时,能加少量硝酸抑制Fe3+水解吗?
提示:不能。因为引入杂质离子NO。 栏目链接二、利用盐类水解设计实验证明弱酸和弱碱
如证明Cu(OH)2为弱碱时,可用CuCl2溶液能使蓝色石蕊试纸变红(显酸性)证之。
三、弱酸、弱碱参与的中和消定实验中指示剂选择
指示剂选择的总原则是,所选择指示剂的变色范围应该与滴定后所得盐溶液的pH值范围相一致。即强酸与弱碱互滴时应选择甲基橙;弱酸与强碱互滴时应选择酚酞。
四、用潮湿的pH试纸测盐溶液pH值的误差分析
测定盐溶液pH时,试纸不能湿润,若中性溶液,测得pH不变仍为7,若强酸弱碱盐溶液,测得pH比实际偏大,若强碱弱酸盐溶液,测得pH比实际偏小。
综合
拓展 栏目链接五、加热蒸发和浓缩盐溶液时,最后残留物的判断
加热浓缩不水解的盐溶液时一般得原物质;加热浓缩Na2CO3型的盐溶液一般得原物质;加热浓缩FeCl3 型的盐溶液.最后得到Fe(OH)3,灼烧得Fe2O3 ;加热蒸干(NH4)2CO3或NH4HCO3型的盐溶液时,得不到固体;加热蒸干Ca(HCO3)2型的盐溶液时,最后得相应的正盐;加热Mg(HCO3)2、MgCO3 溶液最后得到Mg(OH)2 固体;加热Na2SO3型盐溶液,最后被空气氧化为Na2SO4。 栏目链接尝试
应用2.在氯化铁溶液中存在下列平衡:
FeCl3+3H2O??Fe(OH)3+3HCl ΔH>0。
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体。向这种液体中加入MgCl2溶液,产生的现象为________。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是________。
(3)在配制FeCl3溶液时,为防止浑浊,应加入______。
(4)向FeCl3溶液中加入少量NaClO溶液,预计可能看到的现象是________。 栏目链接解析:(1)加热FeCl3溶液,得到红褐色透明液体是Fe(OH)3胶体,遇到电解质MgCl2发生聚沉,得到Fe(OH)3沉淀。(2)加热促进FeCl3的水解,得到的HCl挥发,可使水解反应最终进行到底,得到Fe(OH)3沉淀,灼烧后分解产生Fe2O3。(3)为抑制FeCl3水解,应加入浓盐酸。(4)因为Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO,所以得到红褐色沉淀。
答案:(1)生成红褐色沉淀 (2)Fe2O3 (3)少许浓盐酸 (4)生成红褐色沉淀 栏目链接 栏目链接例1 在一定条件下,Na2CO3溶液中存在水解平衡:CO+H2O??HCO+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大,即盐的水解反应的化学平衡常数增大
B.通入CO2,平衡向正反应方向移动
C.升高温度,减小
D.加入NaOH固体,溶液pH减小一、影响水解平衡的因素
栏目链接解析:化学平衡常数只受温度的影响,A错误;通入的CO2与OH-反应,使平衡向正反应方向移动;B正确;温度升高,CO的水解程度增大,c(HCO)增大,c(CO)减小;C错误;加入NaOH固体,溶液的pH增大,D错误。
答案:B
名师点睛:分析化学平衡移动的方向应注意两点:一要明确改变了什么条件;二要明确该条件改变时,化学平衡状态的变量相应地如何变化。
栏目链接1.(双选题)为使Na2S溶液中c(Na+)/c(S2-)的值减小,可加入的物质是( )
A.盐酸 B.适量的NaOH溶液
C.适量的KOH溶液 D.适量KHS溶液
变式
应用 栏目链接解析:在Na2S溶液中存在S2-+H2O??HS-+OH-,HS-+H2O??H2S+OH-。A项,加入盐酸时,H++OH-===H2O,水解平衡右移,c(S2-)减小,c(Na+)/c(S2-)的值增大;B项,加入适量的NaOH溶液,c(OH-)增大,使平衡左移,c(S2-)增大,而c(Na+)增大的更多,故c(Na+)/c(S2-)的值增大;C项,加入适量的KOH溶液,c(OH-)增大,平衡左移,c(S2-)增大,而c(Na+)不变,故c(Na+)/c(S2-)的值减小;D项,加入适量的KHS溶液,c(HS-)增大,平衡左移,c(S2-)增大,而c(Na+)不变,故c(Na+)/c(S2-)的值减小。
答案:CD 栏目链接例2 下列浓度关系正确的是( )
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠溶液与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO)>c(OH-)>
c(HCO)>c(H+)二、粒子浓度的比较
栏目链接解析:氯水中存在的平衡关系有:Cl2+H2O??HClO+Cl-+H+,HClO??H++ClO-,H2O??H++OH-,由此可知氯水中氯元素的存在的形式有Cl2、Cl-、ClO-、HClO,由于HClO部分电离,故c(H+)>c(Cl-)>c(ClO-)>c(OH-),A、B均不正确;由于CH3COO-水解生成CH3COOH,使得c(Na+)>c(CH3COO-),C项错误;Na2CO3溶液存在两种水解平衡:CO+H2O??HCO+OH-,HCO+H2O??H2CO3+OH-,溶液呈碱性,D项正确。
答案:D
栏目链接名师点睛:解决此类问题时,首先分析考查离子浓度大小的关系是相等还是不等。(1)若使用的是“>”或“<”,应主要考虑“电离”和“水解”;(2)若用“=”连接,应根据“守恒”原理,视不同情况,从下列几个方面思考:若等号一端全部是阴离子或阳离子应首先考虑电荷守恒;若等号一端各项中都含有同一种元素时,首先考虑这种元素的原子守恒;若等号一端为c(H+)或c(OH-)时,首先考虑是否符合水的电离守恒。
关于“离子浓度大小的比较规律”见章末知识热点专题探究“二”。
栏目链接变式
应用2.(2014·揭阳市高三学业水平测试)常温下有0.1 mol·L-1的NaHC2O4溶液,其pH=4,下列说法正确的是( )
栏目链接 栏目链接 栏目链接
