【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第四章 第二节 化学电源(33张PPT)
文档属性
| 名称 | 【金版学案】2014-2015学年高中化学 人教版选修4 课件(课标点击+知识导学+典例精析):第四章 第二节 化学电源(33张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-07-30 06:28:30 | ||
图片预览











文档简介
课件33张PPT。第四章 电化学基础
第二节 化学电源 栏目链接1.了解化学电源的优点及在各方面的应用。
2.认识一次电池、二次电池和燃料电池。
3.了解废旧电池对环境的危害,树立环保意识 栏目链接 栏目链接要点一 化学电池
化学电池是将________能变成________能的装置。
1.化学电池的分类
化学电池
2.优点
(1)化学电池的______________较高,供能稳定可靠。
(2)可以制成各种形状和大小、不同容量和电压的电池及电池组。
(3)使用方便,易于维护,并可在各种环境下工作。化学电一次二次燃料能量转换效率 栏目链接3.判断电池优劣的主要标准
(1)比能量:即单位质量或单位体积所能________的多少,单位是(W·h)/kg或(W·h)/L。
(2)比功率:即单位质量或单位体积所能________的大小,单位是W/kg或W/L。
(3)电池的 ________ 的长短。
4.化学电池回收利用
废旧电池中含________和________等有害物质,应回收利用,既减少污染,又节约资源。
输出电能输出功率可储存时间重金属 酸碱 栏目链接要点二 一次电池
一次电池的电解质溶液制成________,不流动,也叫做干电池。
1.特点
一次电池不能充电,不能反复使用。
2.常见的一次电池
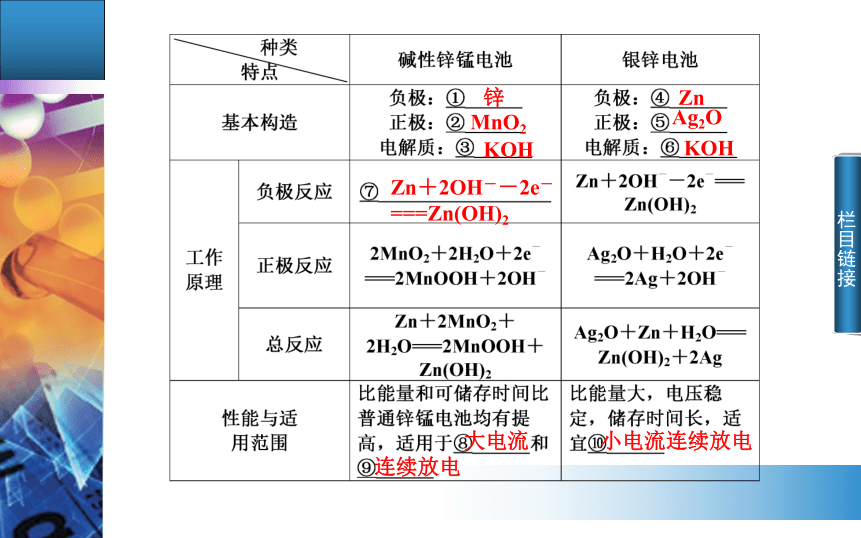
胶状 栏目链接锌MnO2KOHZnAg2OKOHZn+2OH--2e-
===Zn(OH)2大电流连续放电小电流连续放电 栏目链接要点三 二次电池
二次电池放电后可以再________使活性物质获得再生,又称________或________。
1.铅蓄电池的构造
负极:________,正极:________,电解质溶液:______溶液。
2.铅蓄电池的工作原理
(1)放电时:
负极:
________________________________________________________________________;充电充电电池蓄电池PbPbO2H2SO4Pb(s)+SO(aq)-2e-===PbSO4(s) 栏目链接正极:PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O(l);
总反应:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)。
(2)充电时:
铅蓄电池的充电反应是放电反应的逆过程
阴极:_________________________________________________;
阳极:PbSO4(s)+2H2O(l)-2e-===PbO2(s)+4H+(aq)+SO(aq);
总反应:2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)。PbSO4(s)+2e-===Pb(s)+SO(aq) 栏目链接总反应:2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)。
上述充放电反应可写成一个可逆反应方程式:3.铅蓄电池的特点
电压稳定、使用方便、安全可靠、价格低廉、生产生活中应用广泛,缺点是比能量低、笨重、废弃电池污染环境 栏目链接要点四 燃料电池
H2-2e-===2H+H2-2e-+2OH-===2H2O2H2+O2===2H2O小 栏目链接电极反应式的书写方法
1.书写要遵循的原则
原电池两电极上分别发生氧化反应或还原反应,因此电极反应式的书写要遵循质量守恒、电子守恒及电荷守恒。
弱电解质、气体和难溶物均写成化学式,其余的以离子符号表示。
正极反应、负极反应产物根据题意或化学方程式确定,也要注意电解质溶液的成分对电极产物的影响。
2.电极反应式的书写类型
(1)根据装置书写电极反应式。
首先判断该电池所依据的化学反应,从而确定两个半反应即电极反应。综合
拓展 栏目链接(2)给出总反应式,写电极反应式。
各类电极反应式的一般书写步骤为:①列出物质,标电子的得失;②选离子,配电荷;③配个数,巧用水;④两式加,验总式。
如以2H2+O2===2H2O为例,当电解质溶液为KOH溶液时的电极反应式的书写步骤如下:
◆负极反应式的书写
①根据总反应方程式列出总式两边化合价升高的有关物质为H2,转移电子数为4e-:2H2-4e-===4H+。
②根据电解质溶液的酸碱性,用H+或OH-或其他离子配平,使两边电荷总数相等:2H2-4e-+4OH-===4H2O。
注意:电子带负电荷;在碱性溶液中,电极反应式不出现H+。 栏目链接③利用H2O使两边的元素守恒,即得:
2H2-4e-+4OH-===4H2O。
◆正极反应式的书写
①O2+4e-===2O2-。②O2+4e-+2H2O===4OH-,注意在碱性溶液中提供H+使O2-变为OH-的是水,要写成化学式的形式。
将正负极反应式相加,若得到总反应式,说明写法正确。
(3)可充电电池电极反应式的书写。
在书写可充电电池电极反应式时,由于电极都参加反应,且正方向、逆方向反应都能反应,所以要明确电池和电极,放电为原电池,充电为电解池;原电池的负极与电解池的阳极发生氧化反应,对应元素化合价升高;原电池的正极与电解池的阴极发生还原反应,对应元素化合价降低。 栏目链接(4)给出电极反应书写总反应方程式。
根据给出的两个电极反应式,写出总反应方程式时,首先要使两个电极反应式的得失电子相等后将两式相加,消去反应物和生成物中相同的物质即可。注意若反应式同侧出现不能共存的离子,如H+和OH-、Pb2+和SO,要写成反应后的物质如H2O、PbSO4。
特别提示:解答书写有关电极反应式的题目时,应先写出总化学方程式,再找出电解质溶液的成分,最后分别写出正极反应式和负极反应式,从而作出合理的判断。 栏目链接 栏目链接一、一次电池例1碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池负极的电极反应式为Zn-2e-+2OH-===Zn(OH)2
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g解析:该电池中Zn为负极,失去电子;该反应中转移2e-,通过计算每转移0.2 mol电子,Zn反应6.5 g;电子由负极通过外导线流向正极,所以C错。
答案:C
名师点睛:原电池工作时,活泼金属为负极,失去电子,所以电子流向为:负极→导线→正极。
在书写电极反应式时考虑离子反应、离子共存的情况。 栏目链接变式
应用1.(2013·海南卷)Mg—AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+ Mg===Mg2++2Ag+2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl溶液激活
D.可用于海上应急照明供电
栏目链接解析:根据氧化还原判断,Mg为还原剂是负极、失电子,所以A、B都错;C是指电解质溶液可用KCl 溶液代替,C错;明显D正确。
答案:D 栏目链接例2铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电池液为稀硫酸,工作时该电池的总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。试根据上述情况判断:
(1)蓄电池的负极材料是________。
(2)工作时,正极反应为________________________________________________。
(3)工作时,电解质溶液的pH________(填“增大”、“减小”或“不变”)。二、二次电池
栏目链接(4)工作时,电解质溶液中阴离子移向________极。
(5)电流方向从________极流向________极。
(6)充电时,铅蓄电池的负极与电源的________极相连接。
栏目链接解析:蓄电池工作(放电)时,起原电池作用。题中各小题概括叙述了蓄电池放电时所涉及的各个方面,分析如下:根据原电池原理,负极发生氧化反应元素化合价升高,所以Pb为负极;正极发生还原反应元素化合价降低,从总反应式可知,PbO2是氧化剂,即正极反应为:PbO2+SO+4H++2e-===PbSO4+2H2O;从正极反应或电池的总反应可知H2SO4参加了反应,H+转变成H2O,所以pH增大;原电池工作时溶液中阴离子移向负极,阳离子移向正极;电流方向与电子移动方向相反,从正极沿导线流向负极。
答案:(1)Pb (2)PbO2+SO+4H++2e-===PbSO4+2H2O (3)增大 (4)负 (5)正 负 (6)负 栏目链接名师点睛:总反应中,放电的方向为原电池方向,电极名称为正负极,正极发生还原反应,负极发生氧化反应;充电的方向为电解池方向,电极名称为阴阳极,阳极发生氧化反应,阴极发生还原反应。二次电池充电时,需“正接正,负接负”,即原电池的正极连接外接电源的正极,原电池的负极连接外接电源的负极。 栏目链接变式
应用2.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是:
2PbSO4+2H2O充电放电PbO2+Pb+2H2SO4。
下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是:Pb-2e-+SO===PbSO4
D.工作时电解质的密度减小 栏目链接解析:铅蓄电池在工作时相当于原电池,发生氧化反应的电极是负极,发生还原反应的电极是正极,所以Pb是负极,PbO2是正极;在工作时,负极发生的反应是铅失去电子生成Pb2+,Pb2+与溶液中的SO生成PbSO4沉淀,放电时消耗的硫酸与充电时生成的硫酸相等,在电池制备时,PbSO4的量是一定的,制成膏状的PbSO4干燥后安装,说明H2SO4不用补充;放电时,H2SO4被消耗,溶液中的H2SO4的物质的量浓度减小,所以溶液的密度也随之减小。
答案:A 栏目链接三、燃料电池例3一种甲醇、氧气和强碱溶液作电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH+3O2+4OH-??2CO+6H2O,则有关说法正确的是( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH--6e-===CO+6H2O
C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低 栏目链接解析:从电池反应可知,CH3OH为原电池的负极,A选项错误;正极反应为:O2+2H2O+4e-===4OH-,标准状况下,5.6 L O2为0.25 mol,转移电子为1 mol,C选项错误;从正极反应可以看出,正极附近溶液OH-的浓度增大,pH升高,D选项错误。
答案:B
名师点睛:本题考查原电池原理在燃料电池中的具体应用。首先要正确判断出电池的正负极,其方法是确定在该电极上发生的是失电子还是得电子反应,若发生的是失电子反应,则是原电池的负极,反之是正极。解决此类问题应先写出总的化学反应方程式,再结合电解质溶液的成分把总方程式进行整理,最后分别写出正极反应式和负极反应式,结合选项作出合理判断。 栏目链接变式
应用3.(1)今有2H2+O2 2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是__________,电极反应式为:__________________________、____________________________。
(2)如把KOH改为稀H2SO4作导电物质,则电极反应式为:
_________________________________________________、
___________________________________________。
(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化?_____________________________________________。
(3)如把H2改为甲烷,KOH做导电物质,则电极反应式为:
____________________________________________________。 栏目链接解析:解决此题的关键是弄清原电池的电极反应类型:“负极氧化正极还原”。所以氢氧燃料电池中H2为负极反应物,O2为正极反应物;又因为是碱性溶液不可能有H+参加或生成,故负极反应为:2H2+4OH--4e-===4H2O,正极反应为:O2+2H2O+4e-===4OH-。若将导电物质换成酸性溶液,此时应考虑不可能有OH-参加反应也不可能有OH-生成,负极:2H2-4e-===4H+,正极:O2+4H++4e-===2H2O。由于前者在碱性条件反应,KOH量不变,但工作时H2O增多,故溶液变稀,pH将变小;而后者为酸溶液,H2SO4不变,水增多,溶液酸性变小,故pH将变大。如把H2改为甲烷用KOH作导电物质,则不会有CO2放出,该电池中的电极反应为:负极:CH4+10OH--8e-===CO+7H2O,正极:2O2+4H2O+8e-===8OH-。 栏目链接答案:(1)H2 O2 负极:2H2+4OH--4e-===4H2O 正极:O2+2H2O+4e-===4OH-
(2)负极:2H2-4e-===4H+
正极:O2+4H++4e-===2H2O
(1)中pH变小,(2)中pH变大
(3)负极:CH4+10OH-—8e-===CO+7H2O
正极:2O2+4H2O+8e-===8OH- 栏目链接
第二节 化学电源 栏目链接1.了解化学电源的优点及在各方面的应用。
2.认识一次电池、二次电池和燃料电池。
3.了解废旧电池对环境的危害,树立环保意识 栏目链接 栏目链接要点一 化学电池
化学电池是将________能变成________能的装置。
1.化学电池的分类
化学电池
2.优点
(1)化学电池的______________较高,供能稳定可靠。
(2)可以制成各种形状和大小、不同容量和电压的电池及电池组。
(3)使用方便,易于维护,并可在各种环境下工作。化学电一次二次燃料能量转换效率 栏目链接3.判断电池优劣的主要标准
(1)比能量:即单位质量或单位体积所能________的多少,单位是(W·h)/kg或(W·h)/L。
(2)比功率:即单位质量或单位体积所能________的大小,单位是W/kg或W/L。
(3)电池的 ________ 的长短。
4.化学电池回收利用
废旧电池中含________和________等有害物质,应回收利用,既减少污染,又节约资源。
输出电能输出功率可储存时间重金属 酸碱 栏目链接要点二 一次电池
一次电池的电解质溶液制成________,不流动,也叫做干电池。
1.特点
一次电池不能充电,不能反复使用。
2.常见的一次电池
胶状 栏目链接锌MnO2KOHZnAg2OKOHZn+2OH--2e-
===Zn(OH)2大电流连续放电小电流连续放电 栏目链接要点三 二次电池
二次电池放电后可以再________使活性物质获得再生,又称________或________。
1.铅蓄电池的构造
负极:________,正极:________,电解质溶液:______溶液。
2.铅蓄电池的工作原理
(1)放电时:
负极:
________________________________________________________________________;充电充电电池蓄电池PbPbO2H2SO4Pb(s)+SO(aq)-2e-===PbSO4(s) 栏目链接正极:PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O(l);
总反应:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)。
(2)充电时:
铅蓄电池的充电反应是放电反应的逆过程
阴极:_________________________________________________;
阳极:PbSO4(s)+2H2O(l)-2e-===PbO2(s)+4H+(aq)+SO(aq);
总反应:2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)。PbSO4(s)+2e-===Pb(s)+SO(aq) 栏目链接总反应:2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)。
上述充放电反应可写成一个可逆反应方程式:3.铅蓄电池的特点
电压稳定、使用方便、安全可靠、价格低廉、生产生活中应用广泛,缺点是比能量低、笨重、废弃电池污染环境 栏目链接要点四 燃料电池
H2-2e-===2H+H2-2e-+2OH-===2H2O2H2+O2===2H2O小 栏目链接电极反应式的书写方法
1.书写要遵循的原则
原电池两电极上分别发生氧化反应或还原反应,因此电极反应式的书写要遵循质量守恒、电子守恒及电荷守恒。
弱电解质、气体和难溶物均写成化学式,其余的以离子符号表示。
正极反应、负极反应产物根据题意或化学方程式确定,也要注意电解质溶液的成分对电极产物的影响。
2.电极反应式的书写类型
(1)根据装置书写电极反应式。
首先判断该电池所依据的化学反应,从而确定两个半反应即电极反应。综合
拓展 栏目链接(2)给出总反应式,写电极反应式。
各类电极反应式的一般书写步骤为:①列出物质,标电子的得失;②选离子,配电荷;③配个数,巧用水;④两式加,验总式。
如以2H2+O2===2H2O为例,当电解质溶液为KOH溶液时的电极反应式的书写步骤如下:
◆负极反应式的书写
①根据总反应方程式列出总式两边化合价升高的有关物质为H2,转移电子数为4e-:2H2-4e-===4H+。
②根据电解质溶液的酸碱性,用H+或OH-或其他离子配平,使两边电荷总数相等:2H2-4e-+4OH-===4H2O。
注意:电子带负电荷;在碱性溶液中,电极反应式不出现H+。 栏目链接③利用H2O使两边的元素守恒,即得:
2H2-4e-+4OH-===4H2O。
◆正极反应式的书写
①O2+4e-===2O2-。②O2+4e-+2H2O===4OH-,注意在碱性溶液中提供H+使O2-变为OH-的是水,要写成化学式的形式。
将正负极反应式相加,若得到总反应式,说明写法正确。
(3)可充电电池电极反应式的书写。
在书写可充电电池电极反应式时,由于电极都参加反应,且正方向、逆方向反应都能反应,所以要明确电池和电极,放电为原电池,充电为电解池;原电池的负极与电解池的阳极发生氧化反应,对应元素化合价升高;原电池的正极与电解池的阴极发生还原反应,对应元素化合价降低。 栏目链接(4)给出电极反应书写总反应方程式。
根据给出的两个电极反应式,写出总反应方程式时,首先要使两个电极反应式的得失电子相等后将两式相加,消去反应物和生成物中相同的物质即可。注意若反应式同侧出现不能共存的离子,如H+和OH-、Pb2+和SO,要写成反应后的物质如H2O、PbSO4。
特别提示:解答书写有关电极反应式的题目时,应先写出总化学方程式,再找出电解质溶液的成分,最后分别写出正极反应式和负极反应式,从而作出合理的判断。 栏目链接 栏目链接一、一次电池例1碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池负极的电极反应式为Zn-2e-+2OH-===Zn(OH)2
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g解析:该电池中Zn为负极,失去电子;该反应中转移2e-,通过计算每转移0.2 mol电子,Zn反应6.5 g;电子由负极通过外导线流向正极,所以C错。
答案:C
名师点睛:原电池工作时,活泼金属为负极,失去电子,所以电子流向为:负极→导线→正极。
在书写电极反应式时考虑离子反应、离子共存的情况。 栏目链接变式
应用1.(2013·海南卷)Mg—AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+ Mg===Mg2++2Ag+2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl溶液激活
D.可用于海上应急照明供电
栏目链接解析:根据氧化还原判断,Mg为还原剂是负极、失电子,所以A、B都错;C是指电解质溶液可用KCl 溶液代替,C错;明显D正确。
答案:D 栏目链接例2铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电池液为稀硫酸,工作时该电池的总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。试根据上述情况判断:
(1)蓄电池的负极材料是________。
(2)工作时,正极反应为________________________________________________。
(3)工作时,电解质溶液的pH________(填“增大”、“减小”或“不变”)。二、二次电池
栏目链接(4)工作时,电解质溶液中阴离子移向________极。
(5)电流方向从________极流向________极。
(6)充电时,铅蓄电池的负极与电源的________极相连接。
栏目链接解析:蓄电池工作(放电)时,起原电池作用。题中各小题概括叙述了蓄电池放电时所涉及的各个方面,分析如下:根据原电池原理,负极发生氧化反应元素化合价升高,所以Pb为负极;正极发生还原反应元素化合价降低,从总反应式可知,PbO2是氧化剂,即正极反应为:PbO2+SO+4H++2e-===PbSO4+2H2O;从正极反应或电池的总反应可知H2SO4参加了反应,H+转变成H2O,所以pH增大;原电池工作时溶液中阴离子移向负极,阳离子移向正极;电流方向与电子移动方向相反,从正极沿导线流向负极。
答案:(1)Pb (2)PbO2+SO+4H++2e-===PbSO4+2H2O (3)增大 (4)负 (5)正 负 (6)负 栏目链接名师点睛:总反应中,放电的方向为原电池方向,电极名称为正负极,正极发生还原反应,负极发生氧化反应;充电的方向为电解池方向,电极名称为阴阳极,阳极发生氧化反应,阴极发生还原反应。二次电池充电时,需“正接正,负接负”,即原电池的正极连接外接电源的正极,原电池的负极连接外接电源的负极。 栏目链接变式
应用2.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是:
2PbSO4+2H2O充电放电PbO2+Pb+2H2SO4。
下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是:Pb-2e-+SO===PbSO4
D.工作时电解质的密度减小 栏目链接解析:铅蓄电池在工作时相当于原电池,发生氧化反应的电极是负极,发生还原反应的电极是正极,所以Pb是负极,PbO2是正极;在工作时,负极发生的反应是铅失去电子生成Pb2+,Pb2+与溶液中的SO生成PbSO4沉淀,放电时消耗的硫酸与充电时生成的硫酸相等,在电池制备时,PbSO4的量是一定的,制成膏状的PbSO4干燥后安装,说明H2SO4不用补充;放电时,H2SO4被消耗,溶液中的H2SO4的物质的量浓度减小,所以溶液的密度也随之减小。
答案:A 栏目链接三、燃料电池例3一种甲醇、氧气和强碱溶液作电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH+3O2+4OH-??2CO+6H2O,则有关说法正确的是( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH--6e-===CO+6H2O
C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低 栏目链接解析:从电池反应可知,CH3OH为原电池的负极,A选项错误;正极反应为:O2+2H2O+4e-===4OH-,标准状况下,5.6 L O2为0.25 mol,转移电子为1 mol,C选项错误;从正极反应可以看出,正极附近溶液OH-的浓度增大,pH升高,D选项错误。
答案:B
名师点睛:本题考查原电池原理在燃料电池中的具体应用。首先要正确判断出电池的正负极,其方法是确定在该电极上发生的是失电子还是得电子反应,若发生的是失电子反应,则是原电池的负极,反之是正极。解决此类问题应先写出总的化学反应方程式,再结合电解质溶液的成分把总方程式进行整理,最后分别写出正极反应式和负极反应式,结合选项作出合理判断。 栏目链接变式
应用3.(1)今有2H2+O2 2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是__________,电极反应式为:__________________________、____________________________。
(2)如把KOH改为稀H2SO4作导电物质,则电极反应式为:
_________________________________________________、
___________________________________________。
(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化?_____________________________________________。
(3)如把H2改为甲烷,KOH做导电物质,则电极反应式为:
____________________________________________________。 栏目链接解析:解决此题的关键是弄清原电池的电极反应类型:“负极氧化正极还原”。所以氢氧燃料电池中H2为负极反应物,O2为正极反应物;又因为是碱性溶液不可能有H+参加或生成,故负极反应为:2H2+4OH--4e-===4H2O,正极反应为:O2+2H2O+4e-===4OH-。若将导电物质换成酸性溶液,此时应考虑不可能有OH-参加反应也不可能有OH-生成,负极:2H2-4e-===4H+,正极:O2+4H++4e-===2H2O。由于前者在碱性条件反应,KOH量不变,但工作时H2O增多,故溶液变稀,pH将变小;而后者为酸溶液,H2SO4不变,水增多,溶液酸性变小,故pH将变大。如把H2改为甲烷用KOH作导电物质,则不会有CO2放出,该电池中的电极反应为:负极:CH4+10OH--8e-===CO+7H2O,正极:2O2+4H2O+8e-===8OH-。 栏目链接答案:(1)H2 O2 负极:2H2+4OH--4e-===4H2O 正极:O2+2H2O+4e-===4OH-
(2)负极:2H2-4e-===4H+
正极:O2+4H++4e-===2H2O
(1)中pH变小,(2)中pH变大
(3)负极:CH4+10OH-—8e-===CO+7H2O
正极:2O2+4H2O+8e-===8OH- 栏目链接
