【备考2023】浙教版科学“冲刺重高”压轴训练(二十九):表格类化学计算(含解析)
文档属性
| 名称 | 【备考2023】浙教版科学“冲刺重高”压轴训练(二十九):表格类化学计算(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 504.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-18 21:14:32 | ||
图片预览




文档简介
1.实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如表,请分析计算:
实验组别 一 二 三 四
稀盐酸质量/g 100.0 100.0 100.0 100.0
混合物质量/g 3.0 6.0 9.0 12.0
所得溶液质量/g 101.9 103.8 105.0 a
剩余固体质量/g 0 0 m n
(1)反应后,稀盐酸还有剩余的是第 组;
(2)求混合物中碳酸钙和氯化钙质量之比;
(3)表中a的值为 ;
(4)求表中m的值。
2.为了测定硫酸铜晶体(CuSO4 xH2O)中的x值,将硫酸铜晶体放在坩埚中加热,直至不含结晶水,某学生测得的实验数据为
质量/g
坩埚+硫酸铜晶体 15.8
坩埚+无水硫酸铜 14.2
坩 埚 11.8
(1)根据实验数据,硫酸铜晶体中含结晶水 g;
(2)计算出CuSO4 xH2O中x的值(取整数);
(3)精确实验测得硫酸铜晶体的化学式为CuSO4 5H2O,那么实验产生的误差可能是下列情况中的 造成的(用编号表示).
A.加热前坩埚不干燥
B.加热时晶体有少量溅出坩埚
C.加热时蓝色未完全变白
D.加热后坩埚未放入干燥器中冷却.
3.取石灰石样品4克,把20克稀盐酸分4次加入样品中( 样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶与水),充分反应后经过过滤、干燥,最后称量,得如下数据:
实验次数 第1次 第2次 第3次 第5次
稀盐酸用量/克 5 5 5 5
剩余固体质量/克 3 2 1 1
(1)求该石灰石样品中碳酸钙的质量分数。
(2)计算稀盐酸的溶质质量分数。
4.草木灰是农村常用的一种肥料(其有效成分是K2CO3)。某兴趣小组为了测定草木灰中K2CO3的含量,取现有的草木灰40g放入锥形瓶中,将40g盐酸分4次(每次10g)加入瓶中,所得溶液总质量与加入盐酸的关系如下表;已知K2CO3+2HC=2KCl+H2O+CO2↑(假设草木灰中除K2CO3外,其它物质均不溶于水,也不与盐酸反应并写出结算过程)
所加次数 第一次 第二次 第三次 第四次
锥形瓶中物质总质量/g 49.68 59.36 69.12 79.12
(1)以上四次实验,其中盐酸有剩余的是 。
(2)第一次加入盐酸后产生气体的质量为 克。
(3)草木灰中K2CO3的质量分数为多少?
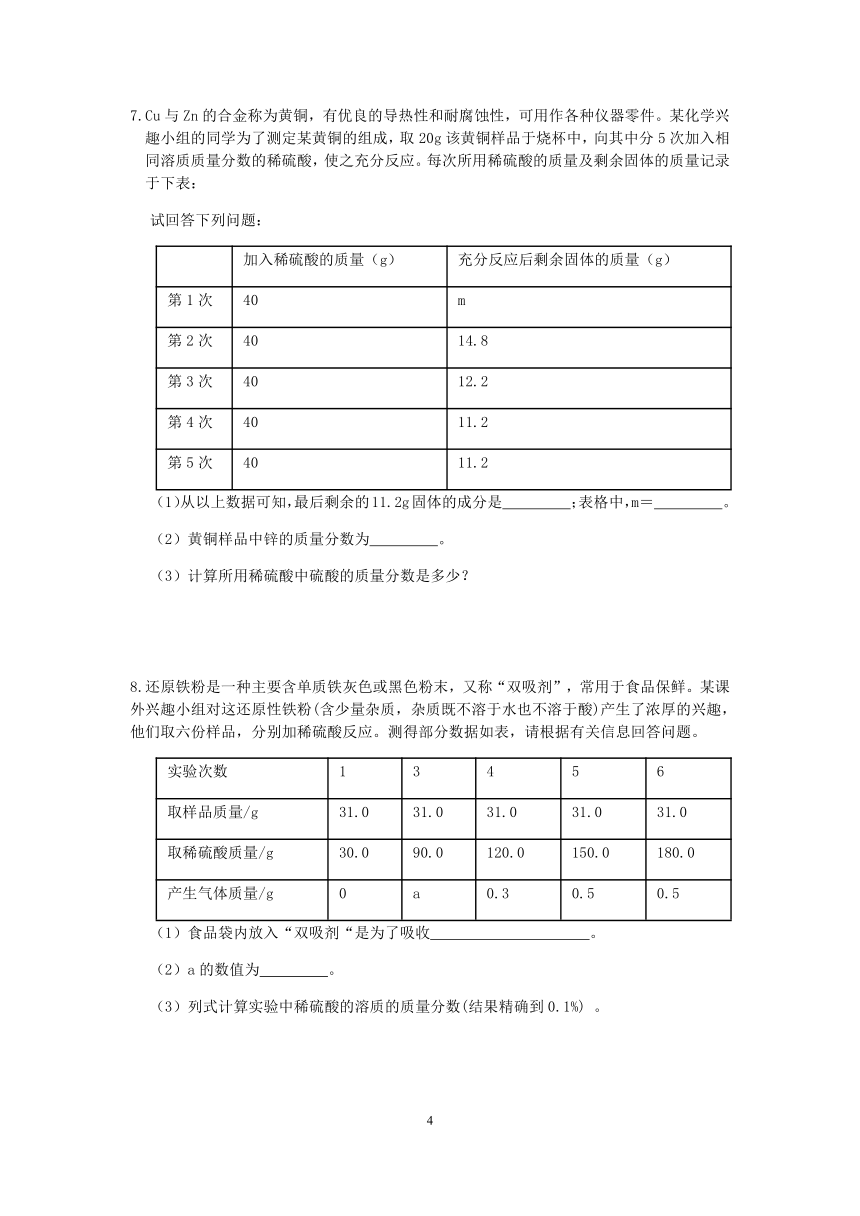
5.Cu,Zn合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量 (g) 充分反应后剩余固体的质量 (g)
第 1 次 40 m
第 2 次 40 14.8
第 3 次 40 12.2
第 4 次 40 11.2
第 5 次 40 11.2
试回答下列问题:
(1)从以上数据可知,最后剩余的 11.2g 固体的成分是 ;表格中,m= .
(2)黄铜样品中锌的质量分数为 .
(3)计算所用稀硫酸中硫酸的质量分数是多少?
6.某化学兴趣小组为了测定某黄铜(铜、饰合金)样品中锌的质量分数,取10g样品放入烧杯中。再取 60g稀硫酸分六次加入烧杯中,直至充分反应,实验数据如下:
第一次 第二次 第三次 第四次 第五次 第六次
加入H2SO4的质量(g) 10 10 10 10 10 10
剩余固体的质量(g) 9.35 8.7 8.05 7.4 6.95
(1)黄铜样品中锌的质量分数为多少?
(2)所用稀硫酸的质量分数为多少
7.Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第1次 40 m
第2次 40 14.8
第3次 40 12.2
第4次 40 11.2
第5次 40 11.2
(1)从以上数据可知,最后剩余的11.2g固体的成分是 ;表格中,m= 。
(2)黄铜样品中锌的质量分数为 。
(3)计算所用稀硫酸中硫酸的质量分数是多少?
8.还原铁粉是一种主要含单质铁灰色或黑色粉末,又称“双吸剂”,常用于食品保鲜。某课外兴趣小组对这还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸)产生了浓厚的兴趣,他们取六份样品,分别加稀硫酸反应。测得部分数据如表,请根据有关信息回答问题。
实验次数 1 3 4 5 6
取样品质量/g 31.0 31.0 31.0 31.0 31.0
取稀硫酸质量/g 30.0 90.0 120.0 150.0 180.0
产生气体质量/g 0 a 0.3 0.5 0.5
(1)食品袋内放入“双吸剂“是为了吸收 。
(2)a的数值为 。
(3)列式计算实验中稀硫酸的溶质的质量分数(结果精确到0.1%) 。
9.Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第1次 40 m
第2次 40 14.8
第3次 40 12.2
第4次 40 11.2
第5次 40 11.2
试回答下列问题:
(1)从以上数据可知,最后剩余的11.2g固体的成分是 ;表格中,m= 。
(2)黄铜样品中锌的质量分数为 。
(3)计算所用稀硫酸中硫酸的质量分数是多少?
10.铁的锈蚀对社会生产造成较大损害,但也有有利的一面。
(1)某些食品包装袋内常放入铁粉作“双吸剂”(吸收氧气和水蒸气,含少量杂质,杂质既不溶于水也不溶于酸),以防止食品腐败。小明取了一包食品袋中的“双吸剂”,均分出完全相同的5份样品,分别加入浓度相同的稀硫酸充分反应。测得如下表数据,请根据有关信息回答问题:
实验次数 1 2 3 4 5
样品质量/g 30 30 30 30 30
稀硫酸质量/g 30 90 120 1505 180
产生气体质量/g 0 0.1 0.3 0.5 0.6
①食品袋内的“双吸剂”用铁粉而不用铁块的理由是 。
②通过计算求30g样品中单质铁的质量 。
(2)暖宝宝的主要成分是:铁粉、碳粉、水、食盐等,它的产热原理与铁生锈相同,能在短时间内产生大量的热,且食盐能使铁快速生锈。小明利用如图装置推测:U型管左侧红墨水水位先上升。但实际上他观察到反应开始后左侧水位反而先下降。请解释U型管左侧红墨水先下降的原因 。
11.小华想测定Cu—Zn合金和Cu—Ag合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器。
(1)根据现有的条件,你认为能测出 合金中铜的质量分数。
A.Cu—Zn合金
B.Cu—Ag合金
C.Cu—Zn合金和Cu—Ag合金
(2)为了测定该合金的组成,小华称取10克该合金粉末,在粉末中连续三次加入稀盐酸反应。每加一次盐酸,小华记录所得气体的质量,根据下表实验数据,求出该合金中铜的质量分数。(列式计算)
第一次 第二次 第三次
连续加入盐酸的体积(mL) 10 10 10
生成氢气的质量(g) 0.08 0.08 0.04
12.某样品为Cu和CuO的混合物。为测定样品中CuO的含量,甲、乙、丙、丁四位学生用同一样品分别进行实验,测定的数据如下:
物质质量 甲 乙 丙 丁
所取固体样品的质量(g) 30 25 20 20
加入硫酸溶液的质量(g) 100 100 100 120
反应后剩余固体的质量(g) 22 17 12 12
分析实验数据,回答下列问题:
(1)写出氧化铜与硫酸反应的化学方程式: 。
(2)求混合物中氧化铜的质量分数。
(3)求硫酸溶液的质量分数。
13.市售的工业纯碱往往含有杂质氯化钠,某科学小组以某品牌工业纯碱为样品测定其中Na2CO3的质量分数,实验过程如图所示:
请回答下列问题:
(1)写出实验过程中相关反应的化学方程式 。
(2)若取用样品的质量为10.7g,且实验过程中无质量损失,生成沉淀B的质量为10g,求纯碱样品中Na2CO3的质量?
(3)请通过计算,判断该产品是否符合包装说明?
14.在一定量的氢氧化钠稀溶液中逐渐滴加稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:
反应时间(秒) 0 25 50 75 100 125 150 175 200
滴入稀盐酸体积(毫升) 0 4 8 12 16 20 24 28 32
pH 13.2 13.0 12.7 12.4 12.1 7.0 2.0 1.6 1.3
温度(℃) 36.9 37.5 38.0 38.5 38.8 39.2 39.0 38.8 38.6
(1)观察上表发现,当反应时间在 秒时开始,溶液中氯化钠的质量不再增加。
(2)完成上述实验,能否用氢氧化钠固体代替,并请说明原因 。
(3)结合上表中滴入稀盐酸体积与pH的变化数据,试计算氢氧化钠稀溶液中溶质的质量(稀HCl的密度取1.0g/mL,稀盐酸溶质质量分数为7.3%)
15.Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 ① ② ③ ④
NaOH溶液质量/g 10.0 20.0 30.0 40.0
Mg(OH)2质量/g 0.232 0.522 0.580 0.580
(1)实验 (填实验编号)中硫酸镁完全反应。
(2)计算100g混合溶液中含MgSO4的质量分数。(写出计算过程)。
参考答案
1.解:(1)根据图表中数据分析,每消耗3.0g混合物,溶液增加1.9g,第三次加入混合物9.0g,溶液增加质量为5.0g小于1.9g×3,说明混合物剩余,稀盐酸完全反应;第一、二组稀盐酸还有剩余,故填:一、二;
(2)由第一组数据可知,二氧化碳的质量为100.0+3.0g﹣101.9g=1.1g
设3.0g混合物中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 1.1g
x=2.5g
混合物中碳酸钙和氯化钙质量之比为2.5g:(3.0g﹣2.5g)=5:1;故填:5:1;
(3)由于第三组混合物剩余,稀盐酸完全反应;所以第四组比第三组多溶解了12.0g﹣9.0g=3.0g混合物中的氯化钙,3.0g混合物中的氯化钙质量为3.0g0.5g,所以a=105.0+0.5=105.5,故填:105.5;
(4)第三组中产生二氧化碳的质量为100.0g+9.0g﹣105.0g﹣m=4.0g﹣m
设反应的碳酸钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
y 4.0g﹣m
y,
9.0g混合物中的碳酸钙质量为9.0g7.5g
所以m=7.5g
m=1.25g,故填:1.25。
2.解:由表格中的数据,水的质量为反应前后固体质量的差,则水的质量为:15.8g﹣14.2g=1.6g;
(2)由表格中的数据,硫酸铜的质量为:14.2g﹣11.8g=2.4g,
则CuSO 4.xH2OCuSO 4+xH2O,
160 18x
2.4g 1.6g
x=6;
(3)硫酸铜晶体中结晶水的质量分数为:100%=40%,
A、加热前坩埚不干燥,加热后水挥发,导致水的质量测定结果偏大,故A正确;
B、加热过程中晶体有少量溅失会导致测定的水的质量偏大,故B正确;
C、加热时蓝色未完全变白,水的质量偏小,导致测定的水的质量偏小,故C错误;
D、加热后容器未放入干燥器中冷却会导致测定的水的质量偏小,故D错误.
故选:AB.
故答案为:(1)1.6g;(2)6;(3)AB.
3.(1)由题意样品中杂质不参与反应且不溶于水,样品中碳酸钙的质量为4g-1g=3g,则样品中碳酸钙的质量分数为
(2)根据题意加入10g稀盐酸反应了2g碳酸钙,设参加反应的氯化氢的质量为x,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
2g x
x=1.46g
稀盐酸的溶质质量分数
4.(1)三、四(2)0.32
(3)解:设草木灰中碳酸钾质量为x克,
CO2的质量为:80-79.12=0.88克
K2CO3+2H Cl =2KCl+H2O+CO2↑
138 44
X 0.88g
X=2.76g
草木灰中K2CO3的质量分数 :
5.(1)Cu;17.4
(2)44%
(3)设稀硫酸质量分数为X
Zn+ H2SO4= ZnSO4+ H2↑
65 98
2.6g 40gx
65:98=2.6g:40gx
x=9.8%
6.(1)解:由表中的数据可知,每加入10g的稀硫酸消耗固体的质量为0.65g,第五次加入10g的稀硫酸只反应掉的固体是0.45g<0.65g,说明有剩余硫酸,剩余的固体是不反应的铜,所以黄铜样品中锌的质量为:10g-6.95g=3.05g;
所以黄铜样品中锌的质量分数为:
答:黄铜样品中锌的质量分数为30.5%;
(2)设10g稀硫酸中溶质质量为x
Zn+ H2SO4=ZnSO4+H2↑
65 98
0.65g x
解得:x=0.98g
稀硫酸中溶质质量分数为:
答:所用稀硫酸的质量分数为9.8%.
7.(1)Cu;17.4
(2)44%
(3)设所用稀硫酸中硫酸的质量分数为x
Zn+H2SO4=ZnSO4+H2↑
65 98
2.6g 40gx
65:98=2.6g:40gx
x=9.8%
【解析】(1)由表中数据可知,第4次后再增加稀硫酸,固体质量不再减少,说明能与稀硫酸反应的锌完全反应,11.2克为不能与稀硫酸反应的铜的质量,40克稀硫酸完全反应消耗锌的质量为2.6g,则m=14.8+2.6=17.4;
(2)黄铜中锌的质量分数为=44%;
8.(1)吸收氧气和水蒸气
(2)0.1
(3)30克稀硫酸与铁完全反应产生氢气质量为0.5-0.3=0.2g,设稀硫酸的溶质质量分数为x
Fe+H2SO4=FeSO4+H2↑
98 2
30gx 0.2g
98:2=30gx:0.2g
x=32.7%
【解析】(1)食品袋内放入“双吸剂“是为了吸收氧气和水蒸气;
(2)由表中所给数据可知,30克稀硫酸与铁完全反应产生氢气质量为0.5-0.3=0.2g,则表中a为0.1;
(3)30克稀硫酸与铁完全反应产生氢气质量为0.5-0.3=0.2g,设稀硫酸的溶质质量分数为x
Fe+H2SO4=FeSO4+H2↑
98 2
30gx 0.2g
98:2=30gx:0.2g
x=32.7%
9.(1)Cu;17.4
(2)44%
(3)设40g稀硫酸中硫酸的质量为x
H2SO4+Zn═ZnSO4+H2↑
98 65
x 2.6g
;
解得:x=3.92g
稀硫酸中硫酸的质量分数为:。
【解析】(1)由金属活动性可知,合金中只有锌可以与硫酸反应。由表中的数据可知:第4次再加入40g稀硫酸时。第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应。反应掉的锌的质量为:14.8g-12.2g=2.6g。据此分析,m=14.8g+2.6g=17.4g。由第四次反应掉的锌的质量为:12.2g-11.2g=1g<2.6g,可判断此时合金中金属锌已完全反应,剩余的固体11.2g的成分是铜;
(2)黄铜样品中锌的质量分数为:;
10.(1)增大接触面积;16.8g
(2)左边能使铁生锈。生锈需要消耗氧气,气压下降,放出大量的热,气压迅速增大
【解析】(1)①食品袋内的“双吸剂”用铁粉而不用铁块的理由是:增大接触面积;
②根据表格可知,生成氢气的质量为0.6g,
设参加反应的铁单质的质量为x,
Fe+2HCl=FeCl2+H2↑;
56 2
x 0.6g
;
解得:x=16.8g。
(2)U型管左侧红墨水先下降的原因:左边能使铁生锈。生锈需要消耗氧气,气压下降,放出大量的热,气压迅速增大。
11.(1)A
(2)解:设10克Cu—Zn合金中Zn的质量为x.
Zn+H2SO4=ZnSO4+ H2↑
65 2
x 0.2g
x=6.5g
铜的质量分数为:
答:该合金中铜的质量分数为
【解析】(1)实验室只提供了一瓶稀盐酸,只有两种金属一种能与盐酸反应而另一种不能与盐酸反应,这样才能测量出其中一种金属的质量,进而得到另一种金属质量,最终才能测出铜的质量分数,合金中Cu-Zn组合符合该条件;Cu-Ag合金中的铜、银均不与稀盐酸反应,不能测出铜的质量分数。
12.(1)CuO+H2SO4=CuSO4+H2O
(2)由表中数据可知,加入100克硫酸时,固体都减少8克,说明100克硫酸完全反应消耗8克氧化铜,由丙丁数据可知,20克固体与100克硫酸恰好完全反应,则氧化铜的质量分数为;
(3)设硫酸的质量分数为x
CuO+H2SO4=CuSO4+H2O
80 98
8g 100gx
80:98=8g:100gx
x=9.8%.
13.(1)Na2CO3+CaCl2=CaCO3↓+2NaCl
(2)解:设纯碱样品中Na2CO3的质量为x
=
x=10.6g
答:纯碱样品中Na2CO3的质量为10.6g。
(3)解:纯碱样品中Na2CO3的质量分数= ×100%≈99.1%>99%,所以该产品符合包装说明
14.(1)125
(2)NaOH溶于水放出热量,会干扰结果
(3)恰好完全反应时消耗HCl质量为20mL× 1.0g/mL ×7.3%=1.46g
设氢氧化钠稀溶液中溶质的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 1.46g
40:36.5=x:1.46g
x=1.6g
【解析】(1)氢氧化钠与盐酸反应生成氯化钠和水,恰好完全反应时氯化钠不再增加,此时溶液中pH=7,由表中数据可知,当反应时间在125秒时开始,溶液中氯化钠的质量不再增加 ;
(2)氢氧化钠固体溶解也会放热,干扰结果,所以不能用氢氧化钠固体代替溶液进行实验;
(3)恰好完全反应时消耗HCl质量为20mL× 1.0g/mL ×7.3%=1.46g
设氢氧化钠稀溶液中溶质的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 1.46g
40:36.5=x:1.46g
x=1.6g
15.(1)③④
(2)设100混合溶液中含MgSO4的质量为x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓;
120 58
x 0.580g
;
解得:x=1.2g
100g混合溶液中含硫酸镁的质量分数:。
【解析】(1)由实验②可知,每消耗10.0gNaOH溶液生成氢氧化镁沉淀0.29g,第③次在增加10.0gNaOH溶液沉淀增加的质量为0.058g<0.29g,说明此时硫酸镁完全反应,氢氧化钠已过量,所以实验③④中硫酸镁完全反应。
(2)设100混合溶液中含MgSO4的质量为x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓;
120 58
x 0.580g
;
解得:x=1.2g
100g混合溶液中含硫酸镁的质量分数:。
表格类化学计算
实验组别 一 二 三 四
稀盐酸质量/g 100.0 100.0 100.0 100.0
混合物质量/g 3.0 6.0 9.0 12.0
所得溶液质量/g 101.9 103.8 105.0 a
剩余固体质量/g 0 0 m n
(1)反应后,稀盐酸还有剩余的是第 组;
(2)求混合物中碳酸钙和氯化钙质量之比;
(3)表中a的值为 ;
(4)求表中m的值。
2.为了测定硫酸铜晶体(CuSO4 xH2O)中的x值,将硫酸铜晶体放在坩埚中加热,直至不含结晶水,某学生测得的实验数据为
质量/g
坩埚+硫酸铜晶体 15.8
坩埚+无水硫酸铜 14.2
坩 埚 11.8
(1)根据实验数据,硫酸铜晶体中含结晶水 g;
(2)计算出CuSO4 xH2O中x的值(取整数);
(3)精确实验测得硫酸铜晶体的化学式为CuSO4 5H2O,那么实验产生的误差可能是下列情况中的 造成的(用编号表示).
A.加热前坩埚不干燥
B.加热时晶体有少量溅出坩埚
C.加热时蓝色未完全变白
D.加热后坩埚未放入干燥器中冷却.
3.取石灰石样品4克,把20克稀盐酸分4次加入样品中( 样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶与水),充分反应后经过过滤、干燥,最后称量,得如下数据:
实验次数 第1次 第2次 第3次 第5次
稀盐酸用量/克 5 5 5 5
剩余固体质量/克 3 2 1 1
(1)求该石灰石样品中碳酸钙的质量分数。
(2)计算稀盐酸的溶质质量分数。
4.草木灰是农村常用的一种肥料(其有效成分是K2CO3)。某兴趣小组为了测定草木灰中K2CO3的含量,取现有的草木灰40g放入锥形瓶中,将40g盐酸分4次(每次10g)加入瓶中,所得溶液总质量与加入盐酸的关系如下表;已知K2CO3+2HC=2KCl+H2O+CO2↑(假设草木灰中除K2CO3外,其它物质均不溶于水,也不与盐酸反应并写出结算过程)
所加次数 第一次 第二次 第三次 第四次
锥形瓶中物质总质量/g 49.68 59.36 69.12 79.12
(1)以上四次实验,其中盐酸有剩余的是 。
(2)第一次加入盐酸后产生气体的质量为 克。
(3)草木灰中K2CO3的质量分数为多少?
5.Cu,Zn合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量 (g) 充分反应后剩余固体的质量 (g)
第 1 次 40 m
第 2 次 40 14.8
第 3 次 40 12.2
第 4 次 40 11.2
第 5 次 40 11.2
试回答下列问题:
(1)从以上数据可知,最后剩余的 11.2g 固体的成分是 ;表格中,m= .
(2)黄铜样品中锌的质量分数为 .
(3)计算所用稀硫酸中硫酸的质量分数是多少?
6.某化学兴趣小组为了测定某黄铜(铜、饰合金)样品中锌的质量分数,取10g样品放入烧杯中。再取 60g稀硫酸分六次加入烧杯中,直至充分反应,实验数据如下:
第一次 第二次 第三次 第四次 第五次 第六次
加入H2SO4的质量(g) 10 10 10 10 10 10
剩余固体的质量(g) 9.35 8.7 8.05 7.4 6.95
(1)黄铜样品中锌的质量分数为多少?
(2)所用稀硫酸的质量分数为多少
7.Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第1次 40 m
第2次 40 14.8
第3次 40 12.2
第4次 40 11.2
第5次 40 11.2
(1)从以上数据可知,最后剩余的11.2g固体的成分是 ;表格中,m= 。
(2)黄铜样品中锌的质量分数为 。
(3)计算所用稀硫酸中硫酸的质量分数是多少?
8.还原铁粉是一种主要含单质铁灰色或黑色粉末,又称“双吸剂”,常用于食品保鲜。某课外兴趣小组对这还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸)产生了浓厚的兴趣,他们取六份样品,分别加稀硫酸反应。测得部分数据如表,请根据有关信息回答问题。
实验次数 1 3 4 5 6
取样品质量/g 31.0 31.0 31.0 31.0 31.0
取稀硫酸质量/g 30.0 90.0 120.0 150.0 180.0
产生气体质量/g 0 a 0.3 0.5 0.5
(1)食品袋内放入“双吸剂“是为了吸收 。
(2)a的数值为 。
(3)列式计算实验中稀硫酸的溶质的质量分数(结果精确到0.1%) 。
9.Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第1次 40 m
第2次 40 14.8
第3次 40 12.2
第4次 40 11.2
第5次 40 11.2
试回答下列问题:
(1)从以上数据可知,最后剩余的11.2g固体的成分是 ;表格中,m= 。
(2)黄铜样品中锌的质量分数为 。
(3)计算所用稀硫酸中硫酸的质量分数是多少?
10.铁的锈蚀对社会生产造成较大损害,但也有有利的一面。
(1)某些食品包装袋内常放入铁粉作“双吸剂”(吸收氧气和水蒸气,含少量杂质,杂质既不溶于水也不溶于酸),以防止食品腐败。小明取了一包食品袋中的“双吸剂”,均分出完全相同的5份样品,分别加入浓度相同的稀硫酸充分反应。测得如下表数据,请根据有关信息回答问题:
实验次数 1 2 3 4 5
样品质量/g 30 30 30 30 30
稀硫酸质量/g 30 90 120 1505 180
产生气体质量/g 0 0.1 0.3 0.5 0.6
①食品袋内的“双吸剂”用铁粉而不用铁块的理由是 。
②通过计算求30g样品中单质铁的质量 。
(2)暖宝宝的主要成分是:铁粉、碳粉、水、食盐等,它的产热原理与铁生锈相同,能在短时间内产生大量的热,且食盐能使铁快速生锈。小明利用如图装置推测:U型管左侧红墨水水位先上升。但实际上他观察到反应开始后左侧水位反而先下降。请解释U型管左侧红墨水先下降的原因 。
11.小华想测定Cu—Zn合金和Cu—Ag合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器。
(1)根据现有的条件,你认为能测出 合金中铜的质量分数。
A.Cu—Zn合金
B.Cu—Ag合金
C.Cu—Zn合金和Cu—Ag合金
(2)为了测定该合金的组成,小华称取10克该合金粉末,在粉末中连续三次加入稀盐酸反应。每加一次盐酸,小华记录所得气体的质量,根据下表实验数据,求出该合金中铜的质量分数。(列式计算)
第一次 第二次 第三次
连续加入盐酸的体积(mL) 10 10 10
生成氢气的质量(g) 0.08 0.08 0.04
12.某样品为Cu和CuO的混合物。为测定样品中CuO的含量,甲、乙、丙、丁四位学生用同一样品分别进行实验,测定的数据如下:
物质质量 甲 乙 丙 丁
所取固体样品的质量(g) 30 25 20 20
加入硫酸溶液的质量(g) 100 100 100 120
反应后剩余固体的质量(g) 22 17 12 12
分析实验数据,回答下列问题:
(1)写出氧化铜与硫酸反应的化学方程式: 。
(2)求混合物中氧化铜的质量分数。
(3)求硫酸溶液的质量分数。
13.市售的工业纯碱往往含有杂质氯化钠,某科学小组以某品牌工业纯碱为样品测定其中Na2CO3的质量分数,实验过程如图所示:
请回答下列问题:
(1)写出实验过程中相关反应的化学方程式 。
(2)若取用样品的质量为10.7g,且实验过程中无质量损失,生成沉淀B的质量为10g,求纯碱样品中Na2CO3的质量?
(3)请通过计算,判断该产品是否符合包装说明?
14.在一定量的氢氧化钠稀溶液中逐渐滴加稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:
反应时间(秒) 0 25 50 75 100 125 150 175 200
滴入稀盐酸体积(毫升) 0 4 8 12 16 20 24 28 32
pH 13.2 13.0 12.7 12.4 12.1 7.0 2.0 1.6 1.3
温度(℃) 36.9 37.5 38.0 38.5 38.8 39.2 39.0 38.8 38.6
(1)观察上表发现,当反应时间在 秒时开始,溶液中氯化钠的质量不再增加。
(2)完成上述实验,能否用氢氧化钠固体代替,并请说明原因 。
(3)结合上表中滴入稀盐酸体积与pH的变化数据,试计算氢氧化钠稀溶液中溶质的质量(稀HCl的密度取1.0g/mL,稀盐酸溶质质量分数为7.3%)
15.Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 ① ② ③ ④
NaOH溶液质量/g 10.0 20.0 30.0 40.0
Mg(OH)2质量/g 0.232 0.522 0.580 0.580
(1)实验 (填实验编号)中硫酸镁完全反应。
(2)计算100g混合溶液中含MgSO4的质量分数。(写出计算过程)。
参考答案
1.解:(1)根据图表中数据分析,每消耗3.0g混合物,溶液增加1.9g,第三次加入混合物9.0g,溶液增加质量为5.0g小于1.9g×3,说明混合物剩余,稀盐酸完全反应;第一、二组稀盐酸还有剩余,故填:一、二;
(2)由第一组数据可知,二氧化碳的质量为100.0+3.0g﹣101.9g=1.1g
设3.0g混合物中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 1.1g
x=2.5g
混合物中碳酸钙和氯化钙质量之比为2.5g:(3.0g﹣2.5g)=5:1;故填:5:1;
(3)由于第三组混合物剩余,稀盐酸完全反应;所以第四组比第三组多溶解了12.0g﹣9.0g=3.0g混合物中的氯化钙,3.0g混合物中的氯化钙质量为3.0g0.5g,所以a=105.0+0.5=105.5,故填:105.5;
(4)第三组中产生二氧化碳的质量为100.0g+9.0g﹣105.0g﹣m=4.0g﹣m
设反应的碳酸钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
y 4.0g﹣m
y,
9.0g混合物中的碳酸钙质量为9.0g7.5g
所以m=7.5g
m=1.25g,故填:1.25。
2.解:由表格中的数据,水的质量为反应前后固体质量的差,则水的质量为:15.8g﹣14.2g=1.6g;
(2)由表格中的数据,硫酸铜的质量为:14.2g﹣11.8g=2.4g,
则CuSO 4.xH2OCuSO 4+xH2O,
160 18x
2.4g 1.6g
x=6;
(3)硫酸铜晶体中结晶水的质量分数为:100%=40%,
A、加热前坩埚不干燥,加热后水挥发,导致水的质量测定结果偏大,故A正确;
B、加热过程中晶体有少量溅失会导致测定的水的质量偏大,故B正确;
C、加热时蓝色未完全变白,水的质量偏小,导致测定的水的质量偏小,故C错误;
D、加热后容器未放入干燥器中冷却会导致测定的水的质量偏小,故D错误.
故选:AB.
故答案为:(1)1.6g;(2)6;(3)AB.
3.(1)由题意样品中杂质不参与反应且不溶于水,样品中碳酸钙的质量为4g-1g=3g,则样品中碳酸钙的质量分数为
(2)根据题意加入10g稀盐酸反应了2g碳酸钙,设参加反应的氯化氢的质量为x,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
2g x
x=1.46g
稀盐酸的溶质质量分数
4.(1)三、四(2)0.32
(3)解:设草木灰中碳酸钾质量为x克,
CO2的质量为:80-79.12=0.88克
K2CO3+2H Cl =2KCl+H2O+CO2↑
138 44
X 0.88g
X=2.76g
草木灰中K2CO3的质量分数 :
5.(1)Cu;17.4
(2)44%
(3)设稀硫酸质量分数为X
Zn+ H2SO4= ZnSO4+ H2↑
65 98
2.6g 40gx
65:98=2.6g:40gx
x=9.8%
6.(1)解:由表中的数据可知,每加入10g的稀硫酸消耗固体的质量为0.65g,第五次加入10g的稀硫酸只反应掉的固体是0.45g<0.65g,说明有剩余硫酸,剩余的固体是不反应的铜,所以黄铜样品中锌的质量为:10g-6.95g=3.05g;
所以黄铜样品中锌的质量分数为:
答:黄铜样品中锌的质量分数为30.5%;
(2)设10g稀硫酸中溶质质量为x
Zn+ H2SO4=ZnSO4+H2↑
65 98
0.65g x
解得:x=0.98g
稀硫酸中溶质质量分数为:
答:所用稀硫酸的质量分数为9.8%.
7.(1)Cu;17.4
(2)44%
(3)设所用稀硫酸中硫酸的质量分数为x
Zn+H2SO4=ZnSO4+H2↑
65 98
2.6g 40gx
65:98=2.6g:40gx
x=9.8%
【解析】(1)由表中数据可知,第4次后再增加稀硫酸,固体质量不再减少,说明能与稀硫酸反应的锌完全反应,11.2克为不能与稀硫酸反应的铜的质量,40克稀硫酸完全反应消耗锌的质量为2.6g,则m=14.8+2.6=17.4;
(2)黄铜中锌的质量分数为=44%;
8.(1)吸收氧气和水蒸气
(2)0.1
(3)30克稀硫酸与铁完全反应产生氢气质量为0.5-0.3=0.2g,设稀硫酸的溶质质量分数为x
Fe+H2SO4=FeSO4+H2↑
98 2
30gx 0.2g
98:2=30gx:0.2g
x=32.7%
【解析】(1)食品袋内放入“双吸剂“是为了吸收氧气和水蒸气;
(2)由表中所给数据可知,30克稀硫酸与铁完全反应产生氢气质量为0.5-0.3=0.2g,则表中a为0.1;
(3)30克稀硫酸与铁完全反应产生氢气质量为0.5-0.3=0.2g,设稀硫酸的溶质质量分数为x
Fe+H2SO4=FeSO4+H2↑
98 2
30gx 0.2g
98:2=30gx:0.2g
x=32.7%
9.(1)Cu;17.4
(2)44%
(3)设40g稀硫酸中硫酸的质量为x
H2SO4+Zn═ZnSO4+H2↑
98 65
x 2.6g
;
解得:x=3.92g
稀硫酸中硫酸的质量分数为:。
【解析】(1)由金属活动性可知,合金中只有锌可以与硫酸反应。由表中的数据可知:第4次再加入40g稀硫酸时。第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应。反应掉的锌的质量为:14.8g-12.2g=2.6g。据此分析,m=14.8g+2.6g=17.4g。由第四次反应掉的锌的质量为:12.2g-11.2g=1g<2.6g,可判断此时合金中金属锌已完全反应,剩余的固体11.2g的成分是铜;
(2)黄铜样品中锌的质量分数为:;
10.(1)增大接触面积;16.8g
(2)左边能使铁生锈。生锈需要消耗氧气,气压下降,放出大量的热,气压迅速增大
【解析】(1)①食品袋内的“双吸剂”用铁粉而不用铁块的理由是:增大接触面积;
②根据表格可知,生成氢气的质量为0.6g,
设参加反应的铁单质的质量为x,
Fe+2HCl=FeCl2+H2↑;
56 2
x 0.6g
;
解得:x=16.8g。
(2)U型管左侧红墨水先下降的原因:左边能使铁生锈。生锈需要消耗氧气,气压下降,放出大量的热,气压迅速增大。
11.(1)A
(2)解:设10克Cu—Zn合金中Zn的质量为x.
Zn+H2SO4=ZnSO4+ H2↑
65 2
x 0.2g
x=6.5g
铜的质量分数为:
答:该合金中铜的质量分数为
【解析】(1)实验室只提供了一瓶稀盐酸,只有两种金属一种能与盐酸反应而另一种不能与盐酸反应,这样才能测量出其中一种金属的质量,进而得到另一种金属质量,最终才能测出铜的质量分数,合金中Cu-Zn组合符合该条件;Cu-Ag合金中的铜、银均不与稀盐酸反应,不能测出铜的质量分数。
12.(1)CuO+H2SO4=CuSO4+H2O
(2)由表中数据可知,加入100克硫酸时,固体都减少8克,说明100克硫酸完全反应消耗8克氧化铜,由丙丁数据可知,20克固体与100克硫酸恰好完全反应,则氧化铜的质量分数为;
(3)设硫酸的质量分数为x
CuO+H2SO4=CuSO4+H2O
80 98
8g 100gx
80:98=8g:100gx
x=9.8%.
13.(1)Na2CO3+CaCl2=CaCO3↓+2NaCl
(2)解:设纯碱样品中Na2CO3的质量为x
=
x=10.6g
答:纯碱样品中Na2CO3的质量为10.6g。
(3)解:纯碱样品中Na2CO3的质量分数= ×100%≈99.1%>99%,所以该产品符合包装说明
14.(1)125
(2)NaOH溶于水放出热量,会干扰结果
(3)恰好完全反应时消耗HCl质量为20mL× 1.0g/mL ×7.3%=1.46g
设氢氧化钠稀溶液中溶质的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 1.46g
40:36.5=x:1.46g
x=1.6g
【解析】(1)氢氧化钠与盐酸反应生成氯化钠和水,恰好完全反应时氯化钠不再增加,此时溶液中pH=7,由表中数据可知,当反应时间在125秒时开始,溶液中氯化钠的质量不再增加 ;
(2)氢氧化钠固体溶解也会放热,干扰结果,所以不能用氢氧化钠固体代替溶液进行实验;
(3)恰好完全反应时消耗HCl质量为20mL× 1.0g/mL ×7.3%=1.46g
设氢氧化钠稀溶液中溶质的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 1.46g
40:36.5=x:1.46g
x=1.6g
15.(1)③④
(2)设100混合溶液中含MgSO4的质量为x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓;
120 58
x 0.580g
;
解得:x=1.2g
100g混合溶液中含硫酸镁的质量分数:。
【解析】(1)由实验②可知,每消耗10.0gNaOH溶液生成氢氧化镁沉淀0.29g,第③次在增加10.0gNaOH溶液沉淀增加的质量为0.058g<0.29g,说明此时硫酸镁完全反应,氢氧化钠已过量,所以实验③④中硫酸镁完全反应。
(2)设100混合溶液中含MgSO4的质量为x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓;
120 58
x 0.580g
;
解得:x=1.2g
100g混合溶液中含硫酸镁的质量分数:。
表格类化学计算
同课章节目录
