【备考2023】浙教版科学“冲刺重高”压轴训练(三十):图像类化学计算(含解析)
文档属性
| 名称 | 【备考2023】浙教版科学“冲刺重高”压轴训练(三十):图像类化学计算(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 572.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-18 21:21:32 | ||
图片预览

文档简介
1.科学兴趣小组的同学取一定量的某碱式碳酸铜晶体【Cu2(OH)2CO3·2H2O】投一定量入水中,后往其中逐滴加入稀盐酸。
(1)请预测一开始滴入盐酸 (填“是”、“否”)会产生气泡。
(2)某同学通过实验得到沉淀质量、气体质量与加入盐酸的关系如图1:当加入60 mL盐酸时的总化学反应方程式为 。
(3)若完全反应后产生的气体全部通入100g 8%的NaOH溶液中充分反应,所得溶液的溶质总质量为 。
2.某溶液中可能含有氢氧化钠、碳酸钠、硫酸钠、氯化钠、硝酸钠中的一种或几种,小晨同学为测定其成分,进行如下实验。首先她取了一定样品,先后逐滴加入氯化钡溶液、稀硝酸。0~t1时刻表示加入的氯化钡过程;t1时刻之后表示加入的稀硝酸的过程,她将产生沉淀的质量与时间的关系绘制成了如图所示的图像。回答下列问题:
(1)由上述实验可知,原溶液中一定含 ;
(2)BD之间(不包括B、D端点)对应的溶液中的一定存在的离子有 ;(用离子符号表示)
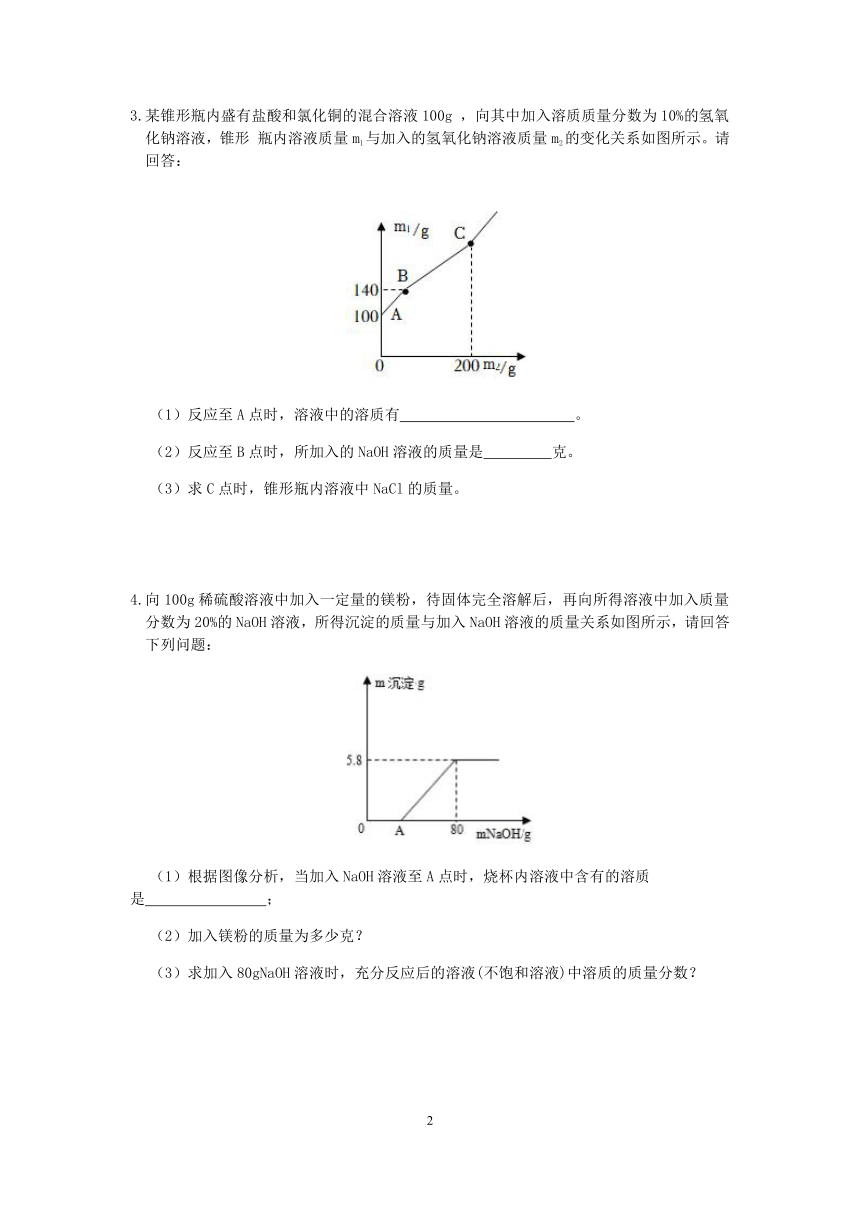
3.某锥形瓶内盛有盐酸和氯化铜的混合溶液100g ,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形 瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。请回答:
(1)反应至A点时,溶液中的溶质有 。
(2)反应至B点时,所加入的NaOH溶液的质量是 克。
(3)求C点时,锥形瓶内溶液中NaCl的质量。
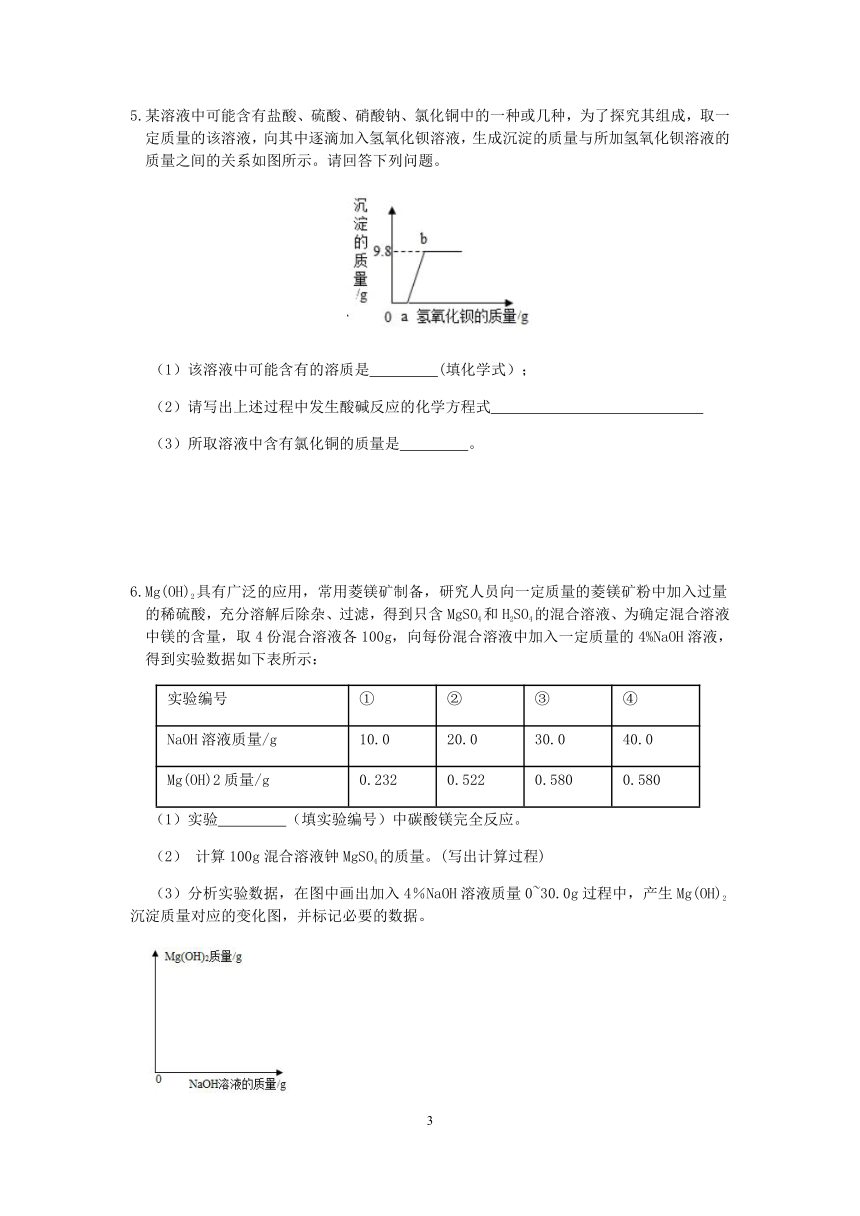
4.向100g稀硫酸溶液中加入一定量的镁粉,待固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀的质量与加入NaOH溶液的质量关系如图所示,请回答下列问题:
(1)根据图像分析,当加入NaOH溶液至A点时,烧杯内溶液中含有的溶质是 ;
(2)加入镁粉的质量为多少克?
(3)求加入80gNaOH溶液时,充分反应后的溶液(不饱和溶液)中溶质的质量分数?
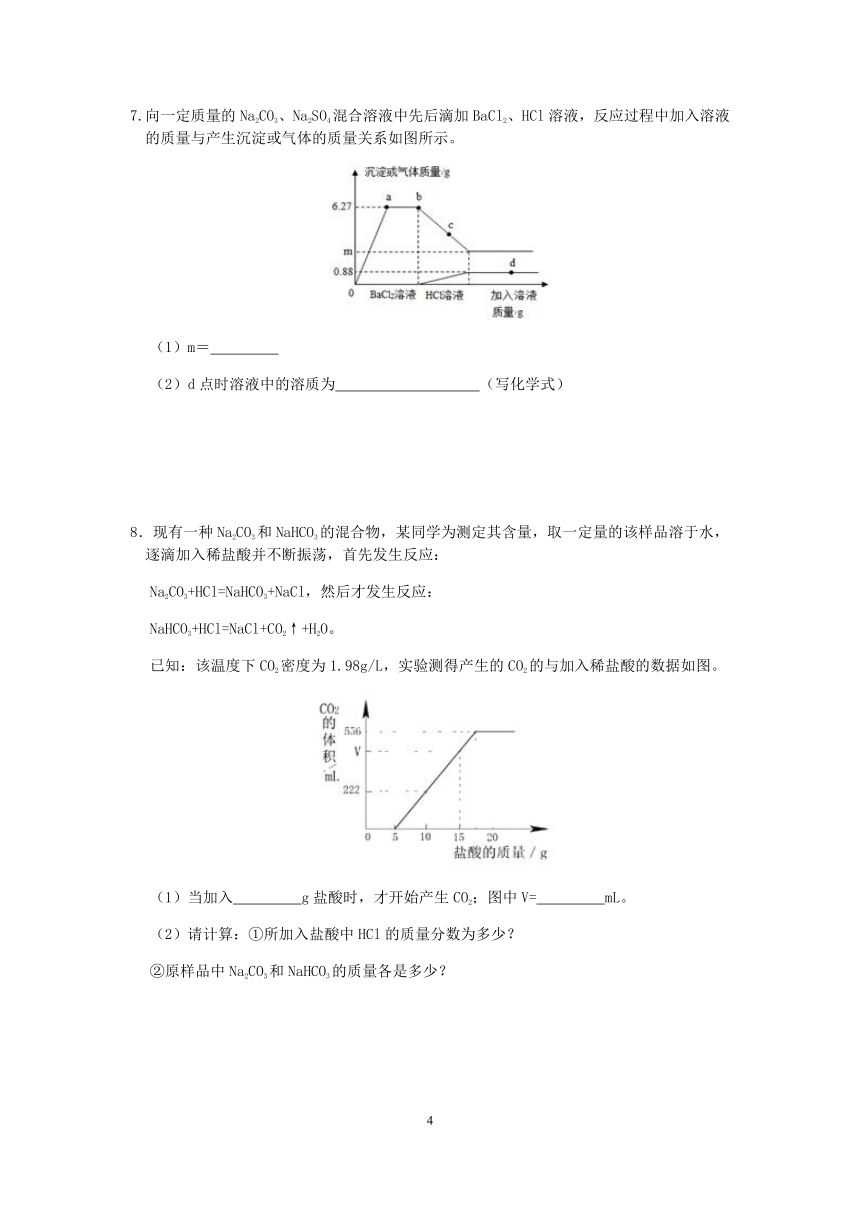
5.某溶液中可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,取一定质量的该溶液,向其中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。请回答下列问题。
(1)该溶液中可能含有的溶质是 (填化学式);
(2)请写出上述过程中发生酸碱反应的化学方程式
(3)所取溶液中含有氯化铜的质量是 。
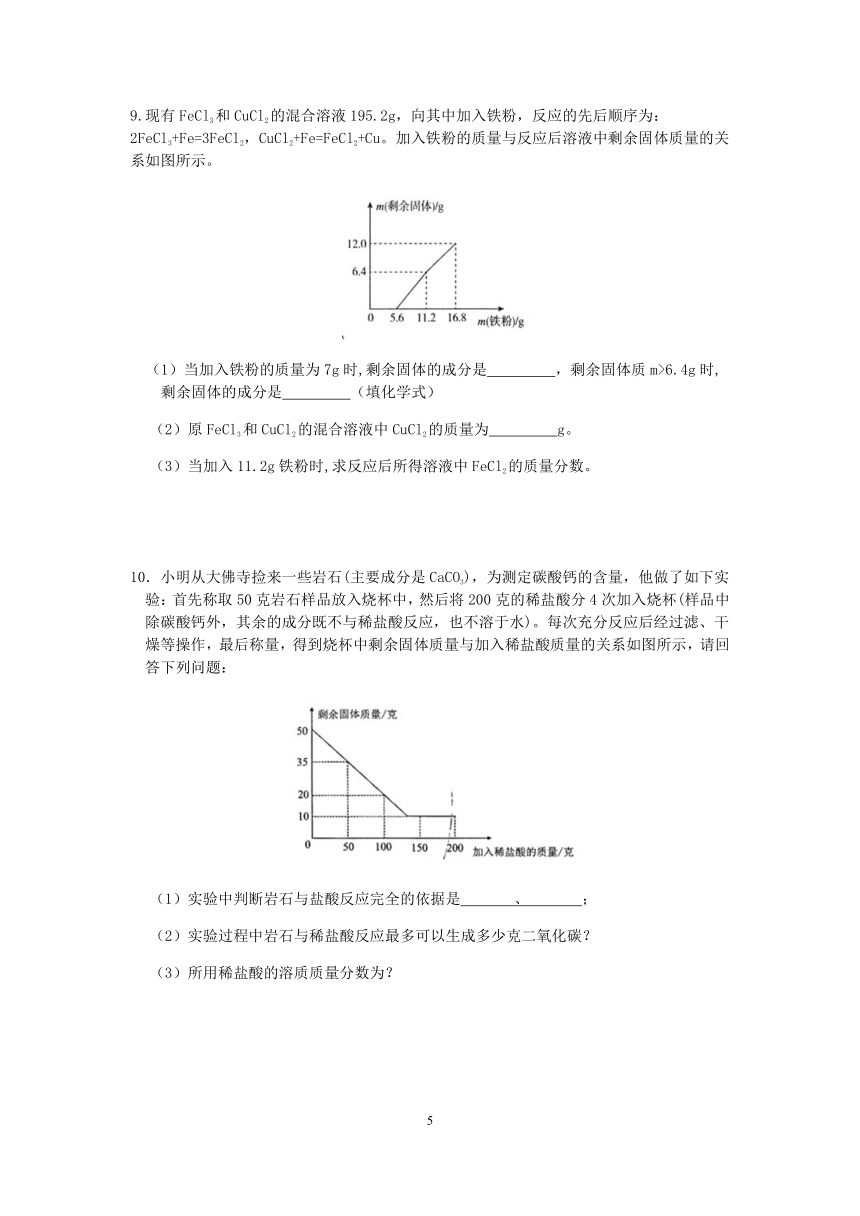
6.Mg(OH)2具有广泛的应用,常用菱镁矿制备,研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液、为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 ① ② ③ ④
NaOH溶液质量/g 10.0 20.0 30.0 40.0
Mg(OH)2质量/g 0.232 0.522 0.580 0.580
(1)实验 (填实验编号)中碳酸镁完全反应。
(2) 计算100g混合溶液钟MgSO4的质量。(写出计算过程)
(3)分析实验数据,在图中画出加入4%NaOH溶液质量0~30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标记必要的数据。
7.向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示。
(1)m=
(2)d点时溶液中的溶质为 (写化学式)
8.现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:
Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:
NaHCO3+HCl=NaCl+CO2↑+H2O。
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如图。
(1)当加入 g盐酸时,才开始产生CO2;图中V= mL。
(2)请计算:①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?
9.现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe=3FeCl2,CuCl2+Fe=FeCl2+Cu。加入铁粉的质量与反应后溶液中剩余固体质量的关系如图所示。
(1)当加入铁粉的质量为7g时,剩余固体的成分是 ,剩余固体质m>6.4g时,剩余固体的成分是 (填化学式)
(2)原FeCl3和CuCl2的混合溶液中CuCl2的质量为 g。
(3)当加入11.2g铁粉时,求反应后所得溶液中FeCl2的质量分数。
10.小明从大佛寺捡来一些岩石(主要成分是CaCO3),为测定碳酸钙的含量,他做了如下实验:首先称取50克岩石样品放入烧杯中,然后将200克的稀盐酸分4次加入烧杯(样品中除碳酸钙外,其余的成分既不与稀盐酸反应,也不溶于水)。每次充分反应后经过滤、干燥等操作,最后称量,得到烧杯中剩余固体质量与加入稀盐酸质量的关系如图所示,请回答下列问题:
(1)实验中判断岩石与盐酸反应完全的依据是 、 ;
(2)实验过程中岩石与稀盐酸反应最多可以生成多少克二氧化碳?
(3)所用稀盐酸的溶质质量分数为?
11.实验室制取氧气时,某同学取质量为15.0g的氯酸钾和二氧化锰的固体混合物加热,固体质量与反应时间的关系如图甲所示。
(1)t0~t1时段固体质量不变,是因为 ;t4~t5时段固体质量不变,是因为 。
(2)t4时,制得氧气质量是 克。
(3)t5时MnO2的质量为多少?(写出计算过程)
(4)请在图乙中画出固体中氧元素质量在t0~t5时段的变化曲线。
12.某实验小组拟利用相同条件下等质量的同种酸溶液与金属反应来探究“金属 活动性与反应放出热量”之间的关系。实验装置如“图1”;实验完成后,根据传感器探头测量的从反应开始到反应停止时的数值绘制的曲线图如“图2”;实验所用酸与金属粉末的种类和质量如下表。请回答问题并进行相关计算。
实验编组 等质量稀硫酸 金属粉末质量/种类 对应曲线
① 含H2SO49.8g 6.5g/镁 a
② 含H2SO49. 8g 6.5g/锌 b
③ 含H2SO49. 8g 6.5g/铁 c (待绘制)
(1)根据实验探究目的,对比曲线a、b,可得出的结论是 。
(2)通过计算说明三组实验充分反应后哪种金属剩余的质量最多,剩余多少?
(3)在“图2”中画出曲线C的大致位置及趋势。
13.科学兴趣小组对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究,测定石头纸中碳酸钙的质量分数。 实验方法是:均匀称取七份样品分别和稀盐酸反应(CaCO3+2HCl=CaCl2+H2O+CO2↑),用电子天平及有关装置进行实验,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
通过对数据的分析和比较,回答下列有关问题
(1)m为 。
(2)石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
(3)在坐标图中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图。
14.实验室通常用化学方法制取氧气,某同学取质量为m 的高锰酸钾固体加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题:
(1)t0—t1时段氧气的质量未增加,其原因可能是 t0—t1时段 ;
(2)请根据图中数据计算高锰酸钾的质量m为多少?(写出计算过程)
参考答案
1.(1)否
(2)Cu2CO3(OH)2+2HCl = CuCO3+CuCl2+2H2O( 或 Cu2CO3(OH)2·2H2O +2HCl = CuCO3+CuCl2+4H2O)
(3)13.7 g
【解析】(1)取一定量的某碱式碳酸铜晶体【Cu2(OH)2CO3 2H2O】投一定量入水中,后往其中逐滴加入稀盐酸,酸中的氢离子先与碱式碳酸铜晶体中的氢氧根离子反应生成了水,然后再和碳酸根离子反应生成二氧化碳和水,因此预测一开始滴入盐酸不会产生气泡.
(2)由图象可知,当加入60mL盐酸时,稀盐酸恰好与碱式碳酸铜反应生成了碳酸钙和氯化钙和水,反应的化学方程式是:Cu2(OH)2CO3 2H2O+2HCl=CuCO3+CuCl2+4H2O;
(3)设碱式碳酸铜与盐酸反应生成的二氧化眼的质量为x,
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 44
33.3g x
;
解得:x=6.6g;
设100g 8%的氢氧化钠反应的二氧化碳的质量y、生成的碳酸钠的质量为z
2NaOH+CO2═Na2CO3+H2O
80 44 106
100g×8% y z
;
解得:y=4.4g,z=10.6g;
由上述计算可知,与氢氧化钠反应的二氧化碳的质量是4.4g<6.6g,与碳酸钠反应的二氧化碳的质量为6.6g-4.4g=2.2g;
设2.2g二氧化碳与碳酸钠反应的质量为m,生成的碳酸氢钠的质量为n
Na2CO3+H2O+CO2=2NaHCO3
106 44 168
m 2.2g n
;
解得:m=5.3g,n=8.4g;
所得溶液的溶质总质量为:10.6g-5.3g+8.4g=13.7g。
2.(1)氢氧化钠、碳酸钠、硫酸钠
(2)Ba2+、Na+、 Cl-、OH-、NO3-
【解析】(1) 取样品先后逐滴加入氯化钡溶液、稀硝酸,0~t1时刻表示加入的氯化钡过程,产生沉淀;t1时刻之后加入的稀硝酸,沉淀过一段时间开始消失,最终没有完全消失,说明沉淀中既有碳酸钡又有硫酸钡,因加入硝酸沉淀没有立即减少,说明溶液中一定含有氢氧化钠、碳酸钠和硫酸钠;(2) 由图像可知加入氯化钡过量,BD之间为氢氧化钠与硝酸的反应,对应的溶液溶质为氢氧化钠、氯化钠、硝酸钠 、氯化钡,所以溶液中离子有 Ba2+、Na+、 Cl-、OH-、NO3- ;
3.(1)NaCl、 CuCl2 、HCl(2)40(3)C点时氯化铜也刚好完全反应,共消耗氢氧化钠溶液质量200克,由钠元素质量守恒可知,反应的氢氧化钠中钠元素质量即为生成氯化钠中钠元素质量,则生成氯化钠质量为.
【解析】(1)向盛有盐酸和氯化铜的混合溶液100g中加入溶质质量分数为10%的氢氧化钠溶液,氢氧化钠先与盐酸反应,然后再与氯化铜反应,反应至A点时,部分盐酸发生反应,溶液中溶质有NaCl、 CuCl2 、HCl;
(2)反应至B点时,盐酸刚好完全反应,溶液增加质量即为 所加氢氧化钠溶液质量,则所加入的NaOH溶液的质量是40g;
(3)C点时氯化铜也刚好完全反应,共消耗氢氧化钠溶液质量200克,由钠元素质量守恒可知,反应的氢氧化钠中钠元素质量即为生成氯化钠中钠元素质量,则生成氯化钠质量为.
4.(1)NaCl和MgCl2
(2)解:
MgSO4+2NaOH= Mg(OH)2↓+Na2SO4
120 58
x 5.8g
x=12g
Mg+H2SO4= MgSO4+ H2↑
24 120 2
y 12g z
y=2.4g
z=0.2g
答:加入镁粉的质量为2.4克。
(3)由钠元素守恒可知,反应后溶液中氯化钠中钠元素质量即为氢氧化钠中钠元素质量,则反应后生成氯化钠质量为=23.4g
则充分反应后的溶液中溶质的质量分数为
【解析】(1)由图像可知,加入氢氧化钠后先没有沉淀生成,说明所得溶液中成分为硫酸和硫酸镁,氢氧化钠是先与硫酸反应,然后再与硫酸镁反应;
(3)由钠元素守恒可知,反应后溶液中氯化钠中钠元素质量即为氢氧化钠中钠元素质量,则反应后生成氯化钠质量为=23.4g
则充分反应后的溶液中溶质的质量分数为
5.(1)NaNO3(2)2HCl+Ba(OH)2=BaCl2+2H2O(3)13.5g
【解析】(1)由图示可知,加入氢氧化钡开始无沉淀生成,过一段时间后开始产生沉淀,因硫酸与氢氧化钡反应开始即产生沉淀,盐酸与氢氧化钡反应无沉淀,氯化铜与氢氧化钡反应产生能溶于酸的氢氧化铜沉淀,说明溶液中一定含盐酸和氯化铜,一定不含硫酸,可能含硝酸钠;
(2)盐酸为酸,氢氧化钡为碱,二者反应生成氯化钡和水,方程式为 2HCl+Ba(OH)2=BaCl2+2H2O ;
(3)由图像可知,反应结束后产生氢氧化铜质量为9.8克,设 所取溶液中含有氯化铜的质量是x
CuCl2+Ba(OH)2=BaCl2+Cu(OH)2
135 98
x 9.8g
135:98=x:9.8g
x=13.5g
6.(1)③④
(2)设100g混合溶液中含MgSO4的质量为x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓;
120 58
x 0.580g
;
解得:x=1.2g
(3)
【解析】(1)由实验②可知,每消耗10.0gNaOH溶液生成氢氧化镁沉淀0.29g,第③次在增加10.0gNaOH溶液沉淀增加的质量为0.058g。第④次再增加10gNaOH溶液后,理论上应该生成:0.058+0.029g=0.087g,但实际上只有0.058g,这说明此时硫酸镁完全反应,氢氧化钠已过量,故选③④;
(3)由于每消耗10.0gNaOH溶液生成氢氧化镁沉淀0.29g,
第①次与硫酸镁反应的氢氧化钠溶液质量为:;
即与硫酸反应的氢氧化钠溶液的质量为:10.0g-8.0g=2.0g;
与硫酸镁反应的氢氧化钠溶液总质量为:;
所以加入4% NaOH溶液质量0-30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图为
7.(1)2.33(2)BaCl2 HCl NaCl
【解析】(1) 由图像可知,加入盐酸后沉淀部分消失产生0.88克气体,说是一定含有碳酸钡和硫酸钡沉淀,设碳酸钡质量为x
BaCO3+2HCl=BaCl2+H2O+CO2↑
197 44
x 0.88g
197:44=x:0.88g
x=3.94,则m=6.27-3.94=2.33g;
(2)d点加入了过量盐酸,碳酸钡与盐酸反应生成氯化钡,碳酸钠与氯化钡或硫酸钠与氯化钡反应都生成氯化钠,所以d点时溶液中的溶质为BaCl2、HCl、NaCl 。
8.(1)5;444
(2)①444mLCO2的质量为:444mL×1.98g/L=0.88g
设产生0.88gCO2时,消耗HCl的质量为xg
NaHCO3+HCl=NaCl+CO2↑+H2O
36.5 44
x 0.88g
解得:x=0.73g
HCl%=0.73÷(15-5)×100%=7.3%(方法可有多种)
②设加入5g盐酸时,有ygNa2CO3转化为zgNaHCO3。
Na2CO3+HCl=====NaHCO3+NaCl
106 36.5 84
y 5g×7.3% z
解得:y=1.06g;z=0.84g
556mLCO2的质量为:[556mL÷(1000mL)]×1.98g/L=1.10g
设放出556mLCO2时反应的NaHCO3质量为m。则:
NaHCO3+HCl=NaCl+CO2↑+H2O
84 44
m 1.10g
解得:m=2.10g
则原样品中NaHCO3的质量为:2.1g-0.84g=1.26g
【解析】(1)当加入5g盐酸时,才开始产生CO2。
当加入10g稀盐酸时,参加反应生成二氧化碳的盐酸质量为;10g-5g=5g,
当二氧化碳的体积为V时,参加反应的稀盐酸的质量为:15g-5g=10g;
根据二氧化碳和稀盐酸质量的正比关系得到:;
解得:V=444ml。
(2) ①444mLCO2的质量为:444mL×1.98g/L=0.88g
设产生0.88gCO2时,消耗HCl的质量为xg
NaHCO3+HCl=NaCl+CO2↑+H2O
36.5 44
x 0.88g
;
解得:x=0.73g。
HCl%=0.73÷(15-5)×100%=7.3%;
②设加入5g盐酸时,有ygNa2CO3转化为zgNaHCO3。
Na2CO3+HCl=NaHCO3+NaCl
106 36.5 84
y 5g×7.3% z
;
;
解得:y=1.06g;z=0.84g。
556mLCO2的质量为:0.556L×1.98g/L=1.10g;
设放出556mLCO2时反应的NaHCO3质量为m。则:
NaHCO3+HCl=NaCl+CO2↑+H2O
84 44
m 1.10g
;
解得:m=2.10g。
则原样品中NaHCO3的质量为:2.1g-0.84g=1.26g。
9.(1)Cu;Fe Cu(2)13.5
(3)与氯化铁反应的铁粉质量为5.6g,设生成氯化亚铁的质量为y,
2FeCl3+Fe═3FeCl2
56 381
5.6g y
;
解得:y=38.1g;
设铁与氯化铜反应生成氯化亚铁的质量为z,
CuCl2+Fe═FeCl2+Cu
127 64
z 6.4g
;
解得:z=12.7g
反应后所得溶液中FeCl2的质量分数:。
【解析】(1)根据图像可知,当加入铁粉质量为7g时,恰好处于5.6g~11.2g之间,此时铁粉和氯化铁的反应已经结束,而铁和氯化铜的反应正在进行,则剩余固体的成分为反应产物Cu。当剩余固体的质量m>6.4g时,此时铁和氯化铜的反应已经结束,那么剩余固体的成分为反应产物Cu和过量的Fe。
(2)根据图像可知,反应生成铜的质量为6.4g,
设参加反应的氯化铜的质量为x,
CuCl2+Fe═FeCl2+Cu
135 64
x 6.4g;
;
解得:x=13.5g
10.(1)剩余固体质量不随加入稀盐酸质量的增加而减少
(2)解:"设最多可以产生的二氧化碳的质量为x
由图像可知样品中碳酸钙的质量为50克-10克=40克
CaCO3+2HCl= CaCl2+H2O+ CO2↑
100 44
40克 x
X=17.6
(3)解;第一次50克稀盐酸加入样品时盐酸完全反应,设50克稀盐酸中含有溶质Y
参加反应的碳酸钙的质量为50克-35克=15克
CaCO3+ 2HCl=CaCl2+H2O+CO2↑
100 73
15克 Y
Y=10.95克
稀盐酸的质量分数HCl%= ×100%= 21.9%
【解析】(1)岩石中的碳酸钙与稀盐酸反应,生成氯化钙、水和二氧化碳气体,随着反应的进行,剩余固体的质量会不断减小。当岩石与稀盐酸完全反应时,不再生成气体,则剩余固体的质量不再发生变化。
(2)反应前后固体质量的减小量就是参加反应的碳酸钙的质量,写出碳酸钙与稀盐酸反应的方程式,然后根据质量之间的比例关系计算出生成二氧化碳的质量。
(3)在第一次加入50g稀盐酸时,固体的质量从50g减小到35g,这就是参加反应的碳酸钙的质量,根据二者反应的方程式计算出参加反应的稀盐酸的溶质质量,最后根据计算出稀盐酸的溶质质量分数。
11.(1)温度不够高,反应没有开始;反应结束了
(2)4.8(3)二氧化锰的质量为2.75克 (4)
【解析】(1)t0~t1时段固体质量不变,是因为、温度不够高,反应没有开始;t4~t5时段固体质量不变,是因为反应结束了。
(2)t4时,制得氧气质量为:15g-10.2g=4.8g;
(3)设参加反应的氯酸钾的质量为x,
245 96
x 4.8g
;
解得:x=12.25g。
则其中MnO2的质量为:15g-12.25g=2.75g。
(4)反应开始时:氯酸钾中氧元素的质量:;
二氧化锰中氧元素的质量:;
此时固体中氧元素的质量为:4.8g+1g=5.8g;
根据甲图可知,从t0~t1,氧元素的质量保持5.8g不变;从t1~t4,氧元素的质量不断减小;从t4~t5,氧元素的质量保持1g不变,如下图所示:
12.(1)金属越活泼,反应放出热量越多(前后互换也对)
(2)解:设需反应掉的镁、锌、铁分别为x、y、z
Mg+ H2SO4=MgSO4+H2↑
24 98
x 9.8
Zn+ H2SO4=ZnSO4+H2↑
65 98
y 9.8
Fe+ H2SO4=FeSO4+H2↑
56 98
z 9.8
x=2.4g,y=6.5g,z=5.6g
而总量都为6.5g,最终镁剩余最多,为6.5-2.4=4.1g-(3)
13.(1)2.20(或2.2)
(2)解:设石头纸样品中碳酸钙的质量分数为x
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 44
6.25gx 2.2g
列比例式:
解得:x=80%
(3)
【解析】(1)第七份中生成的气体与第六份中生成气体的质量相同,因此m=2.2;
(2)设石头纸样品中碳酸钙的质量分数为x,
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 44
6.25gx 2.2g
;
解得:x=80%。
(3) 根据表格可知,当第五次加入25ml稀盐酸生成二氧化碳2.2g以前,生成二氧化碳的质量与加入稀盐酸的质量成正比,图像为一条通过坐标原点的斜线。第五次之后,虽然稀盐酸的质量在增加,但是二氧化碳的质量始终保持2.2g不变,如下图所示:
14.(1)t0—t1时段氧气的质量未增加,其原因可能是 t0—t1时段:温度没有达到分解温度或分解反应未开始进行;
(2)根据图像可知,反应生成氧气的质量为3.2g,
设参加反应的高锰酸钾的质量为x,
2KMnO4 K2MnO4+MnO2+ O2↑
316 32
m 3.2g
m=31.6g;
解得:m=31.6g。
图像类化学计算
(1)请预测一开始滴入盐酸 (填“是”、“否”)会产生气泡。
(2)某同学通过实验得到沉淀质量、气体质量与加入盐酸的关系如图1:当加入60 mL盐酸时的总化学反应方程式为 。
(3)若完全反应后产生的气体全部通入100g 8%的NaOH溶液中充分反应,所得溶液的溶质总质量为 。
2.某溶液中可能含有氢氧化钠、碳酸钠、硫酸钠、氯化钠、硝酸钠中的一种或几种,小晨同学为测定其成分,进行如下实验。首先她取了一定样品,先后逐滴加入氯化钡溶液、稀硝酸。0~t1时刻表示加入的氯化钡过程;t1时刻之后表示加入的稀硝酸的过程,她将产生沉淀的质量与时间的关系绘制成了如图所示的图像。回答下列问题:
(1)由上述实验可知,原溶液中一定含 ;
(2)BD之间(不包括B、D端点)对应的溶液中的一定存在的离子有 ;(用离子符号表示)
3.某锥形瓶内盛有盐酸和氯化铜的混合溶液100g ,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形 瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。请回答:
(1)反应至A点时,溶液中的溶质有 。
(2)反应至B点时,所加入的NaOH溶液的质量是 克。
(3)求C点时,锥形瓶内溶液中NaCl的质量。
4.向100g稀硫酸溶液中加入一定量的镁粉,待固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀的质量与加入NaOH溶液的质量关系如图所示,请回答下列问题:
(1)根据图像分析,当加入NaOH溶液至A点时,烧杯内溶液中含有的溶质是 ;
(2)加入镁粉的质量为多少克?
(3)求加入80gNaOH溶液时,充分反应后的溶液(不饱和溶液)中溶质的质量分数?
5.某溶液中可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,取一定质量的该溶液,向其中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。请回答下列问题。
(1)该溶液中可能含有的溶质是 (填化学式);
(2)请写出上述过程中发生酸碱反应的化学方程式
(3)所取溶液中含有氯化铜的质量是 。
6.Mg(OH)2具有广泛的应用,常用菱镁矿制备,研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液、为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 ① ② ③ ④
NaOH溶液质量/g 10.0 20.0 30.0 40.0
Mg(OH)2质量/g 0.232 0.522 0.580 0.580
(1)实验 (填实验编号)中碳酸镁完全反应。
(2) 计算100g混合溶液钟MgSO4的质量。(写出计算过程)
(3)分析实验数据,在图中画出加入4%NaOH溶液质量0~30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标记必要的数据。
7.向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示。
(1)m=
(2)d点时溶液中的溶质为 (写化学式)
8.现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:
Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:
NaHCO3+HCl=NaCl+CO2↑+H2O。
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如图。
(1)当加入 g盐酸时,才开始产生CO2;图中V= mL。
(2)请计算:①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?
9.现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe=3FeCl2,CuCl2+Fe=FeCl2+Cu。加入铁粉的质量与反应后溶液中剩余固体质量的关系如图所示。
(1)当加入铁粉的质量为7g时,剩余固体的成分是 ,剩余固体质m>6.4g时,剩余固体的成分是 (填化学式)
(2)原FeCl3和CuCl2的混合溶液中CuCl2的质量为 g。
(3)当加入11.2g铁粉时,求反应后所得溶液中FeCl2的质量分数。
10.小明从大佛寺捡来一些岩石(主要成分是CaCO3),为测定碳酸钙的含量,他做了如下实验:首先称取50克岩石样品放入烧杯中,然后将200克的稀盐酸分4次加入烧杯(样品中除碳酸钙外,其余的成分既不与稀盐酸反应,也不溶于水)。每次充分反应后经过滤、干燥等操作,最后称量,得到烧杯中剩余固体质量与加入稀盐酸质量的关系如图所示,请回答下列问题:
(1)实验中判断岩石与盐酸反应完全的依据是 、 ;
(2)实验过程中岩石与稀盐酸反应最多可以生成多少克二氧化碳?
(3)所用稀盐酸的溶质质量分数为?
11.实验室制取氧气时,某同学取质量为15.0g的氯酸钾和二氧化锰的固体混合物加热,固体质量与反应时间的关系如图甲所示。
(1)t0~t1时段固体质量不变,是因为 ;t4~t5时段固体质量不变,是因为 。
(2)t4时,制得氧气质量是 克。
(3)t5时MnO2的质量为多少?(写出计算过程)
(4)请在图乙中画出固体中氧元素质量在t0~t5时段的变化曲线。
12.某实验小组拟利用相同条件下等质量的同种酸溶液与金属反应来探究“金属 活动性与反应放出热量”之间的关系。实验装置如“图1”;实验完成后,根据传感器探头测量的从反应开始到反应停止时的数值绘制的曲线图如“图2”;实验所用酸与金属粉末的种类和质量如下表。请回答问题并进行相关计算。
实验编组 等质量稀硫酸 金属粉末质量/种类 对应曲线
① 含H2SO49.8g 6.5g/镁 a
② 含H2SO49. 8g 6.5g/锌 b
③ 含H2SO49. 8g 6.5g/铁 c (待绘制)
(1)根据实验探究目的,对比曲线a、b,可得出的结论是 。
(2)通过计算说明三组实验充分反应后哪种金属剩余的质量最多,剩余多少?
(3)在“图2”中画出曲线C的大致位置及趋势。
13.科学兴趣小组对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究,测定石头纸中碳酸钙的质量分数。 实验方法是:均匀称取七份样品分别和稀盐酸反应(CaCO3+2HCl=CaCl2+H2O+CO2↑),用电子天平及有关装置进行实验,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
通过对数据的分析和比较,回答下列有关问题
(1)m为 。
(2)石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
(3)在坐标图中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图。
14.实验室通常用化学方法制取氧气,某同学取质量为m 的高锰酸钾固体加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题:
(1)t0—t1时段氧气的质量未增加,其原因可能是 t0—t1时段 ;
(2)请根据图中数据计算高锰酸钾的质量m为多少?(写出计算过程)
参考答案
1.(1)否
(2)Cu2CO3(OH)2+2HCl = CuCO3+CuCl2+2H2O( 或 Cu2CO3(OH)2·2H2O +2HCl = CuCO3+CuCl2+4H2O)
(3)13.7 g
【解析】(1)取一定量的某碱式碳酸铜晶体【Cu2(OH)2CO3 2H2O】投一定量入水中,后往其中逐滴加入稀盐酸,酸中的氢离子先与碱式碳酸铜晶体中的氢氧根离子反应生成了水,然后再和碳酸根离子反应生成二氧化碳和水,因此预测一开始滴入盐酸不会产生气泡.
(2)由图象可知,当加入60mL盐酸时,稀盐酸恰好与碱式碳酸铜反应生成了碳酸钙和氯化钙和水,反应的化学方程式是:Cu2(OH)2CO3 2H2O+2HCl=CuCO3+CuCl2+4H2O;
(3)设碱式碳酸铜与盐酸反应生成的二氧化眼的质量为x,
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 44
33.3g x
;
解得:x=6.6g;
设100g 8%的氢氧化钠反应的二氧化碳的质量y、生成的碳酸钠的质量为z
2NaOH+CO2═Na2CO3+H2O
80 44 106
100g×8% y z
;
解得:y=4.4g,z=10.6g;
由上述计算可知,与氢氧化钠反应的二氧化碳的质量是4.4g<6.6g,与碳酸钠反应的二氧化碳的质量为6.6g-4.4g=2.2g;
设2.2g二氧化碳与碳酸钠反应的质量为m,生成的碳酸氢钠的质量为n
Na2CO3+H2O+CO2=2NaHCO3
106 44 168
m 2.2g n
;
解得:m=5.3g,n=8.4g;
所得溶液的溶质总质量为:10.6g-5.3g+8.4g=13.7g。
2.(1)氢氧化钠、碳酸钠、硫酸钠
(2)Ba2+、Na+、 Cl-、OH-、NO3-
【解析】(1) 取样品先后逐滴加入氯化钡溶液、稀硝酸,0~t1时刻表示加入的氯化钡过程,产生沉淀;t1时刻之后加入的稀硝酸,沉淀过一段时间开始消失,最终没有完全消失,说明沉淀中既有碳酸钡又有硫酸钡,因加入硝酸沉淀没有立即减少,说明溶液中一定含有氢氧化钠、碳酸钠和硫酸钠;(2) 由图像可知加入氯化钡过量,BD之间为氢氧化钠与硝酸的反应,对应的溶液溶质为氢氧化钠、氯化钠、硝酸钠 、氯化钡,所以溶液中离子有 Ba2+、Na+、 Cl-、OH-、NO3- ;
3.(1)NaCl、 CuCl2 、HCl(2)40(3)C点时氯化铜也刚好完全反应,共消耗氢氧化钠溶液质量200克,由钠元素质量守恒可知,反应的氢氧化钠中钠元素质量即为生成氯化钠中钠元素质量,则生成氯化钠质量为.
【解析】(1)向盛有盐酸和氯化铜的混合溶液100g中加入溶质质量分数为10%的氢氧化钠溶液,氢氧化钠先与盐酸反应,然后再与氯化铜反应,反应至A点时,部分盐酸发生反应,溶液中溶质有NaCl、 CuCl2 、HCl;
(2)反应至B点时,盐酸刚好完全反应,溶液增加质量即为 所加氢氧化钠溶液质量,则所加入的NaOH溶液的质量是40g;
(3)C点时氯化铜也刚好完全反应,共消耗氢氧化钠溶液质量200克,由钠元素质量守恒可知,反应的氢氧化钠中钠元素质量即为生成氯化钠中钠元素质量,则生成氯化钠质量为.
4.(1)NaCl和MgCl2
(2)解:
MgSO4+2NaOH= Mg(OH)2↓+Na2SO4
120 58
x 5.8g
x=12g
Mg+H2SO4= MgSO4+ H2↑
24 120 2
y 12g z
y=2.4g
z=0.2g
答:加入镁粉的质量为2.4克。
(3)由钠元素守恒可知,反应后溶液中氯化钠中钠元素质量即为氢氧化钠中钠元素质量,则反应后生成氯化钠质量为=23.4g
则充分反应后的溶液中溶质的质量分数为
【解析】(1)由图像可知,加入氢氧化钠后先没有沉淀生成,说明所得溶液中成分为硫酸和硫酸镁,氢氧化钠是先与硫酸反应,然后再与硫酸镁反应;
(3)由钠元素守恒可知,反应后溶液中氯化钠中钠元素质量即为氢氧化钠中钠元素质量,则反应后生成氯化钠质量为=23.4g
则充分反应后的溶液中溶质的质量分数为
5.(1)NaNO3(2)2HCl+Ba(OH)2=BaCl2+2H2O(3)13.5g
【解析】(1)由图示可知,加入氢氧化钡开始无沉淀生成,过一段时间后开始产生沉淀,因硫酸与氢氧化钡反应开始即产生沉淀,盐酸与氢氧化钡反应无沉淀,氯化铜与氢氧化钡反应产生能溶于酸的氢氧化铜沉淀,说明溶液中一定含盐酸和氯化铜,一定不含硫酸,可能含硝酸钠;
(2)盐酸为酸,氢氧化钡为碱,二者反应生成氯化钡和水,方程式为 2HCl+Ba(OH)2=BaCl2+2H2O ;
(3)由图像可知,反应结束后产生氢氧化铜质量为9.8克,设 所取溶液中含有氯化铜的质量是x
CuCl2+Ba(OH)2=BaCl2+Cu(OH)2
135 98
x 9.8g
135:98=x:9.8g
x=13.5g
6.(1)③④
(2)设100g混合溶液中含MgSO4的质量为x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓;
120 58
x 0.580g
;
解得:x=1.2g
(3)
【解析】(1)由实验②可知,每消耗10.0gNaOH溶液生成氢氧化镁沉淀0.29g,第③次在增加10.0gNaOH溶液沉淀增加的质量为0.058g。第④次再增加10gNaOH溶液后,理论上应该生成:0.058+0.029g=0.087g,但实际上只有0.058g,这说明此时硫酸镁完全反应,氢氧化钠已过量,故选③④;
(3)由于每消耗10.0gNaOH溶液生成氢氧化镁沉淀0.29g,
第①次与硫酸镁反应的氢氧化钠溶液质量为:;
即与硫酸反应的氢氧化钠溶液的质量为:10.0g-8.0g=2.0g;
与硫酸镁反应的氢氧化钠溶液总质量为:;
所以加入4% NaOH溶液质量0-30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图为
7.(1)2.33(2)BaCl2 HCl NaCl
【解析】(1) 由图像可知,加入盐酸后沉淀部分消失产生0.88克气体,说是一定含有碳酸钡和硫酸钡沉淀,设碳酸钡质量为x
BaCO3+2HCl=BaCl2+H2O+CO2↑
197 44
x 0.88g
197:44=x:0.88g
x=3.94,则m=6.27-3.94=2.33g;
(2)d点加入了过量盐酸,碳酸钡与盐酸反应生成氯化钡,碳酸钠与氯化钡或硫酸钠与氯化钡反应都生成氯化钠,所以d点时溶液中的溶质为BaCl2、HCl、NaCl 。
8.(1)5;444
(2)①444mLCO2的质量为:444mL×1.98g/L=0.88g
设产生0.88gCO2时,消耗HCl的质量为xg
NaHCO3+HCl=NaCl+CO2↑+H2O
36.5 44
x 0.88g
解得:x=0.73g
HCl%=0.73÷(15-5)×100%=7.3%(方法可有多种)
②设加入5g盐酸时,有ygNa2CO3转化为zgNaHCO3。
Na2CO3+HCl=====NaHCO3+NaCl
106 36.5 84
y 5g×7.3% z
解得:y=1.06g;z=0.84g
556mLCO2的质量为:[556mL÷(1000mL)]×1.98g/L=1.10g
设放出556mLCO2时反应的NaHCO3质量为m。则:
NaHCO3+HCl=NaCl+CO2↑+H2O
84 44
m 1.10g
解得:m=2.10g
则原样品中NaHCO3的质量为:2.1g-0.84g=1.26g
【解析】(1)当加入5g盐酸时,才开始产生CO2。
当加入10g稀盐酸时,参加反应生成二氧化碳的盐酸质量为;10g-5g=5g,
当二氧化碳的体积为V时,参加反应的稀盐酸的质量为:15g-5g=10g;
根据二氧化碳和稀盐酸质量的正比关系得到:;
解得:V=444ml。
(2) ①444mLCO2的质量为:444mL×1.98g/L=0.88g
设产生0.88gCO2时,消耗HCl的质量为xg
NaHCO3+HCl=NaCl+CO2↑+H2O
36.5 44
x 0.88g
;
解得:x=0.73g。
HCl%=0.73÷(15-5)×100%=7.3%;
②设加入5g盐酸时,有ygNa2CO3转化为zgNaHCO3。
Na2CO3+HCl=NaHCO3+NaCl
106 36.5 84
y 5g×7.3% z
;
;
解得:y=1.06g;z=0.84g。
556mLCO2的质量为:0.556L×1.98g/L=1.10g;
设放出556mLCO2时反应的NaHCO3质量为m。则:
NaHCO3+HCl=NaCl+CO2↑+H2O
84 44
m 1.10g
;
解得:m=2.10g。
则原样品中NaHCO3的质量为:2.1g-0.84g=1.26g。
9.(1)Cu;Fe Cu(2)13.5
(3)与氯化铁反应的铁粉质量为5.6g,设生成氯化亚铁的质量为y,
2FeCl3+Fe═3FeCl2
56 381
5.6g y
;
解得:y=38.1g;
设铁与氯化铜反应生成氯化亚铁的质量为z,
CuCl2+Fe═FeCl2+Cu
127 64
z 6.4g
;
解得:z=12.7g
反应后所得溶液中FeCl2的质量分数:。
【解析】(1)根据图像可知,当加入铁粉质量为7g时,恰好处于5.6g~11.2g之间,此时铁粉和氯化铁的反应已经结束,而铁和氯化铜的反应正在进行,则剩余固体的成分为反应产物Cu。当剩余固体的质量m>6.4g时,此时铁和氯化铜的反应已经结束,那么剩余固体的成分为反应产物Cu和过量的Fe。
(2)根据图像可知,反应生成铜的质量为6.4g,
设参加反应的氯化铜的质量为x,
CuCl2+Fe═FeCl2+Cu
135 64
x 6.4g;
;
解得:x=13.5g
10.(1)剩余固体质量不随加入稀盐酸质量的增加而减少
(2)解:"设最多可以产生的二氧化碳的质量为x
由图像可知样品中碳酸钙的质量为50克-10克=40克
CaCO3+2HCl= CaCl2+H2O+ CO2↑
100 44
40克 x
X=17.6
(3)解;第一次50克稀盐酸加入样品时盐酸完全反应,设50克稀盐酸中含有溶质Y
参加反应的碳酸钙的质量为50克-35克=15克
CaCO3+ 2HCl=CaCl2+H2O+CO2↑
100 73
15克 Y
Y=10.95克
稀盐酸的质量分数HCl%= ×100%= 21.9%
【解析】(1)岩石中的碳酸钙与稀盐酸反应,生成氯化钙、水和二氧化碳气体,随着反应的进行,剩余固体的质量会不断减小。当岩石与稀盐酸完全反应时,不再生成气体,则剩余固体的质量不再发生变化。
(2)反应前后固体质量的减小量就是参加反应的碳酸钙的质量,写出碳酸钙与稀盐酸反应的方程式,然后根据质量之间的比例关系计算出生成二氧化碳的质量。
(3)在第一次加入50g稀盐酸时,固体的质量从50g减小到35g,这就是参加反应的碳酸钙的质量,根据二者反应的方程式计算出参加反应的稀盐酸的溶质质量,最后根据计算出稀盐酸的溶质质量分数。
11.(1)温度不够高,反应没有开始;反应结束了
(2)4.8(3)二氧化锰的质量为2.75克 (4)
【解析】(1)t0~t1时段固体质量不变,是因为、温度不够高,反应没有开始;t4~t5时段固体质量不变,是因为反应结束了。
(2)t4时,制得氧气质量为:15g-10.2g=4.8g;
(3)设参加反应的氯酸钾的质量为x,
245 96
x 4.8g
;
解得:x=12.25g。
则其中MnO2的质量为:15g-12.25g=2.75g。
(4)反应开始时:氯酸钾中氧元素的质量:;
二氧化锰中氧元素的质量:;
此时固体中氧元素的质量为:4.8g+1g=5.8g;
根据甲图可知,从t0~t1,氧元素的质量保持5.8g不变;从t1~t4,氧元素的质量不断减小;从t4~t5,氧元素的质量保持1g不变,如下图所示:
12.(1)金属越活泼,反应放出热量越多(前后互换也对)
(2)解:设需反应掉的镁、锌、铁分别为x、y、z
Mg+ H2SO4=MgSO4+H2↑
24 98
x 9.8
Zn+ H2SO4=ZnSO4+H2↑
65 98
y 9.8
Fe+ H2SO4=FeSO4+H2↑
56 98
z 9.8
x=2.4g,y=6.5g,z=5.6g
而总量都为6.5g,最终镁剩余最多,为6.5-2.4=4.1g-(3)
13.(1)2.20(或2.2)
(2)解:设石头纸样品中碳酸钙的质量分数为x
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 44
6.25gx 2.2g
列比例式:
解得:x=80%
(3)
【解析】(1)第七份中生成的气体与第六份中生成气体的质量相同,因此m=2.2;
(2)设石头纸样品中碳酸钙的质量分数为x,
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 44
6.25gx 2.2g
;
解得:x=80%。
(3) 根据表格可知,当第五次加入25ml稀盐酸生成二氧化碳2.2g以前,生成二氧化碳的质量与加入稀盐酸的质量成正比,图像为一条通过坐标原点的斜线。第五次之后,虽然稀盐酸的质量在增加,但是二氧化碳的质量始终保持2.2g不变,如下图所示:
14.(1)t0—t1时段氧气的质量未增加,其原因可能是 t0—t1时段:温度没有达到分解温度或分解反应未开始进行;
(2)根据图像可知,反应生成氧气的质量为3.2g,
设参加反应的高锰酸钾的质量为x,
2KMnO4 K2MnO4+MnO2+ O2↑
316 32
m 3.2g
m=31.6g;
解得:m=31.6g。
图像类化学计算
同课章节目录
