2.1共价键课件2022-2023学年下学期高二化学人教版(2019)选择性必修2(共34张PPT)
文档属性
| 名称 | 2.1共价键课件2022-2023学年下学期高二化学人教版(2019)选择性必修2(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1018.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-19 19:54:55 | ||
图片预览











文档简介
(共34张PPT)
共价键
课程标准要求
1.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
2.知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
3.知道共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。
一、共价键
1.共价键的概念与特征
(1)概念:原子间通过____________所形成的相互作用,本质是原子轨道的重叠。
(2)特征:
共用电子对
2.共价键的类型——σ键和π键
(1)σ键
形成 成键原子的s轨道或p轨道“________”重叠而形成
类型 s-s型
H—H的s-s σ键的形成
s-p型
H—Cl的s-p σ键的形成
p-p型
Cl—Cl的p-p σ键的形成
特征 ①以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形______,这种特征称为________;②σ键的强度______
头碰头
不变
轴对称
较大
(2)π键
形成 由两个原子的p轨道“________”重叠形成
p-p π 键
p-p π键的形成
特征 ①π键的电子云具有__________性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为______;②π键______旋转;不如σ键______,较易断裂
肩并肩
镜面对称
镜像
不能
牢固
(3)判断σ键、π键的一般规律
共价单键为____键;共价双键中有一个____键、一个____键;共价三键由一个____键和两个____键构成。
σ
σ
π
σ
π
自测
1.判断正误(正确的打“√”,错误的打“×”)。
(1)金属与非金属元素之间不能形成共价键( )
(2)一般来说,σ键比π键强度大,更稳定( )
(3)CO2分子中有一个σ键和一个π键( )
(4)H原子只能形成σ键,C原子可以形成σ键和π键( )
×
√
×
√
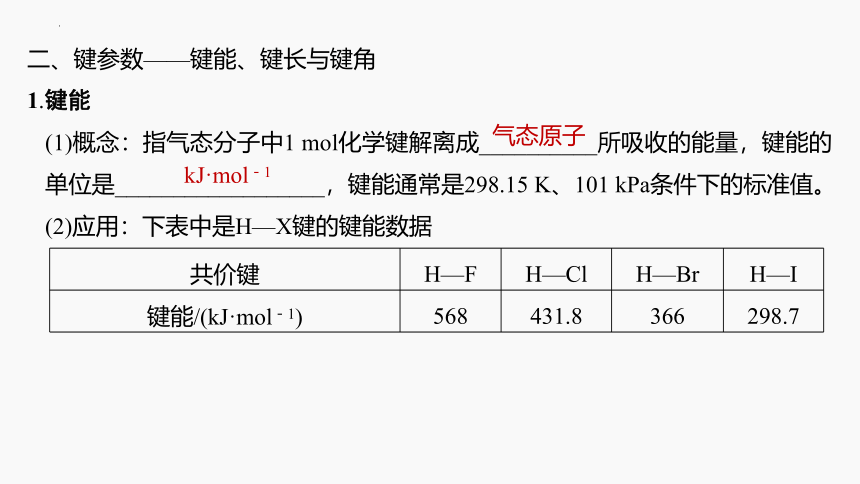
二、键参数——键能、键长与键角
1.键能
(1)概念:指气态分子中1 mol化学键解离成__________所吸收的能量,键能的单位是__________________,键能通常是298.15 K、101 kPa条件下的标准值。
(2)应用:下表中是H—X键的键能数据
气态原子
kJ·mol-1
共价键 H—F H—Cl H—Br H—I
键能/(kJ·mol-1) 568 431.8 366 298.7
①若使2 mol H—Cl断裂为气态原子,则发生的能量变化是吸收__________________能量。
②表中最难断裂的共价键是________,最易断裂的是________。
③由表中共价键键能数据大小说明键能与分子的稳定性HF、HCl、HBr、HI四种分子中,最稳定的是______,最不稳定的是______。
863.6 kJ
H—F
H—I
HF
HI
2.键长
(1)概念:键长是构成化学键的两个原子的________。
(2)键长与原子半径:原子半径决定共价键的键长,原子半径越小,共价键的键长越____。
(3)键长与共价键的稳定性:共价键的键长越短,往往键能越____,表明共价键越______。
核间距
短
大
稳定
3.键角
(1)概念:在多原子分子中,两个相邻________之间的夹角。
(2)键角与分子空间结构:在多原子分子中键角是一定的,这表明共价键具有______性。键角是描述分子__________的重要参数。
(3)实例:CO2分子的结构式为____________________,它的键角为__________,是直线形分子。H2O分子的H—O—H键角为105°,是一种____形(或称角形)分子。
(4)键长和键角的数值可以通过晶体的________________获得。
共价键
方向
空间结构
O===C===O
180°
V
X射线衍射实验
自测
2.判断正误(正确的打“√”,错误的打“×”)。
(1)共价键的键能越大,键长越短,共价键越稳定( )
(2)C=C键的键能是C—C键能的2倍( )
(3)原子半径越大,所形成的共价键键长越大( )
(4)水分子中H—O—H键的键角为180°( )
√
×
√
×
一、σ键和π键的比较
下面是乙烷、乙烯、乙炔的分子结构。
1.仔细观察乙烷、乙烯、乙炔的分子结构,指出它们分子中分别含几个σ键和几个π键?
提示:
分子 共价键类别 乙烷 乙烯 乙炔
σ键数目 7 5 3
π键数目 0 1 2
2.乙烯、乙炔的化学性质为什么比乙烷活泼?
提示:乙烯分子中的碳碳双键是由一个σ键和1个π键构成,乙炔分子中的碳碳三键是由一个σ键、两个π键构成,乙烷分子中只含σ键不含π键;π键原子轨道的重叠程度小、不稳定,容易断裂,而乙烷中的σ键牢固,不易断裂,故乙烷的化学性质稳定。
σ键和π键的比较
键的类型 σ键 π键
原子轨道重叠方式 两个原子的成键轨道沿着键轴的方向以“头碰头”的方式重叠 两个原子的成键轨道以“肩并肩”的方式重叠
原子轨道重叠部位 两原子核之间,在键轴处 键轴上方和下方,键轴处为零
键的类型 σ键 π键
原子轨道重叠程度 大 小
化学活泼性 不活泼 活泼
示意图
(1)因s电子云轮廓图是球形的,故s轨道与s轨道形成σ键时,无方向性。两个s轨道只能形成σ键,不能形成π键。
(2)两个原子间可以只形成σ键,但不能只形成π键。
(3)通常情况下,σ键比π键牢固,π键容易断裂,如乙烯、乙炔的化学性质比乙烷活泼,但N2中的π键由于原子轨道重叠程度大,π键牢固,故N2中的π键不易断裂,不易发生加成反应和氧化反应。
1.下列关于σ键和π键的说法正确的是( )
A
2.下列分子中既含有σ键又含有π键的是( )
A.CH4 B.NH3
C.CO2 D.F2
C
3.下列物质中σ键和π键数目比为1∶2的是( )
A.O2 B.HCN
C.CO2 D.N2
D
二、键参数的应用
1.键参数对分子性质的影响
2.键能的应用
(1)判断共价键的强弱
键能越大,断开化学键时需要的能量越多,化学键越稳定。
(2)判断分子的稳定性
结构相似的分子中,共价键的键能越大,分子越稳定。
(3)计算化学反应的反应热
ΔH=反应物键能总和-生成物键能总和。
3.键长的应用
(1)一般键长越短,键能越大,共价键越稳定,分子越稳定。
(2)键长的比较方法
①根据原子半径比较,同类型的共价键,成键原子的原子半径越小,键长越短。
②根据共用电子对数比较,相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。
4.键角的应用
(1)并不是所有共价键都存在三个键参数,如双原子分子中不存在键角。
(2)由分子构成的物质,其熔沸点与共价键的键长和键能无关。
(3)并非所有的共价键都满足“键长越小,键能越大”,如卤素单质分子中的键长:F—F<Cl—Cl,但键能F—F<Cl—Cl。
4.从键长的角度来判断下列共价键中最稳定的是( )
A.H—F B.N—H
C.C—H D.S—H
A
5.下列说法正确的是( )
A.分子的结构是由键角决定的
B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
C.CF4、CCl4、CBr4、CI4中C—X的键长、键角均相等
D.NH3分子中两个N—H的键角为120°
B
6.下列事实不能用键能的大小来解释的是( )
A.N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
(1)CO2分子中存在________个σ键和________个π键。
(2)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键为________mol。
分子中σ键和π键数目的判断
2
2
7
方法技巧
确定分子或离子中σ键和π键数目的方法
1.丁烯二酸(HOOCCH===CHCOOH)分子结构中含有σ键、π键的个数分别是( )
B
A.4个σ键,1个π键 B.11个σ键、3个π键
C.4个σ键、3个π键 D.9个σ键、5个π键
9NA
共价键
课程标准要求
1.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
2.知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
3.知道共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。
一、共价键
1.共价键的概念与特征
(1)概念:原子间通过____________所形成的相互作用,本质是原子轨道的重叠。
(2)特征:
共用电子对
2.共价键的类型——σ键和π键
(1)σ键
形成 成键原子的s轨道或p轨道“________”重叠而形成
类型 s-s型
H—H的s-s σ键的形成
s-p型
H—Cl的s-p σ键的形成
p-p型
Cl—Cl的p-p σ键的形成
特征 ①以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形______,这种特征称为________;②σ键的强度______
头碰头
不变
轴对称
较大
(2)π键
形成 由两个原子的p轨道“________”重叠形成
p-p π 键
p-p π键的形成
特征 ①π键的电子云具有__________性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为______;②π键______旋转;不如σ键______,较易断裂
肩并肩
镜面对称
镜像
不能
牢固
(3)判断σ键、π键的一般规律
共价单键为____键;共价双键中有一个____键、一个____键;共价三键由一个____键和两个____键构成。
σ
σ
π
σ
π
自测
1.判断正误(正确的打“√”,错误的打“×”)。
(1)金属与非金属元素之间不能形成共价键( )
(2)一般来说,σ键比π键强度大,更稳定( )
(3)CO2分子中有一个σ键和一个π键( )
(4)H原子只能形成σ键,C原子可以形成σ键和π键( )
×
√
×
√
二、键参数——键能、键长与键角
1.键能
(1)概念:指气态分子中1 mol化学键解离成__________所吸收的能量,键能的单位是__________________,键能通常是298.15 K、101 kPa条件下的标准值。
(2)应用:下表中是H—X键的键能数据
气态原子
kJ·mol-1
共价键 H—F H—Cl H—Br H—I
键能/(kJ·mol-1) 568 431.8 366 298.7
①若使2 mol H—Cl断裂为气态原子,则发生的能量变化是吸收__________________能量。
②表中最难断裂的共价键是________,最易断裂的是________。
③由表中共价键键能数据大小说明键能与分子的稳定性HF、HCl、HBr、HI四种分子中,最稳定的是______,最不稳定的是______。
863.6 kJ
H—F
H—I
HF
HI
2.键长
(1)概念:键长是构成化学键的两个原子的________。
(2)键长与原子半径:原子半径决定共价键的键长,原子半径越小,共价键的键长越____。
(3)键长与共价键的稳定性:共价键的键长越短,往往键能越____,表明共价键越______。
核间距
短
大
稳定
3.键角
(1)概念:在多原子分子中,两个相邻________之间的夹角。
(2)键角与分子空间结构:在多原子分子中键角是一定的,这表明共价键具有______性。键角是描述分子__________的重要参数。
(3)实例:CO2分子的结构式为____________________,它的键角为__________,是直线形分子。H2O分子的H—O—H键角为105°,是一种____形(或称角形)分子。
(4)键长和键角的数值可以通过晶体的________________获得。
共价键
方向
空间结构
O===C===O
180°
V
X射线衍射实验
自测
2.判断正误(正确的打“√”,错误的打“×”)。
(1)共价键的键能越大,键长越短,共价键越稳定( )
(2)C=C键的键能是C—C键能的2倍( )
(3)原子半径越大,所形成的共价键键长越大( )
(4)水分子中H—O—H键的键角为180°( )
√
×
√
×
一、σ键和π键的比较
下面是乙烷、乙烯、乙炔的分子结构。
1.仔细观察乙烷、乙烯、乙炔的分子结构,指出它们分子中分别含几个σ键和几个π键?
提示:
分子 共价键类别 乙烷 乙烯 乙炔
σ键数目 7 5 3
π键数目 0 1 2
2.乙烯、乙炔的化学性质为什么比乙烷活泼?
提示:乙烯分子中的碳碳双键是由一个σ键和1个π键构成,乙炔分子中的碳碳三键是由一个σ键、两个π键构成,乙烷分子中只含σ键不含π键;π键原子轨道的重叠程度小、不稳定,容易断裂,而乙烷中的σ键牢固,不易断裂,故乙烷的化学性质稳定。
σ键和π键的比较
键的类型 σ键 π键
原子轨道重叠方式 两个原子的成键轨道沿着键轴的方向以“头碰头”的方式重叠 两个原子的成键轨道以“肩并肩”的方式重叠
原子轨道重叠部位 两原子核之间,在键轴处 键轴上方和下方,键轴处为零
键的类型 σ键 π键
原子轨道重叠程度 大 小
化学活泼性 不活泼 活泼
示意图
(1)因s电子云轮廓图是球形的,故s轨道与s轨道形成σ键时,无方向性。两个s轨道只能形成σ键,不能形成π键。
(2)两个原子间可以只形成σ键,但不能只形成π键。
(3)通常情况下,σ键比π键牢固,π键容易断裂,如乙烯、乙炔的化学性质比乙烷活泼,但N2中的π键由于原子轨道重叠程度大,π键牢固,故N2中的π键不易断裂,不易发生加成反应和氧化反应。
1.下列关于σ键和π键的说法正确的是( )
A
2.下列分子中既含有σ键又含有π键的是( )
A.CH4 B.NH3
C.CO2 D.F2
C
3.下列物质中σ键和π键数目比为1∶2的是( )
A.O2 B.HCN
C.CO2 D.N2
D
二、键参数的应用
1.键参数对分子性质的影响
2.键能的应用
(1)判断共价键的强弱
键能越大,断开化学键时需要的能量越多,化学键越稳定。
(2)判断分子的稳定性
结构相似的分子中,共价键的键能越大,分子越稳定。
(3)计算化学反应的反应热
ΔH=反应物键能总和-生成物键能总和。
3.键长的应用
(1)一般键长越短,键能越大,共价键越稳定,分子越稳定。
(2)键长的比较方法
①根据原子半径比较,同类型的共价键,成键原子的原子半径越小,键长越短。
②根据共用电子对数比较,相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。
4.键角的应用
(1)并不是所有共价键都存在三个键参数,如双原子分子中不存在键角。
(2)由分子构成的物质,其熔沸点与共价键的键长和键能无关。
(3)并非所有的共价键都满足“键长越小,键能越大”,如卤素单质分子中的键长:F—F<Cl—Cl,但键能F—F<Cl—Cl。
4.从键长的角度来判断下列共价键中最稳定的是( )
A.H—F B.N—H
C.C—H D.S—H
A
5.下列说法正确的是( )
A.分子的结构是由键角决定的
B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
C.CF4、CCl4、CBr4、CI4中C—X的键长、键角均相等
D.NH3分子中两个N—H的键角为120°
B
6.下列事实不能用键能的大小来解释的是( )
A.N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
(1)CO2分子中存在________个σ键和________个π键。
(2)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键为________mol。
分子中σ键和π键数目的判断
2
2
7
方法技巧
确定分子或离子中σ键和π键数目的方法
1.丁烯二酸(HOOCCH===CHCOOH)分子结构中含有σ键、π键的个数分别是( )
B
A.4个σ键,1个π键 B.11个σ键、3个π键
C.4个σ键、3个π键 D.9个σ键、5个π键
9NA
