2.13.1共价键的极性课件(共26张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.13.1共价键的极性课件(共26张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-19 00:00:00 | ||
图片预览







文档简介
(共26张PPT)
共价键的极性
课程标准要求
1.知道共价键可分为极性键和非极性键。
2.知道分子可以分为极性分子和非极性分子,了解分子极性与分子中键的极性、分子的空间结构密切相关。
3.根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释。
一、键的极性和分子的极性
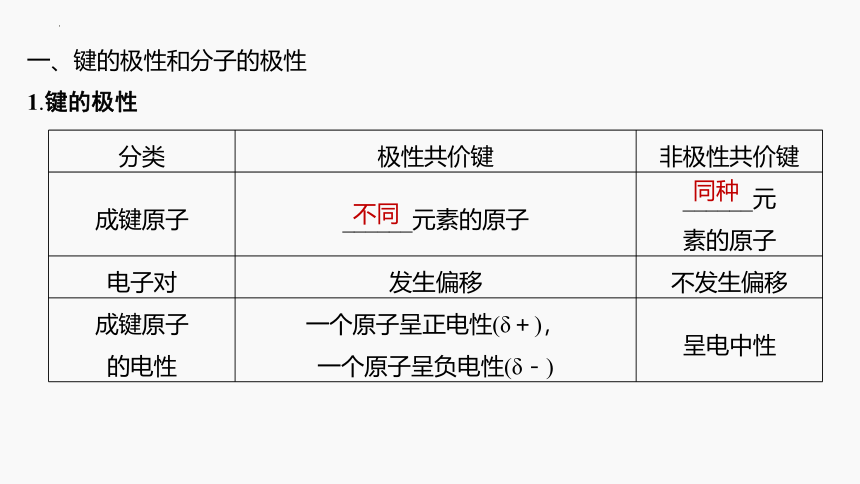
1.键的极性
分类 极性共价键 非极性共价键
成键原子 ______元素的原子 ______元
素的原子
电子对 发生偏移 不发生偏移
成键原子 的电性 一个原子呈正电性(δ+), 一个原子呈负电性(δ-) 呈电中性
不同
同种
2.极性分子和非极性分子
不重合
不等于零
重合
极性
等于零
3.键的极性与分子极性之间的关系
(1)只含非极性键的分子一定是非极性分子。
(2)含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为________分子,否则为______分子。
(3)极性分子中一定有极性键,非极性分子中不一定含有非极性键。含有非极性键的分子不一定为非极性分子。
非极性
极性
自测
1.判断正误(正确的打“√”,错误的打“×”)。
(1)极性分子中不可能含有非极性键( )
(2)非极性分子中一定含有非极性共价键( )
(3)以非极性键结合的双原子分子一定是非极性分子( )
(4)H2O、CO2、CH4都是非极性分子( )
×
×
√
×
二、键的极性对化学性质的影响(以羧酸的酸性为例)
1.酸性强弱的表示方法
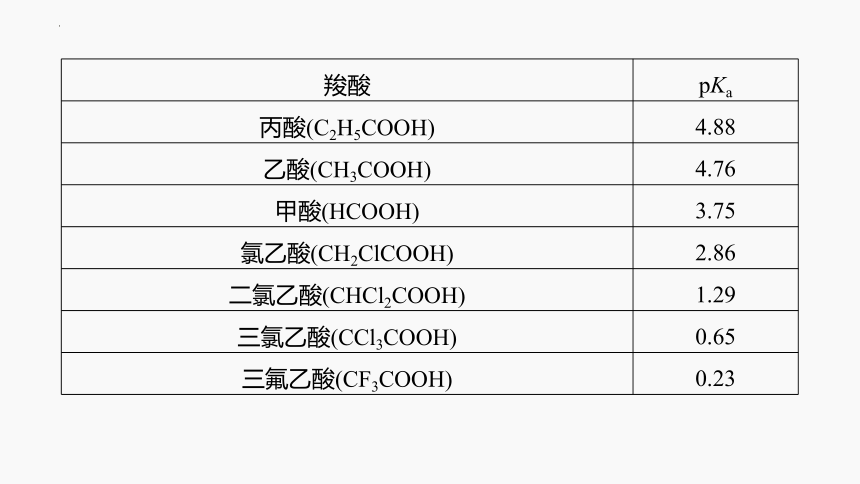
羧酸的酸性强弱与其分子的组成和结构有关,羧酸的酸性可用________表示,pKa=-lg Ka,pKa越小,酸性越____。其中Ka为弱酸的电离常数,不同羧酸pKa如下:
pKa
强
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2.两点结论
(1)三氟乙酸的酸性大于三氯乙酸,这是由于氟的电负性______氯的电负性,F—C的极性______Cl—C的极性,使F3C—的极性______Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+。
(2)烷基是推电子基团,烷基越长推电子效应越大,使羧基中羟基的极性______,羧酸的酸性______,所以甲酸、乙酸、丙酸……随着烷基加长,酸性逐渐______。
大于
大于
大于
越小
越弱
减弱
【微自测】
2.判断正误(正确的打“√”,错误的打“×”)。
(1)氯乙酸的酸性和三氯乙酸的酸性相同( )
(2)甲酸的酸性大于乙酸( )
(3)羧酸的pKa越大,酸性越强( )
(4)三氯乙酸的酸性大于三溴乙酸的酸性( )
×
√
×
√
深化认识键的极性与分子的极性
在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,可看到四氯化碳呈直线状垂直流入烧杯中。将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,观察四氯化碳的流动方向未发生变化;再向另一酸式滴定管中加入蒸馏水,进行同样的实验,观察到水流的方向发生改变。
分子极性的实验
1.用毛皮摩擦过的橡胶棒带负电,为什么橡胶棒不能使CCl4液流的方向改变却能使水流的方向改变?
提示:CCl4尽管是由极性键构成,但CCl4是正四面体结构,正、负电荷的中心重合,极性的向量和为零,整个分子不显电性故CCl4的液流方向不变;H2O分子为V形结构,正、负电荷的中心不重合,极性的向量和不为零,水分子存在极性,故当带负电的橡胶棒靠近水流时,水流的方向发生偏移。
2.已知H2O2的空间结构如下图所示:
H2O2不是直线形的,两个H原子犹如在半展开的书的
两面纸上,书面夹角为93°52′,而两个O—H与O—O
的夹角均为96°52′。
H2O2中共价键的种类有哪些?H2O2的正电中心和负电中心是否重合?H2O2属于极性分子还是非极性分子?
提示:H2O2分子中存在O—H极性键和O—O非极性键;由图示结构可知,H2O2中正电中心和负电中心不重合,H2O2属于极性分子。
1.键的极性与分子极性的关系
2.从向量的角度理解分子的极性
(1)若分子中共价键极性的向量和等于0,则为非极性分子,如CH4、BF3等。
(2)若分子中共价键极性的向量和不等于0,则为极性分子,如H2O、NH3等。
实 例
解 释 2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子 3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子
(1)一般情况下,单质分子为非极性分子,但O3是V形分子,空间不对称结构,故为极性分子。
(2)AB型分子均为极性分子。
(3)只含有极性键的分子不一定是极性分子(如CH4);极性分子不一定只含有极性键(如C2H5OH);含有非极性键的分子不一定是非极性分子(如H2O2)。
1.下列物质中,既含有极性键又含有非极性键的是( )
A.CO2 B.CH4
C.C2H4 D.NH4Cl
C
2.把下列液体分别装在酸式滴定管中,并使其成细流流下,当用带有静电的玻璃棒接近液体细流时,细流不会发生偏移的是( )
A.CH3COOH B.C2H5OH
C.H2O D.CCl4
D
3.含有极性键的非极性分子是( )
A.H2 B.NH3
C.CO2 D.CH2Cl2
C
方法技巧
分子极性判断的方法
方法一:从键的极性角度判断
(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子。如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子。如HCl、HF、HBr。
(3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的是极性分子。如CO2、CH4是非极性分子,H2O、NH3是极性分子。
方法二:从中心原子的化合价角度判断
对于ABn型分子,若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子,实例如表:
分子 BF3 CO2 SO3(g) H2O NH3 SO2
中心原子的化合价的绝对值 3 4 6 2 3 4
中心原子所在的族序数 3 4 6 6 5 6
分子极性 非极性 非极性 非极性 极性 极性 极性
方法三:从中心原子有无孤电子对角度判断
对于ABn型分子,若中心原子A上有孤电子对,则为极性分子;若无孤电子对则为非极性分子。如CH4、BF3、SO3为非极性分子,H2S、SO2、PCl3为极性分子。
【迁移应用】
1.下列分子中,属于非极性分子的是( )
A.SO2 B.NH3
C.BBr3 D.COCl2
C
2.NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子,根据上述实例可以推测出ABn型分子为非极性分子的经验规律是( )
A.分子中必须含有π键
B.在ABn分子中A原子没有孤对电子
C.在ABn分子中不能形成分子间氢键
D.分子中每个共价键的键长应相等
B
3.常温下三氯化氮(NCl3)是一种黄色油状液体,其分子结构呈三角锥形。下列关于三氯化氮的说法正确的是( )
A.分子中N—Cl键是极性键
B.分子中不存在孤电子对
C.NCl3分子是非极性分子
D.因N—Cl键的键能大,所以NCl3的沸点高
A
共价键的极性
课程标准要求
1.知道共价键可分为极性键和非极性键。
2.知道分子可以分为极性分子和非极性分子,了解分子极性与分子中键的极性、分子的空间结构密切相关。
3.根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释。
一、键的极性和分子的极性
1.键的极性
分类 极性共价键 非极性共价键
成键原子 ______元素的原子 ______元
素的原子
电子对 发生偏移 不发生偏移
成键原子 的电性 一个原子呈正电性(δ+), 一个原子呈负电性(δ-) 呈电中性
不同
同种
2.极性分子和非极性分子
不重合
不等于零
重合
极性
等于零
3.键的极性与分子极性之间的关系
(1)只含非极性键的分子一定是非极性分子。
(2)含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为________分子,否则为______分子。
(3)极性分子中一定有极性键,非极性分子中不一定含有非极性键。含有非极性键的分子不一定为非极性分子。
非极性
极性
自测
1.判断正误(正确的打“√”,错误的打“×”)。
(1)极性分子中不可能含有非极性键( )
(2)非极性分子中一定含有非极性共价键( )
(3)以非极性键结合的双原子分子一定是非极性分子( )
(4)H2O、CO2、CH4都是非极性分子( )
×
×
√
×
二、键的极性对化学性质的影响(以羧酸的酸性为例)
1.酸性强弱的表示方法
羧酸的酸性强弱与其分子的组成和结构有关,羧酸的酸性可用________表示,pKa=-lg Ka,pKa越小,酸性越____。其中Ka为弱酸的电离常数,不同羧酸pKa如下:
pKa
强
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2.两点结论
(1)三氟乙酸的酸性大于三氯乙酸,这是由于氟的电负性______氯的电负性,F—C的极性______Cl—C的极性,使F3C—的极性______Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+。
(2)烷基是推电子基团,烷基越长推电子效应越大,使羧基中羟基的极性______,羧酸的酸性______,所以甲酸、乙酸、丙酸……随着烷基加长,酸性逐渐______。
大于
大于
大于
越小
越弱
减弱
【微自测】
2.判断正误(正确的打“√”,错误的打“×”)。
(1)氯乙酸的酸性和三氯乙酸的酸性相同( )
(2)甲酸的酸性大于乙酸( )
(3)羧酸的pKa越大,酸性越强( )
(4)三氯乙酸的酸性大于三溴乙酸的酸性( )
×
√
×
√
深化认识键的极性与分子的极性
在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,可看到四氯化碳呈直线状垂直流入烧杯中。将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,观察四氯化碳的流动方向未发生变化;再向另一酸式滴定管中加入蒸馏水,进行同样的实验,观察到水流的方向发生改变。
分子极性的实验
1.用毛皮摩擦过的橡胶棒带负电,为什么橡胶棒不能使CCl4液流的方向改变却能使水流的方向改变?
提示:CCl4尽管是由极性键构成,但CCl4是正四面体结构,正、负电荷的中心重合,极性的向量和为零,整个分子不显电性故CCl4的液流方向不变;H2O分子为V形结构,正、负电荷的中心不重合,极性的向量和不为零,水分子存在极性,故当带负电的橡胶棒靠近水流时,水流的方向发生偏移。
2.已知H2O2的空间结构如下图所示:
H2O2不是直线形的,两个H原子犹如在半展开的书的
两面纸上,书面夹角为93°52′,而两个O—H与O—O
的夹角均为96°52′。
H2O2中共价键的种类有哪些?H2O2的正电中心和负电中心是否重合?H2O2属于极性分子还是非极性分子?
提示:H2O2分子中存在O—H极性键和O—O非极性键;由图示结构可知,H2O2中正电中心和负电中心不重合,H2O2属于极性分子。
1.键的极性与分子极性的关系
2.从向量的角度理解分子的极性
(1)若分子中共价键极性的向量和等于0,则为非极性分子,如CH4、BF3等。
(2)若分子中共价键极性的向量和不等于0,则为极性分子,如H2O、NH3等。
实 例
解 释 2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子 3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子
(1)一般情况下,单质分子为非极性分子,但O3是V形分子,空间不对称结构,故为极性分子。
(2)AB型分子均为极性分子。
(3)只含有极性键的分子不一定是极性分子(如CH4);极性分子不一定只含有极性键(如C2H5OH);含有非极性键的分子不一定是非极性分子(如H2O2)。
1.下列物质中,既含有极性键又含有非极性键的是( )
A.CO2 B.CH4
C.C2H4 D.NH4Cl
C
2.把下列液体分别装在酸式滴定管中,并使其成细流流下,当用带有静电的玻璃棒接近液体细流时,细流不会发生偏移的是( )
A.CH3COOH B.C2H5OH
C.H2O D.CCl4
D
3.含有极性键的非极性分子是( )
A.H2 B.NH3
C.CO2 D.CH2Cl2
C
方法技巧
分子极性判断的方法
方法一:从键的极性角度判断
(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子。如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子。如HCl、HF、HBr。
(3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的是极性分子。如CO2、CH4是非极性分子,H2O、NH3是极性分子。
方法二:从中心原子的化合价角度判断
对于ABn型分子,若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子,实例如表:
分子 BF3 CO2 SO3(g) H2O NH3 SO2
中心原子的化合价的绝对值 3 4 6 2 3 4
中心原子所在的族序数 3 4 6 6 5 6
分子极性 非极性 非极性 非极性 极性 极性 极性
方法三:从中心原子有无孤电子对角度判断
对于ABn型分子,若中心原子A上有孤电子对,则为极性分子;若无孤电子对则为非极性分子。如CH4、BF3、SO3为非极性分子,H2S、SO2、PCl3为极性分子。
【迁移应用】
1.下列分子中,属于非极性分子的是( )
A.SO2 B.NH3
C.BBr3 D.COCl2
C
2.NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子,根据上述实例可以推测出ABn型分子为非极性分子的经验规律是( )
A.分子中必须含有π键
B.在ABn分子中A原子没有孤对电子
C.在ABn分子中不能形成分子间氢键
D.分子中每个共价键的键长应相等
B
3.常温下三氯化氮(NCl3)是一种黄色油状液体,其分子结构呈三角锥形。下列关于三氯化氮的说法正确的是( )
A.分子中N—Cl键是极性键
B.分子中不存在孤电子对
C.NCl3分子是非极性分子
D.因N—Cl键的键能大,所以NCl3的沸点高
A
