2022-2023学年鲁科版高中化学选择性必修一 2.3.2化学反应速率 (共23张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学选择性必修一 2.3.2化学反应速率 (共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 62.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-19 19:58:49 | ||
图片预览







文档简介
(共23张PPT)
化学反应速率
灭菌后设备需将环境中的H2O2快速分解为H2O和O2,当环境内H2O2浓度降到安全值以下,人员方可进入洁净区。
H2O2分子常温下的分解速率很慢。
如何调控?
任务一 认识化学反应的快慢
安全气囊弹出时间约为0.03s
钟乳石每年平均增长3毫米
哪些现象可以描述反应的快慢?
活动1:定性描述化学反应的快慢
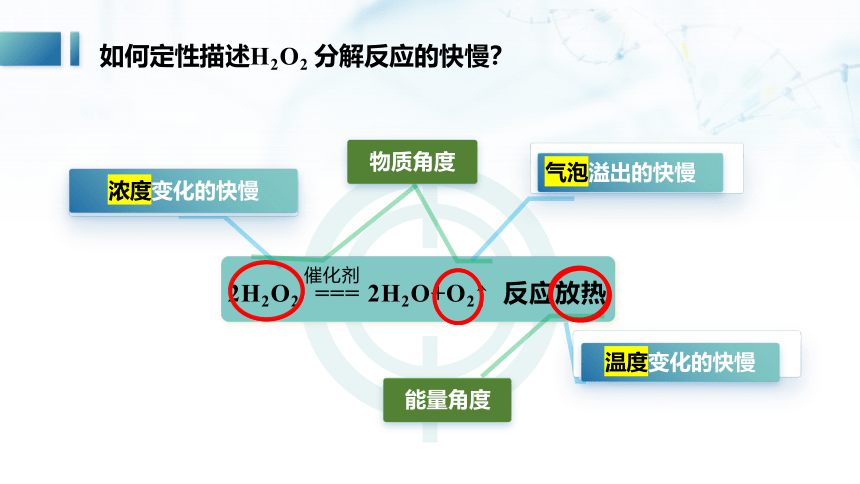
气泡溢出的快慢
温度变化的快慢
质量变化的快慢
颜色变化的快慢
物质角度
能量角度
2H2O2 === 2H2O+O2↑ 反应放热
催化剂
气泡溢出的快慢
温度变化的快慢
浓度变化的快慢
如何定性描述H2O2 分解反应的快慢?
物质角度
能量角度
2-1:基于经验归纳影响化学反应快慢的因素
Fe
Na
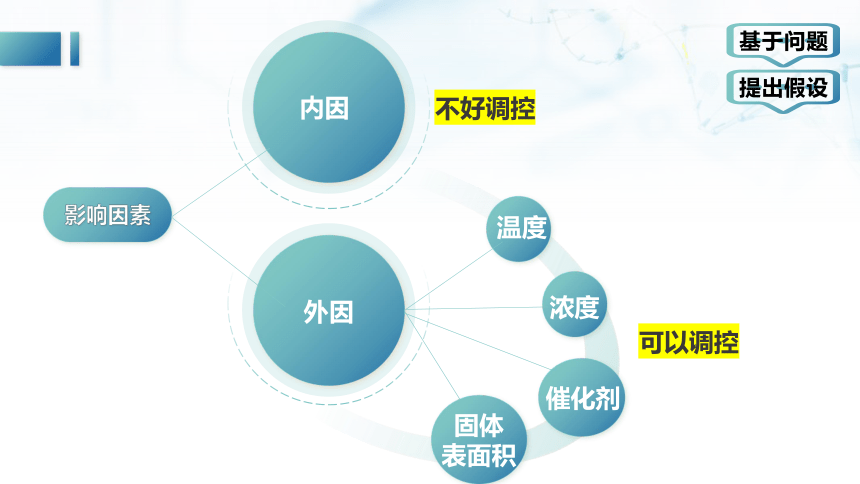
基于问题
自身性质
温度
催化剂
固体表面积
浓度
活动2:探究影响化学反应快慢的因素
外因
内因
基于问题
提出假设
温度
浓度
影响因素
催化剂
固体
表面积
不好调控
可以调控
确定研究对象
确定因变量
确定自变量
确定观测指标
确定设计原则
温度、浓度、催化剂、
化学反应的快慢
气泡溢出的快慢
控制变量法
基于问题
提出假设
明确思路
2-2:明确研究思路与方法
2H2O2 = 2H2O+O2↑
催化剂
【资料卡片】MnO2催化H2O2分解,MnO2固体也参与反应。
固体表面积
基于问题
提出假设
明确思路
2-3:设计实验方案
设计方案
设计实验 预期现象
单一变量 具体方案(试管图)
①温度
②浓度
③催化剂
④固体表面积
【实验用品】
5%H2O2,10%H2O2,1mol/LFeCl3溶液,1mol/LCuCl2溶液,蒸馏水,MnO2粉末,MnO2颗粒;
胶头滴管,试管,盛冷水的烧杯,盛热水的烧杯。
2mL5%H2O2
热水
2滴1mol/LFeCl3溶液
冷水
2mL5%
H2O2
2滴1mol/LFeCl3溶液
2mL
10%H2O2
2滴
蒸馏水
2mL10%H2O2
2滴1mol/L CuCl2
2滴1mol/L FeCl3 溶液
MnO2
粉沫1g
2mL5%H2O2
MnO2颗粒1g
D
A
B
C
2-4:实验验证
小组内合作探究
大组间成果分享
【明确分工】
2名实验操作员
1名新闻发言人
其余同学认真观察
实验验证
提出假设
明确思路
2-5:得出结论
设计方案
基于问题
化学反应快慢的影响因素
温度
浓度
催化剂
固体表面积
其他条件一定时 c 增大,反应更快
其他条件一定时 T 升高,反应更快
其他条件一定时催化剂可以改变反应快慢
同一反应可以有不同催化剂
不同催化剂对同一反应催化效果不同
其他条件一定时,固体表面积增大,反应更快
得出结论
还有哪些影响反应快慢的因素?
氧气
带火星木条
压强
T不变时
改变 P 是通过改变 V 实现的; 实际改变反应物 c
T不变时
P 增大, 反应越快
基于问题
实验验证
确定研究思路
提出假设
设计方案
得出结论
1.影响反应快慢的因素有哪些?
3.控制变量法
5.分组实验
2.假设:
温度、浓度、催化剂、固体表面积
4.讨论实验方案
6.得出结论
2-6: 思维建模
反应规律的探究实验模型
1
确定研究对象
2
确定自变量
确定因变量
4
设计实验
具体操作
3
确定观测指标
控制变量法
控制变量法
研究哪个反应?
变量是什么?
不变量是什么?
哪个现象便于观察快慢?
怎样具体实施?
1.过氧化氢灭菌器灭菌后,需要将环境中残余的H2O2快速分解为H2O和O2。可以从哪几个角度调控反应快慢?
①高效催化剂
②升高温度
迁移运用:调控过氧化氢分解快慢
环境中H2O2浓度要在一定时间内降到安全值以下,人员才可进入。
2H2O2 = 2H2O+O2↑ 反应放热
催化剂
活动1:认识定量表征化学反应快慢的方法
单位时间内密闭容器压强的改变量△p
单位时间内生成气体的体积△V
单位时间内温度的改变量△T
单位时间内浓度的改变量△c
任务二 定量表征化学反应的快慢
2H2O2 = 2H2O+O2↑ 反应放热
催化剂
物质角度
能量角度
活动2:压强法定量表征化学反应的快慢
压强传感器
数据采集器
【实验用品】
具支试管,活塞,烧杯,压强传感器,数据采集器,电脑。
【明确分工】
2名实验操作员
1名电脑操作员
1名数据记录员
1名新闻发言人
其余同学认真观察
热水
冷水
5mL5%H2O2
1滴管1mol/LFeCl3溶液
A温度
B浓度
C催化剂
D固体
表面积
1滴管1mol/LFeCl3溶液
5mL5%
H2O2
5mL10%
H2O2
1滴管1mol/L FeCl3 溶液
1滴管
蒸馏水
1滴管1mol/L CuCl2
5mL10%H2O2
MnO2
粉末1g
MnO2
颗粒1g
2mL5%H2O2
小组内合作探究
大组间成果分享
υ(O2) = ——
Δp(O2)
Δ t
如何用压强定量表征反应的快慢?
化学反应速率:单位时间内,有关物理量变化的多少。
通常用单位时间内反应物浓度的减少或生成物浓度的增加(均取正值)来表示。
单位:mol/(L ·s) 或 mol ·L-1 ·s-1
υ(x) = ——
Δc(x)
Δ t
表达式:
活动3:化学反应速率
υ(H2O2) = —— = 775.3mg/(m3·h)
Δc
Δ t
2.已知环境中H2O2安全浓度不超过1.5mg/m3,某品牌过氧化氢灭菌器工作时峰值浓度为776.8mg/m3。若灭菌后1h人员可以进入清洁区,则H2O2分解的化学反应速率是多少?
迁移运用:调控过氧化氢分解速率
任务三 调控反应速率——解决实际问题
1.汽车尾气中的NO和CO可以生成CO2和N2,但反应速率很慢。可以从哪几个角度调控反应速率?
①高效催化剂
②扩大反应表面积
大力发展新能源汽车
2.汽车尾气进入排气管的温度大约是500~600℃,最适宜的催化剂是哪种?
适宜催化剂:铂、铑、钯
谢谢大家
化学反应速率
灭菌后设备需将环境中的H2O2快速分解为H2O和O2,当环境内H2O2浓度降到安全值以下,人员方可进入洁净区。
H2O2分子常温下的分解速率很慢。
如何调控?
任务一 认识化学反应的快慢
安全气囊弹出时间约为0.03s
钟乳石每年平均增长3毫米
哪些现象可以描述反应的快慢?
活动1:定性描述化学反应的快慢
气泡溢出的快慢
温度变化的快慢
质量变化的快慢
颜色变化的快慢
物质角度
能量角度
2H2O2 === 2H2O+O2↑ 反应放热
催化剂
气泡溢出的快慢
温度变化的快慢
浓度变化的快慢
如何定性描述H2O2 分解反应的快慢?
物质角度
能量角度
2-1:基于经验归纳影响化学反应快慢的因素
Fe
Na
基于问题
自身性质
温度
催化剂
固体表面积
浓度
活动2:探究影响化学反应快慢的因素
外因
内因
基于问题
提出假设
温度
浓度
影响因素
催化剂
固体
表面积
不好调控
可以调控
确定研究对象
确定因变量
确定自变量
确定观测指标
确定设计原则
温度、浓度、催化剂、
化学反应的快慢
气泡溢出的快慢
控制变量法
基于问题
提出假设
明确思路
2-2:明确研究思路与方法
2H2O2 = 2H2O+O2↑
催化剂
【资料卡片】MnO2催化H2O2分解,MnO2固体也参与反应。
固体表面积
基于问题
提出假设
明确思路
2-3:设计实验方案
设计方案
设计实验 预期现象
单一变量 具体方案(试管图)
①温度
②浓度
③催化剂
④固体表面积
【实验用品】
5%H2O2,10%H2O2,1mol/LFeCl3溶液,1mol/LCuCl2溶液,蒸馏水,MnO2粉末,MnO2颗粒;
胶头滴管,试管,盛冷水的烧杯,盛热水的烧杯。
2mL5%H2O2
热水
2滴1mol/LFeCl3溶液
冷水
2mL5%
H2O2
2滴1mol/LFeCl3溶液
2mL
10%H2O2
2滴
蒸馏水
2mL10%H2O2
2滴1mol/L CuCl2
2滴1mol/L FeCl3 溶液
MnO2
粉沫1g
2mL5%H2O2
MnO2颗粒1g
D
A
B
C
2-4:实验验证
小组内合作探究
大组间成果分享
【明确分工】
2名实验操作员
1名新闻发言人
其余同学认真观察
实验验证
提出假设
明确思路
2-5:得出结论
设计方案
基于问题
化学反应快慢的影响因素
温度
浓度
催化剂
固体表面积
其他条件一定时 c 增大,反应更快
其他条件一定时 T 升高,反应更快
其他条件一定时催化剂可以改变反应快慢
同一反应可以有不同催化剂
不同催化剂对同一反应催化效果不同
其他条件一定时,固体表面积增大,反应更快
得出结论
还有哪些影响反应快慢的因素?
氧气
带火星木条
压强
T不变时
改变 P 是通过改变 V 实现的; 实际改变反应物 c
T不变时
P 增大, 反应越快
基于问题
实验验证
确定研究思路
提出假设
设计方案
得出结论
1.影响反应快慢的因素有哪些?
3.控制变量法
5.分组实验
2.假设:
温度、浓度、催化剂、固体表面积
4.讨论实验方案
6.得出结论
2-6: 思维建模
反应规律的探究实验模型
1
确定研究对象
2
确定自变量
确定因变量
4
设计实验
具体操作
3
确定观测指标
控制变量法
控制变量法
研究哪个反应?
变量是什么?
不变量是什么?
哪个现象便于观察快慢?
怎样具体实施?
1.过氧化氢灭菌器灭菌后,需要将环境中残余的H2O2快速分解为H2O和O2。可以从哪几个角度调控反应快慢?
①高效催化剂
②升高温度
迁移运用:调控过氧化氢分解快慢
环境中H2O2浓度要在一定时间内降到安全值以下,人员才可进入。
2H2O2 = 2H2O+O2↑ 反应放热
催化剂
活动1:认识定量表征化学反应快慢的方法
单位时间内密闭容器压强的改变量△p
单位时间内生成气体的体积△V
单位时间内温度的改变量△T
单位时间内浓度的改变量△c
任务二 定量表征化学反应的快慢
2H2O2 = 2H2O+O2↑ 反应放热
催化剂
物质角度
能量角度
活动2:压强法定量表征化学反应的快慢
压强传感器
数据采集器
【实验用品】
具支试管,活塞,烧杯,压强传感器,数据采集器,电脑。
【明确分工】
2名实验操作员
1名电脑操作员
1名数据记录员
1名新闻发言人
其余同学认真观察
热水
冷水
5mL5%H2O2
1滴管1mol/LFeCl3溶液
A温度
B浓度
C催化剂
D固体
表面积
1滴管1mol/LFeCl3溶液
5mL5%
H2O2
5mL10%
H2O2
1滴管1mol/L FeCl3 溶液
1滴管
蒸馏水
1滴管1mol/L CuCl2
5mL10%H2O2
MnO2
粉末1g
MnO2
颗粒1g
2mL5%H2O2
小组内合作探究
大组间成果分享
υ(O2) = ——
Δp(O2)
Δ t
如何用压强定量表征反应的快慢?
化学反应速率:单位时间内,有关物理量变化的多少。
通常用单位时间内反应物浓度的减少或生成物浓度的增加(均取正值)来表示。
单位:mol/(L ·s) 或 mol ·L-1 ·s-1
υ(x) = ——
Δc(x)
Δ t
表达式:
活动3:化学反应速率
υ(H2O2) = —— = 775.3mg/(m3·h)
Δc
Δ t
2.已知环境中H2O2安全浓度不超过1.5mg/m3,某品牌过氧化氢灭菌器工作时峰值浓度为776.8mg/m3。若灭菌后1h人员可以进入清洁区,则H2O2分解的化学反应速率是多少?
迁移运用:调控过氧化氢分解速率
任务三 调控反应速率——解决实际问题
1.汽车尾气中的NO和CO可以生成CO2和N2,但反应速率很慢。可以从哪几个角度调控反应速率?
①高效催化剂
②扩大反应表面积
大力发展新能源汽车
2.汽车尾气进入排气管的温度大约是500~600℃,最适宜的催化剂是哪种?
适宜催化剂:铂、铑、钯
谢谢大家
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
