山东省济宁市泗水县2022-2023学年高二下学期期中考试化学试题(含答案)
文档属性
| 名称 | 山东省济宁市泗水县2022-2023学年高二下学期期中考试化学试题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-19 00:00:00 | ||
图片预览


文档简介
泗水县2022-2023学年高二下学期期中考试
化学试题
说明:
1.本试卷分第Ⅰ卷和第Ⅱ卷,全卷满分100分,考试时间为90分钟。
2.答卷前请将答题卡上有关项目填、涂清楚,将第Ⅰ卷题目的答案用2B铅笔涂在答题卡上,第Ⅱ卷题目的答案用0.5mm黑色中性笔写在答题纸的相应位置上,答案写在试卷上的无效。
3.可能用到的相对原子质量:H-l C-12 O-16 S-32 Fe-56
第Ⅰ卷(选择题 共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.某基态原子的核外电子排布式为,下列说法中错误的是( )
A.该元素原子核外共有34个运动状态不同的电子
B.该元素原子价电子排布式为
C.该元素原子核外电子有18种空间运动状态
D.该元素原子核外有8种能量不同的电子
2.下列描述中正确的是( )
A.基态碳原子的轨道表示式
B.第四周期中未成对电子数最多的原子为Mn
C.基态核外电子的排布为的原子,3p能级有一个空轨道
D.磷元素的第一电离能大于硫元素的第一电离能
3.向盛有硫酸铜溶液的试管里加入氨水,首先形成难溶物;继续添加氨水,难溶物溶解得到深蓝色的透明溶液;再加入适量乙醇,并用玻璃棒摩擦试管璧,析出深蓝色的晶体。下列说法正确的是( )
A.加入氨水,首先形成的难溶物是
B.沉淀溶解后,将生成深蓝色的配离子
C.在中,提供空轨道,的N提供孤对电子
D.析出的深蓝色晶体是
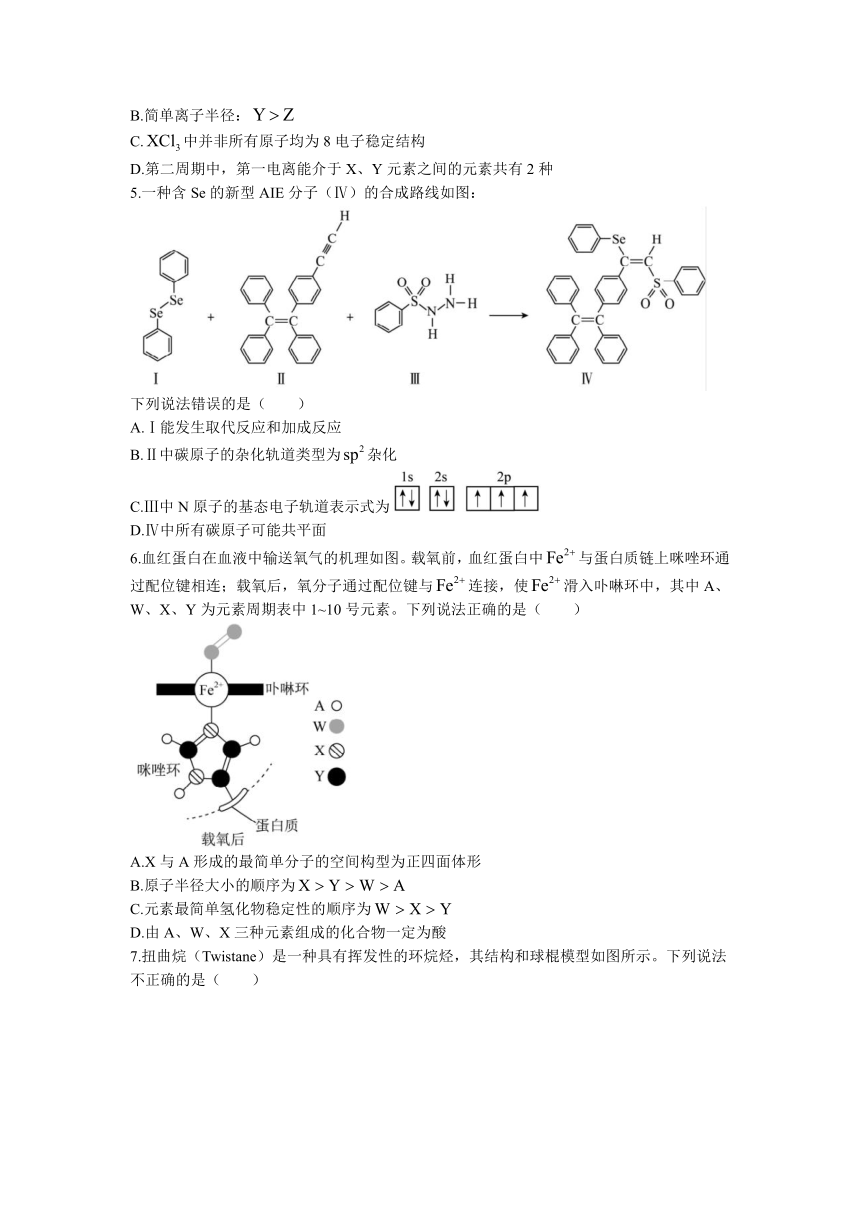
4.由短周期主族元素组成的具有良好的储氢性能的化合物如图所示,元素W、X、Y、Z的原子序数依次增大且总和为24,下列有关叙述错误的是( )
A.分子中Y原子采用杂化
B.简单离子半径:
C.中并非所有原子均为8电子稳定结构
D.第二周期中,第一电离能介于X、Y元素之间的元素共有2种
5.一种含Se的新型AIE分子(Ⅳ)的合成路线如图:
下列说法错误的是( )
A.Ⅰ能发生取代反应和加成反应
B.Ⅱ中碳原子的杂化轨道类型为杂化
C.Ⅲ中N原子的基态电子轨道表示式为
D.Ⅳ中所有碳原子可能共平面
6.血红蛋白在血液中输送氧气的机理如图。载氧前,血红蛋白中与蛋白质链上咪唑环通过配位键相连;载氧后,氧分子通过配位键与连接,使滑入卟啉环中,其中A、W、X、Y为元素周期表中1~10号元素。下列说法正确的是( )
A.X与A形成的最简单分子的空间构型为正四面体形
B.原子半径大小的顺序为
C.元素最简单氢化物稳定性的顺序为
D.由A、W、X三种元素组成的化合物一定为酸
7.扭曲烷(Twistane)是一种具有挥发性的环烷烃,其结构和球棍模型如图所示。下列说法不正确的是( )
A.能发生取代反应,也能发生氧化反应
B.分子式为
C.分子结构中含有4个六元环
D.一氯代物的同分异构体有3种(不考虑立体异构)
8.进行一氯取代反应后,生成4种沸点不同的有机产物的是( )
A.2,2-二甲基丁烷 B.2,2,3-三甲基戊烷
C.2,3-二甲基戊烷 D.2,2-二甲基-3-乙基戊烷
9.研究表明木豆素对学习记忆障碍有一定的改善作用,结构如图所示,下列有关木豆素的说法错误的是( )
A.1mol木豆素最多能与发生加成反应
B.苯环上的一氯代物有4种
C.分子中含3种官能团
D.一定条件下能生成高分子化合物
10.有机物M、N、Q之间的转化关系如图所示,下列说法正确的是( )
A.M的同分异构体有3种(不考虑立体异构)
B.N分子使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理一样
C.Q的一氯代物有一种
D.M、N、Q均能与溴水反应
二、多选题:本题共5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全都选对得4分,选对但不全的得2分,有选错的得0分。
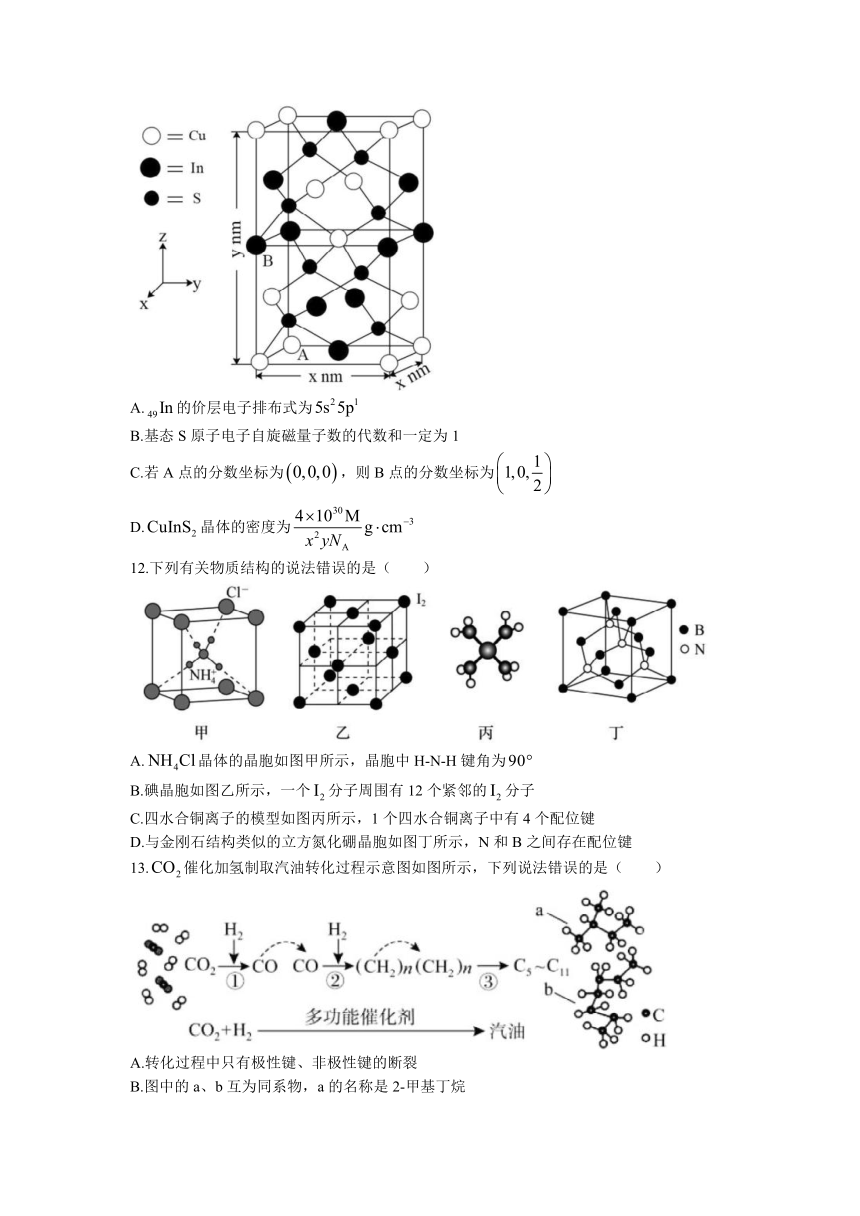
11.(式量为M)晶胞结构如图所示,阿伏加德罗常数为。已知:原子中运动的电子有两种相反的自旋状态,一种自旋状态用表示,与之相反的表示,称为电子的自旋磁量子数。下列说法错误的是( )
A.的价层电子排布式为
B.基态S原子电子自旋磁量子数的代数和一定为1
C.若A点的分数坐标为,则B点的分数坐标为
D.晶体的密度为
12.下列有关物质结构的说法错误的是( )
A.晶体的晶胞如图甲所示,晶胞中H-N-H键角为
B.碘晶胞如图乙所示,一个分子周围有12个紧邻的分子
C.四水合铜离子的模型如图丙所示,1个四水合铜离子中有4个配位键
D.与金刚石结构类似的立方氮化硼晶胞如图丁所示,N和B之间存在配位键
13.催化加氢制取汽油转化过程示意图如图所示,下列说法错误的是( )
A.转化过程中只有极性键、非极性键的断裂
B.图中的a、b互为同系物,a的名称是2-甲基丁烷
C.反应①、②和③的产物中均含有水
D.该转化变废为宝,有利于可持续发展
14.一种生产聚苯乙烯的流程如图:
下列叙述正确的是( )
A.苯乙烯与苯互为同系物
B.苯乙烯分子中所有原子一定在同一平面内
C.反应①的反应类型是取代反应
D.鉴别乙苯与苯乙烯可用的四氯化碳溶液
15.已知某有机化合物A的红外光谱如图所示,下列说法中不正确的是( )
A.由红外光谱可知,分子中碳原子一定有、两种杂化方式
B.由红外光谱可知,该有机化合物分子中至少有三种不同的化学键
C.仅由红外光谱无法得知其相对分子质量
D.若A的结构简式为,则1个分子中有10个键
第Ⅱ卷(非选择题 共60分)
三、非选择题:本题共5小题,共60分。
16.(12分)(1)中的化学键从形成过程来看,属于________(填“”或“”)键。
(2)和分子中C原子的杂化方式分别为________和________。
(3)分子的结构式为,每个分子内含有的键、键数目分别为________。
A.4个键 B.2个键、2个键
C.2个键、1个键 D.3个键、1个键
(4)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
甲:________,乙:________。
17.(12分)铁及其化合物是日常生活生产中应用广泛的材料。
(1)铁元素常见的离子有和,稳定性________(填“大于”“等于”或“小于”),的基态核外价电子排布式为________。
(2)某金属原子簇类配位化合物结构如图
上述化合物中含有三种非金属元素,三种元素原子第一电离能由大到小顺序为________(用元素符号表示),中心原子铁的配位原子是________。
(3)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。该氧化物中、、的个数比为________(填最简整数比)。
(4)铁有、、三种同素异形体,如下图所示。
晶体的一个晶胞中所含有的铁原子数为________,、两种晶胞中铁原子的配位数之比为________。
(5)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,已知:晶体密度为,阿伏加德罗常数的值为,晶胞六棱柱底面边长为,该晶胞的高________pm(列出计算式)。
18.(12分)铜和钛可呈现多种化合价,回答下列问题。
(1)配位化合物中心原子也存在轨道杂化现象,中采取SP杂化,的空间结构为________。
(2)某种含铜热电材料,晶胞结构如图,Cu位于棱、面上,Sb位于体心、顶点,S位于晶胞内,底部边长为,高为,该晶体化学式为________,其中部分原子坐标为、、,Y点的原子坐标为________。
(3)基态Ti原子的价电子轨道表示式为________。
(4)钛基配合物可用于催化环烯烃聚合,其结构如图所示:
钛的配位数为________。
(5)已知与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为________。
19.(12分)如图所示是以石油为原料制备某些化工产品的部分流程。
(1)反应②的化学方程式为________。
(2)B分子中无甲基,B的结构简式为________。
(3)反应①和③的类型依次是________、________。
(4)反应④化学方程式为________。
20.(12分)(1)已知:烃A的质谱图如图1所示。A和溴发生反应生成B:,B是一种二溴代烃,B的HNMR(核磁共振氢谱)如图2所示。
A的分子式为________,反应A到B的反应类型为________,B的结构简式是________。
(2)借助李比希法和现代科学仪器可以确定分子结构。某化学实验小组利用如图所示的装置测定某有机化合物X的组成及结构,取6.72gX与足量氧气充分燃烧,实验结束后,高氯酸镁的质量增加8.64g,碱石棉的质量增加21.12g。
已知X的相对分子质量为84,根据实验数据,X的分子式为________,通过核磁共振氢谱仪测得X的核磁共振氢谱图中只有1组峰,X可能的结构简式为________。
(3)X的同分异构体(不考虑立体异构)中能满足下列条件的有________种
①使溴水因发生反应而褪色 ②碳骨架主链上的碳原子数不小于5
泗水县2022-2023学年高二下学期期中考试
化学试题参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
B D C D B C C D C A BD A AC D AD
16.(1)(2分) (2)sp(2分),(2分) (3)D(2分)
(4)(2分),(2分)。
17.(1)小于(1分),(1分) (2)(2分),S、N(2分) (3)(2分)
(4)4(1分),(1分) (5)(2分)。
18.(1)直线形(2分)
(2)(2分),(2分)。
(3)(2分)
(4)6(2分) (5),或(2分)
19.(1)(3分)
(2)(2分)
(3)加成反应(2分),取代反应(2分)
(4)(3分)。
20.(1)(2分),取代反应(2分),(2分)。
(2)(2分),、(2分)
(3)9(2分)。
化学试题
说明:
1.本试卷分第Ⅰ卷和第Ⅱ卷,全卷满分100分,考试时间为90分钟。
2.答卷前请将答题卡上有关项目填、涂清楚,将第Ⅰ卷题目的答案用2B铅笔涂在答题卡上,第Ⅱ卷题目的答案用0.5mm黑色中性笔写在答题纸的相应位置上,答案写在试卷上的无效。
3.可能用到的相对原子质量:H-l C-12 O-16 S-32 Fe-56
第Ⅰ卷(选择题 共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.某基态原子的核外电子排布式为,下列说法中错误的是( )
A.该元素原子核外共有34个运动状态不同的电子
B.该元素原子价电子排布式为
C.该元素原子核外电子有18种空间运动状态
D.该元素原子核外有8种能量不同的电子
2.下列描述中正确的是( )
A.基态碳原子的轨道表示式
B.第四周期中未成对电子数最多的原子为Mn
C.基态核外电子的排布为的原子,3p能级有一个空轨道
D.磷元素的第一电离能大于硫元素的第一电离能
3.向盛有硫酸铜溶液的试管里加入氨水,首先形成难溶物;继续添加氨水,难溶物溶解得到深蓝色的透明溶液;再加入适量乙醇,并用玻璃棒摩擦试管璧,析出深蓝色的晶体。下列说法正确的是( )
A.加入氨水,首先形成的难溶物是
B.沉淀溶解后,将生成深蓝色的配离子
C.在中,提供空轨道,的N提供孤对电子
D.析出的深蓝色晶体是
4.由短周期主族元素组成的具有良好的储氢性能的化合物如图所示,元素W、X、Y、Z的原子序数依次增大且总和为24,下列有关叙述错误的是( )
A.分子中Y原子采用杂化
B.简单离子半径:
C.中并非所有原子均为8电子稳定结构
D.第二周期中,第一电离能介于X、Y元素之间的元素共有2种
5.一种含Se的新型AIE分子(Ⅳ)的合成路线如图:
下列说法错误的是( )
A.Ⅰ能发生取代反应和加成反应
B.Ⅱ中碳原子的杂化轨道类型为杂化
C.Ⅲ中N原子的基态电子轨道表示式为
D.Ⅳ中所有碳原子可能共平面
6.血红蛋白在血液中输送氧气的机理如图。载氧前,血红蛋白中与蛋白质链上咪唑环通过配位键相连;载氧后,氧分子通过配位键与连接,使滑入卟啉环中,其中A、W、X、Y为元素周期表中1~10号元素。下列说法正确的是( )
A.X与A形成的最简单分子的空间构型为正四面体形
B.原子半径大小的顺序为
C.元素最简单氢化物稳定性的顺序为
D.由A、W、X三种元素组成的化合物一定为酸
7.扭曲烷(Twistane)是一种具有挥发性的环烷烃,其结构和球棍模型如图所示。下列说法不正确的是( )
A.能发生取代反应,也能发生氧化反应
B.分子式为
C.分子结构中含有4个六元环
D.一氯代物的同分异构体有3种(不考虑立体异构)
8.进行一氯取代反应后,生成4种沸点不同的有机产物的是( )
A.2,2-二甲基丁烷 B.2,2,3-三甲基戊烷
C.2,3-二甲基戊烷 D.2,2-二甲基-3-乙基戊烷
9.研究表明木豆素对学习记忆障碍有一定的改善作用,结构如图所示,下列有关木豆素的说法错误的是( )
A.1mol木豆素最多能与发生加成反应
B.苯环上的一氯代物有4种
C.分子中含3种官能团
D.一定条件下能生成高分子化合物
10.有机物M、N、Q之间的转化关系如图所示,下列说法正确的是( )
A.M的同分异构体有3种(不考虑立体异构)
B.N分子使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理一样
C.Q的一氯代物有一种
D.M、N、Q均能与溴水反应
二、多选题:本题共5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全都选对得4分,选对但不全的得2分,有选错的得0分。
11.(式量为M)晶胞结构如图所示,阿伏加德罗常数为。已知:原子中运动的电子有两种相反的自旋状态,一种自旋状态用表示,与之相反的表示,称为电子的自旋磁量子数。下列说法错误的是( )
A.的价层电子排布式为
B.基态S原子电子自旋磁量子数的代数和一定为1
C.若A点的分数坐标为,则B点的分数坐标为
D.晶体的密度为
12.下列有关物质结构的说法错误的是( )
A.晶体的晶胞如图甲所示,晶胞中H-N-H键角为
B.碘晶胞如图乙所示,一个分子周围有12个紧邻的分子
C.四水合铜离子的模型如图丙所示,1个四水合铜离子中有4个配位键
D.与金刚石结构类似的立方氮化硼晶胞如图丁所示,N和B之间存在配位键
13.催化加氢制取汽油转化过程示意图如图所示,下列说法错误的是( )
A.转化过程中只有极性键、非极性键的断裂
B.图中的a、b互为同系物,a的名称是2-甲基丁烷
C.反应①、②和③的产物中均含有水
D.该转化变废为宝,有利于可持续发展
14.一种生产聚苯乙烯的流程如图:
下列叙述正确的是( )
A.苯乙烯与苯互为同系物
B.苯乙烯分子中所有原子一定在同一平面内
C.反应①的反应类型是取代反应
D.鉴别乙苯与苯乙烯可用的四氯化碳溶液
15.已知某有机化合物A的红外光谱如图所示,下列说法中不正确的是( )
A.由红外光谱可知,分子中碳原子一定有、两种杂化方式
B.由红外光谱可知,该有机化合物分子中至少有三种不同的化学键
C.仅由红外光谱无法得知其相对分子质量
D.若A的结构简式为,则1个分子中有10个键
第Ⅱ卷(非选择题 共60分)
三、非选择题:本题共5小题,共60分。
16.(12分)(1)中的化学键从形成过程来看,属于________(填“”或“”)键。
(2)和分子中C原子的杂化方式分别为________和________。
(3)分子的结构式为,每个分子内含有的键、键数目分别为________。
A.4个键 B.2个键、2个键
C.2个键、1个键 D.3个键、1个键
(4)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
甲:________,乙:________。
17.(12分)铁及其化合物是日常生活生产中应用广泛的材料。
(1)铁元素常见的离子有和,稳定性________(填“大于”“等于”或“小于”),的基态核外价电子排布式为________。
(2)某金属原子簇类配位化合物结构如图
上述化合物中含有三种非金属元素,三种元素原子第一电离能由大到小顺序为________(用元素符号表示),中心原子铁的配位原子是________。
(3)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。该氧化物中、、的个数比为________(填最简整数比)。
(4)铁有、、三种同素异形体,如下图所示。
晶体的一个晶胞中所含有的铁原子数为________,、两种晶胞中铁原子的配位数之比为________。
(5)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,已知:晶体密度为,阿伏加德罗常数的值为,晶胞六棱柱底面边长为,该晶胞的高________pm(列出计算式)。
18.(12分)铜和钛可呈现多种化合价,回答下列问题。
(1)配位化合物中心原子也存在轨道杂化现象,中采取SP杂化,的空间结构为________。
(2)某种含铜热电材料,晶胞结构如图,Cu位于棱、面上,Sb位于体心、顶点,S位于晶胞内,底部边长为,高为,该晶体化学式为________,其中部分原子坐标为、、,Y点的原子坐标为________。
(3)基态Ti原子的价电子轨道表示式为________。
(4)钛基配合物可用于催化环烯烃聚合,其结构如图所示:
钛的配位数为________。
(5)已知与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为________。
19.(12分)如图所示是以石油为原料制备某些化工产品的部分流程。
(1)反应②的化学方程式为________。
(2)B分子中无甲基,B的结构简式为________。
(3)反应①和③的类型依次是________、________。
(4)反应④化学方程式为________。
20.(12分)(1)已知:烃A的质谱图如图1所示。A和溴发生反应生成B:,B是一种二溴代烃,B的HNMR(核磁共振氢谱)如图2所示。
A的分子式为________,反应A到B的反应类型为________,B的结构简式是________。
(2)借助李比希法和现代科学仪器可以确定分子结构。某化学实验小组利用如图所示的装置测定某有机化合物X的组成及结构,取6.72gX与足量氧气充分燃烧,实验结束后,高氯酸镁的质量增加8.64g,碱石棉的质量增加21.12g。
已知X的相对分子质量为84,根据实验数据,X的分子式为________,通过核磁共振氢谱仪测得X的核磁共振氢谱图中只有1组峰,X可能的结构简式为________。
(3)X的同分异构体(不考虑立体异构)中能满足下列条件的有________种
①使溴水因发生反应而褪色 ②碳骨架主链上的碳原子数不小于5
泗水县2022-2023学年高二下学期期中考试
化学试题参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
B D C D B C C D C A BD A AC D AD
16.(1)(2分) (2)sp(2分),(2分) (3)D(2分)
(4)(2分),(2分)。
17.(1)小于(1分),(1分) (2)(2分),S、N(2分) (3)(2分)
(4)4(1分),(1分) (5)(2分)。
18.(1)直线形(2分)
(2)(2分),(2分)。
(3)(2分)
(4)6(2分) (5),或(2分)
19.(1)(3分)
(2)(2分)
(3)加成反应(2分),取代反应(2分)
(4)(3分)。
20.(1)(2分),取代反应(2分),(2分)。
(2)(2分),、(2分)
(3)9(2分)。
同课章节目录
