1.2.1有机化合物的分离和提纯(共36张PPT)-高中化学课件(苏教版2019选择性必修3)
文档属性
| 名称 | 1.2.1有机化合物的分离和提纯(共36张PPT)-高中化学课件(苏教版2019选择性必修3) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-20 09:58:14 | ||
图片预览









文档简介
(共36张PPT)
1.2.1有机化合物的分离、提纯
专
题
一
学习目标
01
认识分离和提纯有机物的常见方法
02
能采用合理的方法对混合物进行分离提纯
新课引入
研究有机物的一般步骤
分离、提纯
确定实验式
确定分子式
确定分子结构
重结晶
萃取
蒸馏
分液
01
重结晶
PART ONE
(一)重结晶的基本概念
1.概念:
2.原理:
将混合物中第一次结晶得到的晶体溶于一定量的溶剂中,再进行蒸发(或冷却)、结晶、过滤,如此的多次操作称为重结晶。
重结晶利用混合物中各组分在同一溶剂中的溶解度不同而使它们相互分离。
(二)重结晶的基本操作
2.操作步骤
②被提纯的有机物在此溶剂中的溶解度,
受温度的影响较大
1.选择溶剂的条件
①杂质在此溶剂中溶解度很小或很大
3.装置
加热溶解
趁热过滤
冷却结晶
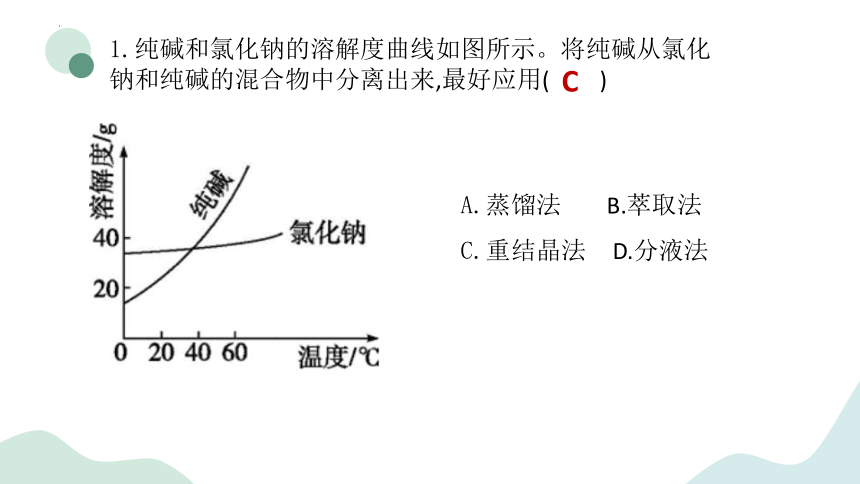
1.纯碱和氯化钠的溶解度曲线如图所示。将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用( )
C
A.蒸馏法 B.萃取法
C.重结晶法 D.分液法
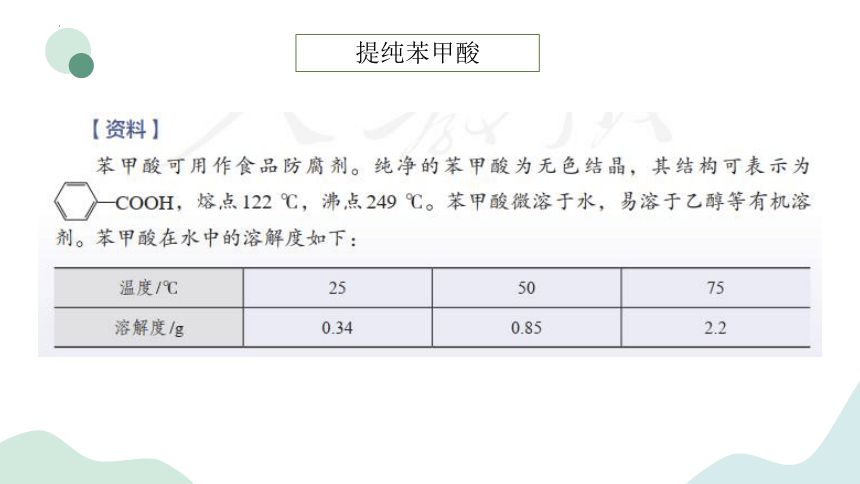
提纯苯甲酸
重结晶法提纯苯甲酸
【实验步骤】
重结晶法提纯苯甲酸
增大苯甲酸在水中的溶解度
温度高,苯甲酸不易析出
溶解时加速溶解、过滤和洗涤时引流
取最后一次洗涤液少许与试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已经除净。
【提问1】溶解粗苯甲酸时加热的作用是什么?
【提问2】趁热过滤的目的是什么?
【提问3】实验操作中多次使用了玻璃棒,分别起到哪些作用?
【提问4】如何检验提纯后的苯甲酸中氯化钠已被除净?
02
萃取丨分液
PART TWO
(一)萃取的基本概念
1.分类:
2.原理:
液-液萃取;固-液萃取
液-液萃取:是向待分离溶液中加入与之不互溶(或部分互溶)的萃取剂,形成共存的两个液相。
常用与水不互溶的有机溶剂有乙醚、石油醚和二氯甲烷等。
固-液萃取:是利用溶剂使固体物料中的可溶性物质溶解于其中而加以分离的操作,又称浸取。
如从植物种子中提取食用油,从甜菜中提取糖。
(二)萃取剂的选择
c. 溶质在萃取剂中的溶解度比在原溶剂中的大得多
a. 萃取剂和原溶剂互不相溶
b. 萃取剂和原溶剂、溶质均不发生化学反应
(三)萃取的基本步骤
注意事项 ①使用分液漏斗前要 ;
②萃取的主要步骤: ;
④分液时下层液体从分液漏斗 口放出,上层液体从
口倒出
上
下
验漏
振荡、静置、分液
振荡的基本操作
半倒立斜向上,轻轻旋转活塞即可
03
蒸馏
PART THREE
(一)蒸馏的基本概念
1.原理:
2.适用条件:
3.实验仪器:
利用混合物中各组分沸点不同,达到分离液态混合物的目的。
(一般有机物与杂质的沸点应相差30℃以上)
温度计
蒸馏
烧瓶
牛角管
锥形瓶
(二)蒸馏的注意事项
(三)分馏
当液态混合物中含有多种沸点不同的有机物组分时,经过多次汽化和冷凝可以将这些成分(馏分)逐步分离,这一过程称为分馏,如石油的分馏等。
课堂小结
作业布置
1.《导与练》P8 学业质量测评
2.《课时作业》P134~136
基础题组:2、4、6、7、9
能力题组:14
04
习题探究
PART FOUR
学业质量测评
萃取与分液的异同
相同点:
1.都使用了分液漏斗
2.分离后都形成两个液相
3.实验操作相同,萃取包含分液
不同点:
1.目的不同,萃取是从液体混合物中提纯物质,分液是分离互不相容的液体混合物
2.提纯物质不同,萃取是为了得到溶质,还有后续操作,(如从CCl4中提取碘);分液是单纯的分离两种液体
2.下列有关实验原理或操作正确的是( )
A.①分离CCl4和水
B.②洗涤沉淀时,向漏斗中加入适量水,搅拌并滤干
C.③液体分层,下层呈无色
D.④除去氯气中的少量氯化氢
A
洗涤沉淀时,应该向漏斗加水,没过沉淀,搅拌滤干,重复2~3次
4.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。下列说法错误的是( )
A.步骤①需要过滤装置
B.步骤③需要用到蒸发皿
C.活性天然产物易溶于有机溶剂,难溶于水
D.步骤④是利用物质沸点差异进行分离的
C
6.将CH3CHO(易溶于水、沸点为20.8 ℃的液体)和CH3COOH分离的正确方法是( )
A.加热蒸馏
B.加入Na2CO3后,通过萃取的方法分离
C.先加入烧碱溶液,之后蒸出乙醛,再加入浓H2SO4,蒸出乙酸
D.和Na反应后进行分离
C
乙酸能和烧碱反应转化为难挥发的盐,乙醛易挥发,在混合物中加入烧碱溶液后蒸出乙醛,再加入浓硫酸,使乙酸钠转化为乙酸,再蒸出乙酸。
7.下列有关物质的分离的说法中,正确的是( )
A.除去乙酸乙酯中的少量乙酸,可加入氢氧化钠溶液充分反应后分液
B.如图所示,振荡后静置,上层溶液颜色保持不变
C.C2H5OH中有CH3COOH,加足量CaO蒸馏除去
D.分液时,分液漏斗中下层液体从下口放出,上层液体也从下口放出
C
分离CH3COOH时,可以使其反应生成高沸点的金属盐(如醋酸钠、醋酸钙等),再通过蒸馏分离出来,然后加浓硫酸转化成乙酸后,再次蒸馏蒸出乙酸。
9.现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图。请填入适当的试剂、分离方法以及所分离的有关物质的名称。
14.苯甲酸广泛存在于自然界,常用于合成杀菌剂和香料等。KMnO4具有强氧化性,其氧化甲苯可生成苯甲酸钾和MnO2。
(1)水从图中仪器A的 (填“M”或“N”)端通入,仪器A的作用是 。
已知:甲苯不溶于水;苯甲酸是一元弱酸,微溶于冷水,易溶于热水,100 ℃升华。
蒸馏时使用直形冷凝管
冷凝回流时使用球形冷凝管
对于回流操作,此时冷凝管的目的是在加热的烧瓶上方施加冷却,让受热汽化的溶剂冷却回反应瓶中,防止溶剂“蒸干”。此时冷凝管垂直放置于反应瓶瓶口上方,原则上直型、球形和蛇形冷凝管都可以用,一般后两者效果较好。
14.苯甲酸广泛存在于自然界,常用于合成杀菌剂和香料等。KMnO4具有强氧化性,其氧化甲苯可生成苯甲酸钾和MnO2。
(1)水从图中仪器A的 (填“M”或“N”)端通入,仪器A的作用是 。
已知:甲苯不溶于水;苯甲酸是一元弱酸,微溶于冷水,易溶于热水,100 ℃升华。
M
冷凝回流,防止甲苯挥发而降低产品的产率
14.苯甲酸广泛存在于自然界,常用于合成杀菌剂和香料等。KMnO4具有强氧化性,其氧化甲苯可生成苯甲酸钾和MnO2。
已知:甲苯不溶于水;苯甲酸是一元弱酸,微溶于冷水,易溶于热水,100 ℃升华。
步骤a:向图中所示装置中加入KMnO4、H2O和甲苯,搅拌、加热至反应完全。
(2)步骤a中反应完全的现象是 。
回流液无油珠
(3)为提高苯甲酸的产率,可以洗涤步骤c中过滤所得滤渣,并将洗涤所得液体与滤液合并。
①滤渣的主要成分是 。
②洗涤滤渣适宜选用 (填字母)。
a.冷水 b.热水
c.NaOH溶液 d.盐酸
14.苯甲酸广泛存在于自然界,常用于合成杀菌剂和香料等。KMnO4具有强氧化性,其氧化甲苯可生成苯甲酸钾和MnO2。
已知:甲苯不溶于水;苯甲酸是一元弱酸,微溶于冷水,易溶于热水,100 ℃升华。
步骤a:向图中所示装置中加入KMnO4、H2O和甲苯,搅拌、加热至反应完全。
MnO2
b
感谢观看
1.2.1有机化合物的分离、提纯
专
题
一
学习目标
01
认识分离和提纯有机物的常见方法
02
能采用合理的方法对混合物进行分离提纯
新课引入
研究有机物的一般步骤
分离、提纯
确定实验式
确定分子式
确定分子结构
重结晶
萃取
蒸馏
分液
01
重结晶
PART ONE
(一)重结晶的基本概念
1.概念:
2.原理:
将混合物中第一次结晶得到的晶体溶于一定量的溶剂中,再进行蒸发(或冷却)、结晶、过滤,如此的多次操作称为重结晶。
重结晶利用混合物中各组分在同一溶剂中的溶解度不同而使它们相互分离。
(二)重结晶的基本操作
2.操作步骤
②被提纯的有机物在此溶剂中的溶解度,
受温度的影响较大
1.选择溶剂的条件
①杂质在此溶剂中溶解度很小或很大
3.装置
加热溶解
趁热过滤
冷却结晶
1.纯碱和氯化钠的溶解度曲线如图所示。将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用( )
C
A.蒸馏法 B.萃取法
C.重结晶法 D.分液法
提纯苯甲酸
重结晶法提纯苯甲酸
【实验步骤】
重结晶法提纯苯甲酸
增大苯甲酸在水中的溶解度
温度高,苯甲酸不易析出
溶解时加速溶解、过滤和洗涤时引流
取最后一次洗涤液少许与试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已经除净。
【提问1】溶解粗苯甲酸时加热的作用是什么?
【提问2】趁热过滤的目的是什么?
【提问3】实验操作中多次使用了玻璃棒,分别起到哪些作用?
【提问4】如何检验提纯后的苯甲酸中氯化钠已被除净?
02
萃取丨分液
PART TWO
(一)萃取的基本概念
1.分类:
2.原理:
液-液萃取;固-液萃取
液-液萃取:是向待分离溶液中加入与之不互溶(或部分互溶)的萃取剂,形成共存的两个液相。
常用与水不互溶的有机溶剂有乙醚、石油醚和二氯甲烷等。
固-液萃取:是利用溶剂使固体物料中的可溶性物质溶解于其中而加以分离的操作,又称浸取。
如从植物种子中提取食用油,从甜菜中提取糖。
(二)萃取剂的选择
c. 溶质在萃取剂中的溶解度比在原溶剂中的大得多
a. 萃取剂和原溶剂互不相溶
b. 萃取剂和原溶剂、溶质均不发生化学反应
(三)萃取的基本步骤
注意事项 ①使用分液漏斗前要 ;
②萃取的主要步骤: ;
④分液时下层液体从分液漏斗 口放出,上层液体从
口倒出
上
下
验漏
振荡、静置、分液
振荡的基本操作
半倒立斜向上,轻轻旋转活塞即可
03
蒸馏
PART THREE
(一)蒸馏的基本概念
1.原理:
2.适用条件:
3.实验仪器:
利用混合物中各组分沸点不同,达到分离液态混合物的目的。
(一般有机物与杂质的沸点应相差30℃以上)
温度计
蒸馏
烧瓶
牛角管
锥形瓶
(二)蒸馏的注意事项
(三)分馏
当液态混合物中含有多种沸点不同的有机物组分时,经过多次汽化和冷凝可以将这些成分(馏分)逐步分离,这一过程称为分馏,如石油的分馏等。
课堂小结
作业布置
1.《导与练》P8 学业质量测评
2.《课时作业》P134~136
基础题组:2、4、6、7、9
能力题组:14
04
习题探究
PART FOUR
学业质量测评
萃取与分液的异同
相同点:
1.都使用了分液漏斗
2.分离后都形成两个液相
3.实验操作相同,萃取包含分液
不同点:
1.目的不同,萃取是从液体混合物中提纯物质,分液是分离互不相容的液体混合物
2.提纯物质不同,萃取是为了得到溶质,还有后续操作,(如从CCl4中提取碘);分液是单纯的分离两种液体
2.下列有关实验原理或操作正确的是( )
A.①分离CCl4和水
B.②洗涤沉淀时,向漏斗中加入适量水,搅拌并滤干
C.③液体分层,下层呈无色
D.④除去氯气中的少量氯化氢
A
洗涤沉淀时,应该向漏斗加水,没过沉淀,搅拌滤干,重复2~3次
4.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。下列说法错误的是( )
A.步骤①需要过滤装置
B.步骤③需要用到蒸发皿
C.活性天然产物易溶于有机溶剂,难溶于水
D.步骤④是利用物质沸点差异进行分离的
C
6.将CH3CHO(易溶于水、沸点为20.8 ℃的液体)和CH3COOH分离的正确方法是( )
A.加热蒸馏
B.加入Na2CO3后,通过萃取的方法分离
C.先加入烧碱溶液,之后蒸出乙醛,再加入浓H2SO4,蒸出乙酸
D.和Na反应后进行分离
C
乙酸能和烧碱反应转化为难挥发的盐,乙醛易挥发,在混合物中加入烧碱溶液后蒸出乙醛,再加入浓硫酸,使乙酸钠转化为乙酸,再蒸出乙酸。
7.下列有关物质的分离的说法中,正确的是( )
A.除去乙酸乙酯中的少量乙酸,可加入氢氧化钠溶液充分反应后分液
B.如图所示,振荡后静置,上层溶液颜色保持不变
C.C2H5OH中有CH3COOH,加足量CaO蒸馏除去
D.分液时,分液漏斗中下层液体从下口放出,上层液体也从下口放出
C
分离CH3COOH时,可以使其反应生成高沸点的金属盐(如醋酸钠、醋酸钙等),再通过蒸馏分离出来,然后加浓硫酸转化成乙酸后,再次蒸馏蒸出乙酸。
9.现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图。请填入适当的试剂、分离方法以及所分离的有关物质的名称。
14.苯甲酸广泛存在于自然界,常用于合成杀菌剂和香料等。KMnO4具有强氧化性,其氧化甲苯可生成苯甲酸钾和MnO2。
(1)水从图中仪器A的 (填“M”或“N”)端通入,仪器A的作用是 。
已知:甲苯不溶于水;苯甲酸是一元弱酸,微溶于冷水,易溶于热水,100 ℃升华。
蒸馏时使用直形冷凝管
冷凝回流时使用球形冷凝管
对于回流操作,此时冷凝管的目的是在加热的烧瓶上方施加冷却,让受热汽化的溶剂冷却回反应瓶中,防止溶剂“蒸干”。此时冷凝管垂直放置于反应瓶瓶口上方,原则上直型、球形和蛇形冷凝管都可以用,一般后两者效果较好。
14.苯甲酸广泛存在于自然界,常用于合成杀菌剂和香料等。KMnO4具有强氧化性,其氧化甲苯可生成苯甲酸钾和MnO2。
(1)水从图中仪器A的 (填“M”或“N”)端通入,仪器A的作用是 。
已知:甲苯不溶于水;苯甲酸是一元弱酸,微溶于冷水,易溶于热水,100 ℃升华。
M
冷凝回流,防止甲苯挥发而降低产品的产率
14.苯甲酸广泛存在于自然界,常用于合成杀菌剂和香料等。KMnO4具有强氧化性,其氧化甲苯可生成苯甲酸钾和MnO2。
已知:甲苯不溶于水;苯甲酸是一元弱酸,微溶于冷水,易溶于热水,100 ℃升华。
步骤a:向图中所示装置中加入KMnO4、H2O和甲苯,搅拌、加热至反应完全。
(2)步骤a中反应完全的现象是 。
回流液无油珠
(3)为提高苯甲酸的产率,可以洗涤步骤c中过滤所得滤渣,并将洗涤所得液体与滤液合并。
①滤渣的主要成分是 。
②洗涤滤渣适宜选用 (填字母)。
a.冷水 b.热水
c.NaOH溶液 d.盐酸
14.苯甲酸广泛存在于自然界,常用于合成杀菌剂和香料等。KMnO4具有强氧化性,其氧化甲苯可生成苯甲酸钾和MnO2。
已知:甲苯不溶于水;苯甲酸是一元弱酸,微溶于冷水,易溶于热水,100 ℃升华。
步骤a:向图中所示装置中加入KMnO4、H2O和甲苯,搅拌、加热至反应完全。
MnO2
b
感谢观看
