2.2.1 烯烃(课件)(共28张PPT)高二化学(人教版2019选择性必修3)
文档属性
| 名称 | 2.2.1 烯烃(课件)(共28张PPT)高二化学(人教版2019选择性必修3) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-20 10:02:03 | ||
图片预览



文档简介
(共28张PPT)
第二节 烯烃 炔烃
第1课时 烯烃
2019人教版 选择性必修3 第二章 烃
【课程学习目标·学科核心素养】
以乙烯为典型物质认识烯烃的结构与性质。能书写相关的化学方程式,发展“宏观辨识与微观探析”学科核心素养。
认识氧化反应、加成反应、加聚反应等有机反应类型。
了解烯烃的立体异构和二烯烃的加成反应。
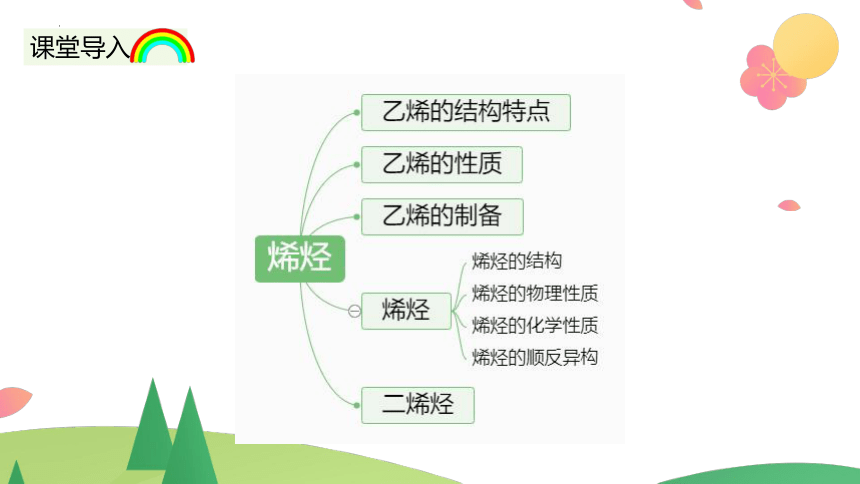
课堂导入
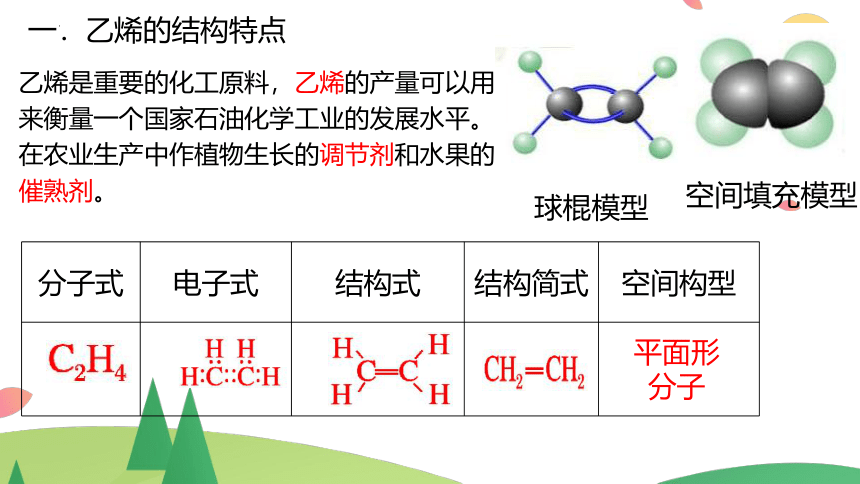
一.乙烯的结构特点
分子式 电子式 结构式 结构简式 空间构型
平面形分子
球棍模型
空间填充模型
乙烯是重要的化工原料,乙烯的产量可以用来衡量一个国家石油化学工业的发展水平。
在农业生产中作植物生长的调节剂和水果的催熟剂。
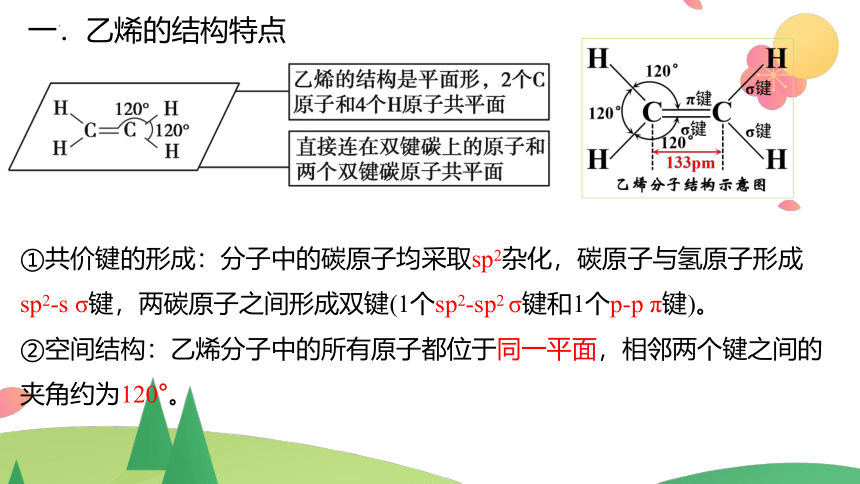
一.乙烯的结构特点
①共价键的形成:分子中的碳原子均采取sp2杂化,碳原子与氢原子形成
sp2-s σ键,两碳原子之间形成双键(1个sp2-sp2 σ键和1个p-p π键)。
②空间结构:乙烯分子中的所有原子都位于同一平面,相邻两个键之间的夹角约为120°。
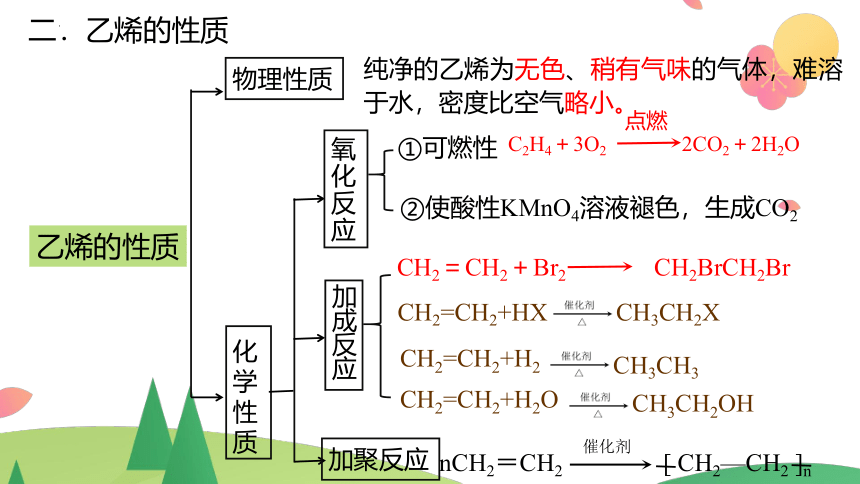
二.乙烯的性质
物理性质
化学性质
纯净的乙烯为无色、稍有气味的气体,难溶于水,密度比空气略小。
氧化反应
加成反应
加聚反应
①可燃性
C2H4+3O2 2CO2+2H2O
点燃
②使酸性KMnO4溶液褪色,生成CO2
CH2=CH2+Br2 CH2BrCH2Br
CH2=CH2+HX
CH3CH2X
CH2=CH2+H2O
CH3CH2OH
CH2=CH2+H2
CH3CH3
乙烯的性质
nCH2=CH2 [ CH2—CH2 ]n
催化剂
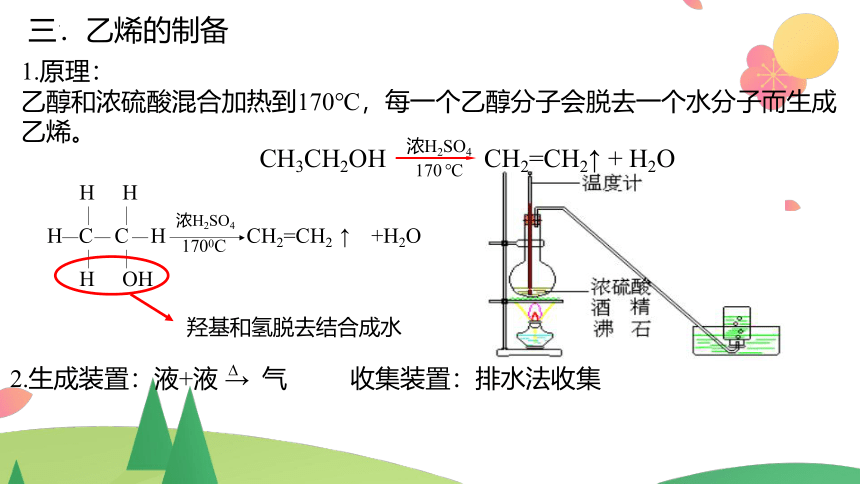
三.乙烯的制备
1.原理:
乙醇和浓硫酸混合加热到170℃,每一个乙醇分子会脱去一个水分子而生成乙烯。
浓H2SO4
1700C
H C C H CH2=CH2 ↑ +H2O
H
H
H
OH
羟基和氢脱去结合成水
2.生成装置:液+液 → 气 收集装置:排水法收集
CH3CH2OH CH2=CH2↑ + H2O
浓H2SO4
170 ℃
三.乙烯的制备
3.注意事项
①V(浓H2SO4):V(C2H5OH)=3:1;浓H2SO4稍过量,提高乙醇利用率;
②烧瓶内加入 碎瓷片/沸石 防止暴沸;
③浓硫酸充当催化剂与脱水剂;
④温度计插入液面以下测混合液温度;
⑤应使温度迅速上升到170℃,当温度在140℃时发生副反应:
⑥烧瓶内溶液变黑:浓硫酸使乙醇脱水碳化,使乙烯中混有CO2,SO2等杂质,应通入碱石灰或10%NaOH溶液除杂。
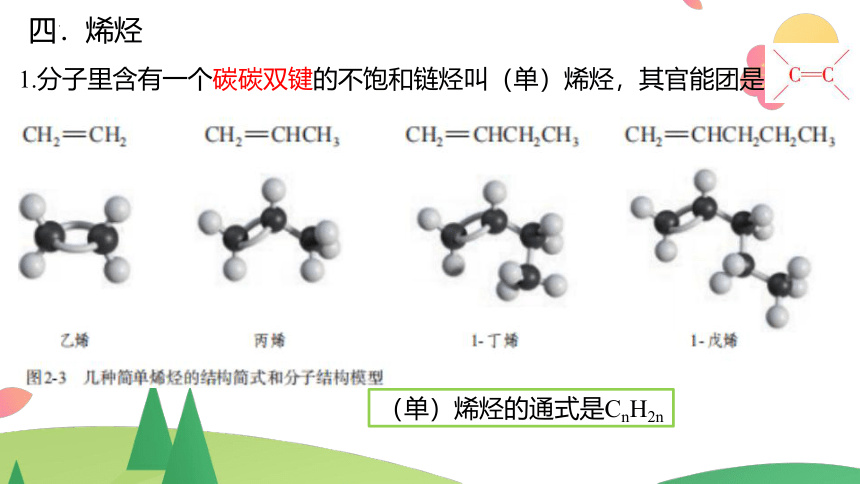
四.烯烃
1.分子里含有一个碳碳双键的不饱和链烃叫(单)烯烃,其官能团是
(单)烯烃的通式是CnH2n
四.烯烃
2.烯烃的物理性质
烯烃物理性质的递变规律与烷烃的相似,沸点也随分子中碳原子数的递增而逐渐升高。烯烃的结构和性质与乙烯的相似,能发生加成反应和氧化反应。
(1)状态:
(2)熔沸点:
(3)密度:随C数目的增加而增大;但相对密度都小于1
(4)溶解性:
随C数目的增加,熔沸点升高
几乎不溶于水;但可溶于有机溶剂
气态→液态→固态。
标准状况下 C2—C4呈气态
碳原子数相同时,支链越多,熔沸点越低。
四.烯烃
3.烯烃的化学性质
(1)由于碳碳双键比碳碳单键更加活泼,较不稳定,更易发生反应,烯烃易氧化、加成(加聚)。
O2
nCO2+nH2O
CnH2n+
烯烃燃烧的通式
①燃烧反应
②被强氧化剂氧化
使酸性KMnO4溶液褪色
CH2=
CO2
KMnO4
H+
KMnO4
H+
C=O
R'
R''
C=
R'
R''
酮
R—CH=
R—COOH
KMnO4
H+
羧酸
CH2=CHCH3
KMnO4
H+
CO2
CH3COOH
CH2=C(CH3)2
KMnO4
H+
CO2
CH3COCH3
四.烯烃
3.烯烃的化学性质
(2)加成反应
①卤素单质或其溶液
卤代烃
CH2=CH2 + Br2
CH2Br—CH2Br
1,2-二溴乙烷
②氢气
烷烃
③卤化氢
卤代烃
④水
醇
CH3-CH=CH2 + H2 CH3-CH2-CH3
催化剂 △
马氏规则:氢上加氢
主要
四.烯烃
3.烯烃的化学性质
CH2=CHCH3 + HCl
Cl
CH3 CHCH3
催化剂
Cl
CH2 CH2CH3
主
次
CH2=CHCH3 + H2O
催化剂
加热、加压
OH
CH3 CHCH3
OH
CH2 CH2CH3
主
次
2-氯丙烷
马氏规则:
不对称烯烃和HX、H2O加成时,氢主要加在含氢多的双键碳原子上。
1-氯丙烷
2-丙醇
1-丙醇
四.烯烃
3.烯烃的化学性质
(3)加聚反应 有机物分子含有C=C、C≡C等不饱和化学键
CH2—CH2
n
PE 聚乙烯
nCH2=CH—CH3
CH2—CH
n
CH3
PP 聚丙烯
丙烯
通式:
nCH= CH
A
B
CH—CH
n
B
A
单体
链节
聚合度
【典例】完成下列加聚反应的化学方程式
①氯乙烯加聚反应:nCH2=CHCl
②丙烯加聚反应:nCH3CH=CH2
③苯乙烯加聚反应:
④ nCH3CH=CHCOOH
[CH—CH2 ]n
CH3
COOH
[CH CH2] n
[CH2—CH ]n
Cl
[CH—CH2 ]n
CH3
二者的结构一样吗?
通过碳碳双键 连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反异构现象。
(1)顺反异构现象
(2)顺反异构体
相同的原子或原子团位于双键同一侧的称为顺式结构,相同的原子或原子团位于双键两侧的称为反式结构,例如顺 -2- 丁烯和反- 2 -丁烯的结构简式分别是 和
四.烯烃
4.烯烃的顺反异构
(3)顺反异构的条件
碳碳双键的每个碳原子必须连接两个不同的原子或原子团。
有顺反异构的类型
无顺反异构的类型
(4)性质顺反异构体的化学性质基本相同,物理性质有一定的差异。
顺-2-丁烯
(3.7℃)
反-2-丁烯
( 0.88℃)
四.烯烃
CH3 CH=CH CH3
CH2
C
CH3
CH3
CH2
CH
CH3
CH2
C=
C
CH3
H
CH3
H
C=
C
CH3
H
CH3
H
【典例】写出符合分子式为C4H8的有机物的结构简式(包括顺反异构)
碳链异构:
位置异构:
顺反异构
官能团异构:
五.二烯烃
二烯烃是分子中含有两个碳碳双键的烯烃,通式CnH2n-2
如1,3-丁二烯:CH2=CH-CH=CH2(共轭二烯烃)
1.加成反应: 1,3-丁二烯与氯气发生加成反应时,
②1,4-加成
③完全加成 CH2==CH—CH==CH2+2Cl2→CH2Cl—CHCl—CHCl—CH2Cl
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底哪一种加成占优势,取决于反应条件。在温度较高的条件下大多发生1,4-加成,在温度较低的条件下大多发生1,2-加成。
①1,2-加成
2.加聚反应
n CH2=CH-CH=CH2
催化剂
、P
1 2 3 4
(1,3-丁二烯)
聚1,3-丁二烯
—CH2-CH=CH-CH2 —
[ ]n
俗称:异戊二烯 聚异戊二烯
学名:2-甲基-1,3-丁二烯 (天然橡胶)
nCH2=C-CH=CH2 [ CH2-C=CH-CH2]n
CH3
CH3
加聚
天然橡胶简介:
五.二烯烃
Diels—Alder成环反应
共轭二烯烃的特征反应
五.二烯烃
效果检测
【典例1】(2021·江苏·盐城市伍佑中学高二期中)乙烯是石油炼制的重要产物,下列关于乙烯的说法中错误的是
A.乙烯是一种植物生长调节剂
B.乙烯分子中的六个原子在同一平面上
C.可用于生产聚乙烯塑料
D.乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同
【答案】D
【典例2】(2021·贵州省思南中学高二期中)下列物质中,属于顺式结构的是
A. B.
C. D.
【答案】C
【典例3】(2021·安徽·蚌埠二中高二期中)2,2,4 - 三甲基戊烷俗称
异辛烷( ),常加入汽油中来减震,下列各烃与氢气加成能得到异辛烷的是
A.2,2,4 -三甲基-1-戊烯 B.2,4,4 - 三甲基-1-戊烯
C.2,4,4 - 三甲基-2-戊炔 D.3,4,4 - 三甲基-1-戊炔
【答案】B
【典例4】(2021·北京理工大学附属中学分校高二期中)已知溴乙烷(CH3CH2Br)在NaOH的乙醇溶液中加热可得到乙烯,某同学利用如图装置验证从反应装置中逸出的气态物质中含有乙烯,下列有关说法中错误的是
A.可用③收集制取的乙烯 B.X是水、Y是酸性KMnO4溶液
C.当Y是溴水时可撤去① D.实验中要注意防火
【答案】A
【典例5】(2021·天津西青·高二期末)已知乙烯能被酸性高锰酸钾溶液氧化成CO2 。既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是
A.将混合气体与足量的氢气反应
B.通入足量溴水中
C.通入酸性高锰酸钾溶液中
D.通入水中
【答案】B
【典例6】(2021·黑龙江·勃利县高级中学高二阶段练习)某烯烃与氢气加成后得到的饱和烃如图所示,该烯烃可能的结构有
A.1种 B.2种 C.3种 D.4种
【答案】B
本课结束
第二节 烯烃 炔烃
第1课时 烯烃
2019人教版 选择性必修3 第二章 烃
【课程学习目标·学科核心素养】
以乙烯为典型物质认识烯烃的结构与性质。能书写相关的化学方程式,发展“宏观辨识与微观探析”学科核心素养。
认识氧化反应、加成反应、加聚反应等有机反应类型。
了解烯烃的立体异构和二烯烃的加成反应。
课堂导入
一.乙烯的结构特点
分子式 电子式 结构式 结构简式 空间构型
平面形分子
球棍模型
空间填充模型
乙烯是重要的化工原料,乙烯的产量可以用来衡量一个国家石油化学工业的发展水平。
在农业生产中作植物生长的调节剂和水果的催熟剂。
一.乙烯的结构特点
①共价键的形成:分子中的碳原子均采取sp2杂化,碳原子与氢原子形成
sp2-s σ键,两碳原子之间形成双键(1个sp2-sp2 σ键和1个p-p π键)。
②空间结构:乙烯分子中的所有原子都位于同一平面,相邻两个键之间的夹角约为120°。
二.乙烯的性质
物理性质
化学性质
纯净的乙烯为无色、稍有气味的气体,难溶于水,密度比空气略小。
氧化反应
加成反应
加聚反应
①可燃性
C2H4+3O2 2CO2+2H2O
点燃
②使酸性KMnO4溶液褪色,生成CO2
CH2=CH2+Br2 CH2BrCH2Br
CH2=CH2+HX
CH3CH2X
CH2=CH2+H2O
CH3CH2OH
CH2=CH2+H2
CH3CH3
乙烯的性质
nCH2=CH2 [ CH2—CH2 ]n
催化剂
三.乙烯的制备
1.原理:
乙醇和浓硫酸混合加热到170℃,每一个乙醇分子会脱去一个水分子而生成乙烯。
浓H2SO4
1700C
H C C H CH2=CH2 ↑ +H2O
H
H
H
OH
羟基和氢脱去结合成水
2.生成装置:液+液 → 气 收集装置:排水法收集
CH3CH2OH CH2=CH2↑ + H2O
浓H2SO4
170 ℃
三.乙烯的制备
3.注意事项
①V(浓H2SO4):V(C2H5OH)=3:1;浓H2SO4稍过量,提高乙醇利用率;
②烧瓶内加入 碎瓷片/沸石 防止暴沸;
③浓硫酸充当催化剂与脱水剂;
④温度计插入液面以下测混合液温度;
⑤应使温度迅速上升到170℃,当温度在140℃时发生副反应:
⑥烧瓶内溶液变黑:浓硫酸使乙醇脱水碳化,使乙烯中混有CO2,SO2等杂质,应通入碱石灰或10%NaOH溶液除杂。
四.烯烃
1.分子里含有一个碳碳双键的不饱和链烃叫(单)烯烃,其官能团是
(单)烯烃的通式是CnH2n
四.烯烃
2.烯烃的物理性质
烯烃物理性质的递变规律与烷烃的相似,沸点也随分子中碳原子数的递增而逐渐升高。烯烃的结构和性质与乙烯的相似,能发生加成反应和氧化反应。
(1)状态:
(2)熔沸点:
(3)密度:随C数目的增加而增大;但相对密度都小于1
(4)溶解性:
随C数目的增加,熔沸点升高
几乎不溶于水;但可溶于有机溶剂
气态→液态→固态。
标准状况下 C2—C4呈气态
碳原子数相同时,支链越多,熔沸点越低。
四.烯烃
3.烯烃的化学性质
(1)由于碳碳双键比碳碳单键更加活泼,较不稳定,更易发生反应,烯烃易氧化、加成(加聚)。
O2
nCO2+nH2O
CnH2n+
烯烃燃烧的通式
①燃烧反应
②被强氧化剂氧化
使酸性KMnO4溶液褪色
CH2=
CO2
KMnO4
H+
KMnO4
H+
C=O
R'
R''
C=
R'
R''
酮
R—CH=
R—COOH
KMnO4
H+
羧酸
CH2=CHCH3
KMnO4
H+
CO2
CH3COOH
CH2=C(CH3)2
KMnO4
H+
CO2
CH3COCH3
四.烯烃
3.烯烃的化学性质
(2)加成反应
①卤素单质或其溶液
卤代烃
CH2=CH2 + Br2
CH2Br—CH2Br
1,2-二溴乙烷
②氢气
烷烃
③卤化氢
卤代烃
④水
醇
CH3-CH=CH2 + H2 CH3-CH2-CH3
催化剂 △
马氏规则:氢上加氢
主要
四.烯烃
3.烯烃的化学性质
CH2=CHCH3 + HCl
Cl
CH3 CHCH3
催化剂
Cl
CH2 CH2CH3
主
次
CH2=CHCH3 + H2O
催化剂
加热、加压
OH
CH3 CHCH3
OH
CH2 CH2CH3
主
次
2-氯丙烷
马氏规则:
不对称烯烃和HX、H2O加成时,氢主要加在含氢多的双键碳原子上。
1-氯丙烷
2-丙醇
1-丙醇
四.烯烃
3.烯烃的化学性质
(3)加聚反应 有机物分子含有C=C、C≡C等不饱和化学键
CH2—CH2
n
PE 聚乙烯
nCH2=CH—CH3
CH2—CH
n
CH3
PP 聚丙烯
丙烯
通式:
nCH= CH
A
B
CH—CH
n
B
A
单体
链节
聚合度
【典例】完成下列加聚反应的化学方程式
①氯乙烯加聚反应:nCH2=CHCl
②丙烯加聚反应:nCH3CH=CH2
③苯乙烯加聚反应:
④ nCH3CH=CHCOOH
[CH—CH2 ]n
CH3
COOH
[CH CH2] n
[CH2—CH ]n
Cl
[CH—CH2 ]n
CH3
二者的结构一样吗?
通过碳碳双键 连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反异构现象。
(1)顺反异构现象
(2)顺反异构体
相同的原子或原子团位于双键同一侧的称为顺式结构,相同的原子或原子团位于双键两侧的称为反式结构,例如顺 -2- 丁烯和反- 2 -丁烯的结构简式分别是 和
四.烯烃
4.烯烃的顺反异构
(3)顺反异构的条件
碳碳双键的每个碳原子必须连接两个不同的原子或原子团。
有顺反异构的类型
无顺反异构的类型
(4)性质顺反异构体的化学性质基本相同,物理性质有一定的差异。
顺-2-丁烯
(3.7℃)
反-2-丁烯
( 0.88℃)
四.烯烃
CH3 CH=CH CH3
CH2
C
CH3
CH3
CH2
CH
CH3
CH2
C=
C
CH3
H
CH3
H
C=
C
CH3
H
CH3
H
【典例】写出符合分子式为C4H8的有机物的结构简式(包括顺反异构)
碳链异构:
位置异构:
顺反异构
官能团异构:
五.二烯烃
二烯烃是分子中含有两个碳碳双键的烯烃,通式CnH2n-2
如1,3-丁二烯:CH2=CH-CH=CH2(共轭二烯烃)
1.加成反应: 1,3-丁二烯与氯气发生加成反应时,
②1,4-加成
③完全加成 CH2==CH—CH==CH2+2Cl2→CH2Cl—CHCl—CHCl—CH2Cl
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底哪一种加成占优势,取决于反应条件。在温度较高的条件下大多发生1,4-加成,在温度较低的条件下大多发生1,2-加成。
①1,2-加成
2.加聚反应
n CH2=CH-CH=CH2
催化剂
、P
1 2 3 4
(1,3-丁二烯)
聚1,3-丁二烯
—CH2-CH=CH-CH2 —
[ ]n
俗称:异戊二烯 聚异戊二烯
学名:2-甲基-1,3-丁二烯 (天然橡胶)
nCH2=C-CH=CH2 [ CH2-C=CH-CH2]n
CH3
CH3
加聚
天然橡胶简介:
五.二烯烃
Diels—Alder成环反应
共轭二烯烃的特征反应
五.二烯烃
效果检测
【典例1】(2021·江苏·盐城市伍佑中学高二期中)乙烯是石油炼制的重要产物,下列关于乙烯的说法中错误的是
A.乙烯是一种植物生长调节剂
B.乙烯分子中的六个原子在同一平面上
C.可用于生产聚乙烯塑料
D.乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同
【答案】D
【典例2】(2021·贵州省思南中学高二期中)下列物质中,属于顺式结构的是
A. B.
C. D.
【答案】C
【典例3】(2021·安徽·蚌埠二中高二期中)2,2,4 - 三甲基戊烷俗称
异辛烷( ),常加入汽油中来减震,下列各烃与氢气加成能得到异辛烷的是
A.2,2,4 -三甲基-1-戊烯 B.2,4,4 - 三甲基-1-戊烯
C.2,4,4 - 三甲基-2-戊炔 D.3,4,4 - 三甲基-1-戊炔
【答案】B
【典例4】(2021·北京理工大学附属中学分校高二期中)已知溴乙烷(CH3CH2Br)在NaOH的乙醇溶液中加热可得到乙烯,某同学利用如图装置验证从反应装置中逸出的气态物质中含有乙烯,下列有关说法中错误的是
A.可用③收集制取的乙烯 B.X是水、Y是酸性KMnO4溶液
C.当Y是溴水时可撤去① D.实验中要注意防火
【答案】A
【典例5】(2021·天津西青·高二期末)已知乙烯能被酸性高锰酸钾溶液氧化成CO2 。既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是
A.将混合气体与足量的氢气反应
B.通入足量溴水中
C.通入酸性高锰酸钾溶液中
D.通入水中
【答案】B
【典例6】(2021·黑龙江·勃利县高级中学高二阶段练习)某烯烃与氢气加成后得到的饱和烃如图所示,该烯烃可能的结构有
A.1种 B.2种 C.3种 D.4种
【答案】B
本课结束
