6.1化学反应与能量变化(共33张PPT)(课件)高一化学人教版2019必修二
文档属性
| 名称 | 6.1化学反应与能量变化(共33张PPT)(课件)高一化学人教版2019必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-20 10:33:51 | ||
图片预览







文档简介
(共33张PPT)
化学反应与能量变化
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到学科研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。从煤、石油、天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
化石燃料燃烧会释放大量的热。除了燃烧,其他化学反应也伴随这放热或吸热现象。
化学反应与能量
1
I long to alleviate this evil, but I cannot, and I too suffer. This has been my life. I have found it worth living
化学反应与热能
实验6-1
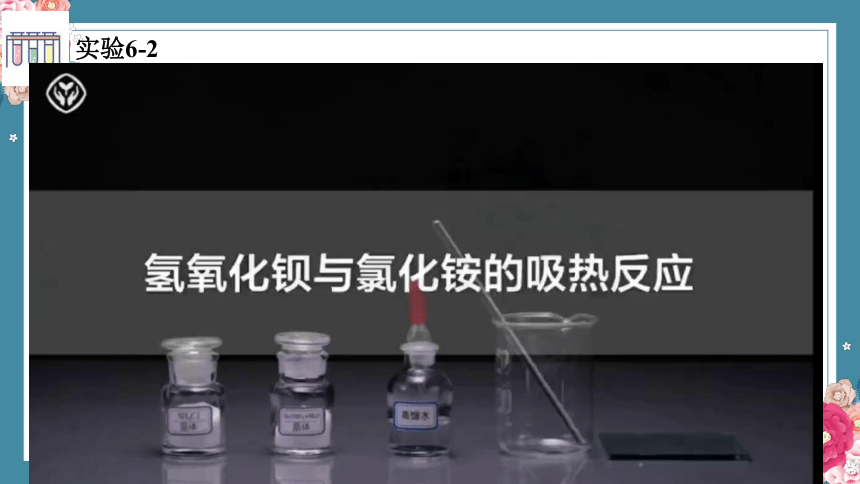
实验6-2
一、放热反应与吸热反应
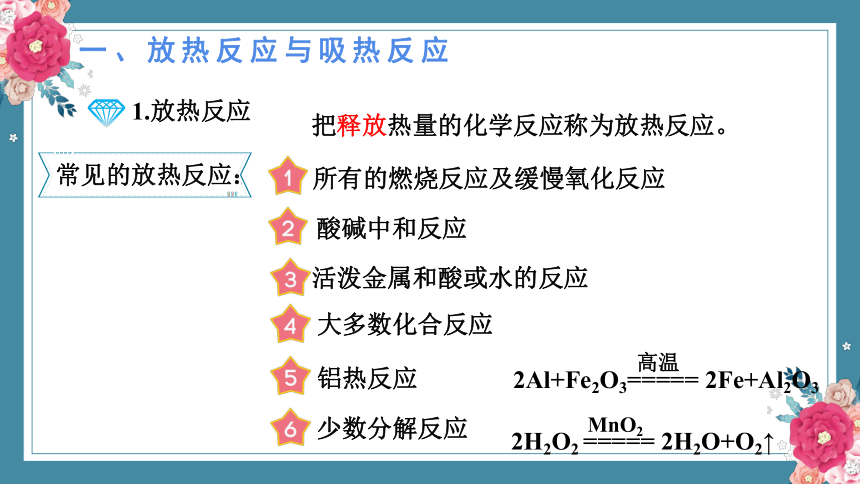
1.放热反应
把释放热量的化学反应称为放热反应。
常见的放热反应:
所有的燃烧反应及缓慢氧化反应
酸碱中和反应
活泼金属和酸或水的反应
大多数化合反应
铝热反应
少数分解反应
2H2O2 ===== 2H2O+O2↑
MnO2
2Al+Fe2O3===== 2Fe+Al2O3
高温
一、放热反应与吸热反应
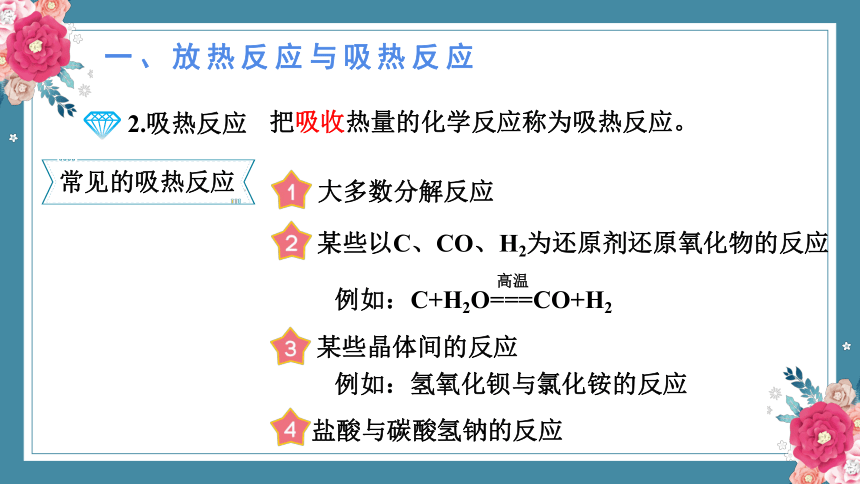
2.吸热反应
把吸收热量的化学反应称为吸热反应。
例如:C+H2O===CO+H2
高温
常见的吸热反应
大多数分解反应
某些以C、CO、H2为还原剂还原氧化物的反应
某些晶体间的反应
例如:氢氧化钡与氯化铵的反应
盐酸与碳酸氢钠的反应
二、化学键与化学反应中能量变化的关系
化学反应的实质
旧键断裂
新键形成
吸收能量
放出能量
断键吸收能量E1>成键释放能量E2 该反应为吸热反应
断键吸收能量E1<成键释放能量E2 该反应为放热反应
化学键的断裂和形成是化学反应中能量变化的主要原因。
化学反应中的物质变化总会伴随着能量变化,
通常主要表现为热量的释放或吸收
1.化学反应的能量变化的本质
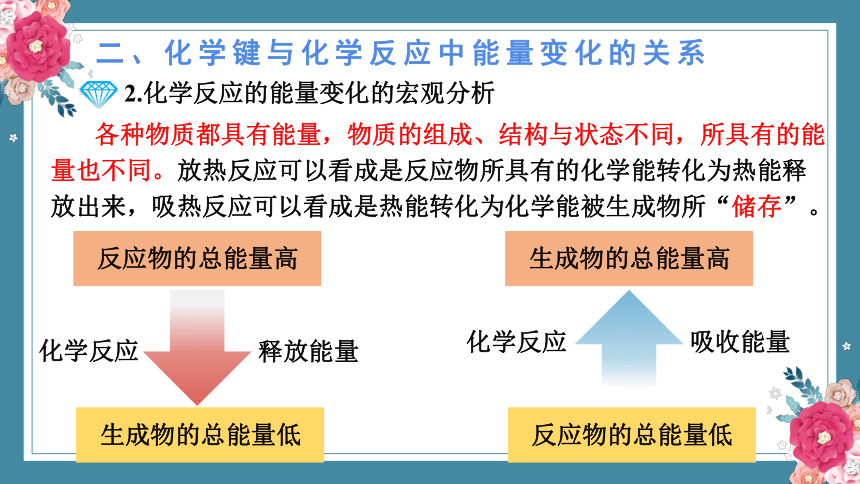
2.化学反应的能量变化的宏观分析
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
反应物的总能量高
化学反应
释放能量
生成物的总能量低
生成物的总能量高
化学反应
吸收能量
反应物的总能量低
二、化学键与化学反应中能量变化的关系
二、化学键与化学反应中能量变化的关系
能量
反应物
生成物
反应过程
2.化学反应的能量变化的宏观分析
反应物的总能量 > 生成物的总能量
放热反应
能量
反应物
生成物
反应过程
反应物的总能量 < 生成物的总能量
吸热反应
三、能量转化与能量利用
1.人类获取热能的主要途径
通过物质的燃烧
煤
石油
天然气
主要形式
三、能量转化与能量利用
2.利用化石燃料亟待解决的问题
一是其短期内不可再生,储量有限,随着能源消费需求的不断增加,能源消费量与储量之间的矛盾日益突显
二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源
三、能量转化与能量利用
3.解决方法
燃料燃烧阶段
可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率
能量利用阶段
可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
节能
4.新能源
具有资源丰富、可以再生、对环境无污染等特点
太阳能
风能
地热能
海洋能
氢能等
三、能量转化与能量利用
2
I long to alleviate this evil, but I cannot, and I too suffer. This has been my life. I have found it worth living
化学反应与电能
我们日常使用的电能主要来自火力发电。火力发电是通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。火力发电过程中,化学能经过一系列能量转化过程,间接转化为电能。其中,燃烧(氧化还原反应)是关键。
火力发电
直接?
化学能
燃料燃烧
热能
蒸汽轮机
机械能
发电机
电能
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的利用率低
实验6-3
z内容内容内容
实验6-3
实验装置 实验现象 实验结论
锌片:逐渐溶解,
表面有气泡产生
铜片:没有变化
锌与稀硫酸反应生成氢气,铜与稀硫酸不反应。
锌片:逐渐溶解
铜片:表面有气泡产生
电流表:指针发生偏转
Zn
稀H2SO4
Cu
A
Zn
稀H2SO4
Cu
锌与稀硫酸发生反应,
但铜片上有氢气生成,
发生反应的同时产生电流。
一、原电池
1.定义
把化学能转化成电能的装置,称为原电池
+
-
负极:
电子流入(或电流流出)的一极
正极:
电子流出(或电流流入)的一极
2.电极
一、原电池
3.电极反应
负极
正极
电极名称:
电极反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
电极反应类型:
氧化反应
还原反应
原电池总反应式: ;
Zn+2H+===Zn2++H2↑
一、原电池
4.粒子移动方向
外电路:
内电路:
阳离子 → 正极
阴离子 → 负极
负极 → 正极
正极→ 负极
电子e-:
电流I:
负极
正极
“电子不下水,离子不上岸”
5.构成原电池的条件
①具有两个能导电的电极
稀硫酸
Zn Zn
一般为两种活动性不同的金属
稀硫酸
Zn Cu
较活泼的金属做负极
较不活泼的金属做负极
或金属与能导电的非金属(石墨等)
5.构成原电池的条件
②具有电解质溶液或熔融电解质
稀硫酸
Zn Cu
酒精
Zn Cu
5.构成原电池的条件
③电极间形成闭合回路
稀硫酸
Zn Cu
Zn Cu
稀硫酸
稀硫酸
Zn Cu
用导线连接两极与电解质溶液共同形成闭合回路
也可以让两个电极直接接触
5.构成原电池的条件
④能自发进行氧化还原反应
一般负极与电解质溶液发生氧化还原反应
即原电池的总反应
稀硫酸
Ag Cu
硫酸铜
Ag Cu
5.构成原电池的条件
①具有两个能导电的电极
②具有电解质溶液或熔融电解质
④能自发进行氧化还原反应
一般为两种活动性不同的金属或金属与能导电的非金属(石墨等)
③电极间形成闭合回路
用导线连接两极与电解质溶液共同形成闭合回路,
也可以让两个电极直接接触
一般负极与电解质溶液发生氧化还原反应
即原电池的总反应
二、化学电源
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
二、化学电源
正极
负极
电解质溶液
e-
这种电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
+
-
逐渐消耗
不断被还原
电池电压逐渐降低,最后失效
锌锰干电池构造原理
1.一次电池
二、化学电源
充电电池又称二次电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态。
2.二次电池
汽车用铅酸蓄电池
镍氢电池
二、化学电源
3.燃料电池
fuel cell
将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,
具有清洁、安全、高效等特点。
燃料电池的能量转化率可以达到80%以上。
原理
优点
与其他电池的区别
反应物不储存在电池内部,由外设设备提供燃料和氧化剂。
使用燃料电池的汽车
谢谢
观看
第六章第一节
化学反应与能量变化
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到学科研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。从煤、石油、天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
化石燃料燃烧会释放大量的热。除了燃烧,其他化学反应也伴随这放热或吸热现象。
化学反应与能量
1
I long to alleviate this evil, but I cannot, and I too suffer. This has been my life. I have found it worth living
化学反应与热能
实验6-1
实验6-2
一、放热反应与吸热反应
1.放热反应
把释放热量的化学反应称为放热反应。
常见的放热反应:
所有的燃烧反应及缓慢氧化反应
酸碱中和反应
活泼金属和酸或水的反应
大多数化合反应
铝热反应
少数分解反应
2H2O2 ===== 2H2O+O2↑
MnO2
2Al+Fe2O3===== 2Fe+Al2O3
高温
一、放热反应与吸热反应
2.吸热反应
把吸收热量的化学反应称为吸热反应。
例如:C+H2O===CO+H2
高温
常见的吸热反应
大多数分解反应
某些以C、CO、H2为还原剂还原氧化物的反应
某些晶体间的反应
例如:氢氧化钡与氯化铵的反应
盐酸与碳酸氢钠的反应
二、化学键与化学反应中能量变化的关系
化学反应的实质
旧键断裂
新键形成
吸收能量
放出能量
断键吸收能量E1>成键释放能量E2 该反应为吸热反应
断键吸收能量E1<成键释放能量E2 该反应为放热反应
化学键的断裂和形成是化学反应中能量变化的主要原因。
化学反应中的物质变化总会伴随着能量变化,
通常主要表现为热量的释放或吸收
1.化学反应的能量变化的本质
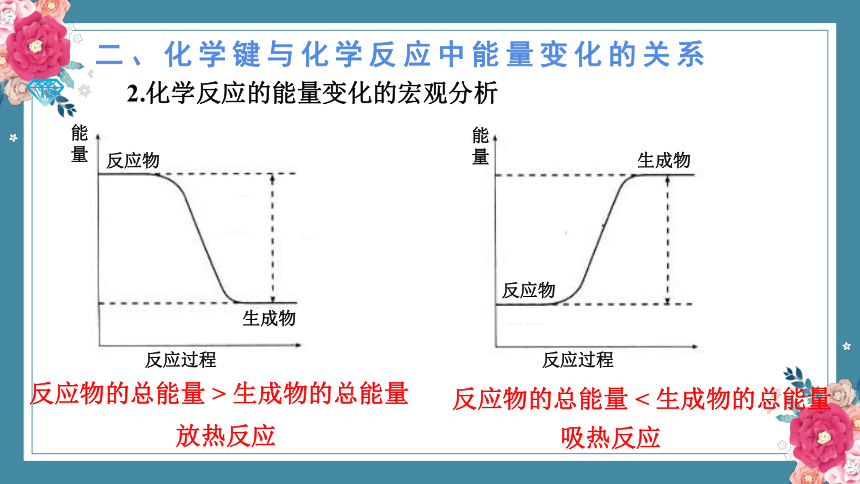
2.化学反应的能量变化的宏观分析
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
反应物的总能量高
化学反应
释放能量
生成物的总能量低
生成物的总能量高
化学反应
吸收能量
反应物的总能量低
二、化学键与化学反应中能量变化的关系
二、化学键与化学反应中能量变化的关系
能量
反应物
生成物
反应过程
2.化学反应的能量变化的宏观分析
反应物的总能量 > 生成物的总能量
放热反应
能量
反应物
生成物
反应过程
反应物的总能量 < 生成物的总能量
吸热反应
三、能量转化与能量利用
1.人类获取热能的主要途径
通过物质的燃烧
煤
石油
天然气
主要形式
三、能量转化与能量利用
2.利用化石燃料亟待解决的问题
一是其短期内不可再生,储量有限,随着能源消费需求的不断增加,能源消费量与储量之间的矛盾日益突显
二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源
三、能量转化与能量利用
3.解决方法
燃料燃烧阶段
可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率
能量利用阶段
可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
节能
4.新能源
具有资源丰富、可以再生、对环境无污染等特点
太阳能
风能
地热能
海洋能
氢能等
三、能量转化与能量利用
2
I long to alleviate this evil, but I cannot, and I too suffer. This has been my life. I have found it worth living
化学反应与电能
我们日常使用的电能主要来自火力发电。火力发电是通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。火力发电过程中,化学能经过一系列能量转化过程,间接转化为电能。其中,燃烧(氧化还原反应)是关键。
火力发电
直接?
化学能
燃料燃烧
热能
蒸汽轮机
机械能
发电机
电能
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的利用率低
实验6-3
z内容内容内容
实验6-3
实验装置 实验现象 实验结论
锌片:逐渐溶解,
表面有气泡产生
铜片:没有变化
锌与稀硫酸反应生成氢气,铜与稀硫酸不反应。
锌片:逐渐溶解
铜片:表面有气泡产生
电流表:指针发生偏转
Zn
稀H2SO4
Cu
A
Zn
稀H2SO4
Cu
锌与稀硫酸发生反应,
但铜片上有氢气生成,
发生反应的同时产生电流。
一、原电池
1.定义
把化学能转化成电能的装置,称为原电池
+
-
负极:
电子流入(或电流流出)的一极
正极:
电子流出(或电流流入)的一极
2.电极
一、原电池
3.电极反应
负极
正极
电极名称:
电极反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
电极反应类型:
氧化反应
还原反应
原电池总反应式: ;
Zn+2H+===Zn2++H2↑
一、原电池
4.粒子移动方向
外电路:
内电路:
阳离子 → 正极
阴离子 → 负极
负极 → 正极
正极→ 负极
电子e-:
电流I:
负极
正极
“电子不下水,离子不上岸”
5.构成原电池的条件
①具有两个能导电的电极
稀硫酸
Zn Zn
一般为两种活动性不同的金属
稀硫酸
Zn Cu
较活泼的金属做负极
较不活泼的金属做负极
或金属与能导电的非金属(石墨等)
5.构成原电池的条件
②具有电解质溶液或熔融电解质
稀硫酸
Zn Cu
酒精
Zn Cu
5.构成原电池的条件
③电极间形成闭合回路
稀硫酸
Zn Cu
Zn Cu
稀硫酸
稀硫酸
Zn Cu
用导线连接两极与电解质溶液共同形成闭合回路
也可以让两个电极直接接触
5.构成原电池的条件
④能自发进行氧化还原反应
一般负极与电解质溶液发生氧化还原反应
即原电池的总反应
稀硫酸
Ag Cu
硫酸铜
Ag Cu
5.构成原电池的条件
①具有两个能导电的电极
②具有电解质溶液或熔融电解质
④能自发进行氧化还原反应
一般为两种活动性不同的金属或金属与能导电的非金属(石墨等)
③电极间形成闭合回路
用导线连接两极与电解质溶液共同形成闭合回路,
也可以让两个电极直接接触
一般负极与电解质溶液发生氧化还原反应
即原电池的总反应
二、化学电源
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
二、化学电源
正极
负极
电解质溶液
e-
这种电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
+
-
逐渐消耗
不断被还原
电池电压逐渐降低,最后失效
锌锰干电池构造原理
1.一次电池
二、化学电源
充电电池又称二次电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态。
2.二次电池
汽车用铅酸蓄电池
镍氢电池
二、化学电源
3.燃料电池
fuel cell
将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,
具有清洁、安全、高效等特点。
燃料电池的能量转化率可以达到80%以上。
原理
优点
与其他电池的区别
反应物不储存在电池内部,由外设设备提供燃料和氧化剂。
使用燃料电池的汽车
谢谢
观看
第六章第一节
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
