专题4第一单元 第一课时 醇的结构和性质 课件(共27张PPT) 苏教版(2019)高二化学选择性必修3
文档属性
| 名称 | 专题4第一单元 第一课时 醇的结构和性质 课件(共27张PPT) 苏教版(2019)高二化学选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-22 08:54:19 | ||
图片预览






文档简介
(共27张PPT)
第1课时 醇的结构和性质
专题4 生活中常用的有机物
--烃的含氧衍生物
第一单元 醇和酚
核心素养目标
1.能描述乙醇的物理性质。
2.能从官能团角度区别醇,酚的结构。
3.能通过实验探究获得乙醇的化学性质。
4.能正确区别消去反应和催化氧化机理。
新课导入
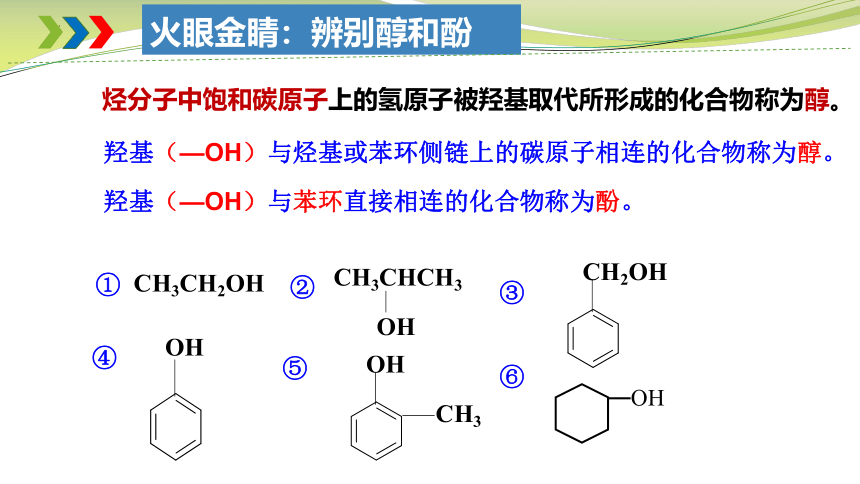
火眼金睛:辨别醇和酚
烃分子中饱和碳原子上的氢原子被羟基取代所形成的化合物称为醇。
OH
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
CH3
①
②
③
④
⑤
羟基(—OH)与苯环直接相连的化合物称为酚。
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
OH
⑥
C—C—O—H
H
H
H
H
H
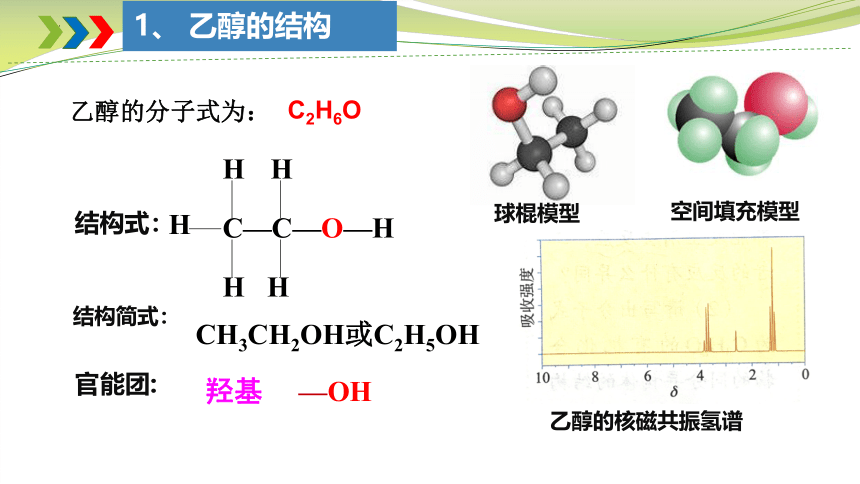
结构式:
CH3CH2OH或C2H5OH
结构简式:
空间填充模型
球棍模型
乙醇的分子式为:
羟基 —OH
官能团:
C2H6O
1、 乙醇的结构
乙醇的核磁共振氢谱
2、乙醇的物理性质
颜 色:
状 态:
气 味:
挥发性:
密 度:
溶解性:
易挥发
液体
有特殊香味
比水小
与水以任意比例互溶
无色透明
为什么乙醇能与水以任意比互溶
交流与思考:
如何检验酒精是否含水?
如何除去酒精中含有的水?
医用酒精 75%(体积分数)
无水酒精 99.5%以上(质量分数)
乙醇与水分子之间也可以形成氢键。
用无水硫酸铜检验 白色变蓝色.
加入新制生石灰后蒸馏
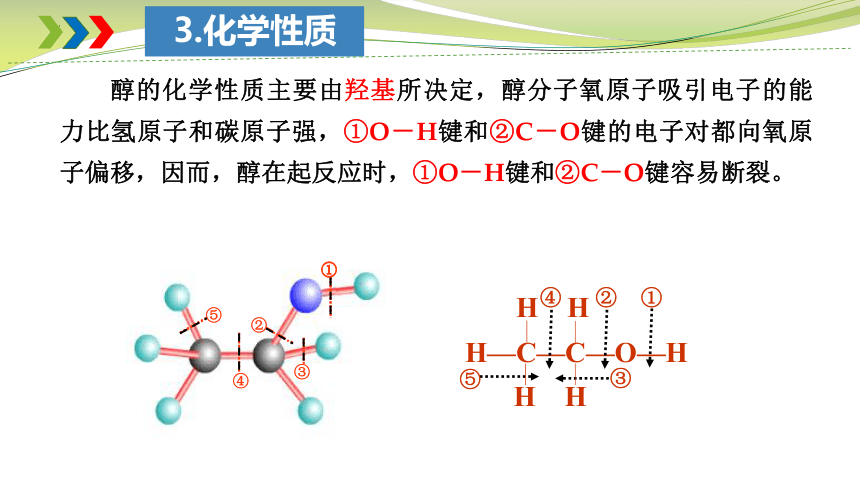
3.化学性质
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O-H键和②C-O键的电子对都向氧原子偏移,因而,醇在起反应时,①O-H键和②C-O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
3.化学性质
思考:
Na保存在煤油中,
不与煤油反应(烃类)
Na不与乙醚反应
Na与乙醇反应断什么键?
【结论】
乙醇羟基上的氢原子比水中氢原子不活泼。
每2mol 羟基与足量的Na反应生成1mol H2
乙醇钠
断①号键
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
置换反应
④
⑤
②
③
①
①
其它活泼金属如钾、钙等也可与乙醇反应产生H2。
醚不能跟钠反应。
②置换反应
②氧化反应
乙醇能够被氧化剂氧化--
a.燃烧(淡蓝色火焰):
2CO2 +3H2O
C2H5OH +3 O2
点燃
b.与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为绿色检验酒驾
酸性高锰酸钾紫色褪去
乙醇有还原性
【视野拓展1】酒精检测仪
酸性K2Cr2O7溶液
橙色
Cr3+
绿色
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4 2K2SO4 + 2Cr2(SO4)3 + 3CH3COOH + 11H2O
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛(无色刺激性气味)
乙 醇
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
c.催化氧化
②氧化反应
黑色变为红色
④
⑤
②
③
①
①
c.催化氧化
断①③号键
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:相邻碳必须有氢
练习:下列各种醇可发生催化氧化的是( )
被氧化成相应醛的是 ( )
A.CH3OH B.HOCH2CH2CH3
C.CH3CH2CHCH3 D.CH3C OH
CH3
-
-
CH3
-
OH
-
醇的结构和性质
催化氧化类型小结 :
叔醇(—OH在叔碳——碳原子上没有H),则不能去氢氧化。
C OH
R2
R1
R3
(3).
(2). 2 CH—OH + O2
R2
R1
Cu
△
(1). 2R—CH2—OH + O2
Cu
△
伯醇(—OH在伯碳——首位碳上),去氢氧化为醛
O
=
2R—C—H + 2H2O
仲醇(—OH在仲碳——中间碳上),去氢氧化为酮
O
=
2R1—C—R2 + 2H2O
醇的催化氧化也可以用银作催化剂。
结合乙醇分子中化学键的极性,推测乙醇还可能具有哪些化学性质。
H—C—C—O—H
H
H
H
H
④
①
②
③
观察实验现象:
方程式:
【预测性质】
H—C—C—O—H
H
H
H
H
④
①
②
③
现象:①烧瓶内液体变成黑色。
②有气体产生,酸性KMnO4溶液和溴的四氯化碳溶液褪色。
消去反应
CH3CH2OH CH2=CH2↑ +H2O
浓硫酸
170℃
浓硫酸将部分乙醇炭化,反应液变黑。
思考:烧瓶内液体为什么变成黑色?
④温度计水银球应置于什么位置?
①混合乙醇和浓硫酸时应注意什么?
③混合液中应放入几片碎瓷片,为什么?
先加入酒精,再加入浓硫酸,
乙醇与浓硫酸体积比1:3
置于反应混合液中。
防止暴沸。
②浓硫酸的作用是什么?
催化剂和脱水剂。
【思考1】
消去反应
思考3:氢氧化钠溶液的作用是什么?
思考2:加热时为什么要使温度迅速升高至1700C?
吸收乙醇和 SO2 防止干扰实验。
减少副产物乙醚的生成
消去反应
思考4:酸性KMnO4溶液的作用是什么?
消去反应:
机理:邻位碳上有氢
证明有乙烯生成
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
下列各种醇可发生消去反应的是: 生成两种烯烃:
A.CH3OH B.HOCH2CH2CH3
C.CH3CH2CHCH3 D.CH3C OH F
CH3
-
-
CH3
-
OH
-
当堂练习
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
④
⑤
②
③
①
①
实验现象:
Ⅱ中产生油状液体,溶液分层。
CH3CH2Br
C2H5 OH + H Br C2H5Br + H2O
△
断②号键
注意:醇还可以与其他氢卤酸反应。
醇分子中的羟基被卤素原子取代生成卤代烃
R—OH+HX―→R—X+H2O
取代反应
取代反应
思考:为什么实验中使用蒸馏水稀释98%硫酸, 不能直接使用浓硫酸?
98%的浓硫酸具有强氧化性,而HBr具有还原性,会发生副反应生成溴单质,而且还能使乙醇脱水。
思考:长导管、试管Ⅱ和烧杯中的水
起到了什么作用?
冷凝作用,试管Ⅱ中的水还可以除去乙醇和HBr 。
卤化钠、浓硫酸的作用是制备卤化氢
课堂小结
分析结构
性质
断键部位
反应类型
反应产物
反应试剂 条件
置换反应
乙醇钠
氧化反应
乙醛、酮
取代反应
卤代烃
消去反应
烯烃
取代反应
醚
H—C—C—O—H
H
H
H
H
④
①
②
③
燃烧
酯化反应
8.关于乙醇的说法中正确的是( )
A.乙醇结构中有﹣OH,所以乙醇溶解于水,可以电离出OH﹣而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼9.乙醇可以发生下列反应,在反应里乙醇分子断裂H—O键的是( )
①乙醇与浓氢溴酸加热发生取代反应 ②乙醇与乙酸的酯化反应③乙醇在浓硫酸存在下发生消去反应 ④乙醇与金属钠的反应A.①② B.③④ C.①③ D.②④
当堂练习
D
D
10.乙醇可以发生下列反应,在反应里乙醇分子断裂C—O键而失去羟基的是( )
①乙醇在浓硫酸存在下发生消去反应 ②乙醇的催化氧化
③乙醇与浓氢溴酸加热发生取代反应 ④乙醇与乙酸的酯化反应A.①② B.③④ C.①③ D.②④
当堂练习
C
谢谢
第1课时 醇的结构和性质
专题4 生活中常用的有机物
--烃的含氧衍生物
第一单元 醇和酚
核心素养目标
1.能描述乙醇的物理性质。
2.能从官能团角度区别醇,酚的结构。
3.能通过实验探究获得乙醇的化学性质。
4.能正确区别消去反应和催化氧化机理。
新课导入
火眼金睛:辨别醇和酚
烃分子中饱和碳原子上的氢原子被羟基取代所形成的化合物称为醇。
OH
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
CH3
①
②
③
④
⑤
羟基(—OH)与苯环直接相连的化合物称为酚。
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
OH
⑥
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH或C2H5OH
结构简式:
空间填充模型
球棍模型
乙醇的分子式为:
羟基 —OH
官能团:
C2H6O
1、 乙醇的结构
乙醇的核磁共振氢谱
2、乙醇的物理性质
颜 色:
状 态:
气 味:
挥发性:
密 度:
溶解性:
易挥发
液体
有特殊香味
比水小
与水以任意比例互溶
无色透明
为什么乙醇能与水以任意比互溶
交流与思考:
如何检验酒精是否含水?
如何除去酒精中含有的水?
医用酒精 75%(体积分数)
无水酒精 99.5%以上(质量分数)
乙醇与水分子之间也可以形成氢键。
用无水硫酸铜检验 白色变蓝色.
加入新制生石灰后蒸馏
3.化学性质
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O-H键和②C-O键的电子对都向氧原子偏移,因而,醇在起反应时,①O-H键和②C-O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
3.化学性质
思考:
Na保存在煤油中,
不与煤油反应(烃类)
Na不与乙醚反应
Na与乙醇反应断什么键?
【结论】
乙醇羟基上的氢原子比水中氢原子不活泼。
每2mol 羟基与足量的Na反应生成1mol H2
乙醇钠
断①号键
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
置换反应
④
⑤
②
③
①
①
其它活泼金属如钾、钙等也可与乙醇反应产生H2。
醚不能跟钠反应。
②置换反应
②氧化反应
乙醇能够被氧化剂氧化--
a.燃烧(淡蓝色火焰):
2CO2 +3H2O
C2H5OH +3 O2
点燃
b.与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为绿色检验酒驾
酸性高锰酸钾紫色褪去
乙醇有还原性
【视野拓展1】酒精检测仪
酸性K2Cr2O7溶液
橙色
Cr3+
绿色
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4 2K2SO4 + 2Cr2(SO4)3 + 3CH3COOH + 11H2O
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛(无色刺激性气味)
乙 醇
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
c.催化氧化
②氧化反应
黑色变为红色
④
⑤
②
③
①
①
c.催化氧化
断①③号键
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:相邻碳必须有氢
练习:下列各种醇可发生催化氧化的是( )
被氧化成相应醛的是 ( )
A.CH3OH B.HOCH2CH2CH3
C.CH3CH2CHCH3 D.CH3C OH
CH3
-
-
CH3
-
OH
-
醇的结构和性质
催化氧化类型小结 :
叔醇(—OH在叔碳——碳原子上没有H),则不能去氢氧化。
C OH
R2
R1
R3
(3).
(2). 2 CH—OH + O2
R2
R1
Cu
△
(1). 2R—CH2—OH + O2
Cu
△
伯醇(—OH在伯碳——首位碳上),去氢氧化为醛
O
=
2R—C—H + 2H2O
仲醇(—OH在仲碳——中间碳上),去氢氧化为酮
O
=
2R1—C—R2 + 2H2O
醇的催化氧化也可以用银作催化剂。
结合乙醇分子中化学键的极性,推测乙醇还可能具有哪些化学性质。
H—C—C—O—H
H
H
H
H
④
①
②
③
观察实验现象:
方程式:
【预测性质】
H—C—C—O—H
H
H
H
H
④
①
②
③
现象:①烧瓶内液体变成黑色。
②有气体产生,酸性KMnO4溶液和溴的四氯化碳溶液褪色。
消去反应
CH3CH2OH CH2=CH2↑ +H2O
浓硫酸
170℃
浓硫酸将部分乙醇炭化,反应液变黑。
思考:烧瓶内液体为什么变成黑色?
④温度计水银球应置于什么位置?
①混合乙醇和浓硫酸时应注意什么?
③混合液中应放入几片碎瓷片,为什么?
先加入酒精,再加入浓硫酸,
乙醇与浓硫酸体积比1:3
置于反应混合液中。
防止暴沸。
②浓硫酸的作用是什么?
催化剂和脱水剂。
【思考1】
消去反应
思考3:氢氧化钠溶液的作用是什么?
思考2:加热时为什么要使温度迅速升高至1700C?
吸收乙醇和 SO2 防止干扰实验。
减少副产物乙醚的生成
消去反应
思考4:酸性KMnO4溶液的作用是什么?
消去反应:
机理:邻位碳上有氢
证明有乙烯生成
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
下列各种醇可发生消去反应的是: 生成两种烯烃:
A.CH3OH B.HOCH2CH2CH3
C.CH3CH2CHCH3 D.CH3C OH F
CH3
-
-
CH3
-
OH
-
当堂练习
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
④
⑤
②
③
①
①
实验现象:
Ⅱ中产生油状液体,溶液分层。
CH3CH2Br
C2H5 OH + H Br C2H5Br + H2O
△
断②号键
注意:醇还可以与其他氢卤酸反应。
醇分子中的羟基被卤素原子取代生成卤代烃
R—OH+HX―→R—X+H2O
取代反应
取代反应
思考:为什么实验中使用蒸馏水稀释98%硫酸, 不能直接使用浓硫酸?
98%的浓硫酸具有强氧化性,而HBr具有还原性,会发生副反应生成溴单质,而且还能使乙醇脱水。
思考:长导管、试管Ⅱ和烧杯中的水
起到了什么作用?
冷凝作用,试管Ⅱ中的水还可以除去乙醇和HBr 。
卤化钠、浓硫酸的作用是制备卤化氢
课堂小结
分析结构
性质
断键部位
反应类型
反应产物
反应试剂 条件
置换反应
乙醇钠
氧化反应
乙醛、酮
取代反应
卤代烃
消去反应
烯烃
取代反应
醚
H—C—C—O—H
H
H
H
H
④
①
②
③
燃烧
酯化反应
8.关于乙醇的说法中正确的是( )
A.乙醇结构中有﹣OH,所以乙醇溶解于水,可以电离出OH﹣而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼9.乙醇可以发生下列反应,在反应里乙醇分子断裂H—O键的是( )
①乙醇与浓氢溴酸加热发生取代反应 ②乙醇与乙酸的酯化反应③乙醇在浓硫酸存在下发生消去反应 ④乙醇与金属钠的反应A.①② B.③④ C.①③ D.②④
当堂练习
D
D
10.乙醇可以发生下列反应,在反应里乙醇分子断裂C—O键而失去羟基的是( )
①乙醇在浓硫酸存在下发生消去反应 ②乙醇的催化氧化
③乙醇与浓氢溴酸加热发生取代反应 ④乙醇与乙酸的酯化反应A.①② B.③④ C.①③ D.②④
当堂练习
C
谢谢
