贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题(含答案)
文档属性
| 名称 | 贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题(含答案) |  | |
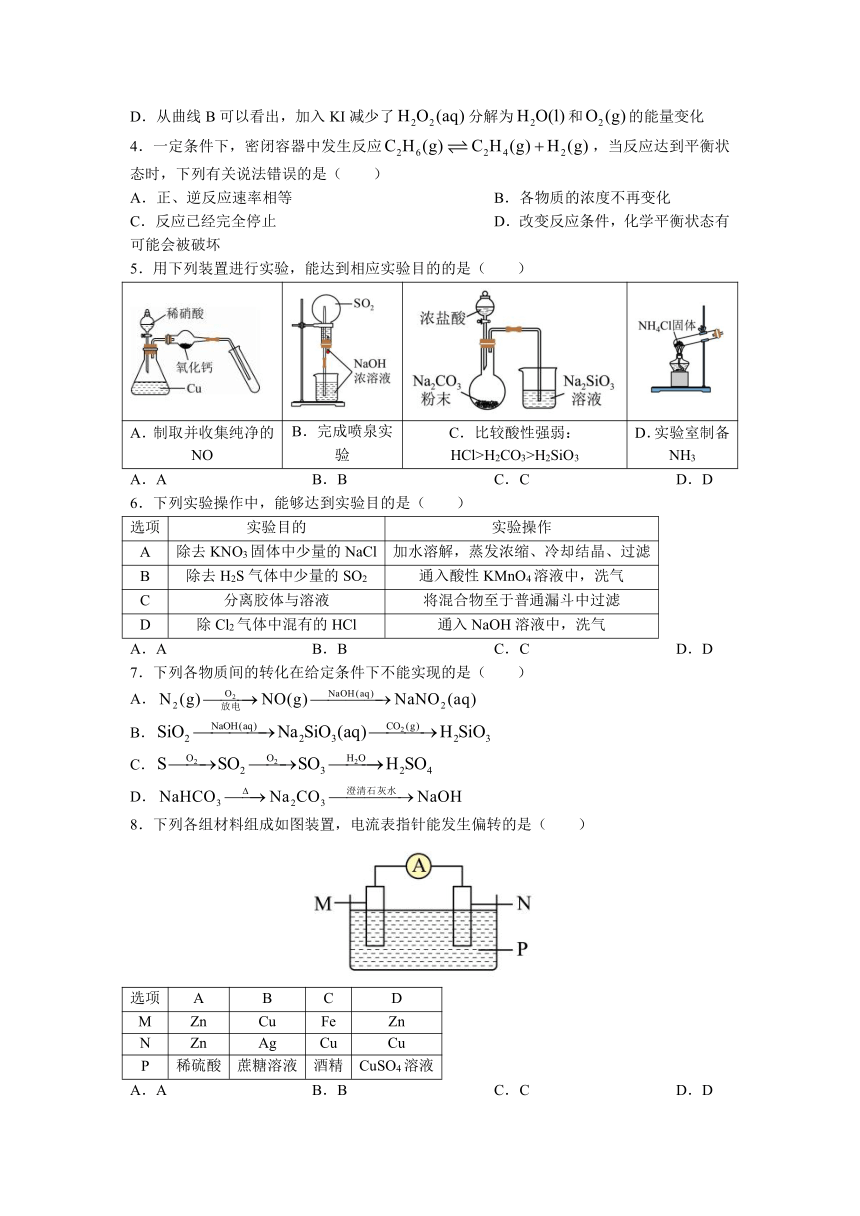
| 格式 | doc | ||
| 文件大小 | 538.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-22 10:12:20 | ||
图片预览


文档简介
仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试
化学试题
可能用到的相对原子质量H 1 C 12 N 14 O 16 S 32 Cl 35.5 Cu 64
一、选择题(该部分有14小题,每小题3分,共42分,每小题只有一个选项符合题意)。
1.下列说法正确的是( )
A.氨氧化法制硝酸使用的铂-钯-铑合金催化剂可提高转化率
B.火力发电是先将化学能转化为热能,热能再转化为电能
C.化石燃料燃烧排放的粉尘、SO2、NOx、CO2是大气污染物
D.合成氨常选择400~500℃是为了提高反应速率降低生产成本
2.碳酸镧可用于治疗高磷酸盐血症,其制备的化学方程式为。下列表示相关微粒的化学用语正确的是( )
A.镧为第ⅦA族元素 B.中子数为8的碳原子:
C.NH4Cl的电子式: D.的结构示意图:
3.已知分解为和的能量变化如图曲线A所示,若在H2O2溶液中加入少量KI,则H2O2的分解过程可表示为:①,②,其能量变化如图曲线B所示。下列有关说法不正确的是( )
A.上述反应①为吸热反应,反应②为放热反应
B.具有的能量大于和具有的总能量
C.在H2O2分解过程中起到催化剂作用
D.从曲线B可以看出,加入KI减少了分解为和的能量变化
4.一定条件下,密闭容器中发生反应,当反应达到平衡状态时,下列有关说法错误的是( )
A.正、逆反应速率相等 B.各物质的浓度不再变化
C.反应已经完全停止 D.改变反应条件,化学平衡状态有可能会被破坏
5.用下列装置进行实验,能达到相应实验目的的是( )
A.制取并收集纯净的NO B.完成喷泉实验 C.比较酸性强弱:HCl>H2CO3>H2SiO3 D.实验室制备NH3
A.A B.B C.C D.D
6.下列实验操作中,能够达到实验目的是( )
选项 实验目的 实验操作
A 除去KNO3固体中少量的NaCl 加水溶解,蒸发浓缩、冷却结晶、过滤
B 除去H2S气体中少量的SO2 通入酸性KMnO4溶液中,洗气
C 分离胶体与溶液 将混合物至于普通漏斗中过滤
D 除Cl2气体中混有的HCl 通入NaOH溶液中,洗气
A.A B.B C.C D.D
7.下列各物质间的转化在给定条件下不能实现的是( )
A.
B.
C.
D.
8.下列各组材料组成如图装置,电流表指针能发生偏转的是( )
选项 A B C D
M Zn Cu Fe Zn
N Zn Ag Cu Cu
P 稀硫酸 蔗糖溶液 酒精 CuSO4溶液
A.A B.B C.C D.D
9.下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:WC.气态氢化物稳定性:Z10.氨法脱硫的原理是,设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.44.8LSO2含有的分子数为2NA B.1.7gNH3含有的中子数目为NA
C.H2O的摩尔质量为18g D.99gNH4HSO3固体含有的离子数为2NA
11.某学习小组为了探究影响高锰酸钾酸性溶液与NaHSO3溶液反应速率的因素,该小组设计如表实验方案。
实验 褪色时间t/min
l 3.0 2.0 1.0 0.0 2.0 8
2 3.0 2.0 2.0 0.0 a 6
3 4.0 2.0 2.0 0.0 0.0 4
4 4.0 2.0 1.0 0.5 b 3
下列说法正确的是( )
A.该反应的离子方程式为:
B.a=1.0,b=0.5
C.实验3从反应开始到反应结束这段时间内反应速率
D.实验证明可能是该反应的催化剂
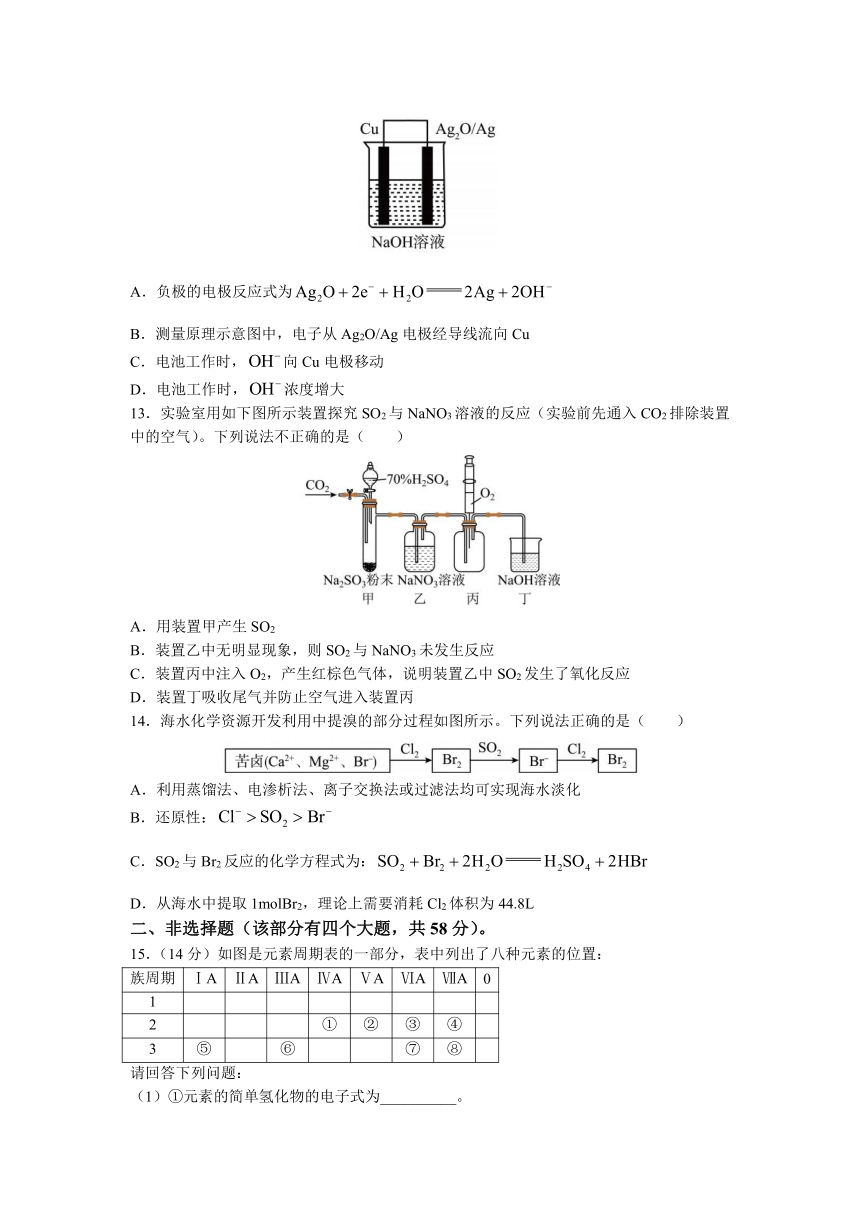
12.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为。下列有关说法正确的是( )
A.负极的电极反应式为
B.测量原理示意图中,电子从Ag2O/Ag电极经导线流向Cu
C.电池工作时,向Cu电极移动
D.电池工作时,浓度增大
13.实验室用如下图所示装置探究SO2与NaNO3溶液的反应(实验前先通入CO2排除装置中的空气)。下列说法不正确的是( )
A.用装置甲产生SO2
B.装置乙中无明显现象,则SO2与NaNO3未发生反应
C.装置丙中注入O2,产生红棕色气体,说明装置乙中SO2发生了氧化反应
D.装置丁吸收尾气并防止空气进入装置丙
14.海水化学资源开发利用中提溴的部分过程如图所示。下列说法正确的是( )
A.利用蒸馏法、电渗析法、离子交换法或过滤法均可实现海水淡化
B.还原性:
C.SO2与Br2反应的化学方程式为:
D.从海水中提取1molBr2,理论上需要消耗Cl2体积为44.8L
二、非选择题(该部分有四个大题,共58分)。
15.(14分)如图是元素周期表的一部分,表中列出了八种元素的位置:
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
请回答下列问题:
(1)①元素的简单氢化物的电子式为__________。
(2)在元素①-⑧中,金属性最强的元素是__________(填元素符号),最高价含氧酸酸性最强的是__________(填化学式)。
(3)②、④、⑥三种元素的简单离子半径由大到小的顺序是__________(填元素符号),③和⑦的简单氢化物的稳定性较强的是__________(填化学式)。
(4)④和⑤所形成的化合物属于__________(填“离子”或“共价”)化合物。
(5)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为__________。
16.(15分)Ⅰ.请根据相关的知识,回答下列问题:
(1)下列变化:①碘的升华;②冰熔化;③氯化钠溶于水;④氯化氢溶于水;⑤氢氧化钠溶于水。
化学键未被破坏的是__________(填序号),仅离子键被破坏的是__________(填序号)。
(2)已知一定条件下,1mol化学键断裂时吸收的能量相关数据如下表:
化学键 H—H O=O H—O
能量(kJ) 436 496 463
在25℃、1.013×105Pa时,H2(g)与O2(g)反应生成lmolH2O(g)时,放出__________kJ热量。
Ⅱ.科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以一定比例混合通入反应器,适当条件下可获得甲醇(CH3OH)。某温度下在2L的恒容密闭容器中,充入2molCO2和6molH2,发生反应:。现测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(3)从反应开始经过15min达到平衡,则这段时间内氢气的平均反应速率__________。
(4)其他条件不变时,下列措施能使生成甲醇(CH3OH)的反应速率增大的是__________(填字母)。
A.降低温度 B.增大CO2的浓度
C.将容器的容积变为1L D.恒容条件下充入一定量Ne
(5)能判断该反应已达到化学反应限度的标志是__________(填字母)。
A.容器中混合气体的密度保持不变
B.容器中CH3OH浓度与CO2浓度相等
C.容器中混合气体的平均相对分子质量保持不变
D.CO2的生成速率与H2O的生成速率相等。
(6)该温度下该反应的平衡常数K=__________。(对于可逆反应,平衡常数表达式为,其中各物质浓度均为平衡时的浓度)
17.(14分)“价—类”二维图是元素化合物知识结构化的良好工具,如图是氮元素的“价—类”二维图。回答下列问题:
(1)N2的电子式为__________.
(2)若物质B为NO2,实验室制备NO2不能用排水法收集的原因是__________.
(3)A是重要的化工原料,可以合成C,写出工业上以A为原料制取C的第一步反应的化学方程式:__________。
(4)实验室中,检验D溶液中所含阳离子的实验操作和现象是__________。
(5)铜和足量的C的稀溶液反应,当生成11.2L(标准状况)气体时,转移电子的数目为__________;反应中C表现的性质为__________(填字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(6)把盛有48mL由NO和NO2组成的混合气体的容器倒置于水中(保持同温同压),待液面稳定后,容器内气体的体积变为24mL,则原混合气中NO的体积是__________mL。
18.(15分)Ⅰ.下图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
请回答下列问题:
(1)该装置将__________能转化为__________能。
(2)催化剂b表面O2发生__________反应,其附近溶液酸性__________(填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:__________.
Ⅱ.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如下:
(4)步骤(Ⅰ)充分反应后进行的实验操作名称是__________.
(5)步骤(Ⅱ)中加入H2O2溶液后需要适当加热但温度不能过高,原因是__________.
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由__________。
(7)步骤(Ⅲ)中将NaOH溶液换成氨气也可以得到沉淀,反应的离子方程式为__________。
仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试
化学参考答案及评分标准
一、选择题(每小题3分,共42分)。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D C D C B A A D D D B C B C
非选择题(除特殊标注外每空2分,共58分)。
15.(14分)
(1)
(2) Na HClO4
(3) N3—>F—>Al3+ H2O
(4)离子
(5)OH-+Al(OH)3=AlO+2H2O
16.(15分)
(1) ①② ③⑤
(2)242
(3)0.15
(4)BC
(5)CD
(6)5.33(或16/3) (3分)
(14分)
(1)
(2)NO2易溶于水,且会与水反应生成NO
(3)4NH3+5O24NO+6H2O
(4)取少量D溶液于试管中,加入适量NaOH溶液并加热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝
(5) 1.5NA D (6)12
(15分)
(1)化学 (1分) 电 (1分)
(2)还原 减弱
(3)SO2+2H2O 2e ==SO42-+4H+
(4) 过滤 (1分)
(5)适当加热可加快反应速率,温度不能过高避免双氧水受热分解。
(6)不可行,溶液B中存在大量Fe3+,往该溶液中滴加氢氧化钠溶液会产生红褐色的Fe(OH)3沉淀,干扰Fe2+的检验。
(7) 3NH3 + 3H2O + Fe3+ == Fe(OH)3 ↓+ 3NH4+
化学试题
可能用到的相对原子质量H 1 C 12 N 14 O 16 S 32 Cl 35.5 Cu 64
一、选择题(该部分有14小题,每小题3分,共42分,每小题只有一个选项符合题意)。
1.下列说法正确的是( )
A.氨氧化法制硝酸使用的铂-钯-铑合金催化剂可提高转化率
B.火力发电是先将化学能转化为热能,热能再转化为电能
C.化石燃料燃烧排放的粉尘、SO2、NOx、CO2是大气污染物
D.合成氨常选择400~500℃是为了提高反应速率降低生产成本
2.碳酸镧可用于治疗高磷酸盐血症,其制备的化学方程式为。下列表示相关微粒的化学用语正确的是( )
A.镧为第ⅦA族元素 B.中子数为8的碳原子:
C.NH4Cl的电子式: D.的结构示意图:
3.已知分解为和的能量变化如图曲线A所示,若在H2O2溶液中加入少量KI,则H2O2的分解过程可表示为:①,②,其能量变化如图曲线B所示。下列有关说法不正确的是( )
A.上述反应①为吸热反应,反应②为放热反应
B.具有的能量大于和具有的总能量
C.在H2O2分解过程中起到催化剂作用
D.从曲线B可以看出,加入KI减少了分解为和的能量变化
4.一定条件下,密闭容器中发生反应,当反应达到平衡状态时,下列有关说法错误的是( )
A.正、逆反应速率相等 B.各物质的浓度不再变化
C.反应已经完全停止 D.改变反应条件,化学平衡状态有可能会被破坏
5.用下列装置进行实验,能达到相应实验目的的是( )
A.制取并收集纯净的NO B.完成喷泉实验 C.比较酸性强弱:HCl>H2CO3>H2SiO3 D.实验室制备NH3
A.A B.B C.C D.D
6.下列实验操作中,能够达到实验目的是( )
选项 实验目的 实验操作
A 除去KNO3固体中少量的NaCl 加水溶解,蒸发浓缩、冷却结晶、过滤
B 除去H2S气体中少量的SO2 通入酸性KMnO4溶液中,洗气
C 分离胶体与溶液 将混合物至于普通漏斗中过滤
D 除Cl2气体中混有的HCl 通入NaOH溶液中,洗气
A.A B.B C.C D.D
7.下列各物质间的转化在给定条件下不能实现的是( )
A.
B.
C.
D.
8.下列各组材料组成如图装置,电流表指针能发生偏转的是( )
选项 A B C D
M Zn Cu Fe Zn
N Zn Ag Cu Cu
P 稀硫酸 蔗糖溶液 酒精 CuSO4溶液
A.A B.B C.C D.D
9.下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W
A.44.8LSO2含有的分子数为2NA B.1.7gNH3含有的中子数目为NA
C.H2O的摩尔质量为18g D.99gNH4HSO3固体含有的离子数为2NA
11.某学习小组为了探究影响高锰酸钾酸性溶液与NaHSO3溶液反应速率的因素,该小组设计如表实验方案。
实验 褪色时间t/min
l 3.0 2.0 1.0 0.0 2.0 8
2 3.0 2.0 2.0 0.0 a 6
3 4.0 2.0 2.0 0.0 0.0 4
4 4.0 2.0 1.0 0.5 b 3
下列说法正确的是( )
A.该反应的离子方程式为:
B.a=1.0,b=0.5
C.实验3从反应开始到反应结束这段时间内反应速率
D.实验证明可能是该反应的催化剂
12.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为。下列有关说法正确的是( )
A.负极的电极反应式为
B.测量原理示意图中,电子从Ag2O/Ag电极经导线流向Cu
C.电池工作时,向Cu电极移动
D.电池工作时,浓度增大
13.实验室用如下图所示装置探究SO2与NaNO3溶液的反应(实验前先通入CO2排除装置中的空气)。下列说法不正确的是( )
A.用装置甲产生SO2
B.装置乙中无明显现象,则SO2与NaNO3未发生反应
C.装置丙中注入O2,产生红棕色气体,说明装置乙中SO2发生了氧化反应
D.装置丁吸收尾气并防止空气进入装置丙
14.海水化学资源开发利用中提溴的部分过程如图所示。下列说法正确的是( )
A.利用蒸馏法、电渗析法、离子交换法或过滤法均可实现海水淡化
B.还原性:
C.SO2与Br2反应的化学方程式为:
D.从海水中提取1molBr2,理论上需要消耗Cl2体积为44.8L
二、非选择题(该部分有四个大题,共58分)。
15.(14分)如图是元素周期表的一部分,表中列出了八种元素的位置:
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
请回答下列问题:
(1)①元素的简单氢化物的电子式为__________。
(2)在元素①-⑧中,金属性最强的元素是__________(填元素符号),最高价含氧酸酸性最强的是__________(填化学式)。
(3)②、④、⑥三种元素的简单离子半径由大到小的顺序是__________(填元素符号),③和⑦的简单氢化物的稳定性较强的是__________(填化学式)。
(4)④和⑤所形成的化合物属于__________(填“离子”或“共价”)化合物。
(5)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为__________。
16.(15分)Ⅰ.请根据相关的知识,回答下列问题:
(1)下列变化:①碘的升华;②冰熔化;③氯化钠溶于水;④氯化氢溶于水;⑤氢氧化钠溶于水。
化学键未被破坏的是__________(填序号),仅离子键被破坏的是__________(填序号)。
(2)已知一定条件下,1mol化学键断裂时吸收的能量相关数据如下表:
化学键 H—H O=O H—O
能量(kJ) 436 496 463
在25℃、1.013×105Pa时,H2(g)与O2(g)反应生成lmolH2O(g)时,放出__________kJ热量。
Ⅱ.科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以一定比例混合通入反应器,适当条件下可获得甲醇(CH3OH)。某温度下在2L的恒容密闭容器中,充入2molCO2和6molH2,发生反应:。现测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(3)从反应开始经过15min达到平衡,则这段时间内氢气的平均反应速率__________。
(4)其他条件不变时,下列措施能使生成甲醇(CH3OH)的反应速率增大的是__________(填字母)。
A.降低温度 B.增大CO2的浓度
C.将容器的容积变为1L D.恒容条件下充入一定量Ne
(5)能判断该反应已达到化学反应限度的标志是__________(填字母)。
A.容器中混合气体的密度保持不变
B.容器中CH3OH浓度与CO2浓度相等
C.容器中混合气体的平均相对分子质量保持不变
D.CO2的生成速率与H2O的生成速率相等。
(6)该温度下该反应的平衡常数K=__________。(对于可逆反应,平衡常数表达式为,其中各物质浓度均为平衡时的浓度)
17.(14分)“价—类”二维图是元素化合物知识结构化的良好工具,如图是氮元素的“价—类”二维图。回答下列问题:
(1)N2的电子式为__________.
(2)若物质B为NO2,实验室制备NO2不能用排水法收集的原因是__________.
(3)A是重要的化工原料,可以合成C,写出工业上以A为原料制取C的第一步反应的化学方程式:__________。
(4)实验室中,检验D溶液中所含阳离子的实验操作和现象是__________。
(5)铜和足量的C的稀溶液反应,当生成11.2L(标准状况)气体时,转移电子的数目为__________;反应中C表现的性质为__________(填字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(6)把盛有48mL由NO和NO2组成的混合气体的容器倒置于水中(保持同温同压),待液面稳定后,容器内气体的体积变为24mL,则原混合气中NO的体积是__________mL。
18.(15分)Ⅰ.下图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
请回答下列问题:
(1)该装置将__________能转化为__________能。
(2)催化剂b表面O2发生__________反应,其附近溶液酸性__________(填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:__________.
Ⅱ.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如下:
(4)步骤(Ⅰ)充分反应后进行的实验操作名称是__________.
(5)步骤(Ⅱ)中加入H2O2溶液后需要适当加热但温度不能过高,原因是__________.
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由__________。
(7)步骤(Ⅲ)中将NaOH溶液换成氨气也可以得到沉淀,反应的离子方程式为__________。
仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试
化学参考答案及评分标准
一、选择题(每小题3分,共42分)。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D C D C B A A D D D B C B C
非选择题(除特殊标注外每空2分,共58分)。
15.(14分)
(1)
(2) Na HClO4
(3) N3—>F—>Al3+ H2O
(4)离子
(5)OH-+Al(OH)3=AlO+2H2O
16.(15分)
(1) ①② ③⑤
(2)242
(3)0.15
(4)BC
(5)CD
(6)5.33(或16/3) (3分)
(14分)
(1)
(2)NO2易溶于水,且会与水反应生成NO
(3)4NH3+5O24NO+6H2O
(4)取少量D溶液于试管中,加入适量NaOH溶液并加热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝
(5) 1.5NA D (6)12
(15分)
(1)化学 (1分) 电 (1分)
(2)还原 减弱
(3)SO2+2H2O 2e ==SO42-+4H+
(4) 过滤 (1分)
(5)适当加热可加快反应速率,温度不能过高避免双氧水受热分解。
(6)不可行,溶液B中存在大量Fe3+,往该溶液中滴加氢氧化钠溶液会产生红褐色的Fe(OH)3沉淀,干扰Fe2+的检验。
(7) 3NH3 + 3H2O + Fe3+ == Fe(OH)3 ↓+ 3NH4+
同课章节目录
