1.2.2 离子反应 课件(共27张PPT) 高中化学人教版 必修一
文档属性
| 名称 | 1.2.2 离子反应 课件(共27张PPT) 高中化学人教版 必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-22 11:01:43 | ||
图片预览








文档简介
(共27张PPT)
1. 理解离子反应的概念。
2. 掌握离子反应发生的条件。
3. 正确判断和书写离子方程式。
学习目标
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑泉”;蜀军先锋王平率数百军士前来探路,由于天气炎热,人马均争先恐后误喝哑泉水(含有较多的硫酸铜);回营后军士们个个说不出话来,生命危在旦夕,诸葛亮也毫无办法。此时,幸巧遇见一老叟,经指点,蜀军众将士及时饮用万安溪安乐泉水(含有较多的碱),终于逐渐转危为安,渡过难关。
“安乐泉”解“哑泉”之毒
情境思考
思考:喝了万安溪安乐泉水为何转危为安呢
安乐泉水中含有较多的碱,大量饮此泉水,其中碱先中和了胃酸,然后多余的碱又会在胃肠中与CuSO4发生反应生成不溶物Cu(OH)2,而不再会被吸收,因此具有解毒作用。
情境思考
实验探究
1.定义:
在水溶液或熔融状态有离子参加或生成的反应叫离子反应。
【实验探究】
实验操作 现象
向盛有2 mL Na2SO4溶液的试管里加入2 mLBaCl2溶液
出现白色沉淀
【实验分析】
BaCl2 + Na2SO4 == 2NaCl + BaSO4 ↓
一、离子反应
现象 分析
Na2SO4 和 BaCl2的 电离方程式 混合前两种溶液 中的离子 混合后溶液
中的离子
出现白色沉淀
Na2SO4 == 2Na+ +
BaCl2 == Ba2+ + 2Cl-
Na+, Ba2+ ,Cl-
Na+ ,Cl-
Na2SO4
BaCl2
2Na+
2Cl-
2Na+
BaSO4
2Cl-
+
+
Ba2+
BaSO4
NaCl
+
结论:Na2SO4与BaCl2溶液反应的实质:
Ba2+ + == BaSO4↓
一、离子反应
2.离子反应的实质:
溶液中离子的种类或浓度发生改变。反应后一般某些离子浓度会减少。
4.离子方程式
(1)定义:用实际参加反应的离子符号来表示反应的式子叫离子方程式 。
(2)书写方法:“写、拆、删、查”四步
一、离子反应
Ba2+ + == BaSO4↓
3. 离子反应发生的条件:
离子之间反应有沉淀或气体或弱电解质生成。
离子发生氧化还原反应。
①写:写出正确的化学方程式。
②拆:把强酸、强碱、可溶性盐、的化学式拆成离子形式,其它(如氧化物,气体,单质,沉淀等)的一律用化学式表示。
③删:把不参加反应的离子从方程式两边删去。
④查:检查方程式两边是否符合原子守恒和电荷守恒。
Na2SO4 + BaCl2 == BaSO4 ↓ + 2NaCl
2Na+ + + Ba2+ + 2Cl- == BaSO4 ↓+ 2Na+ + 2Cl-
2Na+ + + Ba2+ + 2Cl- == BaSO4 ↓+ 2Na+ + 2Cl-
+ Ba2+ == BaSO4 ↓
一、离子反应
【注意】
① 凡在非溶液中进行的反应不能写离子方程式
如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。
即: 2NH4Cl(固) + Ca(OH)2(固) == CaCl2 + 2NH3↑ + 2H2O
△
② 书写离子方程式时,浓硫酸不能拆成离子形式,而浓硝酸、浓盐酸要拆写成离子形式。
③ 氨水作为反应物写为NH3·H2O;作为生成物,若有加热条件或浓度很大时,写为“NH3↑+H2O”
一、离子反应
【注意】
④ 拆写时,微溶物:
如澄清石灰水表示为“Ca2++2OH-”,而石灰乳表示为“Ca(OH)2”。
Ca(OH)2、MgCO3、CaSO4、Ag2SO4
若作为反应物
为澄清溶液时,则写成离子形式
若为浑浊溶液,写成化学式
若作为产物,则一般写成化学式。
一、离子反应
例题1:书写下列反应的离子方程式:
①NaOH溶液与稀硫酸:_________________________________;
②KOH溶液与稀盐酸:___________________________________;
③BaCl2溶液与稀硫酸溶液:______________________________;
④ Ba(OH)2+H2SO4 :____________________________________________;
⑤碳酸钠与稀硫酸:______________________________________;
⑥碳酸钙与稀盐酸:______________________________________。
⑦CH3COOH+KOH:CH3COOH + OH- == CH3COO- + H2O
OH-+H+ == H2O
OH-+H+ == H2O
CaCO3+2H+ == Ca2++CO2↑+H2O
+Ba2+ == BaSO4↓
+2H+ == CO2↑+H2O
Ba2++ 2OH-+2H+ + == BaSO4↓ +2H2O
一、离子反应
(3)离子方程式的意义
① 不仅可以表示某一个具体的反应,
② 而且还可以表示同一类型的离子反应。
(4)与少量或过量有关的离子方程式的书写:
少定多变法
①“定”量少的反应物定为1 mol,其离子化学计量数由化学式确定。
②“变”:过量的反应物,其离子的化学计量数根据实际反应需要的量来确定,不受化学式中比例的限制,是可变的。
一、离子反应
例题2:(1)少量烧碱滴入Ca(HCO3)2溶液:
Ca2++H+OH- == CaCO3↓+H2O
(2)足量烧碱滴入Ca(HCO3)2溶液:
Ca2++2H+2OH- == CaCO3↓++2H2O
(1)NaHCO3少量时:
Ca2++H+OH- == CaCO3↓+H2O
(2)NaHCO3过量时:
Ca2++2H+2OH- == CaCO3↓++2H2O
例题3:NaHCO3溶液与Ca(OH)2溶液混合。
一、离子反应
(1)KHSO4少量时:
Ba2+++H++OH- == BaSO4 ↓ +H2O
(2)KHSO4过量时:
Ba2+++2H++2OH- == BaSO4↓+2H2O
例题4:KHSO4溶液与Ba(OH)2溶液混合?
一、离子反应
(5)离子方程式的正误判断:
① 看是否符合客观事实。
例:铁跟稀硫酸反应: 2Fe+6H+ == 2Fe3++3H2↑
② 看拆分是否正确。
③ 看是否遵守原子守恒和电荷守恒。
例:FeCl2溶液与Cl2反应 Fe2++Cl2 == Fe3++2 Cl-
④ 看是否漏掉了离子反应
例:Ba(OH)2溶液与硫酸铜溶液反应 Ba2++ == BaSO4
⑤看是否符合题设条件及要求,如过量、少量、等物质的量、适量、滴加顺序等对反应方式或产物的影响。
一、离子反应
例题5:
下列反应的离子方程式书写正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+ == Cu2++H2↑
B. 稀硫酸与氢氧化钡溶液混合:+Ba2+ == BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+ == Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+ == 2Fe3++3H2O
D
一、离子反应
1.离子共存:
即溶液中的离子之间不发生化学反应。若发生反应则不能共存。
2.离子不能大量共存的常见类型:
(1)离子之间发生复分解反应,即有沉淀(包括微溶物)或气体或弱电解质生成。
如:Ba2+与 ,H+与、H+与H,H+与OH-、H+与CH3COO-、OH-与等
二、离子共存问题
(2)离子之间发生氧化还原反应。
氧化性离子(如Fe3+、、ClO-、等)与还原性离子(如S2-、I-、Fe2+、等)不能大量共存。
(3)离子之间发生双水解反应不能大量共存。
常见能发生双水解的离子有:Al3+与H、、HS-、 S2- 、ClO-、;Fe3+与H、、ClO-、;Fe2+与;Mg2+与;与、等
二、离子共存问题
易错:注意题中隐含条件:
① 无色溶液:有色离子不能大量存在。常见的有色离子:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、(紫红色)、 (橙红色)等
② 强酸性溶液、pH小于7的溶液或使紫色石蕊变红或甲基橙变红的溶液中含有大量H+,能够与H+反应的离子不能存在。如OH-(大量)、H、HS-、S2-、、H、、、、F-、CN-、 等不能大量存在
③ pH大于7的溶液、使酚酞变红的溶液中存在大量OH-,则与OH-反应的离子不能存在。
如:H+(大量)、Mg2+、Al3+、Ca2+、Fe3+、Cu2+、Fe2+、H、H、
、
二、离子共存问题
例题6:在强碱性溶液中不能大量共存的离子组是( )
A. Ba2+、Na+、 、Cl- B. K+、Na+、 、S2-
C. K+、Na+、 、 D. 、Cu2+、Cl-、
D
例题7:在强酸性或强碱性溶液中都能大量共存的一组离子是 ( )
A. Ba2+、Fe3+、Cl-、 B. Na+、Ca2+、 、
C. Mg2+、 、 、Na+ D. Na+、K+、 、
D
二、离子共存问题
例题8:在pH=1的无色溶液中不能大量共存的离子是( )
A. Cu2+、Ag+、 、Cl- B. 、Mg2+、 、Cl-
C. K+、Na+、Cl-、 D. Zn2+、Na+、、
C
例题9:将Na2CO3固体加入含下列离子的溶液中,溶液中原离子还能够大量存
在的是( )
A.K+、、Na+、Cl- B.K+、Ba2+、OH-、Cl-
C.Na+、H+、 、 D.Na+、I-、Ca2+、
A
二、离子共存问题
三、常见离子的检验方法
小结
D
当堂检测
2.下列离子反应不能发生的是( )
A. HCl+NaOH == NaCl+H2O B. AgNO3+NaCl == AgCl↓+NaNO3
C. KHCO3+HCl == KCl+CO2↑+H2O D. 2HCl+Na2SO4 == 2NaCl+H2SO4
D
3.在强碱性溶液中不能大量共存的离子组是( )
A. Ba2+、Na+、 、Cl- B. K+、Na+、 、S2-
C. K+、Na+、 、 D. 、Cu2+、Cl-、
D
当堂检测
4.下列离子方程式中,正确的是( )
B. 硫化亚铁与稀硫酸反应:FeS + 2H+ == Fe2+ + H2S↑
C. 大理石与盐酸反应: +2H+ == CO2↑ + H2O
D. 铁与氯化铁溶液反应:Fe + Fe3+ == 2Fe2+
A. Ba(OH)2溶液与硫酸反应: Ba2++ == BaSO4↓
B
当堂检测
1. 理解离子反应的概念。
2. 掌握离子反应发生的条件。
3. 正确判断和书写离子方程式。
学习目标
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑泉”;蜀军先锋王平率数百军士前来探路,由于天气炎热,人马均争先恐后误喝哑泉水(含有较多的硫酸铜);回营后军士们个个说不出话来,生命危在旦夕,诸葛亮也毫无办法。此时,幸巧遇见一老叟,经指点,蜀军众将士及时饮用万安溪安乐泉水(含有较多的碱),终于逐渐转危为安,渡过难关。
“安乐泉”解“哑泉”之毒
情境思考
思考:喝了万安溪安乐泉水为何转危为安呢
安乐泉水中含有较多的碱,大量饮此泉水,其中碱先中和了胃酸,然后多余的碱又会在胃肠中与CuSO4发生反应生成不溶物Cu(OH)2,而不再会被吸收,因此具有解毒作用。
情境思考
实验探究
1.定义:
在水溶液或熔融状态有离子参加或生成的反应叫离子反应。
【实验探究】
实验操作 现象
向盛有2 mL Na2SO4溶液的试管里加入2 mLBaCl2溶液
出现白色沉淀
【实验分析】
BaCl2 + Na2SO4 == 2NaCl + BaSO4 ↓
一、离子反应
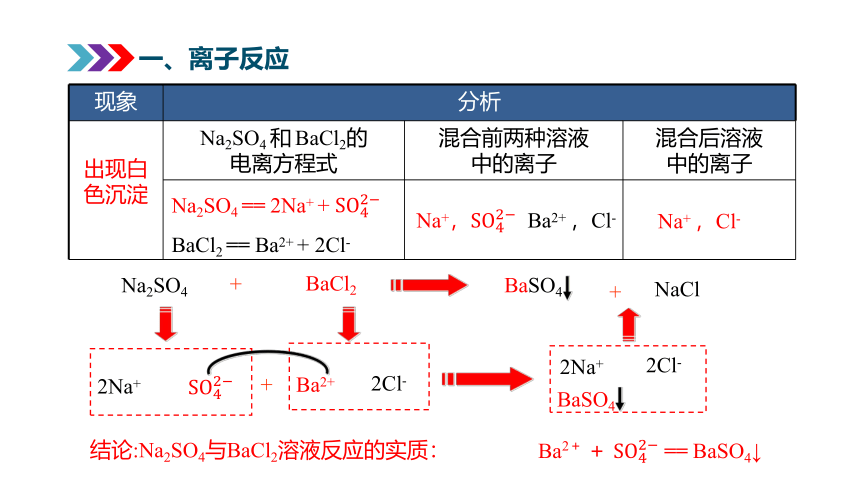
现象 分析
Na2SO4 和 BaCl2的 电离方程式 混合前两种溶液 中的离子 混合后溶液
中的离子
出现白色沉淀
Na2SO4 == 2Na+ +
BaCl2 == Ba2+ + 2Cl-
Na+, Ba2+ ,Cl-
Na+ ,Cl-
Na2SO4
BaCl2
2Na+
2Cl-
2Na+
BaSO4
2Cl-
+
+
Ba2+
BaSO4
NaCl
+
结论:Na2SO4与BaCl2溶液反应的实质:
Ba2+ + == BaSO4↓
一、离子反应
2.离子反应的实质:
溶液中离子的种类或浓度发生改变。反应后一般某些离子浓度会减少。
4.离子方程式
(1)定义:用实际参加反应的离子符号来表示反应的式子叫离子方程式 。
(2)书写方法:“写、拆、删、查”四步
一、离子反应
Ba2+ + == BaSO4↓
3. 离子反应发生的条件:
离子之间反应有沉淀或气体或弱电解质生成。
离子发生氧化还原反应。
①写:写出正确的化学方程式。
②拆:把强酸、强碱、可溶性盐、的化学式拆成离子形式,其它(如氧化物,气体,单质,沉淀等)的一律用化学式表示。
③删:把不参加反应的离子从方程式两边删去。
④查:检查方程式两边是否符合原子守恒和电荷守恒。
Na2SO4 + BaCl2 == BaSO4 ↓ + 2NaCl
2Na+ + + Ba2+ + 2Cl- == BaSO4 ↓+ 2Na+ + 2Cl-
2Na+ + + Ba2+ + 2Cl- == BaSO4 ↓+ 2Na+ + 2Cl-
+ Ba2+ == BaSO4 ↓
一、离子反应
【注意】
① 凡在非溶液中进行的反应不能写离子方程式
如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。
即: 2NH4Cl(固) + Ca(OH)2(固) == CaCl2 + 2NH3↑ + 2H2O
△
② 书写离子方程式时,浓硫酸不能拆成离子形式,而浓硝酸、浓盐酸要拆写成离子形式。
③ 氨水作为反应物写为NH3·H2O;作为生成物,若有加热条件或浓度很大时,写为“NH3↑+H2O”
一、离子反应
【注意】
④ 拆写时,微溶物:
如澄清石灰水表示为“Ca2++2OH-”,而石灰乳表示为“Ca(OH)2”。
Ca(OH)2、MgCO3、CaSO4、Ag2SO4
若作为反应物
为澄清溶液时,则写成离子形式
若为浑浊溶液,写成化学式
若作为产物,则一般写成化学式。
一、离子反应
例题1:书写下列反应的离子方程式:
①NaOH溶液与稀硫酸:_________________________________;
②KOH溶液与稀盐酸:___________________________________;
③BaCl2溶液与稀硫酸溶液:______________________________;
④ Ba(OH)2+H2SO4 :____________________________________________;
⑤碳酸钠与稀硫酸:______________________________________;
⑥碳酸钙与稀盐酸:______________________________________。
⑦CH3COOH+KOH:CH3COOH + OH- == CH3COO- + H2O
OH-+H+ == H2O
OH-+H+ == H2O
CaCO3+2H+ == Ca2++CO2↑+H2O
+Ba2+ == BaSO4↓
+2H+ == CO2↑+H2O
Ba2++ 2OH-+2H+ + == BaSO4↓ +2H2O
一、离子反应
(3)离子方程式的意义
① 不仅可以表示某一个具体的反应,
② 而且还可以表示同一类型的离子反应。
(4)与少量或过量有关的离子方程式的书写:
少定多变法
①“定”量少的反应物定为1 mol,其离子化学计量数由化学式确定。
②“变”:过量的反应物,其离子的化学计量数根据实际反应需要的量来确定,不受化学式中比例的限制,是可变的。
一、离子反应
例题2:(1)少量烧碱滴入Ca(HCO3)2溶液:
Ca2++H+OH- == CaCO3↓+H2O
(2)足量烧碱滴入Ca(HCO3)2溶液:
Ca2++2H+2OH- == CaCO3↓++2H2O
(1)NaHCO3少量时:
Ca2++H+OH- == CaCO3↓+H2O
(2)NaHCO3过量时:
Ca2++2H+2OH- == CaCO3↓++2H2O
例题3:NaHCO3溶液与Ca(OH)2溶液混合。
一、离子反应
(1)KHSO4少量时:
Ba2+++H++OH- == BaSO4 ↓ +H2O
(2)KHSO4过量时:
Ba2+++2H++2OH- == BaSO4↓+2H2O
例题4:KHSO4溶液与Ba(OH)2溶液混合?
一、离子反应
(5)离子方程式的正误判断:
① 看是否符合客观事实。
例:铁跟稀硫酸反应: 2Fe+6H+ == 2Fe3++3H2↑
② 看拆分是否正确。
③ 看是否遵守原子守恒和电荷守恒。
例:FeCl2溶液与Cl2反应 Fe2++Cl2 == Fe3++2 Cl-
④ 看是否漏掉了离子反应
例:Ba(OH)2溶液与硫酸铜溶液反应 Ba2++ == BaSO4
⑤看是否符合题设条件及要求,如过量、少量、等物质的量、适量、滴加顺序等对反应方式或产物的影响。
一、离子反应
例题5:
下列反应的离子方程式书写正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+ == Cu2++H2↑
B. 稀硫酸与氢氧化钡溶液混合:+Ba2+ == BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+ == Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+ == 2Fe3++3H2O
D
一、离子反应
1.离子共存:
即溶液中的离子之间不发生化学反应。若发生反应则不能共存。
2.离子不能大量共存的常见类型:
(1)离子之间发生复分解反应,即有沉淀(包括微溶物)或气体或弱电解质生成。
如:Ba2+与 ,H+与、H+与H,H+与OH-、H+与CH3COO-、OH-与等
二、离子共存问题
(2)离子之间发生氧化还原反应。
氧化性离子(如Fe3+、、ClO-、等)与还原性离子(如S2-、I-、Fe2+、等)不能大量共存。
(3)离子之间发生双水解反应不能大量共存。
常见能发生双水解的离子有:Al3+与H、、HS-、 S2- 、ClO-、;Fe3+与H、、ClO-、;Fe2+与;Mg2+与;与、等
二、离子共存问题
易错:注意题中隐含条件:
① 无色溶液:有色离子不能大量存在。常见的有色离子:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、(紫红色)、 (橙红色)等
② 强酸性溶液、pH小于7的溶液或使紫色石蕊变红或甲基橙变红的溶液中含有大量H+,能够与H+反应的离子不能存在。如OH-(大量)、H、HS-、S2-、、H、、、、F-、CN-、 等不能大量存在
③ pH大于7的溶液、使酚酞变红的溶液中存在大量OH-,则与OH-反应的离子不能存在。
如:H+(大量)、Mg2+、Al3+、Ca2+、Fe3+、Cu2+、Fe2+、H、H、
、
二、离子共存问题
例题6:在强碱性溶液中不能大量共存的离子组是( )
A. Ba2+、Na+、 、Cl- B. K+、Na+、 、S2-
C. K+、Na+、 、 D. 、Cu2+、Cl-、
D
例题7:在强酸性或强碱性溶液中都能大量共存的一组离子是 ( )
A. Ba2+、Fe3+、Cl-、 B. Na+、Ca2+、 、
C. Mg2+、 、 、Na+ D. Na+、K+、 、
D
二、离子共存问题
例题8:在pH=1的无色溶液中不能大量共存的离子是( )
A. Cu2+、Ag+、 、Cl- B. 、Mg2+、 、Cl-
C. K+、Na+、Cl-、 D. Zn2+、Na+、、
C
例题9:将Na2CO3固体加入含下列离子的溶液中,溶液中原离子还能够大量存
在的是( )
A.K+、、Na+、Cl- B.K+、Ba2+、OH-、Cl-
C.Na+、H+、 、 D.Na+、I-、Ca2+、
A
二、离子共存问题
三、常见离子的检验方法
小结
D
当堂检测
2.下列离子反应不能发生的是( )
A. HCl+NaOH == NaCl+H2O B. AgNO3+NaCl == AgCl↓+NaNO3
C. KHCO3+HCl == KCl+CO2↑+H2O D. 2HCl+Na2SO4 == 2NaCl+H2SO4
D
3.在强碱性溶液中不能大量共存的离子组是( )
A. Ba2+、Na+、 、Cl- B. K+、Na+、 、S2-
C. K+、Na+、 、 D. 、Cu2+、Cl-、
D
当堂检测
4.下列离子方程式中,正确的是( )
B. 硫化亚铁与稀硫酸反应:FeS + 2H+ == Fe2+ + H2S↑
C. 大理石与盐酸反应: +2H+ == CO2↑ + H2O
D. 铁与氯化铁溶液反应:Fe + Fe3+ == 2Fe2+
A. Ba(OH)2溶液与硫酸反应: Ba2++ == BaSO4↓
B
当堂检测
