1.2.1电解质的电离 课件(共21张PPT 含视频)高中化学人教版 必修一
文档属性
| 名称 | 1.2.1电解质的电离 课件(共21张PPT 含视频)高中化学人教版 必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 38.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-22 11:03:18 | ||
图片预览








文档简介
(共21张PPT)
了解电解质的概念,以及电解质溶液的导电性。
认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
掌握电解质电离的表示方法。
学习目标
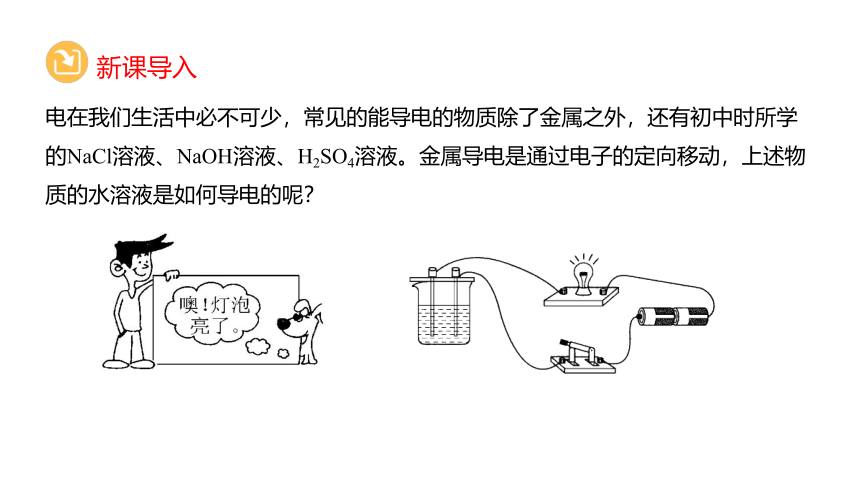
电在我们生活中必不可少,常见的能导电的物质除了金属之外,还有初中时所学的NaCl溶液、NaOH溶液、H2SO4溶液。金属导电是通过电子的定向移动,上述物质的水溶液是如何导电的呢?
新课导入
实验探究
实验步骤
实验现象
实验结论
能够导电
(1)在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
(2)取上述烧杯中的NaCl固体、KNO3固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃杯搅拌,使固体完全溶解形成溶液。如图所示,将石墨电极依次放入NaCl溶液、KNO3溶液中,分别接通电源,观察并记录现象
实验一中灯泡不发光;实验二中灯泡发光。
干燥的NaCl固体、KNO3固体、蒸馏水___________。NaCl溶液、KNO3溶液___________。
不导电
严格来说,蒸馏水也能导电,只是导电能力非常弱,只是用上述实验装置不能测出。
一、定义
1.电解质:在________或____________下能够导电的化合物;
2.非电解质:在水溶液里和熔融状态下都不导电的化合物。
水溶液
熔融状态
注意:
(1)电解质和非电解质都是化合物,单质和混合物既不是电解质,也不是非
电解质;
(2)电解质在“水溶液”里或“熔融状态”下能导电,二者具备其一即可;
(3)非电解质在“水溶液”里和“熔融状态”下不能导电,二者需同时满足。
电解质与非电解质
(1)金属Cu、稀盐酸都能导电,请问金属Cu、稀盐酸属于电解质吗?
(2)判断盐酸、硫酸、稀硝酸、烧碱溶液是否为电解质或非电解质?
(3)CO2、NH3的水溶液能导电,那么CO2、NH3属于电解质吗?
(4)“HCl溶于水能导电,所以HCl是电解质”这种说法是否正确?
(5)“一个物质如果不是电解质,就是非电解质”这种说法是否正确?
都不属于,因为金属Cu是单质,稀盐酸是混合物,两者都不是化合物。
盐酸、稀硝酸、烧碱溶液为混合物,既不是电解质,也不是非电解质;硫酸为电解质。
都不属于,因为电解质必须是自身能电离成自由移动离子的化合物。
不正确,因为前后没有因果关系。
错误,如单质和混合物既不是电解质也不是非电解质。
交流讨论
易错提醒:
(1)电解质和非电解质都是化合物,单质(如Cu、Fe)和混合物(如盐酸、食盐水)既不是电解质,也不是非电解质。
(2)电解质必须是自身能直接电离成自由移动离子的化合物,某些化合物如CO2溶于水可导电,但其本身不是电解质,与水反应生成的H2CO3才是电解质。
易错提醒——电解质与溶解性无关
二、电解质和非电解质的类别
电解质:_______________________________________________________。
非电解质:_____________________________________________________。
酸、碱、盐、金属氧化物、金属氢化物、水
大部分有机化合物、非金属氧化物
AgCl、BaSO4等难溶盐在水中的溶解度极小,不能导电,但这些物质在熔融状态下能导电,在水中溶解的部分也能完全电离,故属于电解质。
1. 下列关于电解质的说法不正确的是( )
A.电解质不一定能导电
B.能导电的不一定是电解质
C.NH3溶于水能导电,因此NH3是电解质
D.乙醇是非电解质,因此乙醇水溶液不能导电
C
学以致用
2. 2021年5月15日,天问一号着陆巡视器成功着陆火星,探测到火星大气由二氧化碳、氩气(Ar)、水蒸气和甲烷等组成,火星土壤中存在着大量氧化铁,上述物质中属于电解质的是( )
A.二氧化碳 B.水 C.甲烷 D.氩气
B
D
3. 下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 混合物 电解质 非电解质
A 盐酸 冰水混合物 硫酸 干冰
B 纯净水 漂白粉 氧化铝 二氧化硫
C 胆矾 碱石灰 铁 碳酸钙
D 液氯 合金 氯化铜 蔗糖
一、电离与电离方程式
1. 电离的概念:电解质在水溶液中或熔融状态下解离成自由移动离子的过程。
2. 电离方程式:用化学式和离子符号表示物质电离过程的式子。
例如:将氯化钠加入水中,在水分子的作用下,钠离子和氯离子脱离NaCl晶体表面,形成了能够自由移动的Na+和Cl-;这一过程可以用电离方程式表示为:
NaCl === Na+ + Cl-
物质的电离与导电性
3. 电离方程式的书写要点:
(1)元素守恒(等号两边的原子种类、数目相等)
(2)电荷守恒(正电荷总数=负电荷总数)
(3)电离过程中,原子团不拆开
练一练:写出下列物质的电离方程式:
(1)HCl:______________________________________________________
(2)KHCO3:__________________________________________________
(3)KHSO4(溶液):____________________________________________
(4)KHSO4(熔融):____________________________________________
HC1== H++Cl-
KHCO3 == K++
KHSO4 == K++H+ +
KHSO4 (熔融)== K++H
二、从电离的角度认识酸、碱、盐的实质
类别 实质 实例
酸 电离时产生的阳离子_________________的化合物 HCl、H2SO4
碱 电离时产生的阴离子_________________的化合物 NaOH、Ca(OH)2
盐 电离时能产生_____________________和______________的化合物 NaCl、Na2CO3、NH4HCO3
全部是H+
全部是OH-
酸根离子
三、物质的导电性问题
1. 物质导电的本质
金属单质和石墨导电靠的是自由移动的电子;电解质溶液或熔融液导电靠的是自由移动的阴、阳离子,其导电的前提是电离。
金属阳离子(或)
2.电解质导电的条件
(1)一般来说,对于NaOH、KCl等可溶性的碱和盐,在_________和
__________都可以导电;
(2)对于难溶性的碱、盐、金属氧化物,如Mg(OH)2、BaSO4、Fe2O3,因为这些物质难溶于水,所以它们只能在____________才可以导电;
(3)像HCl、H2SO4等酸只能在____________才可以导电。
水溶液
熔融状态
熔融状态
水溶液
注意:
电解质与导电性之间没有必然关系:
(1)电解质不一定都能导电:如NaCl固体、HCl气体;
(2)能导电的物质不一定是电解质:如石墨、金属单质、溶液。
学以致用
4. 下列叙述正确的是( )
A.NaCl溶液在电流作用下电离成Na+和Cl-
B.NaCl是电解质,故NaCl晶体能导电
C.氯化氢溶于水能导电,但液态氯化氢不能导电
D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多
C
5. 下列电离方程式正确的是( )
A.NaOH 电离方程式:NaOH== Na++H++O2-
B.硫酸铝的电离方程式:Al2(SO4)3== +
C.NaCl 的电离方程式:NaCl == Na++Cl-
D.硫酸电离方程式:H2SO4== 2H++
通电
D
6. 某课外活动小组根据熔融状态下的NaCl能导电,推测AlCl3在熔融状态下也能导电,可是通过实验发现熔融状态下的AlCl3不能导电,而AlCl3水溶液却能导电,据此回答下列问题。
(1)熔融状态的AlCl3不导电的原因是
。
(2)AlCl3水溶液导电的原因是 。
(3)电解质溶液导电与金属导电的原理 (填“相同”或“不相同”,若填“相同”,下一空不必填写;若填“不相同”,完成下一空),区别
是 。
熔融状态下氯化铝不发生电离,以分子的形式存在,其中不存在自由移动的离子
AlCl3在水溶液中能电离出自由移动的离子
不相同
电解质溶液导电是由于阴阳离子的定向移动,金属导电是由于自由电子的定向移动
电解质与非电解质
电解质的电离
物质的电离与导电性
物质的导电性实验探究
电解质与非电解质的定义
电解质与非电解质的类别
电离与电离方程式
从电离的角度认识酸、碱、盐的实质
物质的导电性问题
课堂小结
了解电解质的概念,以及电解质溶液的导电性。
认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
掌握电解质电离的表示方法。
学习目标
电在我们生活中必不可少,常见的能导电的物质除了金属之外,还有初中时所学的NaCl溶液、NaOH溶液、H2SO4溶液。金属导电是通过电子的定向移动,上述物质的水溶液是如何导电的呢?
新课导入
实验探究
实验步骤
实验现象
实验结论
能够导电
(1)在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
(2)取上述烧杯中的NaCl固体、KNO3固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃杯搅拌,使固体完全溶解形成溶液。如图所示,将石墨电极依次放入NaCl溶液、KNO3溶液中,分别接通电源,观察并记录现象
实验一中灯泡不发光;实验二中灯泡发光。
干燥的NaCl固体、KNO3固体、蒸馏水___________。NaCl溶液、KNO3溶液___________。
不导电
严格来说,蒸馏水也能导电,只是导电能力非常弱,只是用上述实验装置不能测出。
一、定义
1.电解质:在________或____________下能够导电的化合物;
2.非电解质:在水溶液里和熔融状态下都不导电的化合物。
水溶液
熔融状态
注意:
(1)电解质和非电解质都是化合物,单质和混合物既不是电解质,也不是非
电解质;
(2)电解质在“水溶液”里或“熔融状态”下能导电,二者具备其一即可;
(3)非电解质在“水溶液”里和“熔融状态”下不能导电,二者需同时满足。
电解质与非电解质
(1)金属Cu、稀盐酸都能导电,请问金属Cu、稀盐酸属于电解质吗?
(2)判断盐酸、硫酸、稀硝酸、烧碱溶液是否为电解质或非电解质?
(3)CO2、NH3的水溶液能导电,那么CO2、NH3属于电解质吗?
(4)“HCl溶于水能导电,所以HCl是电解质”这种说法是否正确?
(5)“一个物质如果不是电解质,就是非电解质”这种说法是否正确?
都不属于,因为金属Cu是单质,稀盐酸是混合物,两者都不是化合物。
盐酸、稀硝酸、烧碱溶液为混合物,既不是电解质,也不是非电解质;硫酸为电解质。
都不属于,因为电解质必须是自身能电离成自由移动离子的化合物。
不正确,因为前后没有因果关系。
错误,如单质和混合物既不是电解质也不是非电解质。
交流讨论
易错提醒:
(1)电解质和非电解质都是化合物,单质(如Cu、Fe)和混合物(如盐酸、食盐水)既不是电解质,也不是非电解质。
(2)电解质必须是自身能直接电离成自由移动离子的化合物,某些化合物如CO2溶于水可导电,但其本身不是电解质,与水反应生成的H2CO3才是电解质。
易错提醒——电解质与溶解性无关
二、电解质和非电解质的类别
电解质:_______________________________________________________。
非电解质:_____________________________________________________。
酸、碱、盐、金属氧化物、金属氢化物、水
大部分有机化合物、非金属氧化物
AgCl、BaSO4等难溶盐在水中的溶解度极小,不能导电,但这些物质在熔融状态下能导电,在水中溶解的部分也能完全电离,故属于电解质。
1. 下列关于电解质的说法不正确的是( )
A.电解质不一定能导电
B.能导电的不一定是电解质
C.NH3溶于水能导电,因此NH3是电解质
D.乙醇是非电解质,因此乙醇水溶液不能导电
C
学以致用
2. 2021年5月15日,天问一号着陆巡视器成功着陆火星,探测到火星大气由二氧化碳、氩气(Ar)、水蒸气和甲烷等组成,火星土壤中存在着大量氧化铁,上述物质中属于电解质的是( )
A.二氧化碳 B.水 C.甲烷 D.氩气
B
D
3. 下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 混合物 电解质 非电解质
A 盐酸 冰水混合物 硫酸 干冰
B 纯净水 漂白粉 氧化铝 二氧化硫
C 胆矾 碱石灰 铁 碳酸钙
D 液氯 合金 氯化铜 蔗糖
一、电离与电离方程式
1. 电离的概念:电解质在水溶液中或熔融状态下解离成自由移动离子的过程。
2. 电离方程式:用化学式和离子符号表示物质电离过程的式子。
例如:将氯化钠加入水中,在水分子的作用下,钠离子和氯离子脱离NaCl晶体表面,形成了能够自由移动的Na+和Cl-;这一过程可以用电离方程式表示为:
NaCl === Na+ + Cl-
物质的电离与导电性
3. 电离方程式的书写要点:
(1)元素守恒(等号两边的原子种类、数目相等)
(2)电荷守恒(正电荷总数=负电荷总数)
(3)电离过程中,原子团不拆开
练一练:写出下列物质的电离方程式:
(1)HCl:______________________________________________________
(2)KHCO3:__________________________________________________
(3)KHSO4(溶液):____________________________________________
(4)KHSO4(熔融):____________________________________________
HC1== H++Cl-
KHCO3 == K++
KHSO4 == K++H+ +
KHSO4 (熔融)== K++H
二、从电离的角度认识酸、碱、盐的实质
类别 实质 实例
酸 电离时产生的阳离子_________________的化合物 HCl、H2SO4
碱 电离时产生的阴离子_________________的化合物 NaOH、Ca(OH)2
盐 电离时能产生_____________________和______________的化合物 NaCl、Na2CO3、NH4HCO3
全部是H+
全部是OH-
酸根离子
三、物质的导电性问题
1. 物质导电的本质
金属单质和石墨导电靠的是自由移动的电子;电解质溶液或熔融液导电靠的是自由移动的阴、阳离子,其导电的前提是电离。
金属阳离子(或)
2.电解质导电的条件
(1)一般来说,对于NaOH、KCl等可溶性的碱和盐,在_________和
__________都可以导电;
(2)对于难溶性的碱、盐、金属氧化物,如Mg(OH)2、BaSO4、Fe2O3,因为这些物质难溶于水,所以它们只能在____________才可以导电;
(3)像HCl、H2SO4等酸只能在____________才可以导电。
水溶液
熔融状态
熔融状态
水溶液
注意:
电解质与导电性之间没有必然关系:
(1)电解质不一定都能导电:如NaCl固体、HCl气体;
(2)能导电的物质不一定是电解质:如石墨、金属单质、溶液。
学以致用
4. 下列叙述正确的是( )
A.NaCl溶液在电流作用下电离成Na+和Cl-
B.NaCl是电解质,故NaCl晶体能导电
C.氯化氢溶于水能导电,但液态氯化氢不能导电
D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多
C
5. 下列电离方程式正确的是( )
A.NaOH 电离方程式:NaOH== Na++H++O2-
B.硫酸铝的电离方程式:Al2(SO4)3== +
C.NaCl 的电离方程式:NaCl == Na++Cl-
D.硫酸电离方程式:H2SO4== 2H++
通电
D
6. 某课外活动小组根据熔融状态下的NaCl能导电,推测AlCl3在熔融状态下也能导电,可是通过实验发现熔融状态下的AlCl3不能导电,而AlCl3水溶液却能导电,据此回答下列问题。
(1)熔融状态的AlCl3不导电的原因是
。
(2)AlCl3水溶液导电的原因是 。
(3)电解质溶液导电与金属导电的原理 (填“相同”或“不相同”,若填“相同”,下一空不必填写;若填“不相同”,完成下一空),区别
是 。
熔融状态下氯化铝不发生电离,以分子的形式存在,其中不存在自由移动的离子
AlCl3在水溶液中能电离出自由移动的离子
不相同
电解质溶液导电是由于阴阳离子的定向移动,金属导电是由于自由电子的定向移动
电解质与非电解质
电解质的电离
物质的电离与导电性
物质的导电性实验探究
电解质与非电解质的定义
电解质与非电解质的类别
电离与电离方程式
从电离的角度认识酸、碱、盐的实质
物质的导电性问题
课堂小结
