2023届高考化学二轮专题复习:从教学中思考——以构建沉淀溶解平衡为例 课件26张
文档属性
| 名称 | 2023届高考化学二轮专题复习:从教学中思考——以构建沉淀溶解平衡为例 课件26张 |  | |
| 格式 | pptx | ||
| 文件大小 | 25.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-21 08:16:50 | ||
图片预览




文档简介
(共26张PPT)
从教学中思考——以构建沉淀溶解平衡为例
问题背景
现行教材对难溶物沉淀溶解平衡的研究主要集中在沉淀转化及应用两方面,教材对沉淀溶解平衡理论构建不够详实。人教版教材就是先呈现“难溶物溶解度很小,但不是绝对不溶”等事实,继而得出AgCl(s)在水中会少量溶解,由AgCl(s)、Ag+(aq)、Cl-(aq)共存体系来构建沉淀溶解平衡理论,然后通过AgCl、AgI和Ag2S沉淀转化等试管实验阐述沉淀溶解平衡的应用,由此造成学生对沉淀溶解平衡理论的构建体验不足,证据不充分、推理不严密的情况。
难溶电解质的溶解平衡教学中,首先需要构建沉淀溶解平衡理论,但更重要的是需要引导学生理解沉淀物与其他电解质反应的化学原理,这是学习本节内容的主要目的,如通过学习本节知识后,希望学生能从微观角度解释CaCO3为什么能与盐酸,能解释H2S(弱酸)与CuSO4反应得到CuS和H2SO4(强酸)的原因。为此,课题组以探讨如何去除水垢原理为真实情境,依托系列数字化可视化实验帮助学生“看到”难溶物溶解和发生反应的微观过程,通过驱动性问题的设计和证据推理,引导学生构建、应用沉淀溶解平衡理论,充分地发挥数字化实验的优势,突破《沉淀溶解平衡》教学难点。
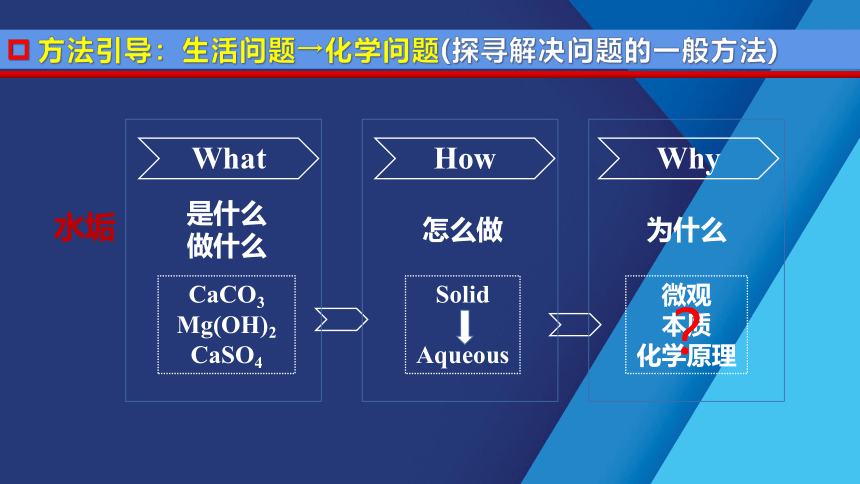
What
How
Why
CaCO3
Mg(OH)2
CaSO4
是什么做什么
怎么做
为什么
Solid
Aqueous
方法引导:生活问题→化学问题(探寻解决问题的一般方法)
微观
本质
化学原理
?
水垢
遇到困难—以除硫酸钙为驱动性任务—激发求知欲
同学家里的水壶 学校食堂的蒸箱 工厂锅炉
1.构建沉淀溶解平衡模型—以碳酸钙沉淀溶解为例
[演示实验]浓度分别为0.1mol/L的Na2CO3与CaCl2溶液混合—等体积混合—沉淀反应
[提出问题]上述反应的离子方程式是怎样的?CO32-与Ca2+能进行到底吗?如何证明?
[事实现象]物质溶解是有限度,许许多多的难溶物实际上是能溶解的?
[设计实验]如何设计实验证明CaCO3是可以溶解的?或者说如何设计实验证明CO32-与Ca2+反应是否能进行到底?
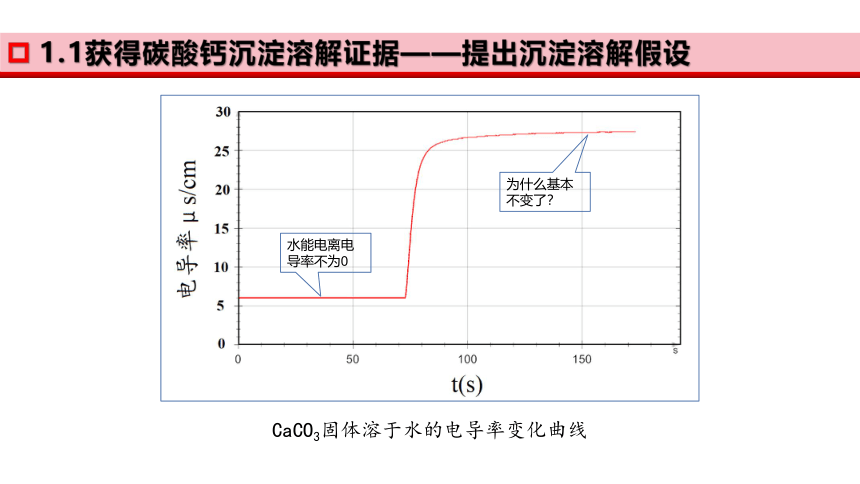
1.1获得碳酸钙沉淀溶解证据——提出沉淀溶解假设
水能电离电导率不为0
为什么基本不变了?
CaCO3固体溶于水的电导率变化曲线
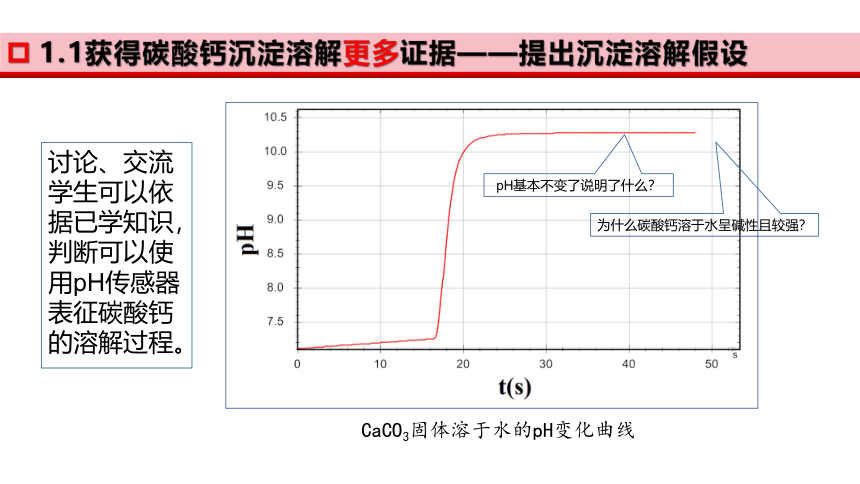
CaCO3固体溶于水的pH变化曲线
pH基本不变了说明了什么?
为什么碳酸钙溶于水呈碱性且较强?
讨论、交流学生可以依据已学知识,判断可以使用pH传感器表征碳酸钙的溶解过程。
1.1获得碳酸钙沉淀溶解更多证据——提出沉淀溶解假设
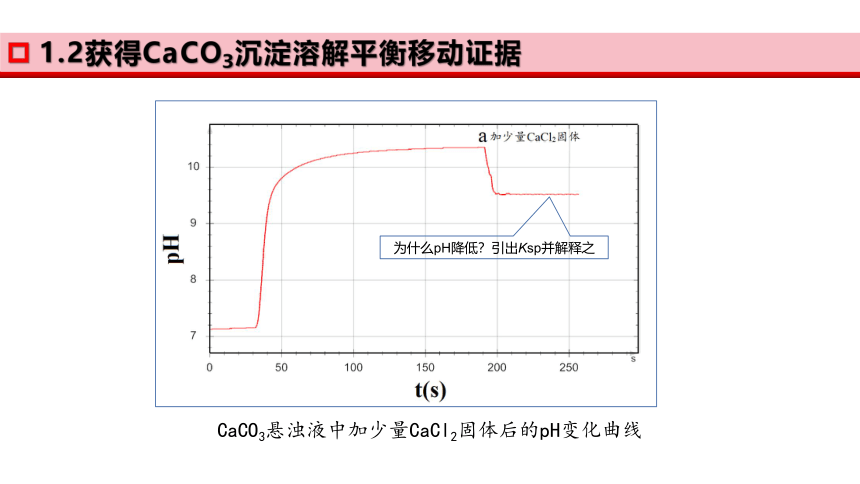
1.2获得CaCO3沉淀溶解平衡移动证据
CaCO3悬浊液中加少量CaCl2固体后的pH变化曲线
为什么pH降低?引出Ksp并解释之
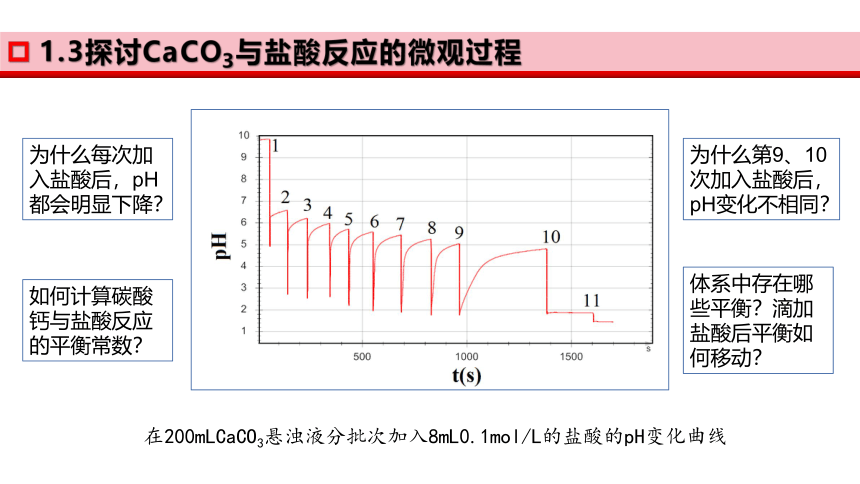
1.3探讨CaCO3与盐酸反应的微观过程
在200mLCaCO3悬浊液分批次加入8mL0.1mol/L的盐酸的pH变化曲线
为什么每次加入盐酸后,pH都会明显下降?
为什么第9、10次加入盐酸后,pH变化不相同?
如何计算碳酸钙与盐酸反应的平衡常数?
体系中存在哪些平衡?滴加盐酸后平衡如何移动?
2.1再次体验Mg(OH)2沉淀溶解建立过程
加大量蒸馏水
加MgSO4(s)
蒸馏水中加Mg(OH)2(s)
表征Mg(OH)2沉淀溶解平衡建立和平衡移动
在150mL含约0.05g的氢氧化镁的悬浊液中,分多次一次性注入0.15mol/L的盐酸,每次约2mL,体系后的pH变化曲线。
第1次
第2次
第3次
第4次
第5次
第6次
2.2探讨Mg(OH)2与盐酸反应的微观过程
加CH3COONH4固体
加FeCl3固体
2.3探索影响Mg(OH)2沉淀溶解平衡的其他因素
Mg(OH)2与乙酸铵、FeCl3溶液反应的pH变化曲线
Mg(OH)2==Mg2+(aq)+2OH-(aq)
3.1应用沉淀溶解平衡理论(如何除CaSO4)——理论计算
平衡常数理论计算,从热力学层面讨论可能性
BaSO4(s)+CO32- BaCO3(s)+SO42-......K1
3.2数字化实验证实或证伪
pH约为12.4Na2CO3浓溶液中加入适量的CaSO4固体
pH持续下降
3.2数字化实验证实或证伪
CaSO4转化为CaCO3过程中继续滴加CaCl2固体的pH变化
沉淀完全
高考链接1
[2023年1月浙江省]15.碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:CaCO3(s) Ca2+(aq)+CO32-(aq)[已知Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11],下列有关说法正确的是
A.上层清液中存在c(Ca2+)=c(CO32-)
B.上层清液中含碳微粒最主要以HCO3-形式存在
C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变
D.通过加Na2SO4溶液可实现CaCO3向CaSO4的有效转化
[解析]
将过量CaCO3粉末置于水中达到溶解平衡后存在如下平衡:
CaCO3(s) Ca2+(aq)+CO32-(aq)——I
CO32-(aq)+H2O HCO3-(aq)+OH-(aq)——II
HCO3-(aq)+H2O H2CO3(aq)+OH-(aq)——III
[认知冲突]
B.上层清液中含碳微粒最主要以HCO3-形式存在
已有认识——盐类水解程度较低——“有害”
[碳酸根离子水解率]
[碳酸根离子水解率]
图1 碳酸根离子浓度与其水解程度之间的系
乙醇钠或甲基钠水解呢?
2022年北京学业水平等级考试18题
高考链接2
容易保存
[教学启示]
同样方法可以求得Ca(OH)2与NH4Cl溶液反应的平衡常数K(2),发现K(2)比K(1)大得多,定量角度说明了“浸钙”和“浸镁”工艺的合理性,“沉镁”的化学过程的理解也一样;“浸钙”之所以不用(NH4)2SO4溶液处理显然是为了避免可能得到CaSO4沉淀;“沉钙”过程之所采用CO2得到CaCO3产品不是因为CaCl2溶液能与CO2反应,而是因为在滤液A中存在较高浓度的NH3·H2O,在氨水的协同下,通入的CO2能很好转化为CO32-,从CO32-浓度变化的视角理解反应原理。解析过程中,应淡化解题的技巧性指导,而应该引导学生写出有关离子方程式——Ca2++CO2+2NH3·H2O=CaCO3↓+2NH4++H2O,求出其平衡常数来说明“沉钙”过程的合理性,从定量视角审视化学反应,发展高价思维。
[教学启示]
[教学启示]
以上工艺的分析,主要建立在定量分析基础上,通过基础知识的熟练掌握、深层理解、融会贯通是学科能力、思维培养的必然要求,更是学科核心素养发展的基础。本题的“浸钙-沉钙”过程与课标建议素材“侯氏制碱法”工艺原理相似,实现了CO2和NH3循环利用,体现了绿色化学思想。由此可知,当使用高考题时教师应淡化解题的技巧性指导,突出解决问题的思想性与规律性,突出解决问题过程中的方法引导,在教学中从定性和定量两个维度推动学生对化学平衡的认识发展,建立基于平衡常数的知识结构和平衡观,构建基于平衡常数的平衡问题的分析的一般思路和方法,进而提高运用学科思想方法分析解决化学问题的意识和能力。
生活问题→化学问题→探寻新工具解决问题
→用新视角审视一类化学反应
抽提解决问题核心方法
从微粒和平衡角度研究新情境问题
构建难溶电解质的沉淀-溶解平衡
审视有难溶电解质参与的复分解反应本质
如解释氢硫酸为什么能与硫酸铜反应得到强酸硫酸?
[观点]
课堂教学中或许可以少做实验,但不能不呈现实验的结果!
不做实验我们就会失去发现真理的机会。
从教学中思考——以构建沉淀溶解平衡为例
问题背景
现行教材对难溶物沉淀溶解平衡的研究主要集中在沉淀转化及应用两方面,教材对沉淀溶解平衡理论构建不够详实。人教版教材就是先呈现“难溶物溶解度很小,但不是绝对不溶”等事实,继而得出AgCl(s)在水中会少量溶解,由AgCl(s)、Ag+(aq)、Cl-(aq)共存体系来构建沉淀溶解平衡理论,然后通过AgCl、AgI和Ag2S沉淀转化等试管实验阐述沉淀溶解平衡的应用,由此造成学生对沉淀溶解平衡理论的构建体验不足,证据不充分、推理不严密的情况。
难溶电解质的溶解平衡教学中,首先需要构建沉淀溶解平衡理论,但更重要的是需要引导学生理解沉淀物与其他电解质反应的化学原理,这是学习本节内容的主要目的,如通过学习本节知识后,希望学生能从微观角度解释CaCO3为什么能与盐酸,能解释H2S(弱酸)与CuSO4反应得到CuS和H2SO4(强酸)的原因。为此,课题组以探讨如何去除水垢原理为真实情境,依托系列数字化可视化实验帮助学生“看到”难溶物溶解和发生反应的微观过程,通过驱动性问题的设计和证据推理,引导学生构建、应用沉淀溶解平衡理论,充分地发挥数字化实验的优势,突破《沉淀溶解平衡》教学难点。
What
How
Why
CaCO3
Mg(OH)2
CaSO4
是什么做什么
怎么做
为什么
Solid
Aqueous
方法引导:生活问题→化学问题(探寻解决问题的一般方法)
微观
本质
化学原理
?
水垢
遇到困难—以除硫酸钙为驱动性任务—激发求知欲
同学家里的水壶 学校食堂的蒸箱 工厂锅炉
1.构建沉淀溶解平衡模型—以碳酸钙沉淀溶解为例
[演示实验]浓度分别为0.1mol/L的Na2CO3与CaCl2溶液混合—等体积混合—沉淀反应
[提出问题]上述反应的离子方程式是怎样的?CO32-与Ca2+能进行到底吗?如何证明?
[事实现象]物质溶解是有限度,许许多多的难溶物实际上是能溶解的?
[设计实验]如何设计实验证明CaCO3是可以溶解的?或者说如何设计实验证明CO32-与Ca2+反应是否能进行到底?
1.1获得碳酸钙沉淀溶解证据——提出沉淀溶解假设
水能电离电导率不为0
为什么基本不变了?
CaCO3固体溶于水的电导率变化曲线
CaCO3固体溶于水的pH变化曲线
pH基本不变了说明了什么?
为什么碳酸钙溶于水呈碱性且较强?
讨论、交流学生可以依据已学知识,判断可以使用pH传感器表征碳酸钙的溶解过程。
1.1获得碳酸钙沉淀溶解更多证据——提出沉淀溶解假设
1.2获得CaCO3沉淀溶解平衡移动证据
CaCO3悬浊液中加少量CaCl2固体后的pH变化曲线
为什么pH降低?引出Ksp并解释之
1.3探讨CaCO3与盐酸反应的微观过程
在200mLCaCO3悬浊液分批次加入8mL0.1mol/L的盐酸的pH变化曲线
为什么每次加入盐酸后,pH都会明显下降?
为什么第9、10次加入盐酸后,pH变化不相同?
如何计算碳酸钙与盐酸反应的平衡常数?
体系中存在哪些平衡?滴加盐酸后平衡如何移动?
2.1再次体验Mg(OH)2沉淀溶解建立过程
加大量蒸馏水
加MgSO4(s)
蒸馏水中加Mg(OH)2(s)
表征Mg(OH)2沉淀溶解平衡建立和平衡移动
在150mL含约0.05g的氢氧化镁的悬浊液中,分多次一次性注入0.15mol/L的盐酸,每次约2mL,体系后的pH变化曲线。
第1次
第2次
第3次
第4次
第5次
第6次
2.2探讨Mg(OH)2与盐酸反应的微观过程
加CH3COONH4固体
加FeCl3固体
2.3探索影响Mg(OH)2沉淀溶解平衡的其他因素
Mg(OH)2与乙酸铵、FeCl3溶液反应的pH变化曲线
Mg(OH)2==Mg2+(aq)+2OH-(aq)
3.1应用沉淀溶解平衡理论(如何除CaSO4)——理论计算
平衡常数理论计算,从热力学层面讨论可能性
BaSO4(s)+CO32- BaCO3(s)+SO42-......K1
3.2数字化实验证实或证伪
pH约为12.4Na2CO3浓溶液中加入适量的CaSO4固体
pH持续下降
3.2数字化实验证实或证伪
CaSO4转化为CaCO3过程中继续滴加CaCl2固体的pH变化
沉淀完全
高考链接1
[2023年1月浙江省]15.碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:CaCO3(s) Ca2+(aq)+CO32-(aq)[已知Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11],下列有关说法正确的是
A.上层清液中存在c(Ca2+)=c(CO32-)
B.上层清液中含碳微粒最主要以HCO3-形式存在
C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变
D.通过加Na2SO4溶液可实现CaCO3向CaSO4的有效转化
[解析]
将过量CaCO3粉末置于水中达到溶解平衡后存在如下平衡:
CaCO3(s) Ca2+(aq)+CO32-(aq)——I
CO32-(aq)+H2O HCO3-(aq)+OH-(aq)——II
HCO3-(aq)+H2O H2CO3(aq)+OH-(aq)——III
[认知冲突]
B.上层清液中含碳微粒最主要以HCO3-形式存在
已有认识——盐类水解程度较低——“有害”
[碳酸根离子水解率]
[碳酸根离子水解率]
图1 碳酸根离子浓度与其水解程度之间的系
乙醇钠或甲基钠水解呢?
2022年北京学业水平等级考试18题
高考链接2
容易保存
[教学启示]
同样方法可以求得Ca(OH)2与NH4Cl溶液反应的平衡常数K(2),发现K(2)比K(1)大得多,定量角度说明了“浸钙”和“浸镁”工艺的合理性,“沉镁”的化学过程的理解也一样;“浸钙”之所以不用(NH4)2SO4溶液处理显然是为了避免可能得到CaSO4沉淀;“沉钙”过程之所采用CO2得到CaCO3产品不是因为CaCl2溶液能与CO2反应,而是因为在滤液A中存在较高浓度的NH3·H2O,在氨水的协同下,通入的CO2能很好转化为CO32-,从CO32-浓度变化的视角理解反应原理。解析过程中,应淡化解题的技巧性指导,而应该引导学生写出有关离子方程式——Ca2++CO2+2NH3·H2O=CaCO3↓+2NH4++H2O,求出其平衡常数来说明“沉钙”过程的合理性,从定量视角审视化学反应,发展高价思维。
[教学启示]
[教学启示]
以上工艺的分析,主要建立在定量分析基础上,通过基础知识的熟练掌握、深层理解、融会贯通是学科能力、思维培养的必然要求,更是学科核心素养发展的基础。本题的“浸钙-沉钙”过程与课标建议素材“侯氏制碱法”工艺原理相似,实现了CO2和NH3循环利用,体现了绿色化学思想。由此可知,当使用高考题时教师应淡化解题的技巧性指导,突出解决问题的思想性与规律性,突出解决问题过程中的方法引导,在教学中从定性和定量两个维度推动学生对化学平衡的认识发展,建立基于平衡常数的知识结构和平衡观,构建基于平衡常数的平衡问题的分析的一般思路和方法,进而提高运用学科思想方法分析解决化学问题的意识和能力。
生活问题→化学问题→探寻新工具解决问题
→用新视角审视一类化学反应
抽提解决问题核心方法
从微粒和平衡角度研究新情境问题
构建难溶电解质的沉淀-溶解平衡
审视有难溶电解质参与的复分解反应本质
如解释氢硫酸为什么能与硫酸铜反应得到强酸硫酸?
[观点]
课堂教学中或许可以少做实验,但不能不呈现实验的结果!
不做实验我们就会失去发现真理的机会。
同课章节目录
