2023届高考化学二轮专题复习:化学反应速率复习课件19张
文档属性
| 名称 | 2023届高考化学二轮专题复习:化学反应速率复习课件19张 |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-21 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
化学反应速率复习
1、利用公式进行简单化学反应速率的计算
2、学会判断速率大小及掌握影响速率的因素
3、掌握化学平衡的判断方法
新课展示
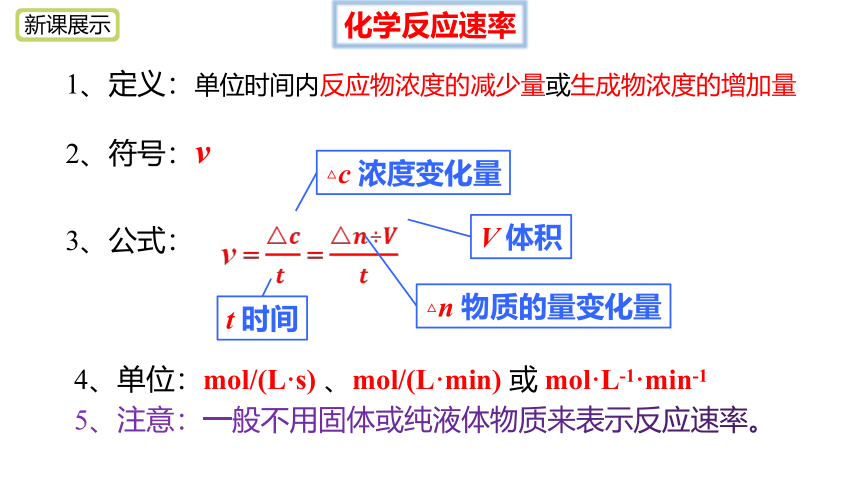
1、定义:单位时间内反应物浓度的减少量或生成物浓度的增加量
3、公式:
4、单位:mol/(L·s) 、mol/(L·min) 或 mol·L-1·min-1
2、符号:v
△c 浓度变化量
t 时间
△n 物质的量变化量
V 体积
1、某反应的反应物 A 浓度在 5 min 内由 6 mol·L-1 变成了
2 mol·L-1,则v (A)=__________________
0.8 mol·L-1·min-1
2、一个 5L 的容器中,盛入 8.0mol 某气体反应物,5min
后,测得这种气体反应物还剩余 6.8mol,这种反应物的化
学反应速率为_____________________
0.048 mol·L-1·min-1
解:
= 4 mol·L-1 ÷ 5 min = 0.8 mol·L-1·min-1
解:
1、简单化学反应速率的计算
C
2、比较化学反应速率的大小
将不同物质所表示的反应速率用同一物质来表示,再进行大小比较。
A
C
3、根据系数之比=△n之比=△c之比=速率之比 求方程式
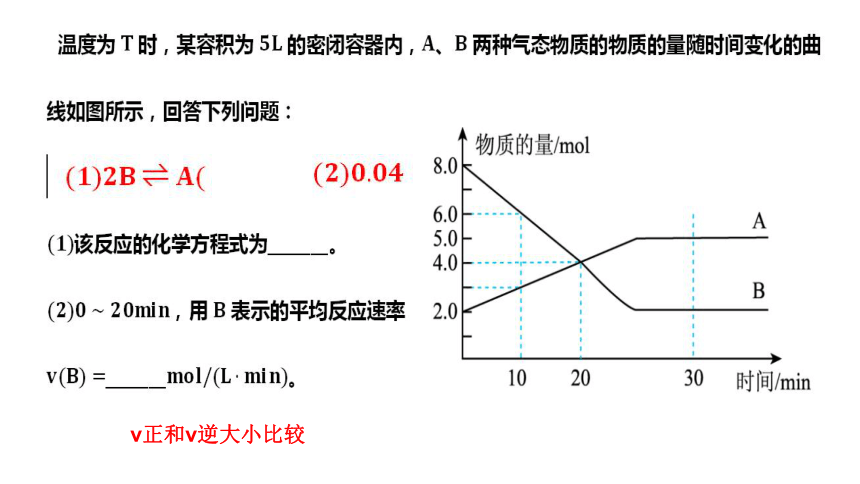
v正和v逆大小比较
4、影响化学反应速率的因素
内因
外因
反应物本身的性质,如金属活动性,是影响化学反应速率的决定性因素,不可调控
外界环境对化学反应速率的影响因素,如催化剂、温度、浓度等,可人为调控
反应物的化学性质越活泼,化学反应速率越快;反之,化学反应速率越慢
AC
5、化学平衡状态的特征
(1) 逆:研究对象是可逆反应
(2) 等:同一物质 v正 = v逆 ≠ 0
(3) 动:一种动态平衡;化学反应达到平衡时,反应并没有停止。
(4) 定:在平衡混合物中,各组成成分的含量保持不变
(5) 变:当外界条件发生改变,原来的化学平衡就会被破坏,
并在新的条件下建立新的化学平衡。
化学平衡的本质
化学平衡的标志
逆、等、动、定、变
6、化学平衡状态的判断
直接依据
① 由化学平衡本质 v正 = v逆 ,即 v生成 = v消耗 ,方向相反
等号两边同生共死,等号一边一生一死,量与系数成正比
相同时间内,生成 2mol SO3 同时消耗 1mol O2
2SO2 + O2 2SO3
催化剂
例如
相同时间内,生成 2mol SO2 同时消耗 1mol O2
相同时间内,生成 2mol SO2 同时消耗 2mol SO2
X
② 由化学平衡标志——各组成成分的含量保持不变
各组分浓度 c 不再改变
各组分物质的量 n 不再改变
各组分质量 m 不再改变
各组分百分含量不再改变,如质量分数 w 、体积分数
是各组分,不是总成分
6、化学平衡状态的判断
间接依据
① 密闭容器中总体积 V 或 总压强 P 不再改变
以 m A(g) + n B(g) p C(g) + q D(g) 为例
总成分的含量由变到不变
③ 混合气体的密度 ρ 不再改变
② 混合气体的平均相对分子质量 M 不再改变
④ 混合气体的颜色不再改变
以 m A(g) + n B(g) p C(g) + q D(g) 为例
由变到不变
⑤ 体系的温度不再改变
D
A
C
BDE
化学反应速率复习
1、利用公式进行简单化学反应速率的计算
2、学会判断速率大小及掌握影响速率的因素
3、掌握化学平衡的判断方法
新课展示
1、定义:单位时间内反应物浓度的减少量或生成物浓度的增加量
3、公式:
4、单位:mol/(L·s) 、mol/(L·min) 或 mol·L-1·min-1
2、符号:v
△c 浓度变化量
t 时间
△n 物质的量变化量
V 体积
1、某反应的反应物 A 浓度在 5 min 内由 6 mol·L-1 变成了
2 mol·L-1,则v (A)=__________________
0.8 mol·L-1·min-1
2、一个 5L 的容器中,盛入 8.0mol 某气体反应物,5min
后,测得这种气体反应物还剩余 6.8mol,这种反应物的化
学反应速率为_____________________
0.048 mol·L-1·min-1
解:
= 4 mol·L-1 ÷ 5 min = 0.8 mol·L-1·min-1
解:
1、简单化学反应速率的计算
C
2、比较化学反应速率的大小
将不同物质所表示的反应速率用同一物质来表示,再进行大小比较。
A
C
3、根据系数之比=△n之比=△c之比=速率之比 求方程式
v正和v逆大小比较
4、影响化学反应速率的因素
内因
外因
反应物本身的性质,如金属活动性,是影响化学反应速率的决定性因素,不可调控
外界环境对化学反应速率的影响因素,如催化剂、温度、浓度等,可人为调控
反应物的化学性质越活泼,化学反应速率越快;反之,化学反应速率越慢
AC
5、化学平衡状态的特征
(1) 逆:研究对象是可逆反应
(2) 等:同一物质 v正 = v逆 ≠ 0
(3) 动:一种动态平衡;化学反应达到平衡时,反应并没有停止。
(4) 定:在平衡混合物中,各组成成分的含量保持不变
(5) 变:当外界条件发生改变,原来的化学平衡就会被破坏,
并在新的条件下建立新的化学平衡。
化学平衡的本质
化学平衡的标志
逆、等、动、定、变
6、化学平衡状态的判断
直接依据
① 由化学平衡本质 v正 = v逆 ,即 v生成 = v消耗 ,方向相反
等号两边同生共死,等号一边一生一死,量与系数成正比
相同时间内,生成 2mol SO3 同时消耗 1mol O2
2SO2 + O2 2SO3
催化剂
例如
相同时间内,生成 2mol SO2 同时消耗 1mol O2
相同时间内,生成 2mol SO2 同时消耗 2mol SO2
X
② 由化学平衡标志——各组成成分的含量保持不变
各组分浓度 c 不再改变
各组分物质的量 n 不再改变
各组分质量 m 不再改变
各组分百分含量不再改变,如质量分数 w 、体积分数
是各组分,不是总成分
6、化学平衡状态的判断
间接依据
① 密闭容器中总体积 V 或 总压强 P 不再改变
以 m A(g) + n B(g) p C(g) + q D(g) 为例
总成分的含量由变到不变
③ 混合气体的密度 ρ 不再改变
② 混合气体的平均相对分子质量 M 不再改变
④ 混合气体的颜色不再改变
以 m A(g) + n B(g) p C(g) + q D(g) 为例
由变到不变
⑤ 体系的温度不再改变
D
A
C
BDE
同课章节目录
