2023届高考化学二轮专题复习:无机元素化合物复习无机小流程及无机推断课件32张
文档属性
| 名称 | 2023届高考化学二轮专题复习:无机元素化合物复习无机小流程及无机推断课件32张 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-21 08:19:31 | ||
图片预览









文档简介
(共32张PPT)
无机小流程及无机推断
无机元素化合物复习
知识重构
重温经典
模型建构
规范作答
一、无机工艺小流程背景知识
知识重构
(一)原料预处理
1.粉碎、研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快烧或浸的反应速率、浸出率。
2.灼烧、焙烧、煅烧:除去可燃性杂质、是原料初步转化,便于后续分离。
3.浸出:使矿物原料中的有用组分与杂质选择性地溶解,实现分离。
①水浸:与水接触反应或溶解,做到初步分离。
②酸浸:常用硫酸、盐酸、硝酸等,使可溶性金属离子进入溶液,不溶物通过过滤除去。
③碱浸:碱溶常用NaOH、氨水、Na2CO3溶液等,使某些元素以含氧酸跟离子或与NH3形成配离子进入溶液。
④氨浸:用氨水和铵盐溶液与原料接触,是某些金属离子进入溶液。
知识重构
(二)组分转化
1.通过加入化学试剂,借助复分解反应、氧化还原、沉淀转化、配位络合等反应。实现杂质与目标物质的分离。
2.条件控制
①控制pH:使某些金属离子形成氢氧化物沉淀,促进水解或抑制水解,调整酸碱性,转化某元素的形式等。
②控制温度:加快或降低反应(溶解)速率、影响平衡移动,促进水解使胶体转化为沉淀便于元素分离,防止试剂挥发或分解,控制物质溶解度。
知识重构
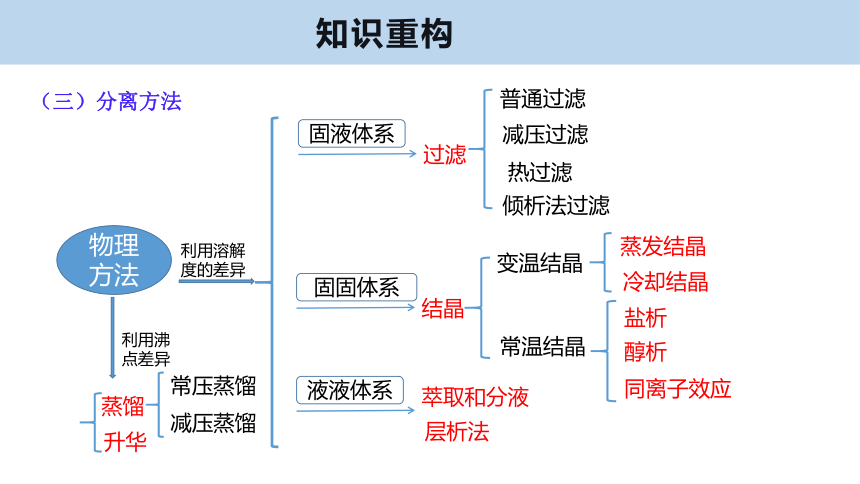
(三)分离方法
物理方法
过滤
普通过滤
减压过滤
热过滤
倾析法过滤
结晶
变温结晶
常温结晶
蒸发结晶
冷却结晶
盐析
醇析
同离子效应
利用溶解度的差异
固液体系
固固体系
液液体系
萃取和分液
层析法
利用沸点差异
蒸馏
升华
常压蒸馏
减压蒸馏
二、无机推断基础知识
知识重构
(1)有色气体:
NO2(红棕色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(紫色)、O3(淡蓝色);无色、刺激性气味的气体:SO2、NH3、HCl等。
(2)有色溶液:
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、Mn(紫红色)、溴水(橙色)、I2的四氯化碳溶液(紫色)。
常用的定性证据
(3)有色固体:
红色:Cu、Cu2O、Fe2O3
红褐色:Fe(OH)3
黄色:AgI、Ag3PO4
浅黄色:S、FeS2、Na2O2、AgBr
蓝色:Cu(OH)2
黑色固体:MnO2、C、CuO、FeO、Fe3O4 、FeS、CuS、Ag2S、PbS
紫黑色:KMnO4、I2
白色:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Al(OH)3、BaCO3、CaCO3、CaSO4、MgCO3等
1.特殊的颜色
二、无机推断基础知识
知识重构
(1)有色气体:
NO2(红棕色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(紫色)、O3(淡蓝色);无色、刺激性气味的气体:SO2、NH3、HCl等。
(2)有色溶液:
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、Mn(紫红色)、溴水(橙色)、I2的四氯化碳溶液(紫色)、Cr3+(绿色)、Cr(黄色)、Cr2(橙色)。
常用的定性证据
(3)有色固体:
红色:Cu、Cu2O、Fe2O3
红褐色:Fe(OH)3
黄色:AgI、Ag3PO4
浅黄色:S、FeS2、Na2O2、AgBr
蓝色:Cu(OH)2
黑色固体:MnO2、C、CuO、FeO、Fe3O4 、FeS、CuS、Ag2S、PbS
紫黑色:KMnO4、I2
白色:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Al(OH)3、BaCO3、CaCO3、CaSO4、MgCO3等
1.特殊的颜色
知识重构
2.特殊反应现象
(1)焰色试验:Na(黄色)、K(紫色)。
(2)使品红溶液褪色的物质:
SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。
NaClO、Ca(ClO)2等次氯酸盐,氯水,过氧化钠,过氧化氢,活性炭等。
(3)白色沉淀[Fe(OH)2] 红褐色沉淀[Fe(OH)3](由白色→灰绿→红褐色)。
(4)在空气中极易由无色变为红棕色:NO。
(5)气体燃烧火焰呈苍白色:H2在Cl2中燃烧。
在空气中点燃火焰呈蓝色:CO、H2、CH4。
(6)使湿润的红色石蕊试纸变蓝:NH3。
知识重构
2.特殊反应现象
(7)使湿润的淀粉碘化钾试纸变蓝:Cl2、Br2、FeCl3、碘水等。
(8)加碱产生白色沉淀,迅速变成灰绿色,最终变成红褐色,必有Fe2+。
(9)加苯酚显紫色或加SCN-显红色或加碱产生红褐色沉淀,必有Fe3+。
(10)遇BaCl2溶液生成不溶于硝酸的白色沉淀,可能是S、Ag+、S。
(11)遇盐酸生成沉淀,可能是S2、Ag+、Si、Al。
(12)遇硫酸生成沉淀,可能是Ba2+、Ca2+、S2、Si、Al。
知识重构
3.常见的配离子(配合物)
中心原子或离子:(有空轨道)
Fe3+、Fe2+、Cu2+、Zn2+、Cr3+、Ni2+、Cd2+等
常见配体(有孤电子对):
H2O、NH3、CO、F-、Cl-、CN-等
常见配合物:
Cu(NH3)4(OH)2、Cu(H2O)4(SO)4、Ag(NH3)2Cl2、K3Fe(CN)6、K4Fe(CN)6、NaAl(OH)4、Na3AlF6等
知识重构
常用的定量证据:
(1)放出气体的体积或生成沉淀的量。
(2)化合物中各元素的含量。
(3)气体的相对密度、相对分子质量。
(4)离子化合物中离子个数比。
(5)反应物之间的物质的量比。
(6)电子总数、质子总数等重要数据。
知识重构
重温经典
模型建构
规范作答
一、无机工艺小流程
重温经典
(2022·河北卷)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:
下列说法错误的是
A. 还原工序逸出的Br2用NaOH溶液吸收,吸收液直接返回还原工序
B. 除杂工序中产生的滤渣可用煤油进行组分分离
C. 中和工序中的化学反应为
D. 参与反应的 为1∶1∶1
【例1】
A
BaBr2+S
BaSO4
CO2
LiBr
HBr
可用Li2O、LiOH、Li2CO3吸收
引入杂质
S单质可溶于煤油等有机溶剂
Br2 + BaS=BaBr2 + S
BaBr2 + H2SO4=2HBr + BaSO4
一、无机工艺小流程
重温经典
(2022·湖南卷)铝电解厂烟气净化的一种简单流程如下:
【例2】
下列说法错误的是
A. 不宜用陶瓷作吸收塔内衬材料
B. 采用溶液喷淋法可提高吸收塔内烟气吸收效率
C. 合成槽中产物主要有 和
D.滤液可回收进入吸收塔循环利用
陶瓷中含有SiO2,HF会腐蚀陶瓷
增大气液接触面积
C
Na2CO3
NaF+NaHCO3
Na2CO3 + HF=NaF + NaHCO3
6NaF + NaAlO2+ 4NaHCO3=Na3AlF6+4Na2CO3 +2H2O
知识重构
重温经典
模型建构
规范作答
无机工艺小流程思维模型:
从物料、反应、操作三要素破解工艺流程
BaBr2+S
BaSO4
CO2
LiBr
HBr
原料
核心操作
副产品
产物
核心反应
物料变化
模型建构
(1)关注核心元素的价态变化,确定反应的类型;
(2)注意过渡金属元素形成氢氧化物沉淀、络合离子性质的差异,实现分离;
(3)从原子经济性角度思考工艺流程中物质的循环使用。
原料
核心
化学反应
加入试剂
原料循环利用
产品
产品分离提纯
原料预处理
除杂、净化
氧化还原
复分解
沉淀转化、络合反应……
模型建构
知识重构
重温经典
模型建构
规范作答
二、无机推断
重温经典
(2023年1月浙江卷)化合物X由三种元素组成,某学习小组按如下流程进行实验:
【例3】
0.005molCa--0.2g
0.01molCl--0.355g
0.64g--0.04molO
0.005molCaCO3
0.01molAgCl
CaCl2O8
定性证据
定量证据
已知:白色固体A用0.0250 mol HCl溶解后,多余的酸用0.0150 mol NaOH恰好中和
NaClO4+Na2CO3
NaCl+NaI+HI+I2
AgCl+AgI
Ag(NH3)2Cl
+
氨水
NH4NO3
+
HNO3
重温经典
(2023年1月浙江卷)化合物X由三种元素组成,某学习小组按如下流程进行实验:
【例3】
0.005molCaCO3
0.01molAgCl
Ca(ClO4)2
AgCl+AgI
Ag(NH3)2Cl
+
氨水
NaClO4+Na2CO3
NaCl+NaI+HI+I2
NH4NO3
+
HNO3
(1)X的组成元索是 ,X的化学式是 。
(2)写出B→C溶液呈棕黄色所发生的化学反应方程式 。
(3)写出生成白色固体H的离子方程式____________________________。
Ca、C1、O
Ca(ClO4)2
8HI+NaClO4==4I2+NaCl+4H2O
[Ag(NH3)2]++Cl-+2H+==AgCl↓+2NH4+
重温经典
(2023年1月浙江卷)化合物X由三种元素组成,某学习小组按如下流程进行实验:
【例3】
0.005molCaCO3
0.01molAgCl
Ca(ClO4)2
AgCl+AgI
Ag(NH3)2Cl
+
氨水
NaClO4+Na2CO3
NaCl+NaI+HI+I2
NH4NO3
+
HNO3
用玻璃棒蘸取溶液I,点在蓝色石蕊试纸上,呈红色说明溶液中有H+;取溶液于试管中,加入NaOH至碱性,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝说明有NH4+
。
(4)设计实验检验溶液I中的阳离子 。
二、无机推断
重温经典
(2022年6月浙江卷)化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
【例4】
BaBr2+S
BaSO4
CO2
LiBr
化合物X在空气中加热到800℃,不发生反应。
定量证据
定性证据
0.015molCu
0.005molBaSO4
0.01molBaSO4
0.015molCu--0.96g
0.005molBa--0.685g
0.32g--0.02molO
BaCu3O4
Cu+Ba(OH)2
NH3+N2+H2O
BaCl2
H2SO4+HCl
重温经典
(2022年6月浙江卷)化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
【例4】
BaBr2+S
BaSO4
CO2
LiBr
化合物X在空气中加热到800℃,不发生反应。
0.015molCu
0.005molBaSO4
0.01molBaSO4
BaCu3O4
请回答:
(1)组成X的三种元素为___________;X的化学式为____________。
(2)溶液C的溶质组成为______________(用化学式表示)。
Cu+Ba(OH)2
NH3+N2+H2O
BaCl2
H2SO4+HCl
BaCu3O4
Ba、Cu、O
H2SO4、HCl
过量反应物+产物
重温经典
(2022年6月浙江卷)化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
【例4】
BaBr2+S
BaSO4
CO2
LiBr
化合物X在空气中加热到800℃,不发生反应。
0.015molCu
0.005molBaSO4
0.01molBaSO4
BaCu3O4
Cu+Ba(OH)2
NH3+N2+H2O
BaCl2
H2SO4+HCl
(3)①写出由X到A的化学方程式_______。
②X难溶于水,但可溶于氨水中,写出该反应的离子方程式_______。
(4)设计实验,检验尾气中相对活泼的2种气体_______。
2NH3+BaCu3O4
Ba(OH)2+3Cu+N2+2H2O
BaCu3O4+12NH3
H2O=3Cu(NH3)
+Ba2++8OH-+8H2O
将湿润的红色石蕊试纸置尾气出口,若变蓝,说明尾气中有NH3。将尾气通入冷的集气瓶中,若有液珠,说明有H2O
近7次浙江省选考分析
考查物质 转化形式 考查元素 类别
2023.1 Ca(ClO4)2 Ca(ClO4)2 Ca,Cl,O 正盐
2022.6 BaCu3O4 BaO.3CuO Ba,Cu,O 氧化物
2022.1 FeH(SO4)2 Fe2(SO4)3.H2SO4 Fe,H,S,O 硫酸盐
2021.6 Al2CuCl8 Cu(AlCl4)2 Al,Cu,Cl 配合物
2021.1 CuS2O6 CuSO4.SO2 Cu,O,S 硫酸盐
2020.7 AlNH3Cl3 AlN.3HCl Al,N,H,Cl 氮化物
2020.1 Ca2HN CaH2.Ca3N2 Ca,N,H 氮化物/氢化物
Cl2+Na2CO3——Cl2O+……
(1)X中一种元素对应的单质,可与足量的Na2CO3溶液反应得到 Cl2O,写出该反应的化学方程式______。
+1
陌生的物质 一样的价态 熟悉的类别
Cl2O ~HClO
2HClO === Cl2O + H2O
Cl2 + H2O HCl + HClO
Na2CO3 + HCl === NaCl + NaHCO3
2 2 2 2
2 2 2 2
2Cl2+2Na2CO3+H2O===Cl2O+2NaCl+2NaHCO3
分类思想
平衡思想
量变思想
价态思想
+)
+1
关注元素价态 运用物质分类
关注元素价态 运用物质分类
(2) X与水反应的化学方程式是________。
K3ClO + H2O ——
K2O+H2O === 2KOH
KCl·K2O
+H2O === 2KOH+KCl
+KCl
KCl+
=== 2KOH+KCl
(3) 写出X(CaCl2O)与稀硫酸混合发生氧化还原反应的离子方程式是________。
Cl-+ClO-+H+==Cl2+H2O
知识重构
重温经典
模型建构
规范作答
模型建构
(2020年1月浙江卷)由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。:
【例】
是什么气体?关键的难点
是单质还是化合物?
0.04molCaCO3
NH3
NH4+
0.04mol Ca +2价 1.60g
0.02mol N -3价 0.28g
0.02mol H -1价 0.02g
定量验证
定性分析
合理猜测
质量守恒
电荷守恒
思维发散 思维收敛
大胆猜测 小心求证
非金属的氢化物?氧化物?
非金属单质H2?Cl2
文字信息
+
框图信息
提取信息
获取证据
组成结构性质
特征数据
守恒关系
基于计算结果
基于已有经验
无机工艺小流程思维模型:
定性证据
物质变化
元素组成
特征性质
特征现象
定量证据
元素比例
物质组成
模型建构
通过近年浙江和各省高考题,我们不难发现,不论是无机推断题还是工艺流程题的呈现方式比较稳定,设问也不回避常见考点,常考常新,陌生元素的出现也让我们防不胜防,同时计算难度加大,但是在落实课程要求,素养评价的主导思想不变。最终考察学生的知识迁移、运用能力,所以在平时做题训练中应更注重在高中知识的支撑下运用已具备的认知模型框架下的思维方式去解题。
高考题给我们的启示
感谢聆听!
无机小流程及无机推断
无机元素化合物复习
知识重构
重温经典
模型建构
规范作答
一、无机工艺小流程背景知识
知识重构
(一)原料预处理
1.粉碎、研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快烧或浸的反应速率、浸出率。
2.灼烧、焙烧、煅烧:除去可燃性杂质、是原料初步转化,便于后续分离。
3.浸出:使矿物原料中的有用组分与杂质选择性地溶解,实现分离。
①水浸:与水接触反应或溶解,做到初步分离。
②酸浸:常用硫酸、盐酸、硝酸等,使可溶性金属离子进入溶液,不溶物通过过滤除去。
③碱浸:碱溶常用NaOH、氨水、Na2CO3溶液等,使某些元素以含氧酸跟离子或与NH3形成配离子进入溶液。
④氨浸:用氨水和铵盐溶液与原料接触,是某些金属离子进入溶液。
知识重构
(二)组分转化
1.通过加入化学试剂,借助复分解反应、氧化还原、沉淀转化、配位络合等反应。实现杂质与目标物质的分离。
2.条件控制
①控制pH:使某些金属离子形成氢氧化物沉淀,促进水解或抑制水解,调整酸碱性,转化某元素的形式等。
②控制温度:加快或降低反应(溶解)速率、影响平衡移动,促进水解使胶体转化为沉淀便于元素分离,防止试剂挥发或分解,控制物质溶解度。
知识重构
(三)分离方法
物理方法
过滤
普通过滤
减压过滤
热过滤
倾析法过滤
结晶
变温结晶
常温结晶
蒸发结晶
冷却结晶
盐析
醇析
同离子效应
利用溶解度的差异
固液体系
固固体系
液液体系
萃取和分液
层析法
利用沸点差异
蒸馏
升华
常压蒸馏
减压蒸馏
二、无机推断基础知识
知识重构
(1)有色气体:
NO2(红棕色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(紫色)、O3(淡蓝色);无色、刺激性气味的气体:SO2、NH3、HCl等。
(2)有色溶液:
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、Mn(紫红色)、溴水(橙色)、I2的四氯化碳溶液(紫色)。
常用的定性证据
(3)有色固体:
红色:Cu、Cu2O、Fe2O3
红褐色:Fe(OH)3
黄色:AgI、Ag3PO4
浅黄色:S、FeS2、Na2O2、AgBr
蓝色:Cu(OH)2
黑色固体:MnO2、C、CuO、FeO、Fe3O4 、FeS、CuS、Ag2S、PbS
紫黑色:KMnO4、I2
白色:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Al(OH)3、BaCO3、CaCO3、CaSO4、MgCO3等
1.特殊的颜色
二、无机推断基础知识
知识重构
(1)有色气体:
NO2(红棕色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(紫色)、O3(淡蓝色);无色、刺激性气味的气体:SO2、NH3、HCl等。
(2)有色溶液:
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、Mn(紫红色)、溴水(橙色)、I2的四氯化碳溶液(紫色)、Cr3+(绿色)、Cr(黄色)、Cr2(橙色)。
常用的定性证据
(3)有色固体:
红色:Cu、Cu2O、Fe2O3
红褐色:Fe(OH)3
黄色:AgI、Ag3PO4
浅黄色:S、FeS2、Na2O2、AgBr
蓝色:Cu(OH)2
黑色固体:MnO2、C、CuO、FeO、Fe3O4 、FeS、CuS、Ag2S、PbS
紫黑色:KMnO4、I2
白色:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Al(OH)3、BaCO3、CaCO3、CaSO4、MgCO3等
1.特殊的颜色
知识重构
2.特殊反应现象
(1)焰色试验:Na(黄色)、K(紫色)。
(2)使品红溶液褪色的物质:
SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。
NaClO、Ca(ClO)2等次氯酸盐,氯水,过氧化钠,过氧化氢,活性炭等。
(3)白色沉淀[Fe(OH)2] 红褐色沉淀[Fe(OH)3](由白色→灰绿→红褐色)。
(4)在空气中极易由无色变为红棕色:NO。
(5)气体燃烧火焰呈苍白色:H2在Cl2中燃烧。
在空气中点燃火焰呈蓝色:CO、H2、CH4。
(6)使湿润的红色石蕊试纸变蓝:NH3。
知识重构
2.特殊反应现象
(7)使湿润的淀粉碘化钾试纸变蓝:Cl2、Br2、FeCl3、碘水等。
(8)加碱产生白色沉淀,迅速变成灰绿色,最终变成红褐色,必有Fe2+。
(9)加苯酚显紫色或加SCN-显红色或加碱产生红褐色沉淀,必有Fe3+。
(10)遇BaCl2溶液生成不溶于硝酸的白色沉淀,可能是S、Ag+、S。
(11)遇盐酸生成沉淀,可能是S2、Ag+、Si、Al。
(12)遇硫酸生成沉淀,可能是Ba2+、Ca2+、S2、Si、Al。
知识重构
3.常见的配离子(配合物)
中心原子或离子:(有空轨道)
Fe3+、Fe2+、Cu2+、Zn2+、Cr3+、Ni2+、Cd2+等
常见配体(有孤电子对):
H2O、NH3、CO、F-、Cl-、CN-等
常见配合物:
Cu(NH3)4(OH)2、Cu(H2O)4(SO)4、Ag(NH3)2Cl2、K3Fe(CN)6、K4Fe(CN)6、NaAl(OH)4、Na3AlF6等
知识重构
常用的定量证据:
(1)放出气体的体积或生成沉淀的量。
(2)化合物中各元素的含量。
(3)气体的相对密度、相对分子质量。
(4)离子化合物中离子个数比。
(5)反应物之间的物质的量比。
(6)电子总数、质子总数等重要数据。
知识重构
重温经典
模型建构
规范作答
一、无机工艺小流程
重温经典
(2022·河北卷)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:
下列说法错误的是
A. 还原工序逸出的Br2用NaOH溶液吸收,吸收液直接返回还原工序
B. 除杂工序中产生的滤渣可用煤油进行组分分离
C. 中和工序中的化学反应为
D. 参与反应的 为1∶1∶1
【例1】
A
BaBr2+S
BaSO4
CO2
LiBr
HBr
可用Li2O、LiOH、Li2CO3吸收
引入杂质
S单质可溶于煤油等有机溶剂
Br2 + BaS=BaBr2 + S
BaBr2 + H2SO4=2HBr + BaSO4
一、无机工艺小流程
重温经典
(2022·湖南卷)铝电解厂烟气净化的一种简单流程如下:
【例2】
下列说法错误的是
A. 不宜用陶瓷作吸收塔内衬材料
B. 采用溶液喷淋法可提高吸收塔内烟气吸收效率
C. 合成槽中产物主要有 和
D.滤液可回收进入吸收塔循环利用
陶瓷中含有SiO2,HF会腐蚀陶瓷
增大气液接触面积
C
Na2CO3
NaF+NaHCO3
Na2CO3 + HF=NaF + NaHCO3
6NaF + NaAlO2+ 4NaHCO3=Na3AlF6+4Na2CO3 +2H2O
知识重构
重温经典
模型建构
规范作答
无机工艺小流程思维模型:
从物料、反应、操作三要素破解工艺流程
BaBr2+S
BaSO4
CO2
LiBr
HBr
原料
核心操作
副产品
产物
核心反应
物料变化
模型建构
(1)关注核心元素的价态变化,确定反应的类型;
(2)注意过渡金属元素形成氢氧化物沉淀、络合离子性质的差异,实现分离;
(3)从原子经济性角度思考工艺流程中物质的循环使用。
原料
核心
化学反应
加入试剂
原料循环利用
产品
产品分离提纯
原料预处理
除杂、净化
氧化还原
复分解
沉淀转化、络合反应……
模型建构
知识重构
重温经典
模型建构
规范作答
二、无机推断
重温经典
(2023年1月浙江卷)化合物X由三种元素组成,某学习小组按如下流程进行实验:
【例3】
0.005molCa--0.2g
0.01molCl--0.355g
0.64g--0.04molO
0.005molCaCO3
0.01molAgCl
CaCl2O8
定性证据
定量证据
已知:白色固体A用0.0250 mol HCl溶解后,多余的酸用0.0150 mol NaOH恰好中和
NaClO4+Na2CO3
NaCl+NaI+HI+I2
AgCl+AgI
Ag(NH3)2Cl
+
氨水
NH4NO3
+
HNO3
重温经典
(2023年1月浙江卷)化合物X由三种元素组成,某学习小组按如下流程进行实验:
【例3】
0.005molCaCO3
0.01molAgCl
Ca(ClO4)2
AgCl+AgI
Ag(NH3)2Cl
+
氨水
NaClO4+Na2CO3
NaCl+NaI+HI+I2
NH4NO3
+
HNO3
(1)X的组成元索是 ,X的化学式是 。
(2)写出B→C溶液呈棕黄色所发生的化学反应方程式 。
(3)写出生成白色固体H的离子方程式____________________________。
Ca、C1、O
Ca(ClO4)2
8HI+NaClO4==4I2+NaCl+4H2O
[Ag(NH3)2]++Cl-+2H+==AgCl↓+2NH4+
重温经典
(2023年1月浙江卷)化合物X由三种元素组成,某学习小组按如下流程进行实验:
【例3】
0.005molCaCO3
0.01molAgCl
Ca(ClO4)2
AgCl+AgI
Ag(NH3)2Cl
+
氨水
NaClO4+Na2CO3
NaCl+NaI+HI+I2
NH4NO3
+
HNO3
用玻璃棒蘸取溶液I,点在蓝色石蕊试纸上,呈红色说明溶液中有H+;取溶液于试管中,加入NaOH至碱性,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝说明有NH4+
。
(4)设计实验检验溶液I中的阳离子 。
二、无机推断
重温经典
(2022年6月浙江卷)化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
【例4】
BaBr2+S
BaSO4
CO2
LiBr
化合物X在空气中加热到800℃,不发生反应。
定量证据
定性证据
0.015molCu
0.005molBaSO4
0.01molBaSO4
0.015molCu--0.96g
0.005molBa--0.685g
0.32g--0.02molO
BaCu3O4
Cu+Ba(OH)2
NH3+N2+H2O
BaCl2
H2SO4+HCl
重温经典
(2022年6月浙江卷)化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
【例4】
BaBr2+S
BaSO4
CO2
LiBr
化合物X在空气中加热到800℃,不发生反应。
0.015molCu
0.005molBaSO4
0.01molBaSO4
BaCu3O4
请回答:
(1)组成X的三种元素为___________;X的化学式为____________。
(2)溶液C的溶质组成为______________(用化学式表示)。
Cu+Ba(OH)2
NH3+N2+H2O
BaCl2
H2SO4+HCl
BaCu3O4
Ba、Cu、O
H2SO4、HCl
过量反应物+产物
重温经典
(2022年6月浙江卷)化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
【例4】
BaBr2+S
BaSO4
CO2
LiBr
化合物X在空气中加热到800℃,不发生反应。
0.015molCu
0.005molBaSO4
0.01molBaSO4
BaCu3O4
Cu+Ba(OH)2
NH3+N2+H2O
BaCl2
H2SO4+HCl
(3)①写出由X到A的化学方程式_______。
②X难溶于水,但可溶于氨水中,写出该反应的离子方程式_______。
(4)设计实验,检验尾气中相对活泼的2种气体_______。
2NH3+BaCu3O4
Ba(OH)2+3Cu+N2+2H2O
BaCu3O4+12NH3
H2O=3Cu(NH3)
+Ba2++8OH-+8H2O
将湿润的红色石蕊试纸置尾气出口,若变蓝,说明尾气中有NH3。将尾气通入冷的集气瓶中,若有液珠,说明有H2O
近7次浙江省选考分析
考查物质 转化形式 考查元素 类别
2023.1 Ca(ClO4)2 Ca(ClO4)2 Ca,Cl,O 正盐
2022.6 BaCu3O4 BaO.3CuO Ba,Cu,O 氧化物
2022.1 FeH(SO4)2 Fe2(SO4)3.H2SO4 Fe,H,S,O 硫酸盐
2021.6 Al2CuCl8 Cu(AlCl4)2 Al,Cu,Cl 配合物
2021.1 CuS2O6 CuSO4.SO2 Cu,O,S 硫酸盐
2020.7 AlNH3Cl3 AlN.3HCl Al,N,H,Cl 氮化物
2020.1 Ca2HN CaH2.Ca3N2 Ca,N,H 氮化物/氢化物
Cl2+Na2CO3——Cl2O+……
(1)X中一种元素对应的单质,可与足量的Na2CO3溶液反应得到 Cl2O,写出该反应的化学方程式______。
+1
陌生的物质 一样的价态 熟悉的类别
Cl2O ~HClO
2HClO === Cl2O + H2O
Cl2 + H2O HCl + HClO
Na2CO3 + HCl === NaCl + NaHCO3
2 2 2 2
2 2 2 2
2Cl2+2Na2CO3+H2O===Cl2O+2NaCl+2NaHCO3
分类思想
平衡思想
量变思想
价态思想
+)
+1
关注元素价态 运用物质分类
关注元素价态 运用物质分类
(2) X与水反应的化学方程式是________。
K3ClO + H2O ——
K2O+H2O === 2KOH
KCl·K2O
+H2O === 2KOH+KCl
+KCl
KCl+
=== 2KOH+KCl
(3) 写出X(CaCl2O)与稀硫酸混合发生氧化还原反应的离子方程式是________。
Cl-+ClO-+H+==Cl2+H2O
知识重构
重温经典
模型建构
规范作答
模型建构
(2020年1月浙江卷)由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。:
【例】
是什么气体?关键的难点
是单质还是化合物?
0.04molCaCO3
NH3
NH4+
0.04mol Ca +2价 1.60g
0.02mol N -3价 0.28g
0.02mol H -1价 0.02g
定量验证
定性分析
合理猜测
质量守恒
电荷守恒
思维发散 思维收敛
大胆猜测 小心求证
非金属的氢化物?氧化物?
非金属单质H2?Cl2
文字信息
+
框图信息
提取信息
获取证据
组成结构性质
特征数据
守恒关系
基于计算结果
基于已有经验
无机工艺小流程思维模型:
定性证据
物质变化
元素组成
特征性质
特征现象
定量证据
元素比例
物质组成
模型建构
通过近年浙江和各省高考题,我们不难发现,不论是无机推断题还是工艺流程题的呈现方式比较稳定,设问也不回避常见考点,常考常新,陌生元素的出现也让我们防不胜防,同时计算难度加大,但是在落实课程要求,素养评价的主导思想不变。最终考察学生的知识迁移、运用能力,所以在平时做题训练中应更注重在高中知识的支撑下运用已具备的认知模型框架下的思维方式去解题。
高考题给我们的启示
感谢聆听!
同课章节目录
