化学人教版(2019)必修第一册1.3.氧化还原反应(5课时 共85张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.氧化还原反应(5课时 共85张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-23 14:03:04 | ||
图片预览









文档简介
(共85张PPT)
第三节 氧化还原反应
第一章 化学物质及其变化
第一课时: 氧化还原反应的特征与本质
课程目标:
1.从发展的观点认识氧化还原反应概念,并分析判断之。
2.理解氧化还原反应与四种基本反应类型的关系,能够正确识别化合、分解、置换反应中的氧化还原反应。
铁生锈有什么现象?属于什么化学反应类型?
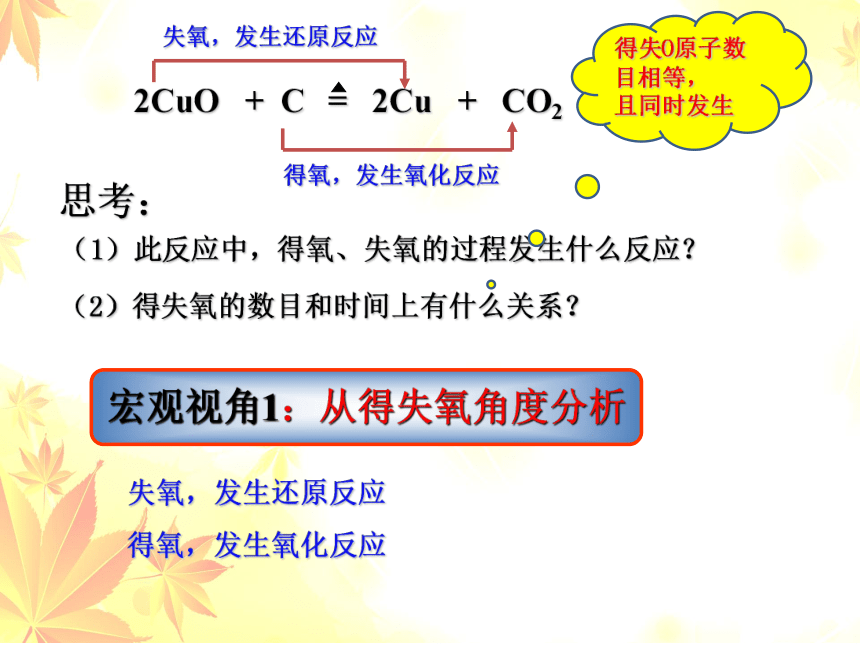
失氧,发生还原反应
得氧,发生氧化反应
2CuO + C = 2Cu + CO2
(1)此反应中,得氧、失氧的过程发生什么反应?
思考:
宏观视角1:从得失氧角度分析
得失O原子数目相等,
且同时发生
(2)得失氧的数目和时间上有什么关系?
失氧,发生还原反应
得氧,发生氧化反应
2CuO + C = 2Cu + CO2
思考:第二个反应中没有O元素参与,但它也属于氧化还原反应。你能找到两个反应的共同点吗?
宏观视角2:从化合价升降角度分析
Fe + CuSO4 == Cu + FeSO4
化合价降低,发生还原反应
化合价升高,发生氧化反应
2CuO + C = 2Cu + CO2
氧化反应 还原反应
得失氧角度
化合价升降角度
化合价降低
化合价升高
得氧
失氧
氧化还原反应的宏观特征
有元素化合价发生升降
得失氧只是氧化还原反应的特例。
有元素化合价发生升降的化学反应,
叫做氧化还原反应。
练习1:判断下列化学反应哪些是氧化还原反应:
1、Fe + CuSO4 = Cu + FeSO4
2、2FeCl2 + Cl2 = 2FeCl3
3、CuO + H2 == Cu+ H2O
4、CaCO3 + H2O + CO2 == Ca(HCO3)2
5、2CO + O2 == 2CO2
6、2Fe(OH)3 == Fe2O3 + 3H2O
7、NaCl + AgNO3 = AgCl↓ + NaNO3
思考:
氧化还原反应为何会出现元素化合价的升降?
知识回顾:原子结构示意图与离子的稳定结构(H、Na、Cl)
H原子最外层2e-最稳定,
其它原子最外层8e-最稳定,
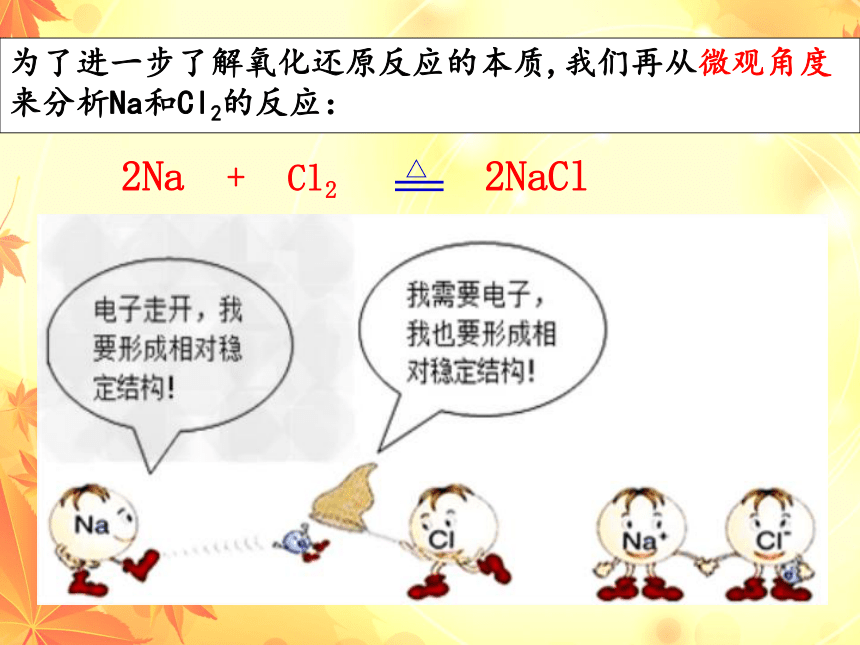
为了进一步了解氧化还原反应的本质,我们再从微观角度来分析Na和Cl2的反应:
2Na + Cl2 2NaCl
△
金属原子失去e-变成阳离子,带正电,化合价升高;
非金属原子得到e-变成阴离子,带负电,化合价降低;
结论:元素化合价升降的原因之一(NaCl型)
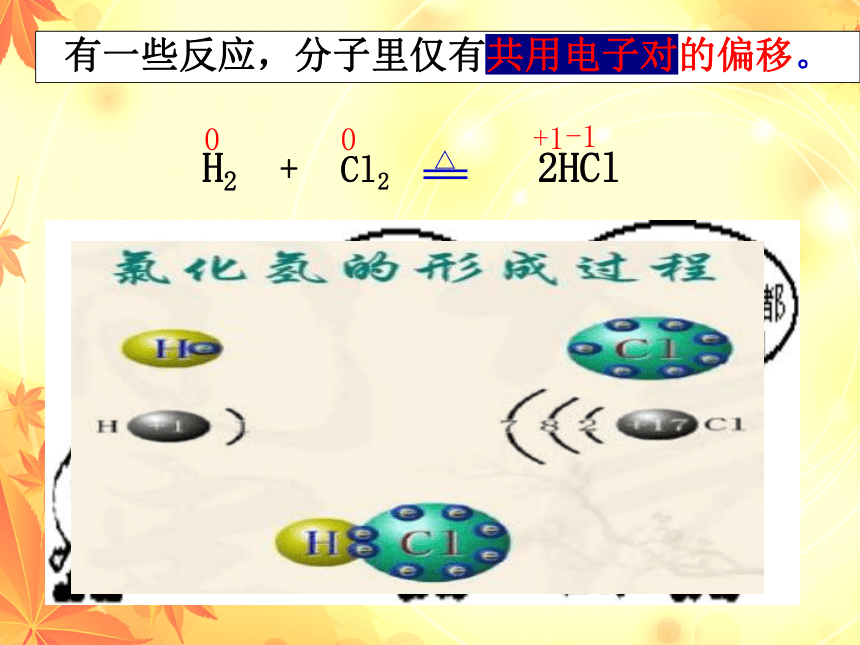
有一些反应,分子里仅有共用电子对的偏移。
H2 + Cl2 2HCl
△
0
0
+1
-1
非金属元素之间通过共用电子对形成化合物;
不同的元素吸引电子对的能力不同,导致共用电子对发生偏移;
共用电子对偏向的元素化合价降低(Cl)
共用电子对偏离的元素化合价升高(H)
结论:元素化合价升降的原因之二(HCl型)
一、氧化还原反应
宏观视角 微观角度
维度一 维度二 维度三
氧化反应
还原反应
得氧
失氧
化合价升高
化合价降低
元素失电子
元素得电子
宏观特征
有元素化合价发生升降
微观本质
有电子的转移
氧化还原反应概念的发展
弗兰克兰
1774年
1852年
1897年
二、四种基本反应与氧化还原反应的关系
举例
化学反应分类P27
练习:
1.下列反应中属于氧化还原反应,但反应类型不属于四种基本反应类型的是_____
A.Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
C.Fe2O3 + 3CO == 2Fe + 3CO2
高温
B.CuO + H2 == Cu + H2O
△
D.H2 + S == H2S
△
2、下列反应一定属于氧化还原反应的是( )
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
3、日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜铸塑像上出现铜绿[Cu2(OH)2CO3]
B.铁制菜刀生锈
C.大理石雕像被酸腐蚀毁坏 D.铝锅表面生成致密的氧化膜
思考:有单质参加或单质生成的反应一定是氧化还原反应吗?
不一定。
如:3O2 == 2O3
小结:氧化还原反应的特征与本质
宏观特征 得失“O” 特例
化合价升降 一般特征
微观本质 电子转移
第三节 氧化还原反应
第一章 化学物质及其变化
第二课时: 氧化剂和还原剂
课程目标:
1.掌握氧化还原反应的相关概念。
2.了解常见的氧化剂和还原剂
3.学会用双线桥法和单线桥法表示电子的转移。
氧化还原反应的特征和本质是什么?
要点回顾
举例说明四种基本反应类型与氧化还原反应的关系。
上述反应中CuO作 (氧化剂/还原剂),
Cu元素在反应中 电子,化合价 (升高/降低),
所以CuO在反应中被 (氧化/还原),
发生 (氧化/还原)反应,
最后生成 (氧化产物/还原产物)。
2CuO + C = 2Cu + CO2
氧化剂
降低
还原
还原
还原产物
概念辨析:用所学氧化还原知识分析问题
得
上述反应中C作 (氧化剂/还原剂),
C元素在反应中 电子化合价 (升高/降低),
所以C在反应中被 (氧化/还原),
发生 (氧化/还原)反应,
最后生成 (氧化产物/还原产物)。
还原剂
升高
氧化
氧化
氧化产物
概念辨析:用所学氧化还原知识分析问题
失
2CuO + C = 2Cu + CO2
口诀:
失(电子)、(化合价升)高、(被)氧(化)
得(电子)、(化合价降)低、(被)还 (原)
考点一:氧化还原反应的概念
氧化剂
电子
化合价
发生 反应(被 )
产物
还原剂
电子
化合价
发生 反应(被 )
产物
反应物
实质
特征
反应类型
反应产物
得
降低
还原
失
升高
氧化
还原
还原
氧化
氧化
例题1、在反应MnO2+4HCl=MnCl2+2H2O+Cl2↑中,
元素化合价升高,被 (填“氧化”或“还原”),
发生 (填“氧化”或“还原”)反应; 元素化合价
降低,被 (填“氧化”或“还原”),发生 (填
“氧化”或“还原”)反应。
氧化剂_______
还原剂_____
氧化产物________
还原产物_________
+4 -1 +2 0
氯
氧化
氧化
锰
还原
还原
MnO2
HCl
MnCl2
Cl2
考点二:常见的氧化剂
(1)典型的非金属单质如:
O2、F2、 Cl2、Br2、I2……
(2)高价态化合物:如
KMnO4、浓H2SO4、HNO3、
H2O2(绿色氧化剂)、FeCl3等。
活泼非金属单质、高价态物质
常见的还原剂
(1)金属单质如:K、Ca、Na、Mg、Al ……
(2)某些非金属单质及其低价态化合物如:
H2、C、CO、SO2、K2S、KI、FeCl2 等
活泼金属单质、低价态物质
P24 思考与讨论
练习1、下列说法正确的是( )
A.在氧化还原反应中,某元素由化合态变为游离态,该元素可能被氧化,也可能被还原
B.在氧化还原反应中,元素化合价升高的反应是还原反应
C.在氧化还原反应中,元素化合价降低的反应是氧化反应
D.化合物分解的产物中有单质,则该分解反应必属于氧化还原反应
AD
练习2、下列说法下说法正确的是( )
A、氧化剂本身被还原,生成氧化产物。
B、氧化剂是在反应中得到电子(或电子对偏向)的物质。
C、还原剂在反应时所含元素的化合价降低。
D、在一个反应中,氧化剂和还原剂可能是同一物质。
BD
思考:在氧化还原反应中一种元素被氧化,则一定有另一种元素被还原,这句话对吗?
氧化剂 、还原剂 可以为同一物质,同样,氧化产物、还原产物也可以为同一物质。如:
不对。可以是同一种元素既被氧化、又还原。
B、归中反应:Fe+2FeCl3==3FeCl2
还原产物
氧化产物
A、歧化反应:2H2O2 ==O2↑+2H2O
氧化剂
还原剂
2KMnO4 = K2MnO4 + MnO2 + O2↑
练习3:指出下列反应中哪种物质是氧化剂 、哪种物质是还原剂以及氧化产物、还原产物。
氧化产物、还原产物可能不止一种物质,同样,氧化剂 、还原剂也可能不止一种物质。如:
2KNO3+ S + 3C = K2S + 3CO2 ↑ + N2↑
1、下列各反应中,水只做氧化剂的是 ( )
A. C+ H2O ==CO+ H2 B.2H2O= 2H2↑+ O2↑
C. Na2O + H2O =2NaOH D.CuO+ H2==Cu+ H2O
2、下列反应中,Na2O2既不是氧化剂又不是还原剂的是( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.2Na2O2+2CO2=2Na2CO3+O2↑
C.2Na2O2+H2SO4=Na2SO4+H2O2
D.3Na2O2(熔融)+Fe2O3=2Na2FeO4+Na2O
小试牛刀
3:下列变化需加入氧化剂才能实现的是( )
AD
A.Zn Zn2+
B.CO2 CO
C.Fe2O3 Fe
D.CO CO2
4、下列变化过程需要加入还原剂的是( )
A. KClO3→KCl B. KCl→AgCl
C. H+→H2 D. C→CO2
C
考点三、表示电子转移的两种方法
1.双线桥法:
Cl2 + H2O = HCl + HClO
双箭号跨过等号,从反应物指向生成物,起止为同一元素。
在双箭号上注明失去或得到电子的总数,得或失两字不能省略,且得失电子总数必须相等。
注 意:
2 Na + Cl2 = 2 NaCl
2.单线桥法:
起点为失电子元素,箭头指向得电子元素。
只标转移电子总数,不标得与失。
注 意:
Cl2 + H2O = HCl + HClO
2 Na + Cl2 = 2 NaCl
失 2e-
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
得 2e-
+4
+2
-1
0
2e-
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
+4
+2
-1
0
课堂练习(调板)
用双线桥表示同种元素的电子得失。
用单线桥表示不同种元素的电子转移。
练 习
分别用双线桥和单线桥表示下列方程式的的电子转移方向和数目
2KMnO4===K2MnO4+MnO2+O2 ↑
2KClO3 === 2KCl + 3O2 ↑
△
△
4P + 5O2 === 2P2O5 ↑
点燃
2HgO === 2Hg+O2 ↑
△
第三节 氧化还原反应
第一章 化学物质及其变化
第三课时: 氧化性、还原性的强弱比较
课程目标:
1.学会从化合价的角度判断物质的氧化性与还原性
2.掌握比较氧化性、还原性强弱的方法
要点回顾:单/双线桥法
3S + 6NaOH==2Na2S + Na2SO3 + 3H2O
物质得电子的能力
物质失电子的能力。
类比:初中化学告诉我们,物质有酸碱性。高中化学告诉我们,物质除了酸碱性,还有氧化性和还原性。
氧化性:
还原性:
氧化剂有氧化性,还原剂有还原性。
最高价元素——只具氧化性
最低价元素——只具还原性
中间价元素——兼有氧化性和还原性
知识点一:价态律—判断物质性质的方法
课堂练习:指出下列物质具有的性质
Fe、H2、HCl、H2O、KMnO4、KClO3、FeCl2
规律小结:
(1)金属无负价,所以金属单质只有还原性
(2)非金属一般有正负化合价,所以非金属单质一般兼具氧化性和还原性。
(3)常见元素的价态变化(由低到高)
H(-1、0、+1)
C(-4、0、+2、+4,举例)
N(-3、0、+2、+4、+5)
O(-2、-1、0)
S(-2、0、+4、+6)
Cl(-1、0、+1、+5、+7)
最高价=最外层电子数
最低价=最外层电子式-8(O、F除外)
1、盐酸具有的化学性质是( )
A.只有还原性 B.只有酸性
C.只有氧化性 D.有酸性、氧化性、还原性
2、现有微粒:①S ②S2- ③Na+ ④Fe2+ ⑤H+ ⑥Cu ⑦HCl ⑧H2O,其中在反应中:
(1)只能作还原剂的是(填序号,下同)__________,
(2)既可作还原剂又可作氧化剂的是_________,
(3)只能作氧化剂的是_________。
4.下列叙述中正确的是 ( )
A.含最高价元素的化合物一定具有强氧化性
B.阳离子只具有氧化性,阴离子只具有还原性
C.失电子越多,还原性越强
D.强氧化剂与强还原剂之间不一定能发生氧化还原反应
氧化性、还原性的强弱取决于得失电子的难易,与得失电子的数目无关;
价态高不一定氧化性强,价态低不一定还原性强。
3.下列叙述中正确的是 ( )
A.发生化学反应时失去电子越多的金属原子,还原性越强
B.失电子能力难的原子获得电子的能力一定强。
C.金属单质只有还原性。
D.非金属单质在反应中只作为氧化剂。
C
D
知识点二:比较氧化性还原性强弱的方法
(强弱比较规律)
方法1、根据反应方程式判断(强“置换”弱)
氧化剂 + 还原剂—— 氧化产物 + 还原产物
[结论] 氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
氧化剂 、 氧化产物具有氧化性
还原剂 、 还原产物具有还原性
例题1、Fe + Cu2+ = Fe2+ + Cu
氧化剂 、 氧化产物分别是 ;
还原剂 、 还原产物分别是 ;
还原性: 氧化性:
Fe>Cu
Cu2+ >Fe2+
例题2、Cl2 + 2I- = I2 + 2Cl-
氧化剂 、 氧化产物分别是 ;
还原剂 、 还原产物分别是 。
还原性: 氧化性:
I->Cl-
Cl2 >I2
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、
方法2、根据金属活泼性顺序表判断
金属单质的还原性(失电子能力)减弱
金属阳离子的氧化性(得电子能力)增强
口诀:单强离弱、单弱离强(举例)
规律小结:
在所有的氧化还原反应中,均遵守“强置换弱”这个规则;
反应物是更强的氧化剂和还原剂,生成物是更弱的氧化剂和还原剂。
强氧化剂 + 强还原剂—— 弱氧化剂 + 弱还原剂
方法3、同种元素价态越高氧化性越强
氧化性:H2SO4 > SO2 > S
Fe3+ >Fe2+
方法4、不同的氧化剂与同一还原剂反应,根据反应产物的价态高低来判断。
Fe + S =FeS
3Fe+ 2O2 =Fe3O4
2Fe+3Cl2 =2FeCl3
氧化性:
S氧化剂
还原剂
方法5、由反应的难易比较:
①不同的氧化剂与同一还原剂反应时,
反应条件越易,其氧化性越强。
②不同的还原剂与同一氧化剂反应时,
反应条件越易,其还原性越强。
2KMnO4 + 16HCl = 2KCl + 5Cl2 ↑+ 8H2O
MnO2 + 4HCl = MnCl2 + 2H2O + Cl2 ↑
O2 + 4HCl === 2H2O + 2 Cl2 ↑
△
催化剂
氧化性:KMnO4 > MnO2 > O2
△
结语:
氧化性、还原性是高中化学中非常重要的概念。
影响物质氧化性、还原性的因素很多,比如温度、浓度、酸碱性等,我们将在后续的内容里继续学习。
强弱比较规律的应用:
1、判断微粒氧化性、还原性的相对强弱。
例如:根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
2、判断氧化还原反应能否发生。
例如:已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性强弱的顺序为Cl-A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.2Fe2++I2=2Fe3++2I-
1、已知反应:①Ni+CuSO4=NiSO4+Cu
②Cu+2AgNO3=Cu(NO3)2+2Ag,则下列判断正确的是 ( )
A.还原性Ni>Cu>Ag B.氧化性Ni2+ >Cu2+ >Ag+
C.还原性Ni2、已知:①2BrO3—+Cl2==Br2+2ClO3—
②5Cl2+I2+6H2O==2HIO3+10HCl
③ClO3—+5Cl—+6H+==3Cl2+3H2O 下列微粒氧化性强弱顺序正确的是 ( )
A. ClO3—>BrO3—>IO3—>Cl2
B. BrO3—> ClO3—>Cl2> IO3—
C. IO3—< BrO3—D. IO3—< ClO3—< BrO3—第三节 氧化还原反应
第一章 化学物质及其变化
第四课时: 氧化还原方程式的配平
配平原则
配
平
步
骤
1.标变价
2.列变化
3.求总数
4.配系数
5.细检查
例题: 配平下列化学反应方程式
Cu+ HNO3 Cu(NO3)2+ NO + H2O
练习
NH3+ O2 NO+ H2O
C+ H2SO4(浓) CO2 ↑+ SO2 +H2O
Cu+ HNO3(浓) Cu(NO3)2+ NO2 + H2O
1、 CO2+ Na2O2== Na2CO3+ O2 2、 H2S+ SO2== S↓+ H2O 3、 KOH(浓)+ Cl2== KCl+ KClO3+ H2O 4、 KClO3+ HCl== KCl+ Cl2+ H2O
第三节 氧化还原反应
第一章 化学物质及其变化
第五课时: 氧化还原反应的规律
课程目标:
初步了解氧化还原反应的基本规律及其应用,会用氧化还原思维解决常见问题。
1.下列反应转化关系(未配平)肯定不正确的是
A.S+KOH→K2SO3+K2S+H2O B.FeO+HNO3→Fe(NO3)3+H2O
C.Cu20+H2SO4→CuSO4+Cu+H2O D.NH4NO3→N2+H2O
2.重铬酸铵〔(NH4)2Cr2O7〕是一种受热易分解的盐。下列各组对重铬酸铵受热分解产物的判断符合实际的是( )
A.Cr、NH3、H2O B.Cr2O3、N2、H2O
C.Cr2O3、NH3、H2O D.CrO3、N2、H2O
规律一:升降律
氧化还原反应中化合价的升降是同时发生的,有升必有降。
应用一:判断反应是否合理
3、G、Q、X、Y、Z均为含氯化合物,我们不了解它们的化学式,但知道它们具有如下的转换关系(未配平):
① G → Q + NaCl ② Q + H2O → X + H2
③ Y + NaOH → G+ Q+H2O ④ Z + NaOH → Q + X + H2O
这五种化合物中,氯的化合价由低到高的顺序为( )
A.GYZQX B.GYQZX
C.QGZYX D.ZXGYQ
应用二:判断元素价态高低
最高价元素——只具氧化性
最低价元素——只具还原性
中间价元素——兼有氧化性和还原性
规律二:价态律—判断物质性质的方法
练习:指出下列物质具有的性质
Fe、H2、HCl、H2O、KMnO4、KClO3、FeCl2
规律三:转化律
同种元素不同价态原子间发生氧化还原反应,总是从高价态与低价态反应后转化生成中间价态的物质,即“只靠拢不交叉”。
应用2、 判断反应能否发生。若有中间价态,则可能发生氧化还原反应,若无,则不能发生。
例如:SO2与H2SO4(浓)之间,Fe2+与Fe3+之间,由于无中间价态而不能发生氧化还原反应。
应用1、 确定氧化产物和还原产物。
如:2H2S+SO2=3S+2H2O,S元素的化合价从-2价和+4价归中到0价。
应用3、“互不交叉”是指,若反应后生成多种中间价态的产物,则遵从邻近变价,互不交叉的原则。用来判断反应转移的电子数。
例如:H2S+H2SO4(浓)=S↓+SO2↑+2H2O,S元素的化合价应从-2价变化为0价,从+6价变化为+4价。而不能认为是从-2→+4价,+6→0价。
1. 一定量的KClO3中加入浓盐酸发生如下反应:KClO3+6HCl==KCl+3Cl2+3H2O,其中发生氧化反应的元素和发生还原反应的元素的质量之比为( )
A. 1:6 B. 6:1 C. 1:5 D. 5:1
2.K35ClO3晶体与H37Cl溶液反应生成氯气、氯化钾和水,此反应生成的氯气的相对分子质量为( )
A.73.3 B.73 C.74 D.70.6
规律四:强弱律
在同一个方程式中
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
规律五:先后律
同一氧化剂(或还原剂)同时与不同还原剂(或氧化剂)反应,当还原剂(或氧化剂)的浓度差别不大时,总是先与还原性(或氧化性)强的反应,然后再与弱的反应。
即谁强谁优先反应!
[讨论] 将少量铁置于等浓度的Cu(NO3)2和AgNO3的混合溶液中,先析出什么物质?
[讨论] 已知还原性:S2->I->Fe2+>Br->Cl-,将Cl2通入含S2-、I-、Fe2+、Br-的混合溶液中,先析出什么物质,最后得到什么物质?
2.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-,其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的个数与溶液中剩余的Fe2+的个数之比为(还原性I->Fe2+>Br->Cl-) ( )A.7∶1 B.7∶2
C.7∶3 D.7∶4
1.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 ( )A.烧杯中有铜无铁 B.烧杯中有铁无铜C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
规律六:守恒律(特别重要!!!)
氧化剂得电子的总数目=还原剂失电子的总数目。
这是配平氧化还原反应方程式的依据,也是有关氧化还原反应计算的依据。
K2Cr2O7+14HCl===2KCl+2CrCl3+3Cl2+7H2O反应中,______ 是氧化剂, ______是还原剂, _______元素被氧化, ______元素被还原,_______是氧化产物, ____是还原产物,电子转移总数为____,若产生6个Cl2分子,则电子转移总数为_.
K2Cr2O7
HCl
氯
铬
Cl2
CrCl3
6e-
+6
-1
+3
0
12e-
例1、一定条件下硝酸铵受热分解的化学方程式(未配平)NH4NO3—HNO3+N2+H20的反应中,被氧化与被还原的原子个数之比为( )
A、5 :3 B、5 :4
C、1 :1 D、3 :5
例2、硫酸铵在强热条件下分解,生成氨、二氧化硫、
氮气和水。反应中氧化产物和还原产物的数目之比为
A.1﹕3 B.2﹕3 C.1﹕1 D.4﹕3
1、工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的系数之比为 ( )A.1:1 B.2:1 C.1:2 D.2:3
2、用Na2SO3还原MnO4-,如果还原2个MnO4-,消耗5个Na2SO3,则锰元素在还原产物中的化合价是( )
A.+1 B.+2 C.+4 D.+5
3.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的系数之比为1︰16,则x值是( ) A.2 B.3 C.4 D.5
4.某反应可表示为:mM+nH++O2===xM2++yH2O,则x值为 ( )A.2 B.4 C.6 D.9
5. 在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为 A.1︰1︰l B.2︰2︰1
C. 2︰3︰l D.4︰3︰2
6.已知氧化还原反应: 2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O 其中1个氧化剂在反应中得到的电子为 ( )A.10 B.11 C.12 D.13
7.金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式
A.方框中的物质应为 Cu2S
B.若有1 分子SO2 生成,则反应转移4 e- 电子
C.SO2既是氧化产物又是还原产物
D.O2只作氧化剂
8.水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+xOH-==Fe3O4+S4O62-+2H2O下列说法正确的是( )
A.硫元素被氧化,铁元素被还原
B.Fe2+、S2O32-都是还原剂
C.x=2
D.每生成1mol Fe3O4,则转移电子数为3mol
9.Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中不正确的是 ( )
A.Na2O2在反应中只作氧化剂
B.2分子FeSO4发生反应时,共有10e-电子转移 C.O2是氧化产物
D.Na2FeO4既是氧化产物又是还原产物
小结: 氧化还原反应的规律
(1)升降律:判断方程式的合理性
(2)价态律:判断物质的氧化性、还原性
(4)强弱律:比较氧化性、还原性强弱
(3)转化律:判断产物及转移电子数
(5)先后律:判断反应的先后顺序
(6)守恒律:配平与计算
第三节 氧化还原反应
第一章 化学物质及其变化
第一课时: 氧化还原反应的特征与本质
课程目标:
1.从发展的观点认识氧化还原反应概念,并分析判断之。
2.理解氧化还原反应与四种基本反应类型的关系,能够正确识别化合、分解、置换反应中的氧化还原反应。
铁生锈有什么现象?属于什么化学反应类型?
失氧,发生还原反应
得氧,发生氧化反应
2CuO + C = 2Cu + CO2
(1)此反应中,得氧、失氧的过程发生什么反应?
思考:
宏观视角1:从得失氧角度分析
得失O原子数目相等,
且同时发生
(2)得失氧的数目和时间上有什么关系?
失氧,发生还原反应
得氧,发生氧化反应
2CuO + C = 2Cu + CO2
思考:第二个反应中没有O元素参与,但它也属于氧化还原反应。你能找到两个反应的共同点吗?
宏观视角2:从化合价升降角度分析
Fe + CuSO4 == Cu + FeSO4
化合价降低,发生还原反应
化合价升高,发生氧化反应
2CuO + C = 2Cu + CO2
氧化反应 还原反应
得失氧角度
化合价升降角度
化合价降低
化合价升高
得氧
失氧
氧化还原反应的宏观特征
有元素化合价发生升降
得失氧只是氧化还原反应的特例。
有元素化合价发生升降的化学反应,
叫做氧化还原反应。
练习1:判断下列化学反应哪些是氧化还原反应:
1、Fe + CuSO4 = Cu + FeSO4
2、2FeCl2 + Cl2 = 2FeCl3
3、CuO + H2 == Cu+ H2O
4、CaCO3 + H2O + CO2 == Ca(HCO3)2
5、2CO + O2 == 2CO2
6、2Fe(OH)3 == Fe2O3 + 3H2O
7、NaCl + AgNO3 = AgCl↓ + NaNO3
思考:
氧化还原反应为何会出现元素化合价的升降?
知识回顾:原子结构示意图与离子的稳定结构(H、Na、Cl)
H原子最外层2e-最稳定,
其它原子最外层8e-最稳定,
为了进一步了解氧化还原反应的本质,我们再从微观角度来分析Na和Cl2的反应:
2Na + Cl2 2NaCl
△
金属原子失去e-变成阳离子,带正电,化合价升高;
非金属原子得到e-变成阴离子,带负电,化合价降低;
结论:元素化合价升降的原因之一(NaCl型)
有一些反应,分子里仅有共用电子对的偏移。
H2 + Cl2 2HCl
△
0
0
+1
-1
非金属元素之间通过共用电子对形成化合物;
不同的元素吸引电子对的能力不同,导致共用电子对发生偏移;
共用电子对偏向的元素化合价降低(Cl)
共用电子对偏离的元素化合价升高(H)
结论:元素化合价升降的原因之二(HCl型)
一、氧化还原反应
宏观视角 微观角度
维度一 维度二 维度三
氧化反应
还原反应
得氧
失氧
化合价升高
化合价降低
元素失电子
元素得电子
宏观特征
有元素化合价发生升降
微观本质
有电子的转移
氧化还原反应概念的发展
弗兰克兰
1774年
1852年
1897年
二、四种基本反应与氧化还原反应的关系
举例
化学反应分类P27
练习:
1.下列反应中属于氧化还原反应,但反应类型不属于四种基本反应类型的是_____
A.Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
C.Fe2O3 + 3CO == 2Fe + 3CO2
高温
B.CuO + H2 == Cu + H2O
△
D.H2 + S == H2S
△
2、下列反应一定属于氧化还原反应的是( )
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
3、日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜铸塑像上出现铜绿[Cu2(OH)2CO3]
B.铁制菜刀生锈
C.大理石雕像被酸腐蚀毁坏 D.铝锅表面生成致密的氧化膜
思考:有单质参加或单质生成的反应一定是氧化还原反应吗?
不一定。
如:3O2 == 2O3
小结:氧化还原反应的特征与本质
宏观特征 得失“O” 特例
化合价升降 一般特征
微观本质 电子转移
第三节 氧化还原反应
第一章 化学物质及其变化
第二课时: 氧化剂和还原剂
课程目标:
1.掌握氧化还原反应的相关概念。
2.了解常见的氧化剂和还原剂
3.学会用双线桥法和单线桥法表示电子的转移。
氧化还原反应的特征和本质是什么?
要点回顾
举例说明四种基本反应类型与氧化还原反应的关系。
上述反应中CuO作 (氧化剂/还原剂),
Cu元素在反应中 电子,化合价 (升高/降低),
所以CuO在反应中被 (氧化/还原),
发生 (氧化/还原)反应,
最后生成 (氧化产物/还原产物)。
2CuO + C = 2Cu + CO2
氧化剂
降低
还原
还原
还原产物
概念辨析:用所学氧化还原知识分析问题
得
上述反应中C作 (氧化剂/还原剂),
C元素在反应中 电子化合价 (升高/降低),
所以C在反应中被 (氧化/还原),
发生 (氧化/还原)反应,
最后生成 (氧化产物/还原产物)。
还原剂
升高
氧化
氧化
氧化产物
概念辨析:用所学氧化还原知识分析问题
失
2CuO + C = 2Cu + CO2
口诀:
失(电子)、(化合价升)高、(被)氧(化)
得(电子)、(化合价降)低、(被)还 (原)
考点一:氧化还原反应的概念
氧化剂
电子
化合价
发生 反应(被 )
产物
还原剂
电子
化合价
发生 反应(被 )
产物
反应物
实质
特征
反应类型
反应产物
得
降低
还原
失
升高
氧化
还原
还原
氧化
氧化
例题1、在反应MnO2+4HCl=MnCl2+2H2O+Cl2↑中,
元素化合价升高,被 (填“氧化”或“还原”),
发生 (填“氧化”或“还原”)反应; 元素化合价
降低,被 (填“氧化”或“还原”),发生 (填
“氧化”或“还原”)反应。
氧化剂_______
还原剂_____
氧化产物________
还原产物_________
+4 -1 +2 0
氯
氧化
氧化
锰
还原
还原
MnO2
HCl
MnCl2
Cl2
考点二:常见的氧化剂
(1)典型的非金属单质如:
O2、F2、 Cl2、Br2、I2……
(2)高价态化合物:如
KMnO4、浓H2SO4、HNO3、
H2O2(绿色氧化剂)、FeCl3等。
活泼非金属单质、高价态物质
常见的还原剂
(1)金属单质如:K、Ca、Na、Mg、Al ……
(2)某些非金属单质及其低价态化合物如:
H2、C、CO、SO2、K2S、KI、FeCl2 等
活泼金属单质、低价态物质
P24 思考与讨论
练习1、下列说法正确的是( )
A.在氧化还原反应中,某元素由化合态变为游离态,该元素可能被氧化,也可能被还原
B.在氧化还原反应中,元素化合价升高的反应是还原反应
C.在氧化还原反应中,元素化合价降低的反应是氧化反应
D.化合物分解的产物中有单质,则该分解反应必属于氧化还原反应
AD
练习2、下列说法下说法正确的是( )
A、氧化剂本身被还原,生成氧化产物。
B、氧化剂是在反应中得到电子(或电子对偏向)的物质。
C、还原剂在反应时所含元素的化合价降低。
D、在一个反应中,氧化剂和还原剂可能是同一物质。
BD
思考:在氧化还原反应中一种元素被氧化,则一定有另一种元素被还原,这句话对吗?
氧化剂 、还原剂 可以为同一物质,同样,氧化产物、还原产物也可以为同一物质。如:
不对。可以是同一种元素既被氧化、又还原。
B、归中反应:Fe+2FeCl3==3FeCl2
还原产物
氧化产物
A、歧化反应:2H2O2 ==O2↑+2H2O
氧化剂
还原剂
2KMnO4 = K2MnO4 + MnO2 + O2↑
练习3:指出下列反应中哪种物质是氧化剂 、哪种物质是还原剂以及氧化产物、还原产物。
氧化产物、还原产物可能不止一种物质,同样,氧化剂 、还原剂也可能不止一种物质。如:
2KNO3+ S + 3C = K2S + 3CO2 ↑ + N2↑
1、下列各反应中,水只做氧化剂的是 ( )
A. C+ H2O ==CO+ H2 B.2H2O= 2H2↑+ O2↑
C. Na2O + H2O =2NaOH D.CuO+ H2==Cu+ H2O
2、下列反应中,Na2O2既不是氧化剂又不是还原剂的是( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.2Na2O2+2CO2=2Na2CO3+O2↑
C.2Na2O2+H2SO4=Na2SO4+H2O2
D.3Na2O2(熔融)+Fe2O3=2Na2FeO4+Na2O
小试牛刀
3:下列变化需加入氧化剂才能实现的是( )
AD
A.Zn Zn2+
B.CO2 CO
C.Fe2O3 Fe
D.CO CO2
4、下列变化过程需要加入还原剂的是( )
A. KClO3→KCl B. KCl→AgCl
C. H+→H2 D. C→CO2
C
考点三、表示电子转移的两种方法
1.双线桥法:
Cl2 + H2O = HCl + HClO
双箭号跨过等号,从反应物指向生成物,起止为同一元素。
在双箭号上注明失去或得到电子的总数,得或失两字不能省略,且得失电子总数必须相等。
注 意:
2 Na + Cl2 = 2 NaCl
2.单线桥法:
起点为失电子元素,箭头指向得电子元素。
只标转移电子总数,不标得与失。
注 意:
Cl2 + H2O = HCl + HClO
2 Na + Cl2 = 2 NaCl
失 2e-
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
得 2e-
+4
+2
-1
0
2e-
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
+4
+2
-1
0
课堂练习(调板)
用双线桥表示同种元素的电子得失。
用单线桥表示不同种元素的电子转移。
练 习
分别用双线桥和单线桥表示下列方程式的的电子转移方向和数目
2KMnO4===K2MnO4+MnO2+O2 ↑
2KClO3 === 2KCl + 3O2 ↑
△
△
4P + 5O2 === 2P2O5 ↑
点燃
2HgO === 2Hg+O2 ↑
△
第三节 氧化还原反应
第一章 化学物质及其变化
第三课时: 氧化性、还原性的强弱比较
课程目标:
1.学会从化合价的角度判断物质的氧化性与还原性
2.掌握比较氧化性、还原性强弱的方法
要点回顾:单/双线桥法
3S + 6NaOH==2Na2S + Na2SO3 + 3H2O
物质得电子的能力
物质失电子的能力。
类比:初中化学告诉我们,物质有酸碱性。高中化学告诉我们,物质除了酸碱性,还有氧化性和还原性。
氧化性:
还原性:
氧化剂有氧化性,还原剂有还原性。
最高价元素——只具氧化性
最低价元素——只具还原性
中间价元素——兼有氧化性和还原性
知识点一:价态律—判断物质性质的方法
课堂练习:指出下列物质具有的性质
Fe、H2、HCl、H2O、KMnO4、KClO3、FeCl2
规律小结:
(1)金属无负价,所以金属单质只有还原性
(2)非金属一般有正负化合价,所以非金属单质一般兼具氧化性和还原性。
(3)常见元素的价态变化(由低到高)
H(-1、0、+1)
C(-4、0、+2、+4,举例)
N(-3、0、+2、+4、+5)
O(-2、-1、0)
S(-2、0、+4、+6)
Cl(-1、0、+1、+5、+7)
最高价=最外层电子数
最低价=最外层电子式-8(O、F除外)
1、盐酸具有的化学性质是( )
A.只有还原性 B.只有酸性
C.只有氧化性 D.有酸性、氧化性、还原性
2、现有微粒:①S ②S2- ③Na+ ④Fe2+ ⑤H+ ⑥Cu ⑦HCl ⑧H2O,其中在反应中:
(1)只能作还原剂的是(填序号,下同)__________,
(2)既可作还原剂又可作氧化剂的是_________,
(3)只能作氧化剂的是_________。
4.下列叙述中正确的是 ( )
A.含最高价元素的化合物一定具有强氧化性
B.阳离子只具有氧化性,阴离子只具有还原性
C.失电子越多,还原性越强
D.强氧化剂与强还原剂之间不一定能发生氧化还原反应
氧化性、还原性的强弱取决于得失电子的难易,与得失电子的数目无关;
价态高不一定氧化性强,价态低不一定还原性强。
3.下列叙述中正确的是 ( )
A.发生化学反应时失去电子越多的金属原子,还原性越强
B.失电子能力难的原子获得电子的能力一定强。
C.金属单质只有还原性。
D.非金属单质在反应中只作为氧化剂。
C
D
知识点二:比较氧化性还原性强弱的方法
(强弱比较规律)
方法1、根据反应方程式判断(强“置换”弱)
氧化剂 + 还原剂—— 氧化产物 + 还原产物
[结论] 氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
氧化剂 、 氧化产物具有氧化性
还原剂 、 还原产物具有还原性
例题1、Fe + Cu2+ = Fe2+ + Cu
氧化剂 、 氧化产物分别是 ;
还原剂 、 还原产物分别是 ;
还原性: 氧化性:
Fe>Cu
Cu2+ >Fe2+
例题2、Cl2 + 2I- = I2 + 2Cl-
氧化剂 、 氧化产物分别是 ;
还原剂 、 还原产物分别是 。
还原性: 氧化性:
I->Cl-
Cl2 >I2
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、
方法2、根据金属活泼性顺序表判断
金属单质的还原性(失电子能力)减弱
金属阳离子的氧化性(得电子能力)增强
口诀:单强离弱、单弱离强(举例)
规律小结:
在所有的氧化还原反应中,均遵守“强置换弱”这个规则;
反应物是更强的氧化剂和还原剂,生成物是更弱的氧化剂和还原剂。
强氧化剂 + 强还原剂—— 弱氧化剂 + 弱还原剂
方法3、同种元素价态越高氧化性越强
氧化性:H2SO4 > SO2 > S
Fe3+ >Fe2+
方法4、不同的氧化剂与同一还原剂反应,根据反应产物的价态高低来判断。
Fe + S =FeS
3Fe+ 2O2 =Fe3O4
2Fe+3Cl2 =2FeCl3
氧化性:
S
还原剂
方法5、由反应的难易比较:
①不同的氧化剂与同一还原剂反应时,
反应条件越易,其氧化性越强。
②不同的还原剂与同一氧化剂反应时,
反应条件越易,其还原性越强。
2KMnO4 + 16HCl = 2KCl + 5Cl2 ↑+ 8H2O
MnO2 + 4HCl = MnCl2 + 2H2O + Cl2 ↑
O2 + 4HCl === 2H2O + 2 Cl2 ↑
△
催化剂
氧化性:KMnO4 > MnO2 > O2
△
结语:
氧化性、还原性是高中化学中非常重要的概念。
影响物质氧化性、还原性的因素很多,比如温度、浓度、酸碱性等,我们将在后续的内容里继续学习。
强弱比较规律的应用:
1、判断微粒氧化性、还原性的相对强弱。
例如:根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
2、判断氧化还原反应能否发生。
例如:已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性强弱的顺序为Cl-
B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.2Fe2++I2=2Fe3++2I-
1、已知反应:①Ni+CuSO4=NiSO4+Cu
②Cu+2AgNO3=Cu(NO3)2+2Ag,则下列判断正确的是 ( )
A.还原性Ni>Cu>Ag B.氧化性Ni2+ >Cu2+ >Ag+
C.还原性Ni
②5Cl2+I2+6H2O==2HIO3+10HCl
③ClO3—+5Cl—+6H+==3Cl2+3H2O 下列微粒氧化性强弱顺序正确的是 ( )
A. ClO3—>BrO3—>IO3—>Cl2
B. BrO3—> ClO3—>Cl2> IO3—
C. IO3—< BrO3—
第一章 化学物质及其变化
第四课时: 氧化还原方程式的配平
配平原则
配
平
步
骤
1.标变价
2.列变化
3.求总数
4.配系数
5.细检查
例题: 配平下列化学反应方程式
Cu+ HNO3 Cu(NO3)2+ NO + H2O
练习
NH3+ O2 NO+ H2O
C+ H2SO4(浓) CO2 ↑+ SO2 +H2O
Cu+ HNO3(浓) Cu(NO3)2+ NO2 + H2O
1、 CO2+ Na2O2== Na2CO3+ O2 2、 H2S+ SO2== S↓+ H2O 3、 KOH(浓)+ Cl2== KCl+ KClO3+ H2O 4、 KClO3+ HCl== KCl+ Cl2+ H2O
第三节 氧化还原反应
第一章 化学物质及其变化
第五课时: 氧化还原反应的规律
课程目标:
初步了解氧化还原反应的基本规律及其应用,会用氧化还原思维解决常见问题。
1.下列反应转化关系(未配平)肯定不正确的是
A.S+KOH→K2SO3+K2S+H2O B.FeO+HNO3→Fe(NO3)3+H2O
C.Cu20+H2SO4→CuSO4+Cu+H2O D.NH4NO3→N2+H2O
2.重铬酸铵〔(NH4)2Cr2O7〕是一种受热易分解的盐。下列各组对重铬酸铵受热分解产物的判断符合实际的是( )
A.Cr、NH3、H2O B.Cr2O3、N2、H2O
C.Cr2O3、NH3、H2O D.CrO3、N2、H2O
规律一:升降律
氧化还原反应中化合价的升降是同时发生的,有升必有降。
应用一:判断反应是否合理
3、G、Q、X、Y、Z均为含氯化合物,我们不了解它们的化学式,但知道它们具有如下的转换关系(未配平):
① G → Q + NaCl ② Q + H2O → X + H2
③ Y + NaOH → G+ Q+H2O ④ Z + NaOH → Q + X + H2O
这五种化合物中,氯的化合价由低到高的顺序为( )
A.GYZQX B.GYQZX
C.QGZYX D.ZXGYQ
应用二:判断元素价态高低
最高价元素——只具氧化性
最低价元素——只具还原性
中间价元素——兼有氧化性和还原性
规律二:价态律—判断物质性质的方法
练习:指出下列物质具有的性质
Fe、H2、HCl、H2O、KMnO4、KClO3、FeCl2
规律三:转化律
同种元素不同价态原子间发生氧化还原反应,总是从高价态与低价态反应后转化生成中间价态的物质,即“只靠拢不交叉”。
应用2、 判断反应能否发生。若有中间价态,则可能发生氧化还原反应,若无,则不能发生。
例如:SO2与H2SO4(浓)之间,Fe2+与Fe3+之间,由于无中间价态而不能发生氧化还原反应。
应用1、 确定氧化产物和还原产物。
如:2H2S+SO2=3S+2H2O,S元素的化合价从-2价和+4价归中到0价。
应用3、“互不交叉”是指,若反应后生成多种中间价态的产物,则遵从邻近变价,互不交叉的原则。用来判断反应转移的电子数。
例如:H2S+H2SO4(浓)=S↓+SO2↑+2H2O,S元素的化合价应从-2价变化为0价,从+6价变化为+4价。而不能认为是从-2→+4价,+6→0价。
1. 一定量的KClO3中加入浓盐酸发生如下反应:KClO3+6HCl==KCl+3Cl2+3H2O,其中发生氧化反应的元素和发生还原反应的元素的质量之比为( )
A. 1:6 B. 6:1 C. 1:5 D. 5:1
2.K35ClO3晶体与H37Cl溶液反应生成氯气、氯化钾和水,此反应生成的氯气的相对分子质量为( )
A.73.3 B.73 C.74 D.70.6
规律四:强弱律
在同一个方程式中
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
规律五:先后律
同一氧化剂(或还原剂)同时与不同还原剂(或氧化剂)反应,当还原剂(或氧化剂)的浓度差别不大时,总是先与还原性(或氧化性)强的反应,然后再与弱的反应。
即谁强谁优先反应!
[讨论] 将少量铁置于等浓度的Cu(NO3)2和AgNO3的混合溶液中,先析出什么物质?
[讨论] 已知还原性:S2->I->Fe2+>Br->Cl-,将Cl2通入含S2-、I-、Fe2+、Br-的混合溶液中,先析出什么物质,最后得到什么物质?
2.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-,其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的个数与溶液中剩余的Fe2+的个数之比为(还原性I->Fe2+>Br->Cl-) ( )A.7∶1 B.7∶2
C.7∶3 D.7∶4
1.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 ( )A.烧杯中有铜无铁 B.烧杯中有铁无铜C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
规律六:守恒律(特别重要!!!)
氧化剂得电子的总数目=还原剂失电子的总数目。
这是配平氧化还原反应方程式的依据,也是有关氧化还原反应计算的依据。
K2Cr2O7+14HCl===2KCl+2CrCl3+3Cl2+7H2O反应中,______ 是氧化剂, ______是还原剂, _______元素被氧化, ______元素被还原,_______是氧化产物, ____是还原产物,电子转移总数为____,若产生6个Cl2分子,则电子转移总数为_.
K2Cr2O7
HCl
氯
铬
Cl2
CrCl3
6e-
+6
-1
+3
0
12e-
例1、一定条件下硝酸铵受热分解的化学方程式(未配平)NH4NO3—HNO3+N2+H20的反应中,被氧化与被还原的原子个数之比为( )
A、5 :3 B、5 :4
C、1 :1 D、3 :5
例2、硫酸铵在强热条件下分解,生成氨、二氧化硫、
氮气和水。反应中氧化产物和还原产物的数目之比为
A.1﹕3 B.2﹕3 C.1﹕1 D.4﹕3
1、工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的系数之比为 ( )A.1:1 B.2:1 C.1:2 D.2:3
2、用Na2SO3还原MnO4-,如果还原2个MnO4-,消耗5个Na2SO3,则锰元素在还原产物中的化合价是( )
A.+1 B.+2 C.+4 D.+5
3.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的系数之比为1︰16,则x值是( ) A.2 B.3 C.4 D.5
4.某反应可表示为:mM+nH++O2===xM2++yH2O,则x值为 ( )A.2 B.4 C.6 D.9
5. 在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为 A.1︰1︰l B.2︰2︰1
C. 2︰3︰l D.4︰3︰2
6.已知氧化还原反应: 2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O 其中1个氧化剂在反应中得到的电子为 ( )A.10 B.11 C.12 D.13
7.金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式
A.方框中的物质应为 Cu2S
B.若有1 分子SO2 生成,则反应转移4 e- 电子
C.SO2既是氧化产物又是还原产物
D.O2只作氧化剂
8.水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+xOH-==Fe3O4+S4O62-+2H2O下列说法正确的是( )
A.硫元素被氧化,铁元素被还原
B.Fe2+、S2O32-都是还原剂
C.x=2
D.每生成1mol Fe3O4,则转移电子数为3mol
9.Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中不正确的是 ( )
A.Na2O2在反应中只作氧化剂
B.2分子FeSO4发生反应时,共有10e-电子转移 C.O2是氧化产物
D.Na2FeO4既是氧化产物又是还原产物
小结: 氧化还原反应的规律
(1)升降律:判断方程式的合理性
(2)价态律:判断物质的氧化性、还原性
(4)强弱律:比较氧化性、还原性强弱
(3)转化律:判断产物及转移电子数
(5)先后律:判断反应的先后顺序
(6)守恒律:配平与计算
