5.2.1 氮气与氮的固定、一氧化氮和二氧化氮 课件(共103张PPT) -高中化学 人教版(2019) 必修二
文档属性
| 名称 | 5.2.1 氮气与氮的固定、一氧化氮和二氧化氮 课件(共103张PPT) -高中化学 人教版(2019) 必修二 |
|
|
| 格式 | pptx | ||
| 文件大小 | 24.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-23 14:09:28 | ||
图片预览











文档简介
(共103张PPT)
第五章
化工生产中的重要非金属元素
第二节
氮及其化合物
第1课时
氮气与氮的固定、一氧化氮和二氧化氮
[明确学习目标]
1.了解氮气的性质及固氮方法。
2.认识一氧化氮、二氧化氮的性质,熟知氮的氧化物溶于水反应的化学方程式。
[核心素养对接]
1.通过NO、NO2、O2溶于水的简单计算的学习培养学生证据推理与模型认知水平。
2.通过学习氮的循环,让学生理解变化观念与平衡思想。
课前篇
·
自主学习固基础
一、氮气与氮的固定
[知识梳理]
1.氮的循环
(1)自然界
①豆科植物根部的根瘤菌,把氮气转变为氨等含氮的化合物。
②在放电条件下,空气中N2与氧气化合为氮的氧化物,并随降雨进入水体和土壤中。
③微生物分解动植物中的蛋白质生成小分子的含氮化合物,回到水体和土壤中。
(2)人类活动
①将空气中N2合成氨,再进一步转化为其他含氮化合物,进入水体和土壤中。
②化石燃料燃烧、森林和农作物的枝叶燃烧所产生的氮氧化物通过大气进入陆地和海洋。
2.氮气的物理性质
颜色 密度 气味 溶解性
______ 比空气______ ______ ____________
无色
小
无味
难溶于水
3.氮气的化学性质
(1) N2与Mg反应:___________________________________;
(2) N2与O2反应:___________________________________;
(3) N2与H2的反应:__________________________________。
N2+3Mg ===== Mg3N2
点燃
N2+O2 ========= 2NO
放电或高温
N2+3H2 ========= 2NH3
高温、高压
催化剂
4.氮的固定
(1)定义:将大气中________的氮转化为____________的过程。
(2)类别
游离态
氮的化合物
雷电
N2+O2===== 2NO
放电
N2+3H2 ======= 2NH3
高温、高压
催化剂
二、一氧化氮与二氧化氮
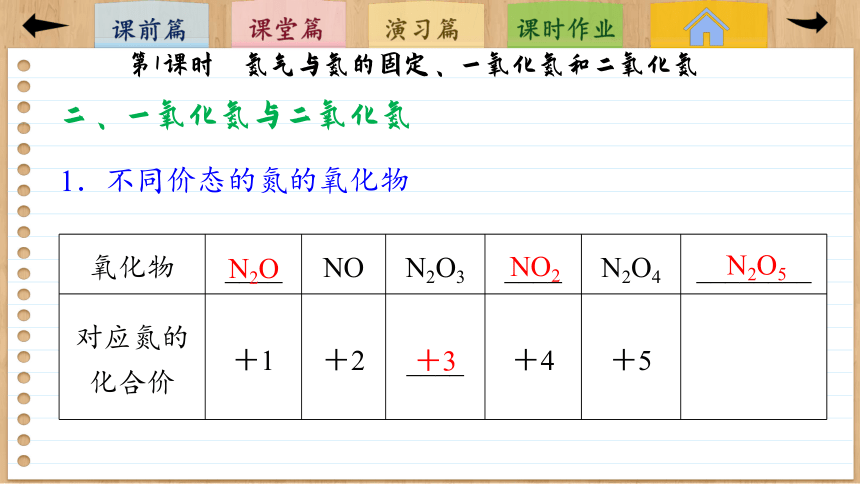
1.不同价态的氮的氧化物
氧化物 ____ NO N2O3 ____ N2O4 ________
对应氮的化合价 +1 +2 ____ +4 +5
N2O
NO2
N2O5
+3
2. NO和NO2
(1) 物理性质
NO NO2
颜色 ________色 ________色
状态 气态 气态
气味 ________ ________气味
毒性 ________ ________
水溶性 ________溶 ________溶
无
红棕
无味
刺激性
有毒
有毒
不
易
(2) 相互转化
① NO→NO2:2NO+O2===2NO2
② NO2→NO:3NO2+H2O===2HNO3+NO
③ 2NO2 → N2O4
[特别提醒]
(1)实验室里收集NO气体是用排水集气法而不能用排空气法。
(2)检验NO气体的方法是向气体中通入O2(或空气),气体由无色变为红棕色。
[自我排查]
(1)空气中N2的体积分数约为78%( )
(2)N2在高温条件下与O2发生燃烧反应生成NO( )
(3)NO在空气中易转化为红棕色NO2( )
(4)NO2与H2O的反应,NO2只作氧化剂( )
一、微判断
二、尝试解答
1.实验室能否用排空气法收集NO气体?能否用排水法收集NO2?为什么?
__________________________________________________________________________________________________________________________________________________________________
提示:不能。NO与空气的密度十分接近且易与空气中的O2反应,故不能用排空气法收集,一般用排水法收集;NO2易与H2O发生反应,故不能用排水法收集,一般用向上排空气法收集。
2.如何除去NO气体中混有的少量NO2气体杂质?
____________________________________________________________________________________________________________________________________________________________________________________
提示:根据NO2与H2O反应能生成NO,既能除去NO2杂质,又不引入其他杂质,故可将混合气体通入盛有水的洗气瓶,然后重新收集气体。
三、微训练
1.下列关于N2的说法错误的是( )
A.通常情况下N2性质很稳定,所以N2可在电焊时作保护气
B.反应N2+O2====2NO是汽车尾气造成污染的主要原因之一
C.N2的质量约占空气总质量的
D.在反应3Mg+N2=====Mg3N2中,N2作氧化剂
C
高温
点燃
解析:N2在空气中的体积含量约为,C项错误。
2.下列关于一氧化氮的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,只能用向上排空气法收集
C
解析:NO是无色气体,不溶于水,可由N2与O2直接化合而得到,且易与空气中的氧气直接反应生成NO2,故只有C项符合题意。
3.如图表示自然界中的氮循环,下列说法正确的是( )。
A.雷电作用中发生的反应是N2+2O2=====2NO2
B.人工固氮过程中,氮元素一定被还原
C.①中涉及的反应可能有:2NO2-+O2===2NO3-
D.②中涉及的反应可能有:2NO3-+12H+ === N2↑+6H2O
高温
解析:大气中的N2和O2在雷电作用下发生反应生成NO,化学方程式为N2+O2=====2NO,A错误;人工固氮可生成氨或铵盐,也可生成硝酸盐,而生成硝酸盐的过程中,氮元素被氧化,B错误;过程①中亚硝酸盐转化为硝酸盐,NO2-被氧化成NO3-,离子方程式为2NO2-+O2===2NO3-,C正确;过程②中硝酸盐被细菌分解,题图中未指明细菌提供酸性条件且所给离子方程式电荷不守恒,D错误。
放电
4.宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红色物质,产生红色的原因是( )
A.高温下N2遇空气生成NO2
B.NO与空气反应生成NO2
C.CO2遇NO反应生成NO2
D.NO遇H2O反应生成NO2
B
解析:根据原高温气体均为无色,但在卫星发射现场却能看到红色物质可推知,是因为发生反应:2NO+O2===2NO2。
课堂篇
·
重点难点要突破
研习 氮的氧化物的性质
[重点讲解]
1.NO和NO2性质的比较
化学反应
化学反应
(1) 氮的氧化物中属于酸性氧化物的只有N2O3、N2O5;N2O、NO、NO2、N2O4都是不成盐氧化物,不是酸性氧化物。
(2)NO易与O2反应、不溶于水、不与水反应,因此收集NO用排水法,不可用排空气法。NO2易与水反应,但很难被O2氧化,因此收集NO2,用向上排空气法,不可用排水法。
(3)NO2和N2O4是两种不同的氧化物,通常情况下,NO2能进行自身二聚:2NO2(红棕色)====N2O4(无色),故NO2中总混有N2O4。
2.氮的氧化物溶于水的计算
(1) 相关反应原理
3NO2+H2O===2HNO3+NO①
2NO+O2===2NO2②
由方程式①×2+②得:4NO2+O2+2H2O===4HNO3③
由方程式①×2+②×3得:4NO+3O2+2H2O===4HNO3④
(2) 氮的氧化物溶于水的三种类型
Ⅰ.NO2气体:NO2气体溶于水时仅涉及反应①,剩余气体为NO。
Ⅱ.NO2和O2的混合气体:NO2和O2的混合气体溶于水时涉及反应③:
x= 0
反应情况 O2过量,剩余气体为O2 恰好完全反应,无气体剩余 NO2过量,又发生反应①,只剩余NO
Ⅲ.NO和O2的混合气体:NO、O2的混合气体溶于水时涉及反应④:
x= 0
反应情况 O2过量,剩余O2 恰好完全反应,无气体剩余 NO过量,剩余NO
[探究活动]
[实验] 探究二氧化氮与水的反应
实验装置
实验操作 实验现象 实验结论
如图所示,在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 无明显现象 NO不溶于水
实验操作 实验现象 实验结论
打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹 注射器中气体由无色变为红棕色,注射器塞子向左移动 NO与空气中的O2发生反应生成红棕色的NO2
振荡注射器 注射器中气体由红棕色变为无色,注射器塞子继续向左移动 NO2与水发生反应
[问题探讨]
1.上述实验过程中发生了哪些化学反应?从氧化还原反应的角度分析,上述反应中NO和NO2的作用是什么?(氧化剂或还原剂)
提示:NO与O2发生反应:2NO+O2===2NO2,NO是还原剂,NO2与水发生反应:3NO2+H2O===2HNO3+ NO,NO2既是氧化剂,又是还原剂。
2.若将注射器中的NO充分转化,应采取何种措施?写出转化过程的总反应化学方程式。
提示:充入足量空气(或O2),可把注射器中的NO完全转化。
化学方程式:①2NO+O2===2NO2
②3NO2+H2O===2HNO3+NO
由①×3+②×2得总化学方程式:
4NO+3O2+2H2O===4HNO3。
3.NO2是酸性氧化物吗?工业生产硝酸时,能否将NO2完全转化为硝酸?写出转化过程的总反应化学方程式
提示:NO2不属于酸性氧化物,原因是NO2与水反应生成HNO3和NO,NO2与HNO3中氮元素的化合价不同,因此NO2不是HNO3对应的酸性氧化物。工业生产硝酸时,通入过量O2,可以把NO2完全转化为HNO3。
化学方程式:3NO2+H2O===2HNO3+NO①
2NO+O2===2NO2②
由①×2+②得总化学方程式:4NO2+O2+2H2O===4HNO3。
4.如何设计实验检验某气体是NO
提示:向盛有无色气体的容器中通入空气(或O2),气体由无色变为红棕色,说明该气体是NO。
[举一反三]
1.(双选)对于反应3NO2+H2O===2HNO3+NO,下列说法正确的是( )
A.氧化剂与还原剂的质量比为1∶2
B.氧化产物与还原产物的物质的量之比为1∶2
C.NO2是氧化剂,H2O是还原剂
D.在反应中若有6 mol NO2参与反应时,有4 mol电子发生转移
AD
解析: ,反应中氧化剂(NO2)与还原剂(NO2)的物质的量之比为1∶2,即质量比为1∶2,A正确;反应中氧化产物(HNO3)与还原产物(NO)的物质的量之比为2∶1,B错误;反应中NO2既是氧化剂又是还原剂,而水既不是氧化剂又不是还原剂,C错误;反应中若有6 mol NO2参加反应时,有4 mol电子发生转移,D正确。
2.下列关于NO和NO2的说法正确的是( )
A.NO2是红棕色气体,易溶于水,属于酸性氧化物
B.NO2可由N2和O2直接化合得到
C.NO和NO2均既可以用排空气法收集又可以用排水法收集
D.NO和NO2在一定条件下可以相互转化
D
解析:NO2不是酸性氧化物,A项错误;在高温或放电条件下,N2和O2直接化合生成NO,NO与O2反应生成NO2,B项错误;NO易与空气中的氧气反应生成NO2,只能用排水法收集,NO2能与水反应,只能用排空气法收集,C项错误;NO和O2反应生成NO2,NO2与H2O反应生成HNO3和NO,D项正确。
3.如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,对原试管中盛装气体的说法正确的是( )
①可能是N2与NO2的混合气体 ②可能是NO2气体
③可能是NO与NO2的混合气体
④只可能是NO2一种气体
A.①② B.②③ C.③④ D.①④
B
解析:因是红棕色气体,那么一定有二氧化氮的存在,二氧化氮与水反应后生成一氧化氮,所以水没有充满试管,继续通入氧气,最终水充满试管,则①肯定错误;③中通入足量的氧气,NO也可以全部被吸收。
4.在一定温度和压强下,将一容积为15 mL的试管充满NO2后,倒置于一个盛有水的水槽中。当试管内液面上升至一定高度不再变化时,在相同条件下再通入O2,若要使试管内液面仍保持在原高度,则通入O2的体积为( )
A.3.75 mL B.7.5 mL
C.8.75 mL D.10.5 mL
C
解析:解析:15 mL NO2与水反应后生成5 mL NO,根据反应4NO+3O2+2H2O===4HNO3,使5 mL NO完全被氧化需O2体积为 5mL×=3.75 mL。根据题意,通入的O2应剩余5 mL,则共需通入O2 8.75 mL。
演习篇
·
学业测试速达标
1.将盛有30 mL NO和NO2混合气体的试管倒置于放满水的水槽中,最后试管中气体的体积是20 mL,则原混合气体中NO的体积是( )
A.24 mL B.15 mL
C.18 mL D.12 mL
B
解析:NO2与水反应3NO2+H2O===2HNO3+NO,设原混合气体中NO与NO2的体积分别为x、y,则据题意,剩余气体体积20 mL是原NO气体与上述反应生成的NO气体的总体积,列方程即可得NO和NO2体积都是15 mL。
2.在NO2被水吸收的反应中,发生还原反应的物质和发生氧化反应的物质的物质的量之比为( )
A.3∶1 B.1∶3 C.1∶2 D.2∶1
C
解析:3NO2+H2O===2HNO3+NO,3 mol NO2中,有2 mol氮原子的价态升高,1 mol氮原子的价态降低,所以发生还原反应的NO2与发生氧化反应的NO2的物质的量之比为1∶2。
3.下列物质的转化必须加入氧化剂且通过一步反应就能完成的是( )
① N2→NO2 ② NO2→NO
③ NO2→HNO3 ④ N2→NO
⑤ N2→NH3
A.① B.②⑤ C.④ D.③④
C
解析:该题有两个要求:(1)必须加入氧化剂;(2)通过一步反应就能完成。反应①、③、④从化合价角度来看都是升高,但反应①N2→NO2不能通过一步反应完成;而反应③NO2→HNO3虽然氮的化合价升高,但不加氧化剂也能完成,如3NO2+H2O===2HNO3+NO,在该反应中,NO2既是氧化剂又是还原剂;只有反应④N2→NO必须加入氧化剂且通过一步反应就能完成。
4.(双选)下列关于NO和NO2的叙述正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的物质的量相等
D.NO2不能用排水法收集,NO不能用排空气法收集
CD
解析:解答本题要抓住NO易被氧化,NO2易与水反应。NO是无色气体,常温常压下,易与空气中的氧气直接化合生成NO2。NO2能与水反应,故不能用排水法收集,NO与O2反应并且密度与空气接近,不能用排空气法收集。
5.利用如图所示装置收集以下7种气体(图中烧瓶的位置不得变化)。
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3
⑥NO ⑦SO2
(1) 若烧瓶是干燥的,则由B口进气收集的
气体有_____________(写序号,下同)。
②④⑦
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3
⑥NO ⑦SO2
(2)若烧瓶充满水,可收集的气体有________,这时气体由________口进入。
(3)若烧瓶是干燥的,则由A口进气,可收集的气体有________。
①③⑥
A
①③⑤
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3
⑥NO ⑦SO2
(4)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有_______________,这时气体由________口进入。
①②③④⑥⑦
B
课时作业(四)
氮气与氮的固定、一氧化氮和二氧化氮
A篇·知识对点训练
1.关于氮气的性质的说法中,错误的是( )
A.氮在自然界中既以游离态存在又以化合态存在
B.通常情况下,氮气性质很不活泼
C.可在氧气中燃烧生成一氧化氮
D.在反应3Mg+N2=====Mg3N2中N2作氧化剂
C
点燃
解析:通常情况下氮气的性质很不活泼,不具有可燃性,在放电或高温条件下,能跟氧气反应。
2.下列关于自然界中氮循环(如下图)的说法不正确的是( )
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参加了氮循环
A
解析:A项,人工固氮合成氨反应中,氮元素的化合价降低被还原,错误;B项,工业合成氨属于人工固氮,正确;C项,硝酸盐转化为蛋白质及经动物消化使蛋白质转化为氨气和铵盐,实现了含氮无机物和含氮有机物的相互转化;并且碳、氢、氧三种元素也参加了氮的循环,C、D正确。
3.四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒立于盛有水的水槽中,充分放置后的现象如图所示。其中原试管充满NO2的是( )
B
解析:NO不溶于水,对应D项;SO2易溶于水,对应A项;NO2与水发生反应3NO2+H2O===2HNO3+NO,试管剩余的气体,对应B项;根据化学方程式Cl2+H2O===HCl+HClO和2HClO=====2HCl+O2↑可知,充分反应后剩余的气体是O2,且Cl2与O2之间满足关系式2Cl2~O2,对应C项。
光照
4.一定条件下,将等体积的NO2和O2的混合气体置于试管并将该试管倒置于水槽中至液面不再上升时,剩余气体的体积约为原体积的( )
A. B.
C. D.
D
解析:根据4NO2+O2+2H2O===4HNO3可知,O2过量。设NO2和O2的体积各1 L,则1 L NO2消耗O2 L,剩余O2 L,占原体积的 = 。
5.同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3>V1>V2
D
解析:可假设试管体积均为2V,每种气体的体积均为V;当倒置于水槽中时:①中有反应:3NO2+H2O===2HNO3+NO,则剩余气体的体积V1=V;②中有反应:4NO2+O2+2H2O===4HNO3,则剩余O2的体积V2= V;③中气体与水不反应,故试管中气体体积V3=2V。综上所述,V3>V1>V2。
6.(双选)在容积为672 mL的烧瓶里充满NO、NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且水充满烧瓶(气体体积都折合成标准状况下)。下列有关叙述中,正确的是( )
A.总反应可能为NO+NO2+O2+H2O===2HNO3
B.总反应可能为4NO+8NO2+5O2+6H2O===12HNO3
C.生成HNO3的物质的量浓度接近0.03 mol·L-1
D.生成HNO3的物质的量浓度约为0.045 mol·L-1
BD
解析:根据得失电子守恒知,3n(NO)+n(NO2)=4n(O2),又由n(NO)+n(NO2)= =0.03 mol,解得n(NO)=0.01 mol,n(NO2)=0.02 mol,则总反应为4NO+8NO2+5O2+6H2O === 12HNO3。V(NO2+NO)∶V(O2)=12∶5,因烧瓶中的气体最终均生成了HNO3,故所得溶液的体积与溶解的NO2、NO体积相等,故浓度为[V(NO2+NO)÷22.4 L·mol-1]÷V瓶=mol·L-1≈0.045 mol·L-1。
7.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积和剩余的2 mL气体可能分别是( )
A.1.2 mL,NO B.2.4 mL,O2
C.3.5 mL,O2 D.4 mL,NO
A
解析:解析:解题依据的化学反应原理为
4NO2+O2+2H2O===4HNO3
3NO2+H2O===2HNO3+NO
设O2的体积为x。剩余的气体有两种可能:①若剩O2,则V剩=x-(12 mL-x)=2mL,解得x=4 mL,B、C不正确。②若剩NO,则V剩= [(12mL-x)-4x]=2 mL,解得x=1.2mL,D不正确。
8.为了探究气态氧化物(SO2、NO2)的性质,某同学设计了一组实验:
用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液,C装置的集气瓶中还有气体剩余。
(1)写出装置B中反应的离子方程式:
________________________________________________
Cl2+SO2+2H2O===4H++2Cl-+SO42-
(2)假设该实验条件下,气体摩尔体积为a L·mol-1。则装置A的集气瓶中所得溶液溶质的物质的量浓度为________。(假设瓶内液体不扩散)
mol·L-1
(3)通入氧气前在C装置的水槽里滴加几滴紫色石蕊溶液,观察到的现象是_______________,通入氧气后,可能观察到的实验现象是________________,写出反应的总化学方程式:
_____________________________________________________。
溶液呈浅红色
溶液红色加深
2SO2+O2+2H2O===2H2SO4
解析:(1)NO2和O2、SO2和Cl2按一定比例可完全溶解于水中形成溶液:4NO2+O2+2H2O===4HNO3,
SO2+Cl2+2H2O===2HCl+H2SO4,
而SO2溶于水只有部分SO2与水反应:SO2+H2O=====H2SO3,很少量的H2SO3消耗很少量的O2,2H2SO3+O2===2H2SO4。
(2)设充满NO2的集气瓶容积为VL,n(NO2)==mol,倒置于水槽中通入O2形成 mol HNO3,溶液体积也为V L,故集气瓶中HNO3浓度为c(HNO3)= = mol·L-1。
(3)H2SO3是弱酸,滴加紫色石蕊溶液显浅红色,通入氧气后,H2SO3被氧化为H2SO4,酸性增强,石蕊溶液所显红色变深。总反应为2SO2+O2+2H2O===2H2SO4。
B篇·综合提升训练
9.不能实现下列物质间直接转化的元素是( )
D
A.碳 B.氮 C.硫 D.铝
解析:A项,碳可以先生成一氧化碳,后生成二氧化碳,再和水反应生成酸,正确;B项,氮气和氧气反应生成一氧化氮,后生成二氧化氮,和水反应时生成硝酸,正确;C项,硫和氧气反应生成二氧化硫,后和氧气反应生成三氧化硫,再和水反应生成硫酸,正确;D项,铝的氧化物只有氧化铝,错误。
10.硝酸工业尾气中含有高浓度的NO和NO2,它们都是大气的重要污染物。已知某厂排放的尾气中NO、NO2的体积比为1∶1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐。则该含氮的钠盐中,氮元素的化合价为
( )
A.-3 B.+1 C.+3 D.+5
C
解析:设该含氮钠盐中氮元素的化合价为x价,NO、NO2在NaOH溶液中发生氧化还原反应生成含氮元素的钠盐,根据得失电子守恒,推知x-2=4-x,解得x=3。
11.(双选)某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中,正确的是( )
A.肯定有SO2和NO B.肯定没有Cl2和NO2
C.可能有Cl2和O2 D.肯定只有NO
AB
解析:由题意可知,混合气体无色,故无Cl2(黄绿色)、NO2(红棕色);能使品红溶液褪色,说明有SO2;剩余气体排入空气中,很快变为红棕色,说明产生了NO2,进而说明原混合气体中有NO,故无O2。
12.工业废气中氮氧化物是主要污染物,为了治理污染,常通入NH3,发生反应NOx+NH3―→N2+H2O。现有NO、NO2的混合气体3 L,用同温同压下3.5 L NH3使其恰好完全转化为N2,则混合气体中NO、NO2的物质的量之比为( )
A.1∶1 B.1∶3
C.2∶1 D.1∶4
B
解析:在相同条件下体积比等于物质的量之比,设混合气体中NO、NO2的物质的量分别是x mol和y mol,根据得失电子守恒可知2x+4y=3×,解得y=3x,因此混合气体中NO、NO2的物质的量之比为1∶3。
13.在一定条件下,将6体积的NO2和一定体积的NO置于试管中,并将试管倒置于水中,当通入4.5体积的O2充分反应后,剩余1.5体积气体,则原NO体积可能为( )
①3体积 ②4体积 ③5体积 ④5.5体积 ⑤2体积
A.③ B.⑤ C.④或⑤ D.②或⑤
C
解析:本题的关键在于理解剩余的1.5体积气体,可能是一氧化氮,也有可能是氧气。若是一氧化氮,则氧气全部反应,二氧化氮完全反应用掉了1.5体积氧气,剩余3体积应该被一氧化氮消耗,所以一氧化氮体积为4体积+1.5体积=5.5体积;若剩余的为氧气,则这过程中一氧化氮消耗的氧气为1.5体积,所以一氧化氮的体积是2体积。
14.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如图:
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:____________________________________。
NO+NO2=======N2O3
一定条件
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是___________________
_____________________________________________________;
滤渣可循环使用,滤渣的主要成分是________(填化学式)。
使尾气中的NO、NO2被充分吸收
Ca(OH)2
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致________________________;
若n(NO)∶n(NO2)<1∶1,则会导致
_______________________________________。
排放气体中NO含量升高
产品Ca(NO2)2中Ca(NO3)2含量升高
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__________________________________________________。
3NO2-+2H+===NO3-+2NO↑+H2O
解析:(1)若NO与NO2反应生成新的氧化物,必然是NO中N的化合价升高被氧化,NO2中N的化合价降低被还原,生成的新的氧化物中N的化合价应该介于+2和+4之间,为+3价,据此写出反应方程式:
NO+NO2=======N2O3
一定条件
(2)气体上升液体下降,这样气液接触充分,使尾气被充分吸收;分析加入的原料及生成物,只有Ca(OH)2微溶于水,所以滤渣的主要成分为Ca(OH)2。
(3)当n(NO)>n(NO2)时,NO过剩;当n(NO)(4)依据化合价升降守恒,NO2-生成NO时氮元素化合价降低,则反应中NO2-中氮元素的化合价也有升高,可能生成NO3-或NO2,但在水溶液中NO2会与水反应生成NO3-,所以最终产物为NO3-,据此写出离子方程式:3NO2-+2H+===NO3-+2NO↑+H2O。
15.已知NO不溶于水,NO2易溶于水,且与水发生反应3NO2+H2O===2HNO3+NO。把盛有48 mL NO和NO2混合气体的容器倒置于水中(保持同温同压),待液面稳定后,容器内气体的体积变为24 mL,则:
(1)原混合气中,NO是________mL,NO2是________mL。
(2)若在剩余的24 mL气体中,通入6 mL O2,待液面稳定后,反应后容器内剩余气体体积为________mL。
12
36
16
(3)若在剩余的24 mL气体中,通入24 mL O2,待液面稳定后,反应后容器内剩余气体体积为________mL。
(4)若在原48 mL NO、NO2中,通入________mL O2再倒置于水中,气体会全部被吸收。
6
18
解析:(1)设NO2的体积为x,
3NO2+H2O===2HNO3+NO 体积差
3 1 2
x (48-24) mL
x=36 mL
V(NO)=(48-36) mL=12 mL。
(2)由4NO + 3O2+2H2O===4HNO3
4 3
8 mL 6 mL
容器内剩余气体为NO,体积为24 mL-8 mL=16 mL。
(3)由4NO~3O2知,24 mL NO只需消耗18 mL的O2,所以反应后容器内剩余O2为24 mL-18 mL=6 mL。
(4)由4NO + 3O2+2H2O===4HNO3
4 3
12 mL 9 mL
4NO2+O2+2H2O===4HNO3
4 1
36 mL 9 mL
可知,通入18 mL O2,可使容器内气体全部被H2O吸收。
本课结束
This lesson is over
THANKS!
第五章
化工生产中的重要非金属元素
第二节
氮及其化合物
第1课时
氮气与氮的固定、一氧化氮和二氧化氮
[明确学习目标]
1.了解氮气的性质及固氮方法。
2.认识一氧化氮、二氧化氮的性质,熟知氮的氧化物溶于水反应的化学方程式。
[核心素养对接]
1.通过NO、NO2、O2溶于水的简单计算的学习培养学生证据推理与模型认知水平。
2.通过学习氮的循环,让学生理解变化观念与平衡思想。
课前篇
·
自主学习固基础
一、氮气与氮的固定
[知识梳理]
1.氮的循环
(1)自然界
①豆科植物根部的根瘤菌,把氮气转变为氨等含氮的化合物。
②在放电条件下,空气中N2与氧气化合为氮的氧化物,并随降雨进入水体和土壤中。
③微生物分解动植物中的蛋白质生成小分子的含氮化合物,回到水体和土壤中。
(2)人类活动
①将空气中N2合成氨,再进一步转化为其他含氮化合物,进入水体和土壤中。
②化石燃料燃烧、森林和农作物的枝叶燃烧所产生的氮氧化物通过大气进入陆地和海洋。
2.氮气的物理性质
颜色 密度 气味 溶解性
______ 比空气______ ______ ____________
无色
小
无味
难溶于水
3.氮气的化学性质
(1) N2与Mg反应:___________________________________;
(2) N2与O2反应:___________________________________;
(3) N2与H2的反应:__________________________________。
N2+3Mg ===== Mg3N2
点燃
N2+O2 ========= 2NO
放电或高温
N2+3H2 ========= 2NH3
高温、高压
催化剂
4.氮的固定
(1)定义:将大气中________的氮转化为____________的过程。
(2)类别
游离态
氮的化合物
雷电
N2+O2===== 2NO
放电
N2+3H2 ======= 2NH3
高温、高压
催化剂
二、一氧化氮与二氧化氮
1.不同价态的氮的氧化物
氧化物 ____ NO N2O3 ____ N2O4 ________
对应氮的化合价 +1 +2 ____ +4 +5
N2O
NO2
N2O5
+3
2. NO和NO2
(1) 物理性质
NO NO2
颜色 ________色 ________色
状态 气态 气态
气味 ________ ________气味
毒性 ________ ________
水溶性 ________溶 ________溶
无
红棕
无味
刺激性
有毒
有毒
不
易
(2) 相互转化
① NO→NO2:2NO+O2===2NO2
② NO2→NO:3NO2+H2O===2HNO3+NO
③ 2NO2 → N2O4
[特别提醒]
(1)实验室里收集NO气体是用排水集气法而不能用排空气法。
(2)检验NO气体的方法是向气体中通入O2(或空气),气体由无色变为红棕色。
[自我排查]
(1)空气中N2的体积分数约为78%( )
(2)N2在高温条件下与O2发生燃烧反应生成NO( )
(3)NO在空气中易转化为红棕色NO2( )
(4)NO2与H2O的反应,NO2只作氧化剂( )
一、微判断
二、尝试解答
1.实验室能否用排空气法收集NO气体?能否用排水法收集NO2?为什么?
__________________________________________________________________________________________________________________________________________________________________
提示:不能。NO与空气的密度十分接近且易与空气中的O2反应,故不能用排空气法收集,一般用排水法收集;NO2易与H2O发生反应,故不能用排水法收集,一般用向上排空气法收集。
2.如何除去NO气体中混有的少量NO2气体杂质?
____________________________________________________________________________________________________________________________________________________________________________________
提示:根据NO2与H2O反应能生成NO,既能除去NO2杂质,又不引入其他杂质,故可将混合气体通入盛有水的洗气瓶,然后重新收集气体。
三、微训练
1.下列关于N2的说法错误的是( )
A.通常情况下N2性质很稳定,所以N2可在电焊时作保护气
B.反应N2+O2====2NO是汽车尾气造成污染的主要原因之一
C.N2的质量约占空气总质量的
D.在反应3Mg+N2=====Mg3N2中,N2作氧化剂
C
高温
点燃
解析:N2在空气中的体积含量约为,C项错误。
2.下列关于一氧化氮的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,只能用向上排空气法收集
C
解析:NO是无色气体,不溶于水,可由N2与O2直接化合而得到,且易与空气中的氧气直接反应生成NO2,故只有C项符合题意。
3.如图表示自然界中的氮循环,下列说法正确的是( )。
A.雷电作用中发生的反应是N2+2O2=====2NO2
B.人工固氮过程中,氮元素一定被还原
C.①中涉及的反应可能有:2NO2-+O2===2NO3-
D.②中涉及的反应可能有:2NO3-+12H+ === N2↑+6H2O
高温
解析:大气中的N2和O2在雷电作用下发生反应生成NO,化学方程式为N2+O2=====2NO,A错误;人工固氮可生成氨或铵盐,也可生成硝酸盐,而生成硝酸盐的过程中,氮元素被氧化,B错误;过程①中亚硝酸盐转化为硝酸盐,NO2-被氧化成NO3-,离子方程式为2NO2-+O2===2NO3-,C正确;过程②中硝酸盐被细菌分解,题图中未指明细菌提供酸性条件且所给离子方程式电荷不守恒,D错误。
放电
4.宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红色物质,产生红色的原因是( )
A.高温下N2遇空气生成NO2
B.NO与空气反应生成NO2
C.CO2遇NO反应生成NO2
D.NO遇H2O反应生成NO2
B
解析:根据原高温气体均为无色,但在卫星发射现场却能看到红色物质可推知,是因为发生反应:2NO+O2===2NO2。
课堂篇
·
重点难点要突破
研习 氮的氧化物的性质
[重点讲解]
1.NO和NO2性质的比较
化学反应
化学反应
(1) 氮的氧化物中属于酸性氧化物的只有N2O3、N2O5;N2O、NO、NO2、N2O4都是不成盐氧化物,不是酸性氧化物。
(2)NO易与O2反应、不溶于水、不与水反应,因此收集NO用排水法,不可用排空气法。NO2易与水反应,但很难被O2氧化,因此收集NO2,用向上排空气法,不可用排水法。
(3)NO2和N2O4是两种不同的氧化物,通常情况下,NO2能进行自身二聚:2NO2(红棕色)====N2O4(无色),故NO2中总混有N2O4。
2.氮的氧化物溶于水的计算
(1) 相关反应原理
3NO2+H2O===2HNO3+NO①
2NO+O2===2NO2②
由方程式①×2+②得:4NO2+O2+2H2O===4HNO3③
由方程式①×2+②×3得:4NO+3O2+2H2O===4HNO3④
(2) 氮的氧化物溶于水的三种类型
Ⅰ.NO2气体:NO2气体溶于水时仅涉及反应①,剩余气体为NO。
Ⅱ.NO2和O2的混合气体:NO2和O2的混合气体溶于水时涉及反应③:
x= 0
反应情况 O2过量,剩余气体为O2 恰好完全反应,无气体剩余 NO2过量,又发生反应①,只剩余NO
Ⅲ.NO和O2的混合气体:NO、O2的混合气体溶于水时涉及反应④:
x= 0
反应情况 O2过量,剩余O2 恰好完全反应,无气体剩余 NO过量,剩余NO
[探究活动]
[实验] 探究二氧化氮与水的反应
实验装置
实验操作 实验现象 实验结论
如图所示,在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 无明显现象 NO不溶于水
实验操作 实验现象 实验结论
打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹 注射器中气体由无色变为红棕色,注射器塞子向左移动 NO与空气中的O2发生反应生成红棕色的NO2
振荡注射器 注射器中气体由红棕色变为无色,注射器塞子继续向左移动 NO2与水发生反应
[问题探讨]
1.上述实验过程中发生了哪些化学反应?从氧化还原反应的角度分析,上述反应中NO和NO2的作用是什么?(氧化剂或还原剂)
提示:NO与O2发生反应:2NO+O2===2NO2,NO是还原剂,NO2与水发生反应:3NO2+H2O===2HNO3+ NO,NO2既是氧化剂,又是还原剂。
2.若将注射器中的NO充分转化,应采取何种措施?写出转化过程的总反应化学方程式。
提示:充入足量空气(或O2),可把注射器中的NO完全转化。
化学方程式:①2NO+O2===2NO2
②3NO2+H2O===2HNO3+NO
由①×3+②×2得总化学方程式:
4NO+3O2+2H2O===4HNO3。
3.NO2是酸性氧化物吗?工业生产硝酸时,能否将NO2完全转化为硝酸?写出转化过程的总反应化学方程式
提示:NO2不属于酸性氧化物,原因是NO2与水反应生成HNO3和NO,NO2与HNO3中氮元素的化合价不同,因此NO2不是HNO3对应的酸性氧化物。工业生产硝酸时,通入过量O2,可以把NO2完全转化为HNO3。
化学方程式:3NO2+H2O===2HNO3+NO①
2NO+O2===2NO2②
由①×2+②得总化学方程式:4NO2+O2+2H2O===4HNO3。
4.如何设计实验检验某气体是NO
提示:向盛有无色气体的容器中通入空气(或O2),气体由无色变为红棕色,说明该气体是NO。
[举一反三]
1.(双选)对于反应3NO2+H2O===2HNO3+NO,下列说法正确的是( )
A.氧化剂与还原剂的质量比为1∶2
B.氧化产物与还原产物的物质的量之比为1∶2
C.NO2是氧化剂,H2O是还原剂
D.在反应中若有6 mol NO2参与反应时,有4 mol电子发生转移
AD
解析: ,反应中氧化剂(NO2)与还原剂(NO2)的物质的量之比为1∶2,即质量比为1∶2,A正确;反应中氧化产物(HNO3)与还原产物(NO)的物质的量之比为2∶1,B错误;反应中NO2既是氧化剂又是还原剂,而水既不是氧化剂又不是还原剂,C错误;反应中若有6 mol NO2参加反应时,有4 mol电子发生转移,D正确。
2.下列关于NO和NO2的说法正确的是( )
A.NO2是红棕色气体,易溶于水,属于酸性氧化物
B.NO2可由N2和O2直接化合得到
C.NO和NO2均既可以用排空气法收集又可以用排水法收集
D.NO和NO2在一定条件下可以相互转化
D
解析:NO2不是酸性氧化物,A项错误;在高温或放电条件下,N2和O2直接化合生成NO,NO与O2反应生成NO2,B项错误;NO易与空气中的氧气反应生成NO2,只能用排水法收集,NO2能与水反应,只能用排空气法收集,C项错误;NO和O2反应生成NO2,NO2与H2O反应生成HNO3和NO,D项正确。
3.如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,对原试管中盛装气体的说法正确的是( )
①可能是N2与NO2的混合气体 ②可能是NO2气体
③可能是NO与NO2的混合气体
④只可能是NO2一种气体
A.①② B.②③ C.③④ D.①④
B
解析:因是红棕色气体,那么一定有二氧化氮的存在,二氧化氮与水反应后生成一氧化氮,所以水没有充满试管,继续通入氧气,最终水充满试管,则①肯定错误;③中通入足量的氧气,NO也可以全部被吸收。
4.在一定温度和压强下,将一容积为15 mL的试管充满NO2后,倒置于一个盛有水的水槽中。当试管内液面上升至一定高度不再变化时,在相同条件下再通入O2,若要使试管内液面仍保持在原高度,则通入O2的体积为( )
A.3.75 mL B.7.5 mL
C.8.75 mL D.10.5 mL
C
解析:解析:15 mL NO2与水反应后生成5 mL NO,根据反应4NO+3O2+2H2O===4HNO3,使5 mL NO完全被氧化需O2体积为 5mL×=3.75 mL。根据题意,通入的O2应剩余5 mL,则共需通入O2 8.75 mL。
演习篇
·
学业测试速达标
1.将盛有30 mL NO和NO2混合气体的试管倒置于放满水的水槽中,最后试管中气体的体积是20 mL,则原混合气体中NO的体积是( )
A.24 mL B.15 mL
C.18 mL D.12 mL
B
解析:NO2与水反应3NO2+H2O===2HNO3+NO,设原混合气体中NO与NO2的体积分别为x、y,则据题意,剩余气体体积20 mL是原NO气体与上述反应生成的NO气体的总体积,列方程即可得NO和NO2体积都是15 mL。
2.在NO2被水吸收的反应中,发生还原反应的物质和发生氧化反应的物质的物质的量之比为( )
A.3∶1 B.1∶3 C.1∶2 D.2∶1
C
解析:3NO2+H2O===2HNO3+NO,3 mol NO2中,有2 mol氮原子的价态升高,1 mol氮原子的价态降低,所以发生还原反应的NO2与发生氧化反应的NO2的物质的量之比为1∶2。
3.下列物质的转化必须加入氧化剂且通过一步反应就能完成的是( )
① N2→NO2 ② NO2→NO
③ NO2→HNO3 ④ N2→NO
⑤ N2→NH3
A.① B.②⑤ C.④ D.③④
C
解析:该题有两个要求:(1)必须加入氧化剂;(2)通过一步反应就能完成。反应①、③、④从化合价角度来看都是升高,但反应①N2→NO2不能通过一步反应完成;而反应③NO2→HNO3虽然氮的化合价升高,但不加氧化剂也能完成,如3NO2+H2O===2HNO3+NO,在该反应中,NO2既是氧化剂又是还原剂;只有反应④N2→NO必须加入氧化剂且通过一步反应就能完成。
4.(双选)下列关于NO和NO2的叙述正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的物质的量相等
D.NO2不能用排水法收集,NO不能用排空气法收集
CD
解析:解答本题要抓住NO易被氧化,NO2易与水反应。NO是无色气体,常温常压下,易与空气中的氧气直接化合生成NO2。NO2能与水反应,故不能用排水法收集,NO与O2反应并且密度与空气接近,不能用排空气法收集。
5.利用如图所示装置收集以下7种气体(图中烧瓶的位置不得变化)。
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3
⑥NO ⑦SO2
(1) 若烧瓶是干燥的,则由B口进气收集的
气体有_____________(写序号,下同)。
②④⑦
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3
⑥NO ⑦SO2
(2)若烧瓶充满水,可收集的气体有________,这时气体由________口进入。
(3)若烧瓶是干燥的,则由A口进气,可收集的气体有________。
①③⑥
A
①③⑤
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3
⑥NO ⑦SO2
(4)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有_______________,这时气体由________口进入。
①②③④⑥⑦
B
课时作业(四)
氮气与氮的固定、一氧化氮和二氧化氮
A篇·知识对点训练
1.关于氮气的性质的说法中,错误的是( )
A.氮在自然界中既以游离态存在又以化合态存在
B.通常情况下,氮气性质很不活泼
C.可在氧气中燃烧生成一氧化氮
D.在反应3Mg+N2=====Mg3N2中N2作氧化剂
C
点燃
解析:通常情况下氮气的性质很不活泼,不具有可燃性,在放电或高温条件下,能跟氧气反应。
2.下列关于自然界中氮循环(如下图)的说法不正确的是( )
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参加了氮循环
A
解析:A项,人工固氮合成氨反应中,氮元素的化合价降低被还原,错误;B项,工业合成氨属于人工固氮,正确;C项,硝酸盐转化为蛋白质及经动物消化使蛋白质转化为氨气和铵盐,实现了含氮无机物和含氮有机物的相互转化;并且碳、氢、氧三种元素也参加了氮的循环,C、D正确。
3.四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒立于盛有水的水槽中,充分放置后的现象如图所示。其中原试管充满NO2的是( )
B
解析:NO不溶于水,对应D项;SO2易溶于水,对应A项;NO2与水发生反应3NO2+H2O===2HNO3+NO,试管剩余的气体,对应B项;根据化学方程式Cl2+H2O===HCl+HClO和2HClO=====2HCl+O2↑可知,充分反应后剩余的气体是O2,且Cl2与O2之间满足关系式2Cl2~O2,对应C项。
光照
4.一定条件下,将等体积的NO2和O2的混合气体置于试管并将该试管倒置于水槽中至液面不再上升时,剩余气体的体积约为原体积的( )
A. B.
C. D.
D
解析:根据4NO2+O2+2H2O===4HNO3可知,O2过量。设NO2和O2的体积各1 L,则1 L NO2消耗O2 L,剩余O2 L,占原体积的 = 。
5.同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3>V1>V2
D
解析:可假设试管体积均为2V,每种气体的体积均为V;当倒置于水槽中时:①中有反应:3NO2+H2O===2HNO3+NO,则剩余气体的体积V1=V;②中有反应:4NO2+O2+2H2O===4HNO3,则剩余O2的体积V2= V;③中气体与水不反应,故试管中气体体积V3=2V。综上所述,V3>V1>V2。
6.(双选)在容积为672 mL的烧瓶里充满NO、NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且水充满烧瓶(气体体积都折合成标准状况下)。下列有关叙述中,正确的是( )
A.总反应可能为NO+NO2+O2+H2O===2HNO3
B.总反应可能为4NO+8NO2+5O2+6H2O===12HNO3
C.生成HNO3的物质的量浓度接近0.03 mol·L-1
D.生成HNO3的物质的量浓度约为0.045 mol·L-1
BD
解析:根据得失电子守恒知,3n(NO)+n(NO2)=4n(O2),又由n(NO)+n(NO2)= =0.03 mol,解得n(NO)=0.01 mol,n(NO2)=0.02 mol,则总反应为4NO+8NO2+5O2+6H2O === 12HNO3。V(NO2+NO)∶V(O2)=12∶5,因烧瓶中的气体最终均生成了HNO3,故所得溶液的体积与溶解的NO2、NO体积相等,故浓度为[V(NO2+NO)÷22.4 L·mol-1]÷V瓶=mol·L-1≈0.045 mol·L-1。
7.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积和剩余的2 mL气体可能分别是( )
A.1.2 mL,NO B.2.4 mL,O2
C.3.5 mL,O2 D.4 mL,NO
A
解析:解析:解题依据的化学反应原理为
4NO2+O2+2H2O===4HNO3
3NO2+H2O===2HNO3+NO
设O2的体积为x。剩余的气体有两种可能:①若剩O2,则V剩=x-(12 mL-x)=2mL,解得x=4 mL,B、C不正确。②若剩NO,则V剩= [(12mL-x)-4x]=2 mL,解得x=1.2mL,D不正确。
8.为了探究气态氧化物(SO2、NO2)的性质,某同学设计了一组实验:
用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液,C装置的集气瓶中还有气体剩余。
(1)写出装置B中反应的离子方程式:
________________________________________________
Cl2+SO2+2H2O===4H++2Cl-+SO42-
(2)假设该实验条件下,气体摩尔体积为a L·mol-1。则装置A的集气瓶中所得溶液溶质的物质的量浓度为________。(假设瓶内液体不扩散)
mol·L-1
(3)通入氧气前在C装置的水槽里滴加几滴紫色石蕊溶液,观察到的现象是_______________,通入氧气后,可能观察到的实验现象是________________,写出反应的总化学方程式:
_____________________________________________________。
溶液呈浅红色
溶液红色加深
2SO2+O2+2H2O===2H2SO4
解析:(1)NO2和O2、SO2和Cl2按一定比例可完全溶解于水中形成溶液:4NO2+O2+2H2O===4HNO3,
SO2+Cl2+2H2O===2HCl+H2SO4,
而SO2溶于水只有部分SO2与水反应:SO2+H2O=====H2SO3,很少量的H2SO3消耗很少量的O2,2H2SO3+O2===2H2SO4。
(2)设充满NO2的集气瓶容积为VL,n(NO2)==mol,倒置于水槽中通入O2形成 mol HNO3,溶液体积也为V L,故集气瓶中HNO3浓度为c(HNO3)= = mol·L-1。
(3)H2SO3是弱酸,滴加紫色石蕊溶液显浅红色,通入氧气后,H2SO3被氧化为H2SO4,酸性增强,石蕊溶液所显红色变深。总反应为2SO2+O2+2H2O===2H2SO4。
B篇·综合提升训练
9.不能实现下列物质间直接转化的元素是( )
D
A.碳 B.氮 C.硫 D.铝
解析:A项,碳可以先生成一氧化碳,后生成二氧化碳,再和水反应生成酸,正确;B项,氮气和氧气反应生成一氧化氮,后生成二氧化氮,和水反应时生成硝酸,正确;C项,硫和氧气反应生成二氧化硫,后和氧气反应生成三氧化硫,再和水反应生成硫酸,正确;D项,铝的氧化物只有氧化铝,错误。
10.硝酸工业尾气中含有高浓度的NO和NO2,它们都是大气的重要污染物。已知某厂排放的尾气中NO、NO2的体积比为1∶1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐。则该含氮的钠盐中,氮元素的化合价为
( )
A.-3 B.+1 C.+3 D.+5
C
解析:设该含氮钠盐中氮元素的化合价为x价,NO、NO2在NaOH溶液中发生氧化还原反应生成含氮元素的钠盐,根据得失电子守恒,推知x-2=4-x,解得x=3。
11.(双选)某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中,正确的是( )
A.肯定有SO2和NO B.肯定没有Cl2和NO2
C.可能有Cl2和O2 D.肯定只有NO
AB
解析:由题意可知,混合气体无色,故无Cl2(黄绿色)、NO2(红棕色);能使品红溶液褪色,说明有SO2;剩余气体排入空气中,很快变为红棕色,说明产生了NO2,进而说明原混合气体中有NO,故无O2。
12.工业废气中氮氧化物是主要污染物,为了治理污染,常通入NH3,发生反应NOx+NH3―→N2+H2O。现有NO、NO2的混合气体3 L,用同温同压下3.5 L NH3使其恰好完全转化为N2,则混合气体中NO、NO2的物质的量之比为( )
A.1∶1 B.1∶3
C.2∶1 D.1∶4
B
解析:在相同条件下体积比等于物质的量之比,设混合气体中NO、NO2的物质的量分别是x mol和y mol,根据得失电子守恒可知2x+4y=3×,解得y=3x,因此混合气体中NO、NO2的物质的量之比为1∶3。
13.在一定条件下,将6体积的NO2和一定体积的NO置于试管中,并将试管倒置于水中,当通入4.5体积的O2充分反应后,剩余1.5体积气体,则原NO体积可能为( )
①3体积 ②4体积 ③5体积 ④5.5体积 ⑤2体积
A.③ B.⑤ C.④或⑤ D.②或⑤
C
解析:本题的关键在于理解剩余的1.5体积气体,可能是一氧化氮,也有可能是氧气。若是一氧化氮,则氧气全部反应,二氧化氮完全反应用掉了1.5体积氧气,剩余3体积应该被一氧化氮消耗,所以一氧化氮体积为4体积+1.5体积=5.5体积;若剩余的为氧气,则这过程中一氧化氮消耗的氧气为1.5体积,所以一氧化氮的体积是2体积。
14.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如图:
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:____________________________________。
NO+NO2=======N2O3
一定条件
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是___________________
_____________________________________________________;
滤渣可循环使用,滤渣的主要成分是________(填化学式)。
使尾气中的NO、NO2被充分吸收
Ca(OH)2
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致________________________;
若n(NO)∶n(NO2)<1∶1,则会导致
_______________________________________。
排放气体中NO含量升高
产品Ca(NO2)2中Ca(NO3)2含量升高
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__________________________________________________。
3NO2-+2H+===NO3-+2NO↑+H2O
解析:(1)若NO与NO2反应生成新的氧化物,必然是NO中N的化合价升高被氧化,NO2中N的化合价降低被还原,生成的新的氧化物中N的化合价应该介于+2和+4之间,为+3价,据此写出反应方程式:
NO+NO2=======N2O3
一定条件
(2)气体上升液体下降,这样气液接触充分,使尾气被充分吸收;分析加入的原料及生成物,只有Ca(OH)2微溶于水,所以滤渣的主要成分为Ca(OH)2。
(3)当n(NO)>n(NO2)时,NO过剩;当n(NO)
15.已知NO不溶于水,NO2易溶于水,且与水发生反应3NO2+H2O===2HNO3+NO。把盛有48 mL NO和NO2混合气体的容器倒置于水中(保持同温同压),待液面稳定后,容器内气体的体积变为24 mL,则:
(1)原混合气中,NO是________mL,NO2是________mL。
(2)若在剩余的24 mL气体中,通入6 mL O2,待液面稳定后,反应后容器内剩余气体体积为________mL。
12
36
16
(3)若在剩余的24 mL气体中,通入24 mL O2,待液面稳定后,反应后容器内剩余气体体积为________mL。
(4)若在原48 mL NO、NO2中,通入________mL O2再倒置于水中,气体会全部被吸收。
6
18
解析:(1)设NO2的体积为x,
3NO2+H2O===2HNO3+NO 体积差
3 1 2
x (48-24) mL
x=36 mL
V(NO)=(48-36) mL=12 mL。
(2)由4NO + 3O2+2H2O===4HNO3
4 3
8 mL 6 mL
容器内剩余气体为NO,体积为24 mL-8 mL=16 mL。
(3)由4NO~3O2知,24 mL NO只需消耗18 mL的O2,所以反应后容器内剩余O2为24 mL-18 mL=6 mL。
(4)由4NO + 3O2+2H2O===4HNO3
4 3
12 mL 9 mL
4NO2+O2+2H2O===4HNO3
4 1
36 mL 9 mL
可知,通入18 mL O2,可使容器内气体全部被H2O吸收。
本课结束
This lesson is over
THANKS!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
