6.2.2 化学反应的限度 化学反应条件的控制 课件(共110张PPT)
文档属性
| 名称 | 6.2.2 化学反应的限度 化学反应条件的控制 课件(共110张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 28.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-23 00:00:00 | ||
图片预览









文档简介
(共110张PPT)
第六章
化学反应与能量
第二节
化学反应的速率与限度
第2课时
化学反应的限度
化学反应条件的控制
[明确学习目标]
1.认识可逆反应,了解化学平衡的含义。
2.会判断化学平衡状态。
3.了解控制反应条件在生产和科学研究中的作用。
[核心素养对接]
通过对化学反应限度的学习,培养学生变化观念与平衡思想。
课前篇
·
自主学习固基础
一、化学反应的限度
[知识梳理]
1.可逆反应
(1) 定义:在同一条件下,既能向________________进行,同时又能向________________进行的化学反应。
正反应方向
逆反应方向
(2) 特点
①正向反应和逆向反应________进行。
②一定条件下,反应物不可能________转化为生成物,即反应物的转化率不可能达到________。
(3)表示:书写可逆反应的化学方程式时不用“===”而用“ ” 。
同时
全部
100%
2.化学平衡状态
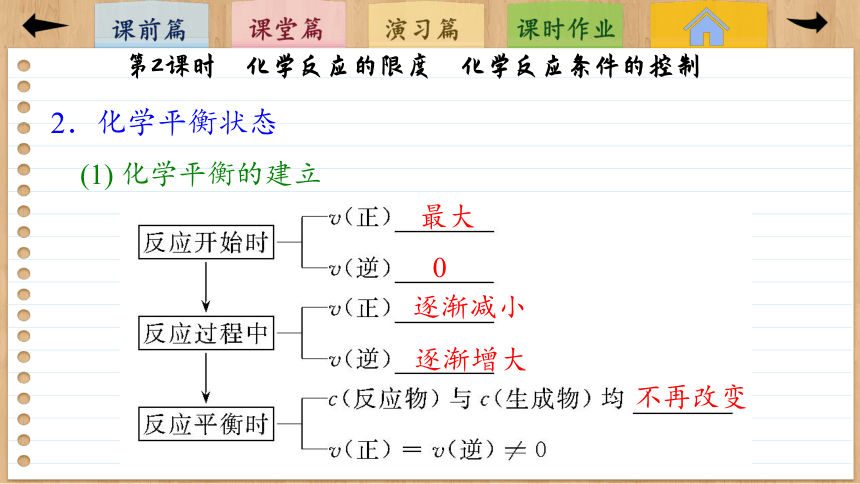
(1) 化学平衡的建立
最大
0
逐渐减小
逐渐增大
不再改变
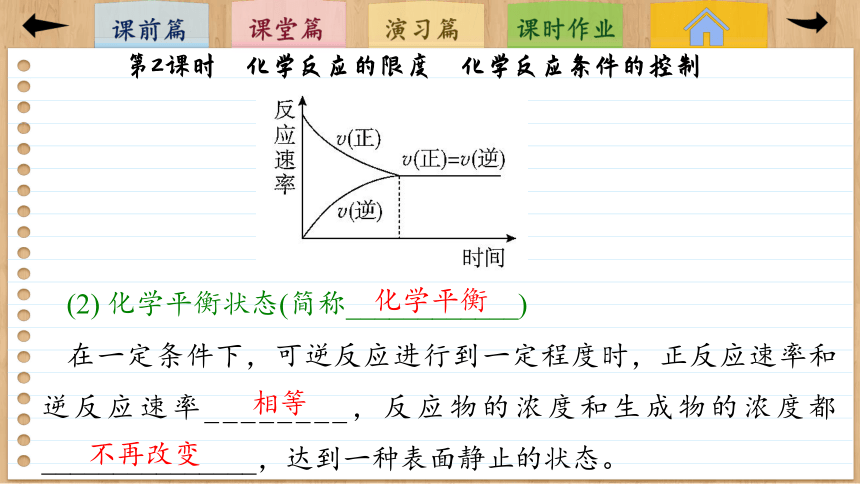
(2) 化学平衡状态(简称____________)
在一定条件下,可逆反应进行到一定程度时,正反应速率和逆反应速率________,反应物的浓度和生成物的浓度都_______________,达到一种表面静止的状态。
化学平衡
相等
不再改变
二、化学反应条件的控制
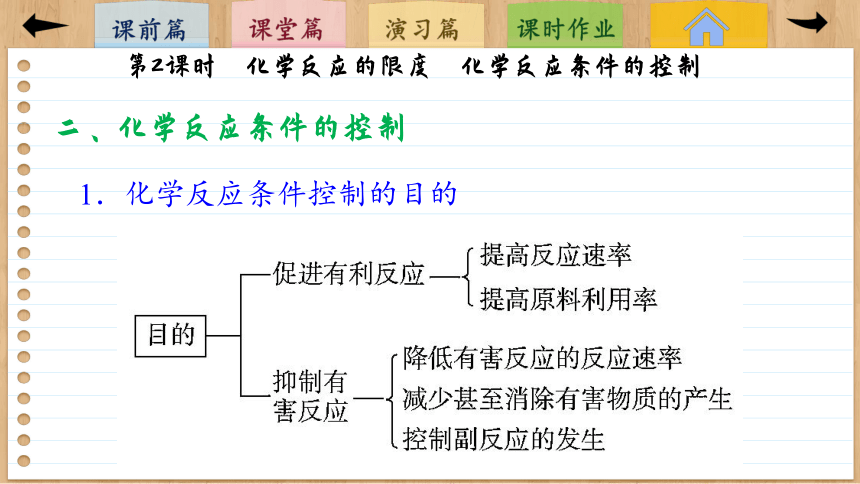
1.化学反应条件控制的目的
2.化工生产中反应条件的调控措施
(1) 考虑因素
化工生产中调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
(2) 实例——合成氨生产条件的选择
[自我排查]
(1)任何可逆反应都有一定的限度( )
(2)化学反应达到限度时,正、逆反应速率相等( )
(3)化学反应的限度与时间的长短无关( )
(4)化学反应的限度是不可改变的( )
一、微判断
二、尝试解答
1.2H2+O2=====2H2O和2H2O=====2H2↑+O2↑是可逆反应吗?_______________________________________________________________________________________________________________________________________________________
提示:不是;因为可逆反应必须是在同一条件下同时进行。
点燃
电解
2.在一定条件下,将1 mol N2和3 mol H2置于密闭容器中充分反应,能否得到2 molNH3。
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
提示:不能;原因是N2与H2合成氨的反应属于可逆反应,反应物转化率达不到100%。
三、微训练
1.下列说法不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应的限度可以通过改变条件来改变
C
解析:对于可逆反应,达到平衡状态时,正、逆反应速率相等,反应物的转化率最大,A、B正确;2SO2+O2======2SO3是可逆反应,无论怎样控制条件,反应物的转化率不可能达到100%,即2 mol SO2与1 mol O2反应不会生成2 mol SO3,C错;化学反应的限度可通过改变条件,如温度、压强等来改变,D正确。
催化剂
△
2.一定温度下,反应A2(g)+B2(g)=====2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol A2的同时生成n mol AB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.单位时间内生成n mol A2的同时生成n mol B2
C
解析:在一定条件下,判断一个反应是否达到平衡,主要看正、逆反应速率是否相等,体系中各组分的浓度(或含量)是否保持不变。
A项中,生成A2是逆反应,生成AB是正反应。显然v(正)B项中,该反应前后气体总的物质的量保持不变,在其他条件一定时,反应从开始至达到平衡,压强一直保持不变,故压强不变不能说明反应是否达到平衡状态;
C项表明v(正)=v(逆),反应已达到平衡状态;
D项中,只说明了逆反应速率,没有说明正反应速率,且不管平衡是否建立,只要反应在进行,生成A2和B2的物质的量之比始终为1∶1。
3.(1)炭在火炉中燃烧得很旺时,在往炉膛底内的热炭上喷洒少量水的瞬间,炉子内的火会更旺这是因为
_____________________________________________________。
(2)(双选)如果欲使炉内炭更充分燃烧,下列措施可行的是
( )
A.向炉内吹空气 B.把块状炭碾碎
C.使用H2O作催化剂 D.提高炉膛内的温度
炭与水反应生成CO和H2,燃烧更快,火焰更旺
AB
解析:往炉膛底内的热炭上喷洒少量水,即在高温下炽热的炭与H2O反应:C(s)+H2O(g)=====CO(g)+H2(g),这样炭经反应变成气体燃料,燃烧时与空气接触更充分,燃烧充分且快,所以炉火更旺。使用催化剂或提高炉内温度只能更快地完成燃烧过程,而并不能为炭燃烧的更充分提供条件。
高温
课堂篇
·
重点难点要突破
研习 化学平衡
[重点讲解]
1.可逆反应的特点
2.化学平衡状态的建立过程
3.化学平衡状态的特征
4.化学平衡状态的判断
(1) 直接标志
①v正=v逆
a.同一种物质的生成速率等于消耗速率;
b.在化学方程式同一边的不同物质的生成速率与消耗速率之比等于化学计量数之比;
c.在化学方程式两边的不同物质的生成(或消耗)速率之比等于化学计量数之比。
②各组分的浓度保持一定
a.各组分的浓度不随时间的改变而改变;
b.各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
(2) 间接标志
①反应体系中的总压强不随时间的改变而变化(适用于反应前后气体体积不等的反应)。
②混合气体的密度不随时间改变而变化(适用于等压条件下反应前后气体体积不等的反应和等容条件下有固、液体参与或生成的反应)。
③全是气体参加的反应,反应前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
④对于反应混合物中存在有颜色变化的物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。
⑤对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
5.化学平衡状态判断的注意事项
(1) 化学平衡状态判断“三关注”
关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
(2) 不能作为“标志”的四种情况
①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。
②恒温恒容下体积不变的反应,体系的压强或总物质的量不再随时间而变化,如2HI(g) ===== H2(g)+I2(g)。
③全是气体参加的体积不变的反应,体系的平均相对分子质量不再随时间而变化,如2HI(g) ==== H2(g)+I2(g)。
④全是气体参加的反应,恒容条件下体系的密度保持不变。
6.有关化学平衡的简单计算
解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。如:
设a mol、b mol分别是A、B两物质起始物质的量,mx mol为反应物A转化的物质的量,nx mol为反应物B转化的物质的量,则:
mA(g)+nB(g) ===== pC(g)+qD(g)
起始/mol a b 0 0
转化/mol mx nx px qx
平衡/mol a-mx b-nx px qx
(1)关于反应物转化率的计算
A的转化率=×100% (计算式中A的量可以指反应物的物质的量、质量、浓度、体积等)。
(2)关于某组分的体积分数的计算
A的体积分数=×100%。
注意:(1)转化量与化学方程式中各物质的化学计量数成比例;(2)这里a、b可指物质的量、浓度、体积等;(3)对于反应物:平衡时的量=起始的量-转化的量;对于生成物:平衡时的量=起始的量+转化的量。同时要注意差量法、守恒法等简单计算方法在化学平衡中的应用。
[联想质疑]
德国化学家哈伯(F.Haber,1868—1934)研究出由氮气和氢气直接合成氨的方法,即“循环法”。在此基础上,他继续研究并改进了合成工艺,使氨的产率达到8%。这是工业普遍采用的直接合成法。反应过程中为解决氢气和氮气合成转化率的问题,将氨产品从合成反应后的气体中分离出来,未反应气和新鲜氢氮气混合重新参与合成反应。
合成氨反应的化学方程式:N2+3H2========2NH3(该反应为可逆反应)。
高温、高压
催化剂
[问题探讨]
1.一定条件下,向容积不变的密闭容器中充入1 mol N2和3 mol H2发生合成氨的反应,反应过程中正、逆反应速率如何变化?正、逆反应速率达到何种关系时反应达到平衡状态?
提示:反应过程中,正反应速率开始最大,后逐渐减小,逆反应速率开始为0,后逐渐增大;当用同种物质表示的正、逆反应速率相等时,反应达到平衡状态。
2.一定条件下,密闭容器中进行合成氨的反应,当1个N≡N键断裂的同时,有6个N—H键形成,此时反应是否处于平衡状态?当反应达平衡后,反应是否停止?
提示:不能判断反应是否处于平衡状态,因为1个N≡N键断裂和6个N—H键形成均指正反应方向,反应过程中的任何时刻均存在上述关系。当反应达到平衡状态后,反应并没有停止,此时v正=v逆≠0。
3.一定条件下,在容积不变的密闭容器中进行合成氨的反应,当容器中压强不变时,反应是否处于平衡状态?当容器中气体的密度不变时,反应是否处于平衡状态?
提示:由于合成氨的反应是气体物质的量减小的反应,故容器内气体的压强会逐渐减小,当压强不变时,说明反应处于平衡状态。容器中气体的密度ρ=,因反应物、生成物均为气体,故气体的总质量不变,则气体的密度在反应过程中保持不变,因此,不能判断反应是否处于平衡状态。
[举一反三]
1.N2(g)+3H2(g)=========2NH3(g)在体积不变的密闭容器中反应,下列叙述表示处于化学平衡状态的是( )
A.N2、H2、NH3的浓度比为1∶3∶2的状态
B.混合气体的密度不随时间而变化
C.当有1 mol N≡N键断裂时,有6 mol N—H键断裂
D.单位时间内消耗a mol N2的同时消耗3a mol的H2的状态
C
高温、高压
催化剂
解析:A中,N2、H2、NH3的浓度之比等于化学计量数之比时,不能确定是否处于平衡状态;
因容器的体积不变,而混合气体的总质量不改变,则无论平衡与否,混合气体的密度均不变,不能确定是否处于平衡状态;
当有1 mol N≡N键断裂时,相当于有1 mol N2发生反应生成2 mol NH3,即生成6 mol N—H键(1 mol NH3中含有3 mol N—H键),与有6 mol N—H键断裂符合v(NH3)正=v(NH3)逆,故处于化学平衡状态;
消耗a mol N2的同时消耗3a mol H2是同向的,不管平衡与否,只要N2和H2反应就一定符合该比例,不能确定是否处于平衡状态。
2.(双选)一定温度下,可逆反应:A(g) +3B(g)====2C(g)达到限度的标志是 ( )
A.C的生成速率与A的消耗速率相等
B.单位时间内生成n mol A,同时消耗3n mol B
C.A、B、C的浓度不再变化
D.A、B、C的分子数之比为1∶3∶2
BC
解析:A项中C的生成速率和A的消耗速率不可能相等;B项中生成A与消耗B的反应方向相反,且生成A与消耗B的物质的量之比为化学计量数之比,故反应达到平衡状态;C项中表示各物质的浓度保持不变,即表明化学反应已达到平衡状态;D项中平衡时,A、B、C的分子数之比与化学计量数之比没有必然关系。
3.一定温度下,在恒容密闭容器中进行的可逆反应:
2NO2(g)=====2NO(g)+O2(g)。
判断下列描述中该反应处于平衡状态的是________。
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤密闭容器中压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
解析:①中单位时间内生成n mol O2的同时生成2n mol的NO2,即正反应速率等于逆反应速率,能说明反应达到平衡状态;
②中描述的都是正反应方向的速率,不能说明反应是否处于平衡状态;
③中无论反应是否达平衡状态,同向的速率之比一定等于化学方程式中相应物质的化学计量数之比;
④中混合气体的颜色不变,即c(NO2)保持不变,说明反应处于平衡状态;
⑤、⑥因该反应是一个反应前后气体物质的量不等的反应,容器的体积固定,故气体的压强不变,气体的平均相对分子质量不变,均能说明反应处于平衡状态。
[规律方法]
利用“变量”与“不变量”来判断化学平衡状态
(1) 选变量
选定反应中“变量”,即随反应进行而变化的量,当变量不再变化时,反应已达平衡。
(2)常见的变量
①气体的颜色;
②对于气体体积有变化的反应来说,恒压反应时的体积、恒容反应时的压强;
③对于反应体系中全部为气体,且气体物质的量有变化的反应来说,混合气体的平均相对分子质量;
④对于反应体系中不全部为气体的反应来说,恒容时混合气体的密度等。
(3) 说明
在利用M、ρ、n(总)、p(总)判断时要注意反应特点和容器的体积变化问题。
演习篇
·
学业测试速达标
1.下列对化学反应速率与化学反应限度的叙述中,不正确的是 ( )
A.当化学反应达到最大限度时反应速率为0
B.同一化学反应,若反应条件不同,限度可能不同
C.化学反应达到限度时,正、逆反应速率相等
D.化学反应的限度与时间的长短无关
A
解析:A项反应达到最大限度时v正=v逆≠0,A项错误;同一化学反应,条件改变,化学平衡可能被破坏,反应限度可能就会被改变,B项正确;任何可逆反应都有一定的限度,当反应达到限度时,即反应达到化学平衡,此时v(正)=v(逆),对同一可逆反应,达到化学平衡时,当外界条件不变时,反应的限度不变,与时间长短无关。
2.下列各组反应互为可逆反应的是( )
①2NaHCO3=====Na2CO3+CO2↑+H2O与CO2+H2O+Na2CO3
===2NaHCO3
②SO2+H2O===H2SO3与H2SO3===SO2+H2O
③N2+3H2=========2NH3与2NH3========= 3H2+N2
④NH3+HCl===NH4Cl与NH4Cl=====NH3↑+HCl↑
A.①② B.②③ C.③④ D.①④
B
△
高温、高压
催化剂
高温、高压
催化剂
△
解析:①④中两反应条件不相同,不互为可逆反应。
3.相同温度和压强下,在容积为2 L的密闭容器中发生反应:2HI(g) ==== H2(g)+I2(g),反应达到平衡状态的标志是( )
A.c(H2)保持不变
B.c(H2)=c(I2)
C.2v正(HI)=v逆(I2)
D.断开2 mol H—I共价键,同时生成1 mol H—H共价键
A
解析:在一定条件下的可逆反应中,如果正、逆反应速率相等,各组分的百分含量保持不变,则达到化学平衡状态。A项,c(H2)保持不变,符合要求;B项,c(H2)=c(I2),不一定是达到平衡,不符合要求;C项,应为v正(HI)=2v逆(I2),错误;D项,断开2 mol H—I共价键是正反应,同时生成1 mol H—H共价键,也是正反应,错误。
4.一定条件下,在密闭容器中进行反应:2SO2+O2=======
2SO3。当SO2、O2、SO3的浓度不再改变时,下列说法正确的是
( )
A.SO2、O2完全转化为SO3
B.正、逆反应速率相等且等于零
C.反应已达到化学平衡状态
D.SO2、O2、SO3的浓度一定相等
C
一定条件
解析:对于反应:2SO2+O2 ======= 2SO3,当SO2、O2、SO3的浓度不再改变时,反应处于平衡状态,这时反应仍然在进行,在单位时间内任一物质的消耗速率与产生速率相等,物质的浓度不变。
一定条件
5.(双选)如图是可逆反应:X2+3Y2 ==== 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
A.t2~t3时,各物质的浓度不再发生变化
B.t2时,反应达到限度
C.t2~t3时,反应已停止进行
D.t1时,反应只向正反应方向进行
AB
解析:t2~t3时正、逆反应速率相等,反应达到平衡状态,各物质的浓度不再发生变化,A正确;t2时正、逆反应速率相等,反应达到平衡状态,即反应达到限度,B正确;t2~t3时正、逆反应速率相等,反应达到平衡状态,但反应速率不为0,反应没有停止,C错误;t1时正反应速率大于逆反应速率,反应向正反应方向进行的同时也向逆反应方向进行,只是向正反应方向进行的程度大,D错误。
6.某温度下,A、B、C三种气体在恒容密闭容器中进行反应,反应从0~2 min进行过程中,在不同反应时间内各物质的量的变化情况如图所示。
(1)该反应的反应物是________,生
成物是________。
(2)化学方程式为________________。
(3)能否计算反应开始至2 min时,用
C表示的反应速率?
________,若不能,则其原因是_________________________
______________________________________________________。
A和B
C
2A+B====2C
不能
没有说明体积,无法计算各物质的物质的量浓度的变化值
(4)关于该反应的说法正确的是________(填字母,下同)。
a.到达2 min时,反应停止
b.在2 min之前A的消耗速率大于A的生成速率
c.在2 min时达到平衡状态是因为此时反应物总物质的量与生成物总物质的量相等
d.2 min时正反应速率与逆反应速率相等
bd
(5) 下列可判断反应已达到平衡状态的是________。
a.A、B、C的反应速率相等
b.A、B的反应速率之比为2∶1
c.混合气体的压强不变
d.生成1 mol C的同时消耗1 mol A和0.5 mol B
c
课时作业(十一)
化学反应的限度
化学反应条件的控制
A篇·知识对点训练
1.对于可逆反应2SO2+O2======2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于O2和SO2中
D.存在于SO2、O2和SO3中
D
催化剂
△
解析:该反应为可逆反应,加入18O2后,它与SO2反应生成SO3,因此SO3中会有18O原子,含有18O原子的SO3会部分分解为SO2和O2,18O原子可能进入O2中,也可能进入SO2中,因此最后SO2、O2和SO3中都会有18O原子。
2.下列关于化学反应限度的说法正确的是( )
A.一个可逆反应达到的平衡状态,就是这个反应在该条件下不再反应
B.当一个可逆反应达到平衡状态时,正、逆反应速率相等
C.平衡状态是一种静止的状态,反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变条件而改变
B
解析:当一个可逆反应达到平衡状态时,正、逆反应速率相等,反应物达到最大转化率,这就是这个反应在该条件下所能达到的限度,不是不再反应,仍在进行,A项错误;当一个可逆反应进行到平衡状态时,正、逆反应速率相等,B项正确;化学平衡状态是一种动态平衡,一旦条件改变,平衡就可能被破坏,化学反应的限度也就可能随之改变,C、D两项错误。
3.假设某化学反应的反应过程如图所示,观察分析,符合图中变化的化学反应为( )
A.A2+3B2===2AB3
B.2AB2+B2===2AB3
C.2A2B+5B2===4AB3
D.2AB2+B2===2AB3
B
解析:由图可知反应物用AB2、B2表示,生成物用AB3表示,反应后反应物与生成物共存,说明反应不能进行到底,为可逆反应,结合反应前后原子守恒可知反应方程式为
2AB2+B2===2AB3。
4.下列哪种说法可以证明反应N2+3H2========2NH3达到平衡状态( )
A.1个N≡N键形成的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
C
高温、高压
催化剂
解析:对于同一种物质,断裂化学键的物质的量与形成化学键的物质的量相等时,反应即达平衡。1个N≡N键断裂的同时,应该有3个H—H键形成或者6个N—H键断裂才能生成1个N≡N键。而不论反应是否达到平衡,只要有1个N≡N键断裂,肯定会有3个H—H键断裂和6个N—H键形成。
5. (双选)一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,能说明反应达到平衡状态的是( )
A.恒容时发生反应:A(g)+B(g) ==== 3C(g)
B.恒压时发生反应:A(g)+B(g) ==== 2C(g)
C.恒容时发生反应:A(g)+2B(g) ==== 2C(g)+D(g)
D.恒压时发生反应:A(g)+2B(g) ==== 3C(g)+D(s)
AD
解析:A项,恒容时发生反应A(g)+B(g) ==== 3C(g),气体的总质量始终不变,反应前后气体总物质的量发生变化,当气体的平均摩尔质量不再改变时,能说明反应达到平衡状态;
B项,恒压时发生反应A(g)+B(g) ==== 2C(g),混合气体的总质量和总物质的量均不变,平均摩尔质量不再改变,不能说明反应达到平衡状态;
C项,恒容时发生反应A(g)+2B(g) ==== 2C(g)+D(g),混合气体的总质量和总物质的量始终不变,平均摩尔质量始终不变,不能说明反应达到平衡状态;
D项,恒压时发生反应A(g)+2B(g) ==== 3C(g)+D(s),反应前后混合气体的总质量发生变化,混合气体的总物质的量一定,气体的平均摩尔质量不再改变时,能说明反应达到平衡状态。
6.一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g)=====Si3N4(s)+12HCl(g)。能表示上述反应达到化学平衡状态的是( )
A.v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
C
高温
解析:v逆(N2)和v正(H2)表示不同的反应方向,当速率之比等于化学计量数之比,则表明反应处于平衡状态,A错误。v正(HCl)和v正(SiCl4)表示同一反应方向,无论是否平衡,均成立,B错误。由于生成物中Si3N4为固体,正反应为气体质量减少的反应,当气体的密度不变时,表明反应处于平衡状态,C正确。浓度关系与平衡与否无关,D项错误。
7.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如表。据此判断下列结论正确的是( )
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为2A+B====2C
D.在t2~t3内A的平均反应速率为 mol·L-1·s-1
解析:A错误,在t3时刻反应达到平衡状态,反应没有停止;B错误,A的转化率=×100% ≈ 67%,B的转化率=×100%=40%,故A的转化率比B的转化率高;C错误,在容器中发生的反应为2A+B===C;D正确,利用公式可求算在t2~t3内A的平均反应速率为mol·L-1·s-1。
8.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)====SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出正确的结论是( )
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
D
解析:化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,A错误;a到b时正反应速率增加,反应物浓度随时间不断减小,B错误;从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,C错误;随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,则SO2的转化率将逐渐增大,D正确。
9.(双选)对于密闭容器中的反应:
N2+3H2=========2NH3,
在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
高温、高压
催化剂
A.NH3在点a′的正反应速率比点b′的正反应速率更大
B.点c反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.点e处c(NH3)不再变化
解析:A项,随着反应的进行,反应物的浓度减小,正反应速率逐渐减小,则a′点的正反应速率比b′点大,正确;B项,c点反应物和生成物的物质的量相等,但没有达到平衡状态,错误;C项,d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,错误;D项,e点处于平衡状态,点e处c(NH3)不再变化,正确。
10.在2 L容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
(1)该反应的化学方程式是______________________________。
(2)反应起始至t,Y的平均反应速率是___________________。
(3)X的转化率是________。
2X====3Y+Z
mol·L-1·min-1
33.3%
(4)关于该反应的说法正确的是________。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
BC
解析:(1)由图像知,从0~t,n(X)减小,n(Y)增加,n(Z)增加,可以确定X为反应物,Y、Z为生成物,从0~t,Δn(X)∶Δn(Y)∶Δn(Z)=0.8∶1.2∶0.4=2∶3∶1,故该反应的化学方程式为2X====3Y+Z。
(2)v(Y)= === mol·L-1·min-1。
(3)α(X)=0.82.4 mol×100%≈33.3%。
(4)t之前,v正>v逆;t时刻为平衡状态,则v正=v逆。
11.在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
是
65%
(2)下图中表示NO2变化曲线的是________,用O2表示从0~2 s内该反应的平均速率v=______________________。
b
0.001 5 mol·L-1·s-1
(3) 能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
bc
解析:(1)该反应是可逆反应,5 s时,NO转化率为:
×100%=65%。
(2)由平衡体系2NO(g)+O2(g)====2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时,c(NO2)==0.006 5 mol·L-1,故表示NO2变化曲线的为b。
v(NO)====0.003 mol·L-1·s-1,则v(O2)=12v(NO)=0.001 5 mol·L-1·s-1。
(3)a项中未指明正、逆反应速率,故无法说明该反应是否达到平衡状态;由于该反应是前后气体体积不相等的反应,当容器内压强保持不变时,说明该反应已达到平衡状态,故b项正确;c项中已说明正、逆反应速率相等,故说明该反应已达到平衡状态;由于气体总质量不变,气体总体积也不变,因此,无论该反应是否达到平衡,容器内气体密度总保持不变,故d项无法说明该反应是否达到平衡状态。
B篇·综合提升训练
12.Ⅰ.某实验小组对H2O2的分解做了如下探究:将质量相同但状态不同的MnO2分别加入盛有15 mL 5%的H2O2溶液的大试管中,并用带火星的木条测试。该实验小组研究影响H2O2分解速率的因素时记录的一组数据如表:
MnO2 触摸试 管情况 观察结果 反应完成所
需的时间
粉末状 很烫 剧烈反应,带火星的木条复燃 3.5 min
块状 微热 反应较慢,火星红亮但木条未复燃 30 min
(1) 写出大试管中发生反应的化学方程式:
______________________________________________,
该反应是________(填“放热”或“吸热”)反应。
2H2O2=========2H2O+O2↑
MnO2
放热
(2)实验结果表明,催化剂的催化效果与___________________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3 min内各
物质的物质的量的变化情况如
图所示(A、B、C均为气体)。
催化剂接触面积的大小
(3)该反应的化学方程式为___________________________。
(4)反应开始至2 min时,B的平均反应速率为________________。
(5)能说明该反应已达到平衡状态的是________(填字母)。
a.v(A)=2v(B)
b.容器内压强保持不变
c.2v逆(A)=v正(B)
d.容器内混合气体的密度保持不变
2A+B====2C
0.1 mol·L-1·min-1
b
(6)在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会减小的是________(填序号)。
①降低温度 ②加入催化剂 ③增大容器体积
①③
解析:(1)大试管中的反应是过氧化氢在二氧化锰作催化剂的条件下分解生成水和氧气,化学方程式为2H2O2=====2H2O+O2↑;试管很烫,说明反应放热。
(2)催化剂的形状不同,催化效果不同,说明催化剂的催化效果和催化剂接触面积的大小有关。
(3)从图像分析,在相同时间内,A减少了2 mol,B减少了1 mol,C增加了2 mol,所以该反应的化学方程式为2A+B===2C。
MnO2
(4)2 min内B减少了1 mol,所以v(B)=1 mol÷5 L÷2 min=0.1 mol·L-1·min-1。
(5)a.没有说明正、逆反应方向,不能说明反应已达平衡;b.压强不变说明反应达到平衡状态;c.反应达到平衡状态时,A的逆反应速率应该是B的正反应速率的2倍,表示为v逆(A)=2v正(B),所以错误;d.容器内的密度始终不变。
(6)①降温,反应速率减小;②加入催化剂,反应速率加快;③增大容器的体积,物质的浓度减小,反应速率减慢。
13.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)==========2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a的值为________。
高温、高压
催化剂
16
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。平衡时NH3的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n(始)∶n(平)=________。
(4)原混合气体中,a∶b=________。
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=_______。
8 mol
5∶4
2∶3
1∶2
解析:(1)反应方程式:
N2+3H2 =========== 2NH3
高温、高压
催化剂
开始/mol a b 0
t时刻/mol 13 6
在t时刻生成了6 mol NH3,消耗了3 mol N2,所以a=13+3=16。
(2)分析题意知,n(NH3)平==8 mol。
(3)平衡混合气体的总物质的量为n平=n(N2)平+n(H2)平+n(NH3)平= =32 mol。
N2 + 3H2 ========= 2NH3
高温、高压
催化剂
起始/mol a b 0
变化/mol 4 12 8
平衡/mol a-4 b-12 8
分析题意:a-4+b-12+8=32,a+b=40。
因a=16,故b=24。n(始)∶n(平)=5∶4。
(4)原混合气体中,a∶b=16∶24=2∶3。
(5)平衡时,N2的转化率为×100%=25%,H2的转化率为×100%=50%,故α(N2)∶α(H2)
本课结束
This lesson is over
THANKS!
第六章
化学反应与能量
第二节
化学反应的速率与限度
第2课时
化学反应的限度
化学反应条件的控制
[明确学习目标]
1.认识可逆反应,了解化学平衡的含义。
2.会判断化学平衡状态。
3.了解控制反应条件在生产和科学研究中的作用。
[核心素养对接]
通过对化学反应限度的学习,培养学生变化观念与平衡思想。
课前篇
·
自主学习固基础
一、化学反应的限度
[知识梳理]
1.可逆反应
(1) 定义:在同一条件下,既能向________________进行,同时又能向________________进行的化学反应。
正反应方向
逆反应方向
(2) 特点
①正向反应和逆向反应________进行。
②一定条件下,反应物不可能________转化为生成物,即反应物的转化率不可能达到________。
(3)表示:书写可逆反应的化学方程式时不用“===”而用“ ” 。
同时
全部
100%
2.化学平衡状态
(1) 化学平衡的建立
最大
0
逐渐减小
逐渐增大
不再改变
(2) 化学平衡状态(简称____________)
在一定条件下,可逆反应进行到一定程度时,正反应速率和逆反应速率________,反应物的浓度和生成物的浓度都_______________,达到一种表面静止的状态。
化学平衡
相等
不再改变
二、化学反应条件的控制
1.化学反应条件控制的目的
2.化工生产中反应条件的调控措施
(1) 考虑因素
化工生产中调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
(2) 实例——合成氨生产条件的选择
[自我排查]
(1)任何可逆反应都有一定的限度( )
(2)化学反应达到限度时,正、逆反应速率相等( )
(3)化学反应的限度与时间的长短无关( )
(4)化学反应的限度是不可改变的( )
一、微判断
二、尝试解答
1.2H2+O2=====2H2O和2H2O=====2H2↑+O2↑是可逆反应吗?_______________________________________________________________________________________________________________________________________________________
提示:不是;因为可逆反应必须是在同一条件下同时进行。
点燃
电解
2.在一定条件下,将1 mol N2和3 mol H2置于密闭容器中充分反应,能否得到2 molNH3。
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
提示:不能;原因是N2与H2合成氨的反应属于可逆反应,反应物转化率达不到100%。
三、微训练
1.下列说法不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应的限度可以通过改变条件来改变
C
解析:对于可逆反应,达到平衡状态时,正、逆反应速率相等,反应物的转化率最大,A、B正确;2SO2+O2======2SO3是可逆反应,无论怎样控制条件,反应物的转化率不可能达到100%,即2 mol SO2与1 mol O2反应不会生成2 mol SO3,C错;化学反应的限度可通过改变条件,如温度、压强等来改变,D正确。
催化剂
△
2.一定温度下,反应A2(g)+B2(g)=====2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol A2的同时生成n mol AB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.单位时间内生成n mol A2的同时生成n mol B2
C
解析:在一定条件下,判断一个反应是否达到平衡,主要看正、逆反应速率是否相等,体系中各组分的浓度(或含量)是否保持不变。
A项中,生成A2是逆反应,生成AB是正反应。显然v(正)
C项表明v(正)=v(逆),反应已达到平衡状态;
D项中,只说明了逆反应速率,没有说明正反应速率,且不管平衡是否建立,只要反应在进行,生成A2和B2的物质的量之比始终为1∶1。
3.(1)炭在火炉中燃烧得很旺时,在往炉膛底内的热炭上喷洒少量水的瞬间,炉子内的火会更旺这是因为
_____________________________________________________。
(2)(双选)如果欲使炉内炭更充分燃烧,下列措施可行的是
( )
A.向炉内吹空气 B.把块状炭碾碎
C.使用H2O作催化剂 D.提高炉膛内的温度
炭与水反应生成CO和H2,燃烧更快,火焰更旺
AB
解析:往炉膛底内的热炭上喷洒少量水,即在高温下炽热的炭与H2O反应:C(s)+H2O(g)=====CO(g)+H2(g),这样炭经反应变成气体燃料,燃烧时与空气接触更充分,燃烧充分且快,所以炉火更旺。使用催化剂或提高炉内温度只能更快地完成燃烧过程,而并不能为炭燃烧的更充分提供条件。
高温
课堂篇
·
重点难点要突破
研习 化学平衡
[重点讲解]
1.可逆反应的特点
2.化学平衡状态的建立过程
3.化学平衡状态的特征
4.化学平衡状态的判断
(1) 直接标志
①v正=v逆
a.同一种物质的生成速率等于消耗速率;
b.在化学方程式同一边的不同物质的生成速率与消耗速率之比等于化学计量数之比;
c.在化学方程式两边的不同物质的生成(或消耗)速率之比等于化学计量数之比。
②各组分的浓度保持一定
a.各组分的浓度不随时间的改变而改变;
b.各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
(2) 间接标志
①反应体系中的总压强不随时间的改变而变化(适用于反应前后气体体积不等的反应)。
②混合气体的密度不随时间改变而变化(适用于等压条件下反应前后气体体积不等的反应和等容条件下有固、液体参与或生成的反应)。
③全是气体参加的反应,反应前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
④对于反应混合物中存在有颜色变化的物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。
⑤对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
5.化学平衡状态判断的注意事项
(1) 化学平衡状态判断“三关注”
关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
(2) 不能作为“标志”的四种情况
①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。
②恒温恒容下体积不变的反应,体系的压强或总物质的量不再随时间而变化,如2HI(g) ===== H2(g)+I2(g)。
③全是气体参加的体积不变的反应,体系的平均相对分子质量不再随时间而变化,如2HI(g) ==== H2(g)+I2(g)。
④全是气体参加的反应,恒容条件下体系的密度保持不变。
6.有关化学平衡的简单计算
解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。如:
设a mol、b mol分别是A、B两物质起始物质的量,mx mol为反应物A转化的物质的量,nx mol为反应物B转化的物质的量,则:
mA(g)+nB(g) ===== pC(g)+qD(g)
起始/mol a b 0 0
转化/mol mx nx px qx
平衡/mol a-mx b-nx px qx
(1)关于反应物转化率的计算
A的转化率=×100% (计算式中A的量可以指反应物的物质的量、质量、浓度、体积等)。
(2)关于某组分的体积分数的计算
A的体积分数=×100%。
注意:(1)转化量与化学方程式中各物质的化学计量数成比例;(2)这里a、b可指物质的量、浓度、体积等;(3)对于反应物:平衡时的量=起始的量-转化的量;对于生成物:平衡时的量=起始的量+转化的量。同时要注意差量法、守恒法等简单计算方法在化学平衡中的应用。
[联想质疑]
德国化学家哈伯(F.Haber,1868—1934)研究出由氮气和氢气直接合成氨的方法,即“循环法”。在此基础上,他继续研究并改进了合成工艺,使氨的产率达到8%。这是工业普遍采用的直接合成法。反应过程中为解决氢气和氮气合成转化率的问题,将氨产品从合成反应后的气体中分离出来,未反应气和新鲜氢氮气混合重新参与合成反应。
合成氨反应的化学方程式:N2+3H2========2NH3(该反应为可逆反应)。
高温、高压
催化剂
[问题探讨]
1.一定条件下,向容积不变的密闭容器中充入1 mol N2和3 mol H2发生合成氨的反应,反应过程中正、逆反应速率如何变化?正、逆反应速率达到何种关系时反应达到平衡状态?
提示:反应过程中,正反应速率开始最大,后逐渐减小,逆反应速率开始为0,后逐渐增大;当用同种物质表示的正、逆反应速率相等时,反应达到平衡状态。
2.一定条件下,密闭容器中进行合成氨的反应,当1个N≡N键断裂的同时,有6个N—H键形成,此时反应是否处于平衡状态?当反应达平衡后,反应是否停止?
提示:不能判断反应是否处于平衡状态,因为1个N≡N键断裂和6个N—H键形成均指正反应方向,反应过程中的任何时刻均存在上述关系。当反应达到平衡状态后,反应并没有停止,此时v正=v逆≠0。
3.一定条件下,在容积不变的密闭容器中进行合成氨的反应,当容器中压强不变时,反应是否处于平衡状态?当容器中气体的密度不变时,反应是否处于平衡状态?
提示:由于合成氨的反应是气体物质的量减小的反应,故容器内气体的压强会逐渐减小,当压强不变时,说明反应处于平衡状态。容器中气体的密度ρ=,因反应物、生成物均为气体,故气体的总质量不变,则气体的密度在反应过程中保持不变,因此,不能判断反应是否处于平衡状态。
[举一反三]
1.N2(g)+3H2(g)=========2NH3(g)在体积不变的密闭容器中反应,下列叙述表示处于化学平衡状态的是( )
A.N2、H2、NH3的浓度比为1∶3∶2的状态
B.混合气体的密度不随时间而变化
C.当有1 mol N≡N键断裂时,有6 mol N—H键断裂
D.单位时间内消耗a mol N2的同时消耗3a mol的H2的状态
C
高温、高压
催化剂
解析:A中,N2、H2、NH3的浓度之比等于化学计量数之比时,不能确定是否处于平衡状态;
因容器的体积不变,而混合气体的总质量不改变,则无论平衡与否,混合气体的密度均不变,不能确定是否处于平衡状态;
当有1 mol N≡N键断裂时,相当于有1 mol N2发生反应生成2 mol NH3,即生成6 mol N—H键(1 mol NH3中含有3 mol N—H键),与有6 mol N—H键断裂符合v(NH3)正=v(NH3)逆,故处于化学平衡状态;
消耗a mol N2的同时消耗3a mol H2是同向的,不管平衡与否,只要N2和H2反应就一定符合该比例,不能确定是否处于平衡状态。
2.(双选)一定温度下,可逆反应:A(g) +3B(g)====2C(g)达到限度的标志是 ( )
A.C的生成速率与A的消耗速率相等
B.单位时间内生成n mol A,同时消耗3n mol B
C.A、B、C的浓度不再变化
D.A、B、C的分子数之比为1∶3∶2
BC
解析:A项中C的生成速率和A的消耗速率不可能相等;B项中生成A与消耗B的反应方向相反,且生成A与消耗B的物质的量之比为化学计量数之比,故反应达到平衡状态;C项中表示各物质的浓度保持不变,即表明化学反应已达到平衡状态;D项中平衡时,A、B、C的分子数之比与化学计量数之比没有必然关系。
3.一定温度下,在恒容密闭容器中进行的可逆反应:
2NO2(g)=====2NO(g)+O2(g)。
判断下列描述中该反应处于平衡状态的是________。
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤密闭容器中压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
解析:①中单位时间内生成n mol O2的同时生成2n mol的NO2,即正反应速率等于逆反应速率,能说明反应达到平衡状态;
②中描述的都是正反应方向的速率,不能说明反应是否处于平衡状态;
③中无论反应是否达平衡状态,同向的速率之比一定等于化学方程式中相应物质的化学计量数之比;
④中混合气体的颜色不变,即c(NO2)保持不变,说明反应处于平衡状态;
⑤、⑥因该反应是一个反应前后气体物质的量不等的反应,容器的体积固定,故气体的压强不变,气体的平均相对分子质量不变,均能说明反应处于平衡状态。
[规律方法]
利用“变量”与“不变量”来判断化学平衡状态
(1) 选变量
选定反应中“变量”,即随反应进行而变化的量,当变量不再变化时,反应已达平衡。
(2)常见的变量
①气体的颜色;
②对于气体体积有变化的反应来说,恒压反应时的体积、恒容反应时的压强;
③对于反应体系中全部为气体,且气体物质的量有变化的反应来说,混合气体的平均相对分子质量;
④对于反应体系中不全部为气体的反应来说,恒容时混合气体的密度等。
(3) 说明
在利用M、ρ、n(总)、p(总)判断时要注意反应特点和容器的体积变化问题。
演习篇
·
学业测试速达标
1.下列对化学反应速率与化学反应限度的叙述中,不正确的是 ( )
A.当化学反应达到最大限度时反应速率为0
B.同一化学反应,若反应条件不同,限度可能不同
C.化学反应达到限度时,正、逆反应速率相等
D.化学反应的限度与时间的长短无关
A
解析:A项反应达到最大限度时v正=v逆≠0,A项错误;同一化学反应,条件改变,化学平衡可能被破坏,反应限度可能就会被改变,B项正确;任何可逆反应都有一定的限度,当反应达到限度时,即反应达到化学平衡,此时v(正)=v(逆),对同一可逆反应,达到化学平衡时,当外界条件不变时,反应的限度不变,与时间长短无关。
2.下列各组反应互为可逆反应的是( )
①2NaHCO3=====Na2CO3+CO2↑+H2O与CO2+H2O+Na2CO3
===2NaHCO3
②SO2+H2O===H2SO3与H2SO3===SO2+H2O
③N2+3H2=========2NH3与2NH3========= 3H2+N2
④NH3+HCl===NH4Cl与NH4Cl=====NH3↑+HCl↑
A.①② B.②③ C.③④ D.①④
B
△
高温、高压
催化剂
高温、高压
催化剂
△
解析:①④中两反应条件不相同,不互为可逆反应。
3.相同温度和压强下,在容积为2 L的密闭容器中发生反应:2HI(g) ==== H2(g)+I2(g),反应达到平衡状态的标志是( )
A.c(H2)保持不变
B.c(H2)=c(I2)
C.2v正(HI)=v逆(I2)
D.断开2 mol H—I共价键,同时生成1 mol H—H共价键
A
解析:在一定条件下的可逆反应中,如果正、逆反应速率相等,各组分的百分含量保持不变,则达到化学平衡状态。A项,c(H2)保持不变,符合要求;B项,c(H2)=c(I2),不一定是达到平衡,不符合要求;C项,应为v正(HI)=2v逆(I2),错误;D项,断开2 mol H—I共价键是正反应,同时生成1 mol H—H共价键,也是正反应,错误。
4.一定条件下,在密闭容器中进行反应:2SO2+O2=======
2SO3。当SO2、O2、SO3的浓度不再改变时,下列说法正确的是
( )
A.SO2、O2完全转化为SO3
B.正、逆反应速率相等且等于零
C.反应已达到化学平衡状态
D.SO2、O2、SO3的浓度一定相等
C
一定条件
解析:对于反应:2SO2+O2 ======= 2SO3,当SO2、O2、SO3的浓度不再改变时,反应处于平衡状态,这时反应仍然在进行,在单位时间内任一物质的消耗速率与产生速率相等,物质的浓度不变。
一定条件
5.(双选)如图是可逆反应:X2+3Y2 ==== 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
A.t2~t3时,各物质的浓度不再发生变化
B.t2时,反应达到限度
C.t2~t3时,反应已停止进行
D.t1时,反应只向正反应方向进行
AB
解析:t2~t3时正、逆反应速率相等,反应达到平衡状态,各物质的浓度不再发生变化,A正确;t2时正、逆反应速率相等,反应达到平衡状态,即反应达到限度,B正确;t2~t3时正、逆反应速率相等,反应达到平衡状态,但反应速率不为0,反应没有停止,C错误;t1时正反应速率大于逆反应速率,反应向正反应方向进行的同时也向逆反应方向进行,只是向正反应方向进行的程度大,D错误。
6.某温度下,A、B、C三种气体在恒容密闭容器中进行反应,反应从0~2 min进行过程中,在不同反应时间内各物质的量的变化情况如图所示。
(1)该反应的反应物是________,生
成物是________。
(2)化学方程式为________________。
(3)能否计算反应开始至2 min时,用
C表示的反应速率?
________,若不能,则其原因是_________________________
______________________________________________________。
A和B
C
2A+B====2C
不能
没有说明体积,无法计算各物质的物质的量浓度的变化值
(4)关于该反应的说法正确的是________(填字母,下同)。
a.到达2 min时,反应停止
b.在2 min之前A的消耗速率大于A的生成速率
c.在2 min时达到平衡状态是因为此时反应物总物质的量与生成物总物质的量相等
d.2 min时正反应速率与逆反应速率相等
bd
(5) 下列可判断反应已达到平衡状态的是________。
a.A、B、C的反应速率相等
b.A、B的反应速率之比为2∶1
c.混合气体的压强不变
d.生成1 mol C的同时消耗1 mol A和0.5 mol B
c
课时作业(十一)
化学反应的限度
化学反应条件的控制
A篇·知识对点训练
1.对于可逆反应2SO2+O2======2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于O2和SO2中
D.存在于SO2、O2和SO3中
D
催化剂
△
解析:该反应为可逆反应,加入18O2后,它与SO2反应生成SO3,因此SO3中会有18O原子,含有18O原子的SO3会部分分解为SO2和O2,18O原子可能进入O2中,也可能进入SO2中,因此最后SO2、O2和SO3中都会有18O原子。
2.下列关于化学反应限度的说法正确的是( )
A.一个可逆反应达到的平衡状态,就是这个反应在该条件下不再反应
B.当一个可逆反应达到平衡状态时,正、逆反应速率相等
C.平衡状态是一种静止的状态,反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变条件而改变
B
解析:当一个可逆反应达到平衡状态时,正、逆反应速率相等,反应物达到最大转化率,这就是这个反应在该条件下所能达到的限度,不是不再反应,仍在进行,A项错误;当一个可逆反应进行到平衡状态时,正、逆反应速率相等,B项正确;化学平衡状态是一种动态平衡,一旦条件改变,平衡就可能被破坏,化学反应的限度也就可能随之改变,C、D两项错误。
3.假设某化学反应的反应过程如图所示,观察分析,符合图中变化的化学反应为( )
A.A2+3B2===2AB3
B.2AB2+B2===2AB3
C.2A2B+5B2===4AB3
D.2AB2+B2===2AB3
B
解析:由图可知反应物用AB2、B2表示,生成物用AB3表示,反应后反应物与生成物共存,说明反应不能进行到底,为可逆反应,结合反应前后原子守恒可知反应方程式为
2AB2+B2===2AB3。
4.下列哪种说法可以证明反应N2+3H2========2NH3达到平衡状态( )
A.1个N≡N键形成的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
C
高温、高压
催化剂
解析:对于同一种物质,断裂化学键的物质的量与形成化学键的物质的量相等时,反应即达平衡。1个N≡N键断裂的同时,应该有3个H—H键形成或者6个N—H键断裂才能生成1个N≡N键。而不论反应是否达到平衡,只要有1个N≡N键断裂,肯定会有3个H—H键断裂和6个N—H键形成。
5. (双选)一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,能说明反应达到平衡状态的是( )
A.恒容时发生反应:A(g)+B(g) ==== 3C(g)
B.恒压时发生反应:A(g)+B(g) ==== 2C(g)
C.恒容时发生反应:A(g)+2B(g) ==== 2C(g)+D(g)
D.恒压时发生反应:A(g)+2B(g) ==== 3C(g)+D(s)
AD
解析:A项,恒容时发生反应A(g)+B(g) ==== 3C(g),气体的总质量始终不变,反应前后气体总物质的量发生变化,当气体的平均摩尔质量不再改变时,能说明反应达到平衡状态;
B项,恒压时发生反应A(g)+B(g) ==== 2C(g),混合气体的总质量和总物质的量均不变,平均摩尔质量不再改变,不能说明反应达到平衡状态;
C项,恒容时发生反应A(g)+2B(g) ==== 2C(g)+D(g),混合气体的总质量和总物质的量始终不变,平均摩尔质量始终不变,不能说明反应达到平衡状态;
D项,恒压时发生反应A(g)+2B(g) ==== 3C(g)+D(s),反应前后混合气体的总质量发生变化,混合气体的总物质的量一定,气体的平均摩尔质量不再改变时,能说明反应达到平衡状态。
6.一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g)=====Si3N4(s)+12HCl(g)。能表示上述反应达到化学平衡状态的是( )
A.v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
C
高温
解析:v逆(N2)和v正(H2)表示不同的反应方向,当速率之比等于化学计量数之比,则表明反应处于平衡状态,A错误。v正(HCl)和v正(SiCl4)表示同一反应方向,无论是否平衡,均成立,B错误。由于生成物中Si3N4为固体,正反应为气体质量减少的反应,当气体的密度不变时,表明反应处于平衡状态,C正确。浓度关系与平衡与否无关,D项错误。
7.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如表。据此判断下列结论正确的是( )
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为2A+B====2C
D.在t2~t3内A的平均反应速率为 mol·L-1·s-1
解析:A错误,在t3时刻反应达到平衡状态,反应没有停止;B错误,A的转化率=×100% ≈ 67%,B的转化率=×100%=40%,故A的转化率比B的转化率高;C错误,在容器中发生的反应为2A+B===C;D正确,利用公式可求算在t2~t3内A的平均反应速率为mol·L-1·s-1。
8.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)====SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出正确的结论是( )
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
D
解析:化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,A错误;a到b时正反应速率增加,反应物浓度随时间不断减小,B错误;从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,C错误;随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,则SO2的转化率将逐渐增大,D正确。
9.(双选)对于密闭容器中的反应:
N2+3H2=========2NH3,
在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
高温、高压
催化剂
A.NH3在点a′的正反应速率比点b′的正反应速率更大
B.点c反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.点e处c(NH3)不再变化
解析:A项,随着反应的进行,反应物的浓度减小,正反应速率逐渐减小,则a′点的正反应速率比b′点大,正确;B项,c点反应物和生成物的物质的量相等,但没有达到平衡状态,错误;C项,d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,错误;D项,e点处于平衡状态,点e处c(NH3)不再变化,正确。
10.在2 L容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
(1)该反应的化学方程式是______________________________。
(2)反应起始至t,Y的平均反应速率是___________________。
(3)X的转化率是________。
2X====3Y+Z
mol·L-1·min-1
33.3%
(4)关于该反应的说法正确的是________。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
BC
解析:(1)由图像知,从0~t,n(X)减小,n(Y)增加,n(Z)增加,可以确定X为反应物,Y、Z为生成物,从0~t,Δn(X)∶Δn(Y)∶Δn(Z)=0.8∶1.2∶0.4=2∶3∶1,故该反应的化学方程式为2X====3Y+Z。
(2)v(Y)= === mol·L-1·min-1。
(3)α(X)=0.82.4 mol×100%≈33.3%。
(4)t之前,v正>v逆;t时刻为平衡状态,则v正=v逆。
11.在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
是
65%
(2)下图中表示NO2变化曲线的是________,用O2表示从0~2 s内该反应的平均速率v=______________________。
b
0.001 5 mol·L-1·s-1
(3) 能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
bc
解析:(1)该反应是可逆反应,5 s时,NO转化率为:
×100%=65%。
(2)由平衡体系2NO(g)+O2(g)====2NO2(g)知,NO2为生成物,初始状态时,c(NO2)=0,随反应的进行,c(NO2)逐渐增大,当达到平衡时,c(NO2)==0.006 5 mol·L-1,故表示NO2变化曲线的为b。
v(NO)====0.003 mol·L-1·s-1,则v(O2)=12v(NO)=0.001 5 mol·L-1·s-1。
(3)a项中未指明正、逆反应速率,故无法说明该反应是否达到平衡状态;由于该反应是前后气体体积不相等的反应,当容器内压强保持不变时,说明该反应已达到平衡状态,故b项正确;c项中已说明正、逆反应速率相等,故说明该反应已达到平衡状态;由于气体总质量不变,气体总体积也不变,因此,无论该反应是否达到平衡,容器内气体密度总保持不变,故d项无法说明该反应是否达到平衡状态。
B篇·综合提升训练
12.Ⅰ.某实验小组对H2O2的分解做了如下探究:将质量相同但状态不同的MnO2分别加入盛有15 mL 5%的H2O2溶液的大试管中,并用带火星的木条测试。该实验小组研究影响H2O2分解速率的因素时记录的一组数据如表:
MnO2 触摸试 管情况 观察结果 反应完成所
需的时间
粉末状 很烫 剧烈反应,带火星的木条复燃 3.5 min
块状 微热 反应较慢,火星红亮但木条未复燃 30 min
(1) 写出大试管中发生反应的化学方程式:
______________________________________________,
该反应是________(填“放热”或“吸热”)反应。
2H2O2=========2H2O+O2↑
MnO2
放热
(2)实验结果表明,催化剂的催化效果与___________________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3 min内各
物质的物质的量的变化情况如
图所示(A、B、C均为气体)。
催化剂接触面积的大小
(3)该反应的化学方程式为___________________________。
(4)反应开始至2 min时,B的平均反应速率为________________。
(5)能说明该反应已达到平衡状态的是________(填字母)。
a.v(A)=2v(B)
b.容器内压强保持不变
c.2v逆(A)=v正(B)
d.容器内混合气体的密度保持不变
2A+B====2C
0.1 mol·L-1·min-1
b
(6)在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会减小的是________(填序号)。
①降低温度 ②加入催化剂 ③增大容器体积
①③
解析:(1)大试管中的反应是过氧化氢在二氧化锰作催化剂的条件下分解生成水和氧气,化学方程式为2H2O2=====2H2O+O2↑;试管很烫,说明反应放热。
(2)催化剂的形状不同,催化效果不同,说明催化剂的催化效果和催化剂接触面积的大小有关。
(3)从图像分析,在相同时间内,A减少了2 mol,B减少了1 mol,C增加了2 mol,所以该反应的化学方程式为2A+B===2C。
MnO2
(4)2 min内B减少了1 mol,所以v(B)=1 mol÷5 L÷2 min=0.1 mol·L-1·min-1。
(5)a.没有说明正、逆反应方向,不能说明反应已达平衡;b.压强不变说明反应达到平衡状态;c.反应达到平衡状态时,A的逆反应速率应该是B的正反应速率的2倍,表示为v逆(A)=2v正(B),所以错误;d.容器内的密度始终不变。
(6)①降温,反应速率减小;②加入催化剂,反应速率加快;③增大容器的体积,物质的浓度减小,反应速率减慢。
13.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)==========2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a的值为________。
高温、高压
催化剂
16
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。平衡时NH3的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n(始)∶n(平)=________。
(4)原混合气体中,a∶b=________。
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=_______。
8 mol
5∶4
2∶3
1∶2
解析:(1)反应方程式:
N2+3H2 =========== 2NH3
高温、高压
催化剂
开始/mol a b 0
t时刻/mol 13 6
在t时刻生成了6 mol NH3,消耗了3 mol N2,所以a=13+3=16。
(2)分析题意知,n(NH3)平==8 mol。
(3)平衡混合气体的总物质的量为n平=n(N2)平+n(H2)平+n(NH3)平= =32 mol。
N2 + 3H2 ========= 2NH3
高温、高压
催化剂
起始/mol a b 0
变化/mol 4 12 8
平衡/mol a-4 b-12 8
分析题意:a-4+b-12+8=32,a+b=40。
因a=16,故b=24。n(始)∶n(平)=5∶4。
(4)原混合气体中,a∶b=16∶24=2∶3。
(5)平衡时,N2的转化率为×100%=25%,H2的转化率为×100%=50%,故α(N2)∶α(H2)
本课结束
This lesson is over
THANKS!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
