7.3.1 乙醇 课件(共107张PPT)
文档属性
| 名称 | 7.3.1 乙醇 课件(共107张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 24.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-23 00:00:00 | ||
图片预览










文档简介
(共107张PPT)
第七章
有机化合物
第三节
乙醇与乙酸
第1课时
乙醇
[明确学习目标]
1.了解烃的衍生物和官能团的概念。
2.掌握乙醇的组成及主要性质。
3.了解乙醇的主要用途及与人类日常生活和健康的关系。
4.初步学会分析官能团与性质关系的方法。
[核心素养对接]
通过对乙醇结构和性质的学习,培养学生宏观辨识与微观探析的能力。
课前篇
·
自主学习固基础
一、烃的衍生物
[知识梳理]
1.烃的衍生物
烃分子中的________被其他________或________所________而生成的一系列化合物称为烃的衍生物。如:乙醇可看成是__________中的一个氢原子被________取代后的产物。
氢原子
原子
原子团
取代
乙烷分子
羟基
2.官能团
决定有机化合物____________的原子或原子团。如
(________)、—OH(________)、 (碳碳双键)等。
特性
碳氯键
羟基
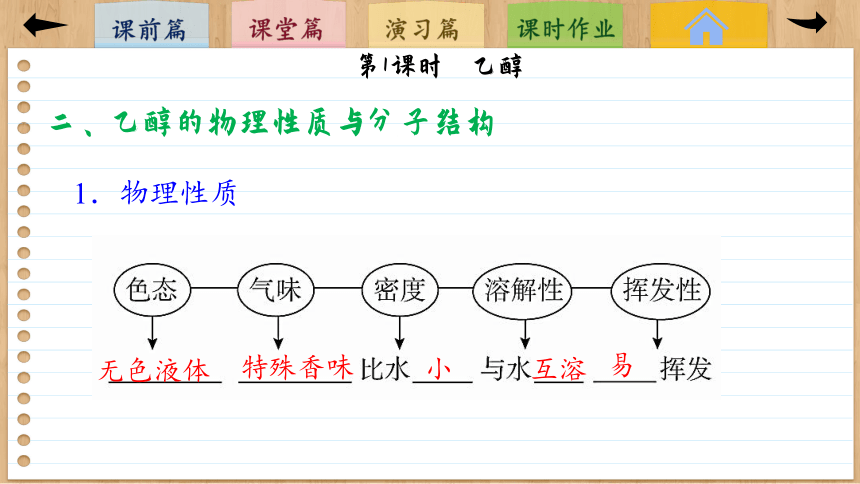
二、乙醇的物理性质与分子结构
1.物理性质
无色液体
特殊香味
小
互溶
易
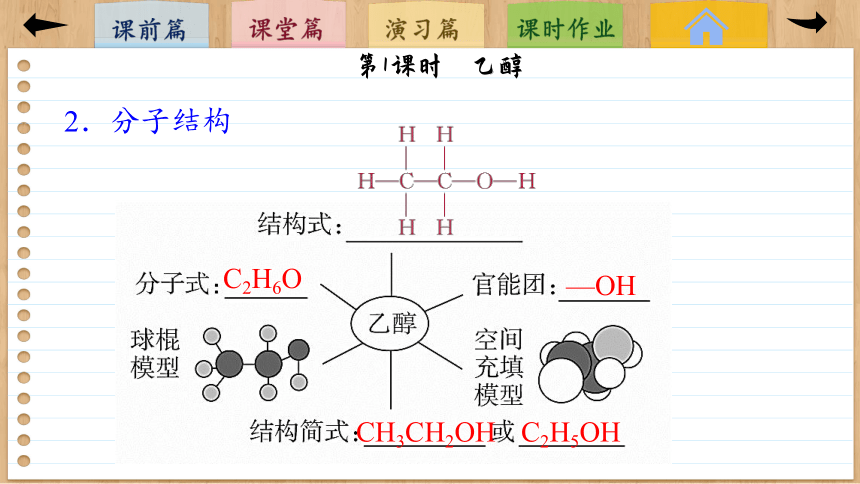
2.分子结构
C2H6O
—OH
CH3CH2OH
C2H5OH
三、乙醇的化学性质
[实验7-4]
实验操作
实验现象 ①钠沉于试管底部,最终慢慢消失,产生无色可燃性气体;
②烧杯内壁有________产生;
③向烧杯中加入澄清石灰水,石灰水____________
产物检验 乙醇与钠反应生成的气体是________
续表
液滴
不变浑浊
H2
1. 乙醇与钠的反应
(1)发生反应的化学方程式为___________________________________________________。
(2) 由实验可知,乙醇与金属钠的反应比水与金属钠的反应平缓得多,说明乙醇羟基中的氢原子不如水分子中的氢原子____________________。
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
活泼
2.乙醇的氧化反应
(1) 乙醇的燃烧
乙醇在空气中燃烧时,放出大量的热:______________________________________________________
____________________________________________。
CH3CH2OH+3O2 ――→ 2CO2+3H2O
点燃
(2) 乙醇的催化氧化
[实验7-5]
实验操作
实验现象 红色光亮的铜丝灼烧后变为黑色,趁热插入乙醇中,铜丝又变为红色。反复几次,闻到试管中的液体有刺激性气味
续表
乙醇在加热和催化剂的作用下,可以被空气中的O2氧化为乙醛:_________________________________________________。
(3)乙醇还可以被一些强氧化剂,如____________________、____________________等直接氧化成乙酸。
2CH3CH2OH+O2――→2CH3CHO+2H2O
催化剂
△
酸性KMnO4溶液
酸性K2Cr2O7溶液
[自我排查]
(1)能用分液的方法分离酒精和水的混合物( )
(2)可用无水硫酸铜检验工业酒精中是否有水( )
(3)乙醇中的羟基不如水中的羟基活泼( )
(4)乙醇分子中含有六个氢原子,故1 mol乙醇与足量的钠反应可以生成3 mol的氢气( )
一、微判断
二、尝试解答
1.能否用乙醇萃取溴水中的溴单质??
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
提示:不能。因为乙醇与水以任意比例互溶。
2.如何证明一个乙醇分子中含有一个羟基?_____________________________________________________________________________________________________________________________________________________________________________________________________________________
提示:根据1 mol乙醇与足量金属钠反应产生0.5 mol氢气,即可证明一个乙醇分子中含有一个羟基。
3.如何检验乙醇中是否含有水?________________________________________________________________________________________________________________________________________________
提示:检验乙醇中是否含有水通常加入无水硫酸铜固体,无水硫酸铜固体变蓝,则证明其中含有水。
三、微训练
1.把质量为m g的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为m g的是( )
A.稀硫酸 B.烧碱溶液
C.乙醇 D.蒸馏水
C
2.下列物质中不能用来区分乙醇和苯的是( )
A.金属钠 B.溴水
C.碳酸钠溶液 D.四氯化碳
D
解析:乙醇和金属钠反应缓慢,苯和金属钠不反应,可以区分,A不符合题意;乙醇溶于溴水,且不分层,苯可以把溴水中的溴萃取出来,出现分层,可以区分,B不符合题意;乙醇和碳酸钠溶液互溶,不分层,苯不溶于碳酸钠溶液,出现分层,可以区分,C不符合题意;乙醇和苯均与四氯化碳互溶,不分层,无法区分二者,D符合题意。
3.下列物质属于烃的衍生物的是______________。
④ ⑤CH3CHO ⑥CH3CH2CH2OH
⑦CH3COOH
②④⑤⑥⑦
解析:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列物质称为烃的衍生物。即烃的衍生物除了含有C、H元素之外,还含有其他元素。
课堂篇
·
重点难点要突破
研习1 乙醇的物理性质及分子结构
[重点讲解]
1.乙醇沸点低,易挥发,应密封保存。
2.含乙醇99.5%(体积分数)以上的叫无水乙醇,制无水乙醇时,要加入新制的生石灰再进行蒸馏,直接蒸馏得不到无水乙醇。
3.—OH(羟基)与OH-(氢氧根离子)的区别
名称 区别 羟基 氢氧根离子
电子式 H [ H]-
电性 不显电性 显负电性
O
..
.
. .
..
O
..
. .
. .
..
稳定程度 不稳定 较稳定
存在 不能独立存在,必须与其他基团结合在一起 能独立存在
来源 H2O失去H的剩余部分 H2O失去H+的剩余部分
相同点 组成元素相同
名称 区别 羟基 氢氧根离子
续表
[联想质疑]
俗话说“酒香不怕巷子深”,意思就是说如果酒酿得好,就是在很深的巷子里,也会有人闻香知味,前来品尝。
[问题探讨]
1.能闻到酒的香味,体现了乙醇的什么性质?
提示:乙醇的挥发性。
2.乙醇能与水以任意比互溶,如何制备无水乙醇?
提示:加生石灰后,加热蒸馏可制得无水乙醇。
3.某有机物的分子式为C2H6O,依据C、H、O的成键特点,判断C2H6O有几种结构?试一一写出它们的结构式,找出乙醇分子,并判断其官能团是什么。
提示:C2H6O的结构有2种,分别为 、 ;
乙醇分子中的官能团是羟基(—OH)。
[举一反三]
1.下列有关乙醇的物理性质的应用中,不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比例溶解于水,所以可以配制不同浓度的酒精溶液
D.由于乙醇容易挥发,所以才有“酒香不怕巷子深”的说法
A
解析:乙醇的密度比水小,但可与水以任意比例互溶,故除去乙醇中的水不能用分液的方法,应先加入生石灰,然后蒸馏。
2.下列关于羟基和氢氧根离子的说法不正确的是( )
A.羟基比氢氧根离子少一个电子
B.二者的组成元素相同
C.羟基不带电,氢氧根离子带一个单位负电荷
D.羟基比氢氧根离子性质稳定
D
解析:羟基和氢氧根离子都是由氢、氧两种元素组成的,其电子式分别为 H和[ H]-,由电子式可知A、B、C正确;羟基中氧原子未达到稳定结构,所以羟基不如氢氧根离子性质稳定,D错误。
O
..
. .
. .
..
O
..
.
. .
..
3.比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
B
解析:乙烷和乙醇的结构简式分别为CH3CH3和CH3CH2OH,所以A、C、D三项正确;乙醇分子中的六个H原子可分为三种,所以B项错误。
研习2 乙醇的化学性质
[重点讲解]
1.乙醇反应时的断键情况
乙醇参与的反应 键的断裂
与钠反应 断①键
燃烧 断①②③④⑤键
催化氧化 断①③键
2.乙醇催化氧化的实质
(1)
总反应的化学方程式为
2CH3CH2OH+O2 ——→ 2CH3CHO+2H2O,
反应中Cu作催化剂。
Cu
△
(2) 反应生成的乙醛是一种无色、具有刺激性气味的液体,与水、乙醇互溶。结构简式为CH3CHO或加 。
(3)乙醇被强氧化剂氧化
乙醇若遇到强氧化剂,如酸性高锰酸钾溶液或酸性重铬酸钾(K2Cr2O7)溶液,可被氧化为乙酸。
CH3CH2OH―――――――――→CH3COOH
KMnO4(H+、aq)
或K2Cr2O7(H+、aq)
(1) 有机反应中,有机物“去氢”或“加氧”的反应称为氧化反应;“加氢”或“去氧”的反应称为还原反应。
(2) 含有—OH的有机物都能与Na反应,如CH3OH(甲醇)、HOCH2CH2OH(乙二醇)等,且1 mol —OH~ mol H2,该关系式常用于确定有机物分子中含有—OH的数目。
[知识拓展]
(3) 乙醇作为一种还原性物质,在酸性条件下,会与橙色的重铬酸钾溶液发生氧化还原反应,得到含Cr3+的绿色溶液,发生反应的化学方程式为3CH3CH2OH+2K2Cr2O7(橙色)+8H2SO4 ――→ 3CH3COOH+2Cr2(SO4)3(绿色)+11H2O+2K2SO4,此反应原理可用于酒精测试,若由橙色变成绿色,则可以判断驾驶员饮酒超过规定标准。
[探究活动]
[实验1] 探究乙醇与钠的反应
实验 操作
实验 现象 ①钠开始沉于试管底部,最终慢慢消失,产生无色可燃性气体;
②烧杯内壁有水珠产生;
③向烧杯中加入澄清石灰水,澄清石灰水不变浑浊
续表
[问题探讨]
1.通过乙醇与钠反应的实验现象,判断产生气体的成分是什么?写出反应的化学方程式。
提示:乙醇与钠反应生成氢气;反应的化学方程式为
2C2H5OH+2Na―→2C2H5ONa+H2↑。
2.如何证明分子式为C2H6O的有机物的结构式是
还是
提示:通过与钠反应,测定产生氢气的量来证明。取1 mol的该有机物与足量的钠反应,测定产生氢气的量,若产生氢气的量为0.5 mol,则证明结构式为 。
3.对比钠与水、钠与乙醇反应的实验现象,比较水和乙醇中羟基氢原子的活泼性。
提示:钠与水反应比钠与乙醇反应剧烈,说明水中的氢原子比乙醇中的羟基氢原子活泼。
[实验2] 探究乙醇的催化氧化反应
实验操作
实验现象 红色光亮的铜丝灼烧后变为黑色,趁热插入乙醇中,铜丝又变为红色。反复几次,闻到试管中的液体有刺激性气味
[问题探讨]
4.实验过程中为什么要把铜丝绕成螺旋状?
提示:增大反应物接触面积,提高反应速率。
5.上述实验过程中,铜丝加热变黑,伸入乙醇中又变红色的原因是什么?反应过程中铜丝的作用是什么?
提示:铜丝变黑是由于铜与空气中的O2反应生成了黑色的氧化铜;伸入乙醇中又变红的原因是CuO被乙醇还原为红色的单质铜;反应过程中铜丝起催化剂的作用。
6.反复几次实验后,闻到试管中有刺激性气味的物质生成,其成分是什么?其中含有的官能团是什么?写出该反应的化学方程式。
提示:乙醛;醛基(—CHO);
2CH3CH2OH+O2―――→2CH3CHO+2H2O。
Cu
△
[举一反三]
1.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述中,正确的是( )
A.钠块沉在乙醇液面的下面
B.钠块熔化成小球
C.钠块在乙醇的液面上游动
D.钠块剧烈反应放出气体
A
解析:因 ρNa > ρ 乙醇,故钠在乙醇液面以下,A正确,则C不正确。因Na与乙醇反应缓慢,故B、D不正确。
2.关于乙醇的说法正确的是( )
A.乙醇结构中有—OH,所以乙醇溶于水,可以电离出OH-而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应比相同条件下水与钠的反应更加平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
D
解析:乙醇不能电离出氢氧根离子,—OH和OH-是完全不同的粒子;乙醇的氧化反应表现的是乙醇的还原性;乙醇与钠反应可以产生氢气,并不是氢离子的性质,不能说明乙醇显酸性。
3.乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断键情况的说明不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③键
C.在银催化共热下与O2反应时断裂①和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
C
解析:乙醇与钠反应生成乙醇钠,是羟基中的O—H键断裂,A正确;乙醇催化氧化生成乙醛时,断裂①和③键,B正确,C错误;乙醇完全燃烧时,化学键①②③④⑤全部断裂。
[规律方法]
乙醇分子中羟基氢的性质
(1) 在乙醇分子中,被钠置换出的氢是羟基中的氢原子,而不是乙基中的氢原子。
(2) CH3CH2OH中羟基中的氢能被置换出来,但CH3CH2OH是非电解质,不能电离出H+。
演习篇
·
学业测试速达标
1.下列说法错误的是( )
A.乙烯:CH2===CH2,官能团为
B.乙炔:CH≡CH,官能团为—C≡C—
C.乙醇:CH3CH2OH,官能团为—OH
D.乙醛:CH3CHO,官能团为—COH
D
解析:醛基写成 或—CHO,—COH是错误写法。
2.下列物质属于烃的衍生物的是( )
① CH3CH3 ② ③ CH3CH2Br
④ ⑤ CH3CH2OH ⑥ CH2ClCH3
A.③④⑤ B.③④⑤⑥
C.②③④⑤ D.②③④⑤⑥
B
解析:③④⑤⑥中相当于烃分子中的氢原子分别被—Br、—NO2、—OH、—Cl取代,故属于烃的衍生物。
3.下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,如变蓝则含水 ②除去乙醇中微量水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④获得无水乙醇的方法通常采用先用生石灰吸水,然后再加热蒸馏
A.①③ B.②④
C.①④ D.③④
C
解析:用无水CuSO4可检验是否有水存在,因为无水CuSO4遇水变蓝,故①正确;乙醇和水均与金属钠反应生成气体,故②错误;含水的酒精直接加热蒸馏,水也会挥发,酒精不纯,故③错误,④正确。
4.(2020·全国卷Ⅰ)国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )
A.CH3CH2OH能与水互溶
B.NaClO通过氧化灭活病毒
C.过氧乙酸相对分子质量为76
D.氯仿的化学名称是四氯化碳
D
解析:本题考查多种常见消毒剂涉及的化学学科知识,体现科学精神与社会责任的化学核心素养。乙醇分子与水可以形成分子间氢键,所以乙醇能与水互溶,A正确;次氯酸钠具有强氧化性,能使病毒中蛋白质变性,故次氯酸钠通过氧化灭活病毒,B正确;过氧乙酸的分子式是C2H4O3,相对分子质量为76,C正确;氯仿的分子式为CHCl3,化学名称为三氯甲烷,D错误。
5.下列说法正确的是( )
A.检测乙醇中是否含有水可加入少量的无水硫酸铜,如果变蓝则含水
B.除去乙醇中的微量水可加入金属钠,使其完全反应
C.获得无水乙醇的方法通常采用先用浓H2SO4吸水,然后再加热蒸馏的方法
D.获得无水乙醇的方法通常采用直接加热蒸馏的方法
A
解析:乙醇、水均能与金属钠反应,故B错误;浓硫酸和乙醇混合加热,会发生化学反应,故C错误;直接蒸馏时乙醇和水一起变为蒸气,难以得到无水乙醇,应先用新制生石灰吸水,再蒸馏,D错误。
课时作业(十四) 乙醇
A篇·知识对点训练
1.下列化学用语正确的是( )
A.乙醇的官能团:—OH
B.乙醇的分子式:CH3CH2OH
C.乙烯的结构简式:CH2CH2
D.乙烯无官能团
A
2.有机物Ⅰ和Ⅱ的结构式如下,下列说法中不正确的是( )
A.Ⅰ和Ⅱ是同分异构体
B.Ⅰ和Ⅱ物理性质有所不同
C.Ⅰ和Ⅱ化学性质相同
D.Ⅰ和Ⅱ含12C的质量分数相同
C
解析:Ⅰ和Ⅱ分子式相同、分子结构不同,互为同分异构体,同分异构体不仅物理性质有差异,化学性质也有差异。Ⅰ和Ⅱ含C的质量分数相同,12C是C的稳定同位素,所以Ⅰ和Ⅱ含12C的质量分数相同。
3.下列说法正确的是( )
A.乙醇在水中能电离出少量的H+,所以乙醇是电解质
B.乙醇与O2发生不完全燃烧生成乙醛
C.乙醇分子中所有的氢原子都可被钠置换出来
D.乙醇是一种很好的溶剂,能溶解多种物质
D
解析:乙醇在水中不能电离,是非电解质;乙醇与O2在催化剂的作用下可生成乙醛,但发生的不是燃烧反应;乙醇能与Na发生反应,但钠只能置换羟基上的氢原子;乙醇是良好的有机溶剂。
4.已知C4H10的同分异构体有两种:CH3CH2CH2CH3、
,则C4H9OH属于醇类的同分异构体共有 ( )
A.1种 B.2种
C.3种 D.4种
D
解析:在所给两种同分异构体中各有两种不同的氢原子,如图C3—C2—CH2—CH3、 ,所以羟基取代这些
氢原子,共得到4种同分异构体。
5.已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇、乙二醇 、丙三醇 分别与足量
金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为
( )
A.6∶3∶2 B.1∶2∶3
C.3∶2∶1 D.4∶3∶2
A
解析:羟基个数与被置换的氢原子个数之比为1∶1。三种醇与钠反应放出等量的氢气,则三种醇提供的羟基数相同,因此三种醇的物质的量之比为 1∶∶ =6∶3∶2。
6.将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,原铜片质量增加的是( )
A.硝酸 B.稀盐酸
C.Ca(OH)2溶液 D.乙醇
C
解析:铜片在酒精灯上加热,发生化学反应:2Cu+O2=====
2CuO,使质量增加。当遇到硝酸和稀盐酸后,发生反应的化学方程式分别为CuO+2HNO3===Cu(NO3)2+H2O、CuO+2HCl===
CuCl2+H2O,反而使铜片质量减少;当遇到乙醇时发生化学反应:CuO+CH3CH2OH――→CH3CHO+H2O+Cu,CuO被还原为Cu,反应前后质量不变;当遇到Ca(OH)2溶液时,CuO不与其反应,故加热后的铜片比原铜片质量增加。
△
△
7.为减少汽车尾气对大气造成的污染,市场上推出了使用乙醇汽油(在汽油中加入适量乙醇)的汽车。下列叙述错误的是( )
A.乙醇汽油是一种化合物
B.汽车使用乙醇汽油可以减少有害气体的排放
C.乙醇充分燃烧生成CO2和H2O
D.用粮食发酵可制得乙醇
A
解析:乙醇汽油属于混合物,因此A错误。
8.下列有机物中,不属于烃的衍生物的是( )
A. B.CH3CH2NO2
C.CH2===CHBr D. — CH2—CH2 —
D
[ ]n
解析: 可看作苯分子中的一个氢原子被Cl取代;CH3CH2NO2可看作CH3CH3分子中的一个氢原子被硝基取代;CH2===CHBr可看作CH2===CH2分子中的一个氢原子被Br所取代的产物;只有 — CH2—CH2 — 不属于烃的衍生物。
[ ]n
9.下列物质中可使酸性高锰酸钾溶液褪色,不能使溴水褪色的是( )
A.甲烷 B.乙烯 C.乙醇 D.苯
解析:甲烷既不能使酸性高锰酸钾溶液褪色,也不能使溴水褪色;苯不能使酸性高锰酸钾溶液褪色,能使溴水褪色;乙烯使二者都能褪色;乙醇可被酸性高锰酸钾溶液氧化而使之褪色,但不与溴水反应,不能使之褪色。
C
10.如图是A分子的球棍模型和B分子的空间充填模型,回答下列问题:
(1) A和B的关系是_________。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式:__________________________________________。
同系物
2CH3OH+O2 ―――→ 2HCHO+2H2O
催化剂
△
(3)写出B分子和金属钠反应的化学方程式:__________________________________________________。
(4) B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是____________。
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
取代反应
解析:根据成键原则,可以判断A和B的结构简式分别是CH3OH(甲醇)和CH3CH2OH,它们结构相似,互称为同系物;它们都含—OH,甲醇和乙醇性质相似,能被氧化成相应的醛;根据B在加热条件下能与HBr发生反应生成溴乙烷的特点可知该反应为取代反应。
11.乙醇能与紫红色的酸性KMnO4溶液或橙色的酸性K2Cr2O7溶液反应,现象为_______________________________________
_______________________________________________________
______________________________________________________________________________________,
乙醇最终被________为________。
酸性KMnO4溶液褪色;酸性K2Cr2O7溶液由橙色变为绿色
氧化
乙酸
B篇·综合提升训练
12.某有机物(含C、H、O)的分子球棍模型如图所示,有关该物质的说法正确的是 ( )
A.含有取代基团OH-
B.碳、氢原子个数比为1∶3
C.结构简式为CH3—O—CH3
D.具有酸性
B
解析:题图为乙醇的球棍模型,含有取代基—OH,A项错误;分子式是C2H6O,碳、氢原子个数比为1∶3,B项正确;结构简式为CH3CH2OH,C项错误;乙醇溶液呈中性,D项错误。
13.(双选)下列关于乙醇的说法正确的是( )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有还原性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
BD
解析:乙醇不能电离出氢氧根离子,—OH和OH-是完全不同的粒子;乙醇的氧化反应表现的是乙醇的还原性;乙醇与钠反应可以产生氢气,不能说明乙醇显酸性;乙醇与钠反应比水与钠反应平缓,说明乙醇羟基上的氢原子不如水中的氢原子活泼。
14.乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是________L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO
和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是_____mol,燃烧产物的平均摩尔质量是_____ g·mol-1。
4.48
0.55
26.8
解析:(1)由题意:
2Na ~ H2
46 g 22.4 L
9.2 g V(H2)
V(H2)=
=4.48 L。
(2) 根据氢原子守恒,可得:
C2H5OH ~ 3H2O
1 mol 54 g
n(C2H5OH) 10.8 g
n(C2H5OH)==0.2 mol。
碱石灰增重的质量即为生成CO2的质量,
故n(CO2)= = 0.3 mol。
根据化学反应过程中碳原子守恒可得:
n(CO)=2×0.2 mol-0.3 mol=0.1 mol。
根据氧原子守恒:
n(O2)==0.55 mol。
产物的总物质的量n=(0.6+0.3+0.1)mol=1 mol;
产物的总质量m=(10.8+13.2+2.8)g=26.8 g;
产物平均摩尔质量=26.8 g·mol-1。
15.乙醇是生活中常见的有机物,能进行如下图所示的多种反应,A、C都是有机物。
写出下列反应的化学方程式:
①______________________________________________;
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
②____________________________________________;
③______________________________________________。
CH3CH2OH+3O2 ――→ 2CO2+3H2O
点燃
2CH3CH2OH+O2――→2CH3CHO+2H2O
Cu
△
16.有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。其实验操作为预先使棉花团浸透乙醇,并照图安装好装置;在铜丝的中间部分加热,片刻后开始(间歇性)鼓入空气,即可观察到明显的实验现象。
请回答下列问题:
(1)被加热的铜丝处发生反应的化学方程式为______________________________________________________。
(2)从A管中可观察到的实验现象是________________________
___________________________________。
从中可认识到在该实验过程中,催化剂参加了化学反应,还可认识到催化剂起催化作用时需要一定的________。
2CH3CH2OH+O2――→2CH3CHO+2H2O
Cu
△
受热部分的铜丝随间歇性地鼓入空气而交替出现变黑、变红
温度
(3)实验一段时间后,如果撤掉酒精灯,反应还能否继续进行?________,原受热部分的铜丝有什么现象?
____________________________________________________________________________________________________________________________________________________________,
其原因是_____________________________________________
______________________________。
能
仍可看到原受热部分的铜丝交替出现变黑、变红的现象
乙醇的催化氧化反应是放热反应
解析:乙醇在Cu作催化剂时发生氧化反应的机理为
2Cu+O2=====2CuO(铜丝变黑);
CH3CH2OH+CuO――→CH3CHO+Cu+H2O
(铜丝由黑变红)。
△
△
本课结束
This lesson is over
THANKS!
第七章
有机化合物
第三节
乙醇与乙酸
第1课时
乙醇
[明确学习目标]
1.了解烃的衍生物和官能团的概念。
2.掌握乙醇的组成及主要性质。
3.了解乙醇的主要用途及与人类日常生活和健康的关系。
4.初步学会分析官能团与性质关系的方法。
[核心素养对接]
通过对乙醇结构和性质的学习,培养学生宏观辨识与微观探析的能力。
课前篇
·
自主学习固基础
一、烃的衍生物
[知识梳理]
1.烃的衍生物
烃分子中的________被其他________或________所________而生成的一系列化合物称为烃的衍生物。如:乙醇可看成是__________中的一个氢原子被________取代后的产物。
氢原子
原子
原子团
取代
乙烷分子
羟基
2.官能团
决定有机化合物____________的原子或原子团。如
(________)、—OH(________)、 (碳碳双键)等。
特性
碳氯键
羟基
二、乙醇的物理性质与分子结构
1.物理性质
无色液体
特殊香味
小
互溶
易
2.分子结构
C2H6O
—OH
CH3CH2OH
C2H5OH
三、乙醇的化学性质
[实验7-4]
实验操作
实验现象 ①钠沉于试管底部,最终慢慢消失,产生无色可燃性气体;
②烧杯内壁有________产生;
③向烧杯中加入澄清石灰水,石灰水____________
产物检验 乙醇与钠反应生成的气体是________
续表
液滴
不变浑浊
H2
1. 乙醇与钠的反应
(1)发生反应的化学方程式为___________________________________________________。
(2) 由实验可知,乙醇与金属钠的反应比水与金属钠的反应平缓得多,说明乙醇羟基中的氢原子不如水分子中的氢原子____________________。
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
活泼
2.乙醇的氧化反应
(1) 乙醇的燃烧
乙醇在空气中燃烧时,放出大量的热:______________________________________________________
____________________________________________。
CH3CH2OH+3O2 ――→ 2CO2+3H2O
点燃
(2) 乙醇的催化氧化
[实验7-5]
实验操作
实验现象 红色光亮的铜丝灼烧后变为黑色,趁热插入乙醇中,铜丝又变为红色。反复几次,闻到试管中的液体有刺激性气味
续表
乙醇在加热和催化剂的作用下,可以被空气中的O2氧化为乙醛:_________________________________________________。
(3)乙醇还可以被一些强氧化剂,如____________________、____________________等直接氧化成乙酸。
2CH3CH2OH+O2――→2CH3CHO+2H2O
催化剂
△
酸性KMnO4溶液
酸性K2Cr2O7溶液
[自我排查]
(1)能用分液的方法分离酒精和水的混合物( )
(2)可用无水硫酸铜检验工业酒精中是否有水( )
(3)乙醇中的羟基不如水中的羟基活泼( )
(4)乙醇分子中含有六个氢原子,故1 mol乙醇与足量的钠反应可以生成3 mol的氢气( )
一、微判断
二、尝试解答
1.能否用乙醇萃取溴水中的溴单质??
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
提示:不能。因为乙醇与水以任意比例互溶。
2.如何证明一个乙醇分子中含有一个羟基?_____________________________________________________________________________________________________________________________________________________________________________________________________________________
提示:根据1 mol乙醇与足量金属钠反应产生0.5 mol氢气,即可证明一个乙醇分子中含有一个羟基。
3.如何检验乙醇中是否含有水?________________________________________________________________________________________________________________________________________________
提示:检验乙醇中是否含有水通常加入无水硫酸铜固体,无水硫酸铜固体变蓝,则证明其中含有水。
三、微训练
1.把质量为m g的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为m g的是( )
A.稀硫酸 B.烧碱溶液
C.乙醇 D.蒸馏水
C
2.下列物质中不能用来区分乙醇和苯的是( )
A.金属钠 B.溴水
C.碳酸钠溶液 D.四氯化碳
D
解析:乙醇和金属钠反应缓慢,苯和金属钠不反应,可以区分,A不符合题意;乙醇溶于溴水,且不分层,苯可以把溴水中的溴萃取出来,出现分层,可以区分,B不符合题意;乙醇和碳酸钠溶液互溶,不分层,苯不溶于碳酸钠溶液,出现分层,可以区分,C不符合题意;乙醇和苯均与四氯化碳互溶,不分层,无法区分二者,D符合题意。
3.下列物质属于烃的衍生物的是______________。
④ ⑤CH3CHO ⑥CH3CH2CH2OH
⑦CH3COOH
②④⑤⑥⑦
解析:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列物质称为烃的衍生物。即烃的衍生物除了含有C、H元素之外,还含有其他元素。
课堂篇
·
重点难点要突破
研习1 乙醇的物理性质及分子结构
[重点讲解]
1.乙醇沸点低,易挥发,应密封保存。
2.含乙醇99.5%(体积分数)以上的叫无水乙醇,制无水乙醇时,要加入新制的生石灰再进行蒸馏,直接蒸馏得不到无水乙醇。
3.—OH(羟基)与OH-(氢氧根离子)的区别
名称 区别 羟基 氢氧根离子
电子式 H [ H]-
电性 不显电性 显负电性
O
..
.
. .
..
O
..
. .
. .
..
稳定程度 不稳定 较稳定
存在 不能独立存在,必须与其他基团结合在一起 能独立存在
来源 H2O失去H的剩余部分 H2O失去H+的剩余部分
相同点 组成元素相同
名称 区别 羟基 氢氧根离子
续表
[联想质疑]
俗话说“酒香不怕巷子深”,意思就是说如果酒酿得好,就是在很深的巷子里,也会有人闻香知味,前来品尝。
[问题探讨]
1.能闻到酒的香味,体现了乙醇的什么性质?
提示:乙醇的挥发性。
2.乙醇能与水以任意比互溶,如何制备无水乙醇?
提示:加生石灰后,加热蒸馏可制得无水乙醇。
3.某有机物的分子式为C2H6O,依据C、H、O的成键特点,判断C2H6O有几种结构?试一一写出它们的结构式,找出乙醇分子,并判断其官能团是什么。
提示:C2H6O的结构有2种,分别为 、 ;
乙醇分子中的官能团是羟基(—OH)。
[举一反三]
1.下列有关乙醇的物理性质的应用中,不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比例溶解于水,所以可以配制不同浓度的酒精溶液
D.由于乙醇容易挥发,所以才有“酒香不怕巷子深”的说法
A
解析:乙醇的密度比水小,但可与水以任意比例互溶,故除去乙醇中的水不能用分液的方法,应先加入生石灰,然后蒸馏。
2.下列关于羟基和氢氧根离子的说法不正确的是( )
A.羟基比氢氧根离子少一个电子
B.二者的组成元素相同
C.羟基不带电,氢氧根离子带一个单位负电荷
D.羟基比氢氧根离子性质稳定
D
解析:羟基和氢氧根离子都是由氢、氧两种元素组成的,其电子式分别为 H和[ H]-,由电子式可知A、B、C正确;羟基中氧原子未达到稳定结构,所以羟基不如氢氧根离子性质稳定,D错误。
O
..
. .
. .
..
O
..
.
. .
..
3.比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
B
解析:乙烷和乙醇的结构简式分别为CH3CH3和CH3CH2OH,所以A、C、D三项正确;乙醇分子中的六个H原子可分为三种,所以B项错误。
研习2 乙醇的化学性质
[重点讲解]
1.乙醇反应时的断键情况
乙醇参与的反应 键的断裂
与钠反应 断①键
燃烧 断①②③④⑤键
催化氧化 断①③键
2.乙醇催化氧化的实质
(1)
总反应的化学方程式为
2CH3CH2OH+O2 ——→ 2CH3CHO+2H2O,
反应中Cu作催化剂。
Cu
△
(2) 反应生成的乙醛是一种无色、具有刺激性气味的液体,与水、乙醇互溶。结构简式为CH3CHO或加 。
(3)乙醇被强氧化剂氧化
乙醇若遇到强氧化剂,如酸性高锰酸钾溶液或酸性重铬酸钾(K2Cr2O7)溶液,可被氧化为乙酸。
CH3CH2OH―――――――――→CH3COOH
KMnO4(H+、aq)
或K2Cr2O7(H+、aq)
(1) 有机反应中,有机物“去氢”或“加氧”的反应称为氧化反应;“加氢”或“去氧”的反应称为还原反应。
(2) 含有—OH的有机物都能与Na反应,如CH3OH(甲醇)、HOCH2CH2OH(乙二醇)等,且1 mol —OH~ mol H2,该关系式常用于确定有机物分子中含有—OH的数目。
[知识拓展]
(3) 乙醇作为一种还原性物质,在酸性条件下,会与橙色的重铬酸钾溶液发生氧化还原反应,得到含Cr3+的绿色溶液,发生反应的化学方程式为3CH3CH2OH+2K2Cr2O7(橙色)+8H2SO4 ――→ 3CH3COOH+2Cr2(SO4)3(绿色)+11H2O+2K2SO4,此反应原理可用于酒精测试,若由橙色变成绿色,则可以判断驾驶员饮酒超过规定标准。
[探究活动]
[实验1] 探究乙醇与钠的反应
实验 操作
实验 现象 ①钠开始沉于试管底部,最终慢慢消失,产生无色可燃性气体;
②烧杯内壁有水珠产生;
③向烧杯中加入澄清石灰水,澄清石灰水不变浑浊
续表
[问题探讨]
1.通过乙醇与钠反应的实验现象,判断产生气体的成分是什么?写出反应的化学方程式。
提示:乙醇与钠反应生成氢气;反应的化学方程式为
2C2H5OH+2Na―→2C2H5ONa+H2↑。
2.如何证明分子式为C2H6O的有机物的结构式是
还是
提示:通过与钠反应,测定产生氢气的量来证明。取1 mol的该有机物与足量的钠反应,测定产生氢气的量,若产生氢气的量为0.5 mol,则证明结构式为 。
3.对比钠与水、钠与乙醇反应的实验现象,比较水和乙醇中羟基氢原子的活泼性。
提示:钠与水反应比钠与乙醇反应剧烈,说明水中的氢原子比乙醇中的羟基氢原子活泼。
[实验2] 探究乙醇的催化氧化反应
实验操作
实验现象 红色光亮的铜丝灼烧后变为黑色,趁热插入乙醇中,铜丝又变为红色。反复几次,闻到试管中的液体有刺激性气味
[问题探讨]
4.实验过程中为什么要把铜丝绕成螺旋状?
提示:增大反应物接触面积,提高反应速率。
5.上述实验过程中,铜丝加热变黑,伸入乙醇中又变红色的原因是什么?反应过程中铜丝的作用是什么?
提示:铜丝变黑是由于铜与空气中的O2反应生成了黑色的氧化铜;伸入乙醇中又变红的原因是CuO被乙醇还原为红色的单质铜;反应过程中铜丝起催化剂的作用。
6.反复几次实验后,闻到试管中有刺激性气味的物质生成,其成分是什么?其中含有的官能团是什么?写出该反应的化学方程式。
提示:乙醛;醛基(—CHO);
2CH3CH2OH+O2―――→2CH3CHO+2H2O。
Cu
△
[举一反三]
1.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述中,正确的是( )
A.钠块沉在乙醇液面的下面
B.钠块熔化成小球
C.钠块在乙醇的液面上游动
D.钠块剧烈反应放出气体
A
解析:因 ρNa > ρ 乙醇,故钠在乙醇液面以下,A正确,则C不正确。因Na与乙醇反应缓慢,故B、D不正确。
2.关于乙醇的说法正确的是( )
A.乙醇结构中有—OH,所以乙醇溶于水,可以电离出OH-而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应比相同条件下水与钠的反应更加平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
D
解析:乙醇不能电离出氢氧根离子,—OH和OH-是完全不同的粒子;乙醇的氧化反应表现的是乙醇的还原性;乙醇与钠反应可以产生氢气,并不是氢离子的性质,不能说明乙醇显酸性。
3.乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断键情况的说明不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③键
C.在银催化共热下与O2反应时断裂①和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
C
解析:乙醇与钠反应生成乙醇钠,是羟基中的O—H键断裂,A正确;乙醇催化氧化生成乙醛时,断裂①和③键,B正确,C错误;乙醇完全燃烧时,化学键①②③④⑤全部断裂。
[规律方法]
乙醇分子中羟基氢的性质
(1) 在乙醇分子中,被钠置换出的氢是羟基中的氢原子,而不是乙基中的氢原子。
(2) CH3CH2OH中羟基中的氢能被置换出来,但CH3CH2OH是非电解质,不能电离出H+。
演习篇
·
学业测试速达标
1.下列说法错误的是( )
A.乙烯:CH2===CH2,官能团为
B.乙炔:CH≡CH,官能团为—C≡C—
C.乙醇:CH3CH2OH,官能团为—OH
D.乙醛:CH3CHO,官能团为—COH
D
解析:醛基写成 或—CHO,—COH是错误写法。
2.下列物质属于烃的衍生物的是( )
① CH3CH3 ② ③ CH3CH2Br
④ ⑤ CH3CH2OH ⑥ CH2ClCH3
A.③④⑤ B.③④⑤⑥
C.②③④⑤ D.②③④⑤⑥
B
解析:③④⑤⑥中相当于烃分子中的氢原子分别被—Br、—NO2、—OH、—Cl取代,故属于烃的衍生物。
3.下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,如变蓝则含水 ②除去乙醇中微量水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④获得无水乙醇的方法通常采用先用生石灰吸水,然后再加热蒸馏
A.①③ B.②④
C.①④ D.③④
C
解析:用无水CuSO4可检验是否有水存在,因为无水CuSO4遇水变蓝,故①正确;乙醇和水均与金属钠反应生成气体,故②错误;含水的酒精直接加热蒸馏,水也会挥发,酒精不纯,故③错误,④正确。
4.(2020·全国卷Ⅰ)国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )
A.CH3CH2OH能与水互溶
B.NaClO通过氧化灭活病毒
C.过氧乙酸相对分子质量为76
D.氯仿的化学名称是四氯化碳
D
解析:本题考查多种常见消毒剂涉及的化学学科知识,体现科学精神与社会责任的化学核心素养。乙醇分子与水可以形成分子间氢键,所以乙醇能与水互溶,A正确;次氯酸钠具有强氧化性,能使病毒中蛋白质变性,故次氯酸钠通过氧化灭活病毒,B正确;过氧乙酸的分子式是C2H4O3,相对分子质量为76,C正确;氯仿的分子式为CHCl3,化学名称为三氯甲烷,D错误。
5.下列说法正确的是( )
A.检测乙醇中是否含有水可加入少量的无水硫酸铜,如果变蓝则含水
B.除去乙醇中的微量水可加入金属钠,使其完全反应
C.获得无水乙醇的方法通常采用先用浓H2SO4吸水,然后再加热蒸馏的方法
D.获得无水乙醇的方法通常采用直接加热蒸馏的方法
A
解析:乙醇、水均能与金属钠反应,故B错误;浓硫酸和乙醇混合加热,会发生化学反应,故C错误;直接蒸馏时乙醇和水一起变为蒸气,难以得到无水乙醇,应先用新制生石灰吸水,再蒸馏,D错误。
课时作业(十四) 乙醇
A篇·知识对点训练
1.下列化学用语正确的是( )
A.乙醇的官能团:—OH
B.乙醇的分子式:CH3CH2OH
C.乙烯的结构简式:CH2CH2
D.乙烯无官能团
A
2.有机物Ⅰ和Ⅱ的结构式如下,下列说法中不正确的是( )
A.Ⅰ和Ⅱ是同分异构体
B.Ⅰ和Ⅱ物理性质有所不同
C.Ⅰ和Ⅱ化学性质相同
D.Ⅰ和Ⅱ含12C的质量分数相同
C
解析:Ⅰ和Ⅱ分子式相同、分子结构不同,互为同分异构体,同分异构体不仅物理性质有差异,化学性质也有差异。Ⅰ和Ⅱ含C的质量分数相同,12C是C的稳定同位素,所以Ⅰ和Ⅱ含12C的质量分数相同。
3.下列说法正确的是( )
A.乙醇在水中能电离出少量的H+,所以乙醇是电解质
B.乙醇与O2发生不完全燃烧生成乙醛
C.乙醇分子中所有的氢原子都可被钠置换出来
D.乙醇是一种很好的溶剂,能溶解多种物质
D
解析:乙醇在水中不能电离,是非电解质;乙醇与O2在催化剂的作用下可生成乙醛,但发生的不是燃烧反应;乙醇能与Na发生反应,但钠只能置换羟基上的氢原子;乙醇是良好的有机溶剂。
4.已知C4H10的同分异构体有两种:CH3CH2CH2CH3、
,则C4H9OH属于醇类的同分异构体共有 ( )
A.1种 B.2种
C.3种 D.4种
D
解析:在所给两种同分异构体中各有两种不同的氢原子,如图C3—C2—CH2—CH3、 ,所以羟基取代这些
氢原子,共得到4种同分异构体。
5.已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇、乙二醇 、丙三醇 分别与足量
金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为
( )
A.6∶3∶2 B.1∶2∶3
C.3∶2∶1 D.4∶3∶2
A
解析:羟基个数与被置换的氢原子个数之比为1∶1。三种醇与钠反应放出等量的氢气,则三种醇提供的羟基数相同,因此三种醇的物质的量之比为 1∶∶ =6∶3∶2。
6.将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,原铜片质量增加的是( )
A.硝酸 B.稀盐酸
C.Ca(OH)2溶液 D.乙醇
C
解析:铜片在酒精灯上加热,发生化学反应:2Cu+O2=====
2CuO,使质量增加。当遇到硝酸和稀盐酸后,发生反应的化学方程式分别为CuO+2HNO3===Cu(NO3)2+H2O、CuO+2HCl===
CuCl2+H2O,反而使铜片质量减少;当遇到乙醇时发生化学反应:CuO+CH3CH2OH――→CH3CHO+H2O+Cu,CuO被还原为Cu,反应前后质量不变;当遇到Ca(OH)2溶液时,CuO不与其反应,故加热后的铜片比原铜片质量增加。
△
△
7.为减少汽车尾气对大气造成的污染,市场上推出了使用乙醇汽油(在汽油中加入适量乙醇)的汽车。下列叙述错误的是( )
A.乙醇汽油是一种化合物
B.汽车使用乙醇汽油可以减少有害气体的排放
C.乙醇充分燃烧生成CO2和H2O
D.用粮食发酵可制得乙醇
A
解析:乙醇汽油属于混合物,因此A错误。
8.下列有机物中,不属于烃的衍生物的是( )
A. B.CH3CH2NO2
C.CH2===CHBr D. — CH2—CH2 —
D
[ ]n
解析: 可看作苯分子中的一个氢原子被Cl取代;CH3CH2NO2可看作CH3CH3分子中的一个氢原子被硝基取代;CH2===CHBr可看作CH2===CH2分子中的一个氢原子被Br所取代的产物;只有 — CH2—CH2 — 不属于烃的衍生物。
[ ]n
9.下列物质中可使酸性高锰酸钾溶液褪色,不能使溴水褪色的是( )
A.甲烷 B.乙烯 C.乙醇 D.苯
解析:甲烷既不能使酸性高锰酸钾溶液褪色,也不能使溴水褪色;苯不能使酸性高锰酸钾溶液褪色,能使溴水褪色;乙烯使二者都能褪色;乙醇可被酸性高锰酸钾溶液氧化而使之褪色,但不与溴水反应,不能使之褪色。
C
10.如图是A分子的球棍模型和B分子的空间充填模型,回答下列问题:
(1) A和B的关系是_________。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式:__________________________________________。
同系物
2CH3OH+O2 ―――→ 2HCHO+2H2O
催化剂
△
(3)写出B分子和金属钠反应的化学方程式:__________________________________________________。
(4) B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是____________。
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
取代反应
解析:根据成键原则,可以判断A和B的结构简式分别是CH3OH(甲醇)和CH3CH2OH,它们结构相似,互称为同系物;它们都含—OH,甲醇和乙醇性质相似,能被氧化成相应的醛;根据B在加热条件下能与HBr发生反应生成溴乙烷的特点可知该反应为取代反应。
11.乙醇能与紫红色的酸性KMnO4溶液或橙色的酸性K2Cr2O7溶液反应,现象为_______________________________________
_______________________________________________________
______________________________________________________________________________________,
乙醇最终被________为________。
酸性KMnO4溶液褪色;酸性K2Cr2O7溶液由橙色变为绿色
氧化
乙酸
B篇·综合提升训练
12.某有机物(含C、H、O)的分子球棍模型如图所示,有关该物质的说法正确的是 ( )
A.含有取代基团OH-
B.碳、氢原子个数比为1∶3
C.结构简式为CH3—O—CH3
D.具有酸性
B
解析:题图为乙醇的球棍模型,含有取代基—OH,A项错误;分子式是C2H6O,碳、氢原子个数比为1∶3,B项正确;结构简式为CH3CH2OH,C项错误;乙醇溶液呈中性,D项错误。
13.(双选)下列关于乙醇的说法正确的是( )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有还原性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
BD
解析:乙醇不能电离出氢氧根离子,—OH和OH-是完全不同的粒子;乙醇的氧化反应表现的是乙醇的还原性;乙醇与钠反应可以产生氢气,不能说明乙醇显酸性;乙醇与钠反应比水与钠反应平缓,说明乙醇羟基上的氢原子不如水中的氢原子活泼。
14.乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是________L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO
和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是_____mol,燃烧产物的平均摩尔质量是_____ g·mol-1。
4.48
0.55
26.8
解析:(1)由题意:
2Na ~ H2
46 g 22.4 L
9.2 g V(H2)
V(H2)=
=4.48 L。
(2) 根据氢原子守恒,可得:
C2H5OH ~ 3H2O
1 mol 54 g
n(C2H5OH) 10.8 g
n(C2H5OH)==0.2 mol。
碱石灰增重的质量即为生成CO2的质量,
故n(CO2)= = 0.3 mol。
根据化学反应过程中碳原子守恒可得:
n(CO)=2×0.2 mol-0.3 mol=0.1 mol。
根据氧原子守恒:
n(O2)==0.55 mol。
产物的总物质的量n=(0.6+0.3+0.1)mol=1 mol;
产物的总质量m=(10.8+13.2+2.8)g=26.8 g;
产物平均摩尔质量=26.8 g·mol-1。
15.乙醇是生活中常见的有机物,能进行如下图所示的多种反应,A、C都是有机物。
写出下列反应的化学方程式:
①______________________________________________;
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
②____________________________________________;
③______________________________________________。
CH3CH2OH+3O2 ――→ 2CO2+3H2O
点燃
2CH3CH2OH+O2――→2CH3CHO+2H2O
Cu
△
16.有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。其实验操作为预先使棉花团浸透乙醇,并照图安装好装置;在铜丝的中间部分加热,片刻后开始(间歇性)鼓入空气,即可观察到明显的实验现象。
请回答下列问题:
(1)被加热的铜丝处发生反应的化学方程式为______________________________________________________。
(2)从A管中可观察到的实验现象是________________________
___________________________________。
从中可认识到在该实验过程中,催化剂参加了化学反应,还可认识到催化剂起催化作用时需要一定的________。
2CH3CH2OH+O2――→2CH3CHO+2H2O
Cu
△
受热部分的铜丝随间歇性地鼓入空气而交替出现变黑、变红
温度
(3)实验一段时间后,如果撤掉酒精灯,反应还能否继续进行?________,原受热部分的铜丝有什么现象?
____________________________________________________________________________________________________________________________________________________________,
其原因是_____________________________________________
______________________________。
能
仍可看到原受热部分的铜丝交替出现变黑、变红的现象
乙醇的催化氧化反应是放热反应
解析:乙醇在Cu作催化剂时发生氧化反应的机理为
2Cu+O2=====2CuO(铜丝变黑);
CH3CH2OH+CuO――→CH3CHO+Cu+H2O
(铜丝由黑变红)。
△
△
本课结束
This lesson is over
THANKS!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
