化学人教版(2019)必修第一册1.2.3常见离子方程式的书写(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.3常见离子方程式的书写(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 358.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-23 15:55:54 | ||
图片预览








文档简介
(共29张PPT)
离子反应课时3
常见离子方程式书写与注意事项
一、离子方程式书写的难点:“拆与不拆”
1:可拆成离子的电解质
①强酸:HCl、H2SO4、HNO3等;
②强碱:KOH、NaOH、Ba(OH)2等。
特例:Ca(OH)2是微溶物,作反应物,若为澄清石灰水,写离子形式;若为石灰乳,写分子式。
③可溶盐(请观察溶解性表120页)
钾、钠、铵、硝酸盐全溶
SO42-不溶于Ba2+、Ca2+、Ag+
Cl-不溶于Ag+
CO32-只溶K+、Na+、NH4+(Mg2+微溶)
盐的溶解性基本规律
2:不可拆成离子的物质
①气体、单质、氧化物
②弱酸:HF 、CH3COOH 、H2S、HClO等
③弱碱: NH3 · H2O
④难溶的碱、盐
⑤水
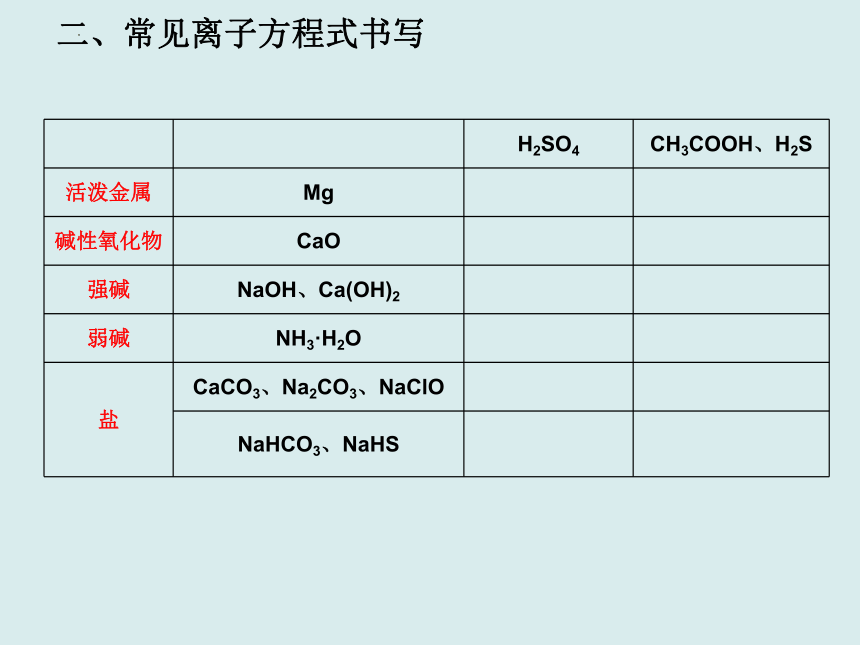
二、常见离子方程式书写
H2SO4 CH3COOH、H2S
活泼金属 Mg
碱性氧化物 CaO
强碱 NaOH、Ca(OH)2
弱碱 NH3·H2O
盐 CaCO3、Na2CO3、NaClO
NaHCO3、NaHS
1、酸碱的中和反应
(1)强酸与强碱反应的离子方程式
OH- + H+ == H2O
特例:H2SO4与Ba(OH)2反应的离子方程式
Ba(OH)2 + H2SO4== BaSO4↓ +2H2O
Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓ +2H2O
H2SO4与Ba(OH)2反应,除了有水生成,还有沉淀产生。
(2)强酸与弱碱反应的离子方程式
HCl与氨水反应的离子方程式
H+ + NH3·H2O== H2O +NH4+
HCl与Cu(OH)2反应的离子方程式
2H+ + Cu(OH)2== 2H2O +Cu2+
强酸/强碱在离子方程式以“H+/OH-”表示,
弱酸/弱碱包括氨水和难溶的碱在离子方程式以其分子式表示。
(3)强碱与弱酸反应的离子方程式
CH3COOH与NaOH反应的离子方程式
OH- + CH3COOH== H2O + CH3COO-
H2S与NaOH反应的离子方程式
2OH- + H2S== 2H2O + S2-
OH- + H2S== H2O + HS-
(4)弱碱与弱酸反应的离子方程式
CH3COOH与氨水反应的离子方程式
NH3·H2O + CH3COOH== H2O + NH4+ + CH3COO-
H2S与氨水反应的离子方程式
2NH3·H2O + H2S== 2H2O + 2NH4+ + S2-
多元弱酸与碱反应,
若碱过量,则生成正盐;
酸过量,则生成酸式盐。
NH3·H2O + H2S== H2O + NH4+ + HS-
2、活泼金属与酸反应
试写出金属Mg与HCl、H2SO4、CH3COOH反应的离子方程式
Mg + 2H+ == Mg2+ + H2↑
Mg与HCl、H2SO4反应的离子方程式
Mg与CH3COOH反应的离子方程式
Mg + 2CH3COOH == Mg2+ + 2CH3COO- + H2↑
3、金属氧化物与酸反应
试写出CaO与HCl、H2SO4、CH3COOH反应的离子方程式
CaO + 2H+ == Ca2+ + H2O
CaO与HCl、H2SO4等强酸反应的离子方程式
CaO与CH3COOH等弱酸反应的离子方程式
CaO + 2CH3COOH == Ca2+ + 2CH3COO- + H2O
4、非金属氧化物与碱反应
试写出CO2与NaOH反应的离子方程式
CO2 + 2OH-== CO32- + H2O
(1)CO2与足量NaOH反应的离子方程式
规律:多元弱酸的酸酐(CO2、SO2等)与碱反应,
若碱过量,则生成正盐;碱不足则生成酸式盐。
试题中常见如下表达方式:“少量CO2通入NaOH溶液中的离子方程式”
CO2 + OH-== HCO3-
(2)CO2与少量NaOH反应的离子方程式
试题中常见如下表达方式:“足量CO2通入NaOH溶液中的离子方程式”
CO2 + 2NaOH(足量)== Na2CO3(正盐)+ H2O
CO2 + NaOH(不足)== NaHCO3(酸式盐)
趁热打铁
试写出SO2与NaOH反应的离子方程式
SO2 + 2OH-== SO32- + H2O
(1)CO2与足量NaOH反应的离子方程式
SO2 + OH-== HSO3-
(2)SO2与少量NaOH反应的离子方程式
SO2 + 2NaOH(足量)== Na2SO3(正盐)+ H2O
SO2 + NaOH(不足)== NaSCO3(酸式盐)
试写出CO2与Ca(OH)2反应的离子方程式
CO2 + Ca2+ + 2OH-== CaCO3 + H2O
(1)少量CO2通入澄清石灰水中的离子方程式与现象
CO2 + OH-== HCO3-
(2)足量CO2通入澄清石灰水中的离子方程式与现象
Ca(OH)2是微溶物,作反应物,若为澄清石灰水,写离子形式;若为石灰乳,写分子式。
溶液变浑浊
无明显现象
CO2 + Ca2+ + 2OH-== CaCO3 + H2O
(3)向澄清石灰水中缓慢、持续通入CO2的离子方程式与现象
开始时CO2不足,
溶液变浑浊
沉淀逐渐溶解,溶液最终变澄清。
CO2 + CaCO3 + H2O== Ca2+ + 2HCO3-
CO2 + Ca(OH)2== CaCO3 + H2O
CO2通入石灰乳中的离子方程式与现象
因为石灰乳本身是浑浊的,且浓度很大,所以看不出沉淀产生,也不存在足量、少量问题。
试写出CO2与NH3·H2O反应的离子方程式
CO2 + 2NH3·H2O== CO32- +2NH4+ + H2O
(1)CO2与足量氨水反应的离子方程式
(2)CO2与少量氨水反应的离子方程式
CO2 + NH3·H2O== HCO3- +NH4+
5、弱酸盐与酸反应--强酸制弱酸
(1)向可溶性正盐Na2CO3溶液中逐滴加盐酸的离子方程式与现象
CO32-+ 2H+ ==CO2↑+H2O
CO32-+ H+ == HCO3-
后,酸过量,产生气泡
先,酸不足,无气泡
(2)向可溶性正盐Na2CO3溶液中一次性加足量盐酸的离子方程式与现象
HCO3-+ H+ == H2O+ CO2↑
Na2CO3溶液
Na2CO3溶液
稀硫酸
稀硫酸
开始酸不足无气泡,
后酸足量产生气泡。
酸足量一开始即产生气泡。
CO32-+ H+ == HCO3-
HCO3-+ H+ == H2O+ CO2↑
CO32-+ 2H+ ==CO2↑+H2O
实战演练
(3)向难溶性正盐CaCO3固体中加盐酸的离子方程式与现象
CaCO3+ 2H+ ==CO2↑+ Ca2+ + H2O
生成气泡
加酸即生成气泡
(4)向可溶性酸式盐NaHCO3溶液中加盐酸的离子方程式与现象
HCO3-+ H+ == H2O+ CO2↑
写出分别向Na2CO3、NaHCO3溶液、CaCO3固体中加醋酸的离子方程式与现象
CaCO3+ 2CH3COOH ==CO2↑+ Ca2+ + 2CH3COO- +H2O
HCO3-+ CH3COOH == H2O + CH3COO- + CO2↑
实战演练
CO32-+ 2CH3COOH ==CO2↑+ 2CH3COO- + H2O
小结:酸与挥发性多元弱酸的盐反应,
若酸不足,则生成酸式盐,酸足量则产生气泡;
(5)酸与一些特殊的弱酸的盐反应,
如HCl与NaClO、CH3COONa反应的离子方程式
ClO-+ H+ == HClO
CH3COO- + H+ == CH3COOH
酸与难挥发的弱酸的盐反应,则直接生成难电离的弱酸分子。
(1)NaHCO3溶液与NaOH溶液反应的离子方程式
HCO3-+ OH- == H2O + CO32-
6、盐与碱反应
(2)NaHCO3溶液与Ca(OH)2溶液反应的离子方程式
HCO3-+ OH- + Ca2+== H2O + CaCO3↓
NaHCO3 + Ca(OH)2==H2O + NaOH + CaCO3↓
碱过量
2HCO3-+ 2OH- + Ca2+== 2H2O + CO32- + CaCO3↓
2NaHCO3 + Ca(OH)2==2H2O + Na2CO3 + CaCO3↓
碱不足
(4)铵盐与强碱的反应,不加热时生成NH3·H2O, 加热时生成NH3。如NaOH与NH4Cl反应
NH4+ +OH-== NH3·H2O
NH4+ +OH-=== NH3↑+H2O
△
(3)NaHCO3溶液与氨水溶液反应的离子方程式
NH3·H2O+ HCO3- == NH4+ +CO32-+H2O
(5)MgCl2、CuSO4等与NaOH溶液的反应,遵循强碱制弱碱的原则,一般生成难溶的碱。
(6)向Ba(OH)2溶液中滴加NaHSO4溶液,
当溶液呈中性时的离子方程式
Ba2+ +2OH-+ 2H++SO42- == BaSO4↓ +2H2O
Ba(OH)2 + 2NaHSO4== BaSO4↓ +2H2O +Na2SO4
当Ba2+沉淀完全时的离子方程式
Ba(OH)2 + NaHSO4== BaSO4↓ + H2O +NaOH
Ba2+ +OH-+ H++SO42- == BaSO4↓ +H2O
此时溶液呈碱性
(7)向AlNH4(SO4)2溶液中滴加Ba(OH)2溶液(Al3+优先与OH-反应)
当Al3+沉淀完全时的离子方程式
Al3+ +3OH-+1.5Ba2++1.5SO42- == Al(OH)3↓+1.5BaSO4↓
AlNH4(SO4)2+1.5Ba(OH)2==Al(OH)3↓+1.5BaSO4↓+0.5(NH4)2SO4
2Al3+ +6OH-+3Ba2++3SO42- == 2Al(OH)3↓+3BaSO4↓
当SO42-沉淀完全时的离子方程式
AlNH4(SO4)2+2Ba(OH)2==Al(OH)3↓+2BaSO4↓+NH3·H2O
Al3+ +4OH-+2Ba2++2SO42-+NH4+ == Al(OH)3↓+2BaSO4↓+NH3·H2O
(7)向AlNH4(SO4)2溶液中滴加Ba(OH)2溶液(Al3+优先与OH-反应)
盐与盐反应一般有沉淀、气体或水生成
如NaCl与AgNO3溶液的反应;CaCl2与Na2CO3反应等
Ba2+ + SO42- == BaSO4↓
BaCl2 + NaHSO4== BaSO4↓ +HCl +NaCl
7、盐与盐反应
比较特殊的盐是NaHSO4,其溶液显强酸性,可与钡盐反应,也可某些弱酸盐反应,如NaHCO3、Na2S、NaClO等。
NaHCO3 + NaHSO4== Na2SO4 + H2O + CO2↑
HCO3-+ H+ == H2O+ CO2↑
课堂小结
1、离子反应发生的条件,除了生成沉淀、气体、水之外,还可以生成难电离的物质,另外溶液中的置换反应也属于离子反应。
要注意观念的更新。
2、注意弱酸酸式盐的相关反应
多元弱酸与强碱反应,
碱过量生成正盐,酸过量生成酸式盐;
多元弱酸对应的氧化物与强碱反应也有类似情况;
弱酸的酸式盐即能与强酸反应生成弱酸,
又能与强碱反应正盐。
弱酸的酸式酸根HCO3- 、HSO3- 、HS-
反应物的过量或不足会导致不一样的离子反应,所以审题时要特别注意理解题意。
如“向盛有碳酸钠溶液的试管中逐滴加盐酸”,意味着开始时试管中的Na2CO3是过量的,则HCl是不足的,故一开始并无气泡产生,随着HCl的滴加,会产生气泡。
“向盛有盐酸的试管中逐滴加碳酸钠溶液”,意味着开始时试管中的HCl是过量的,则一开始就会产生气泡。
条件不同,现象不同,离子方程式自然不同。
3、注意分析反应中物质的过量或不足问题
离子反应课时3
常见离子方程式书写与注意事项
一、离子方程式书写的难点:“拆与不拆”
1:可拆成离子的电解质
①强酸:HCl、H2SO4、HNO3等;
②强碱:KOH、NaOH、Ba(OH)2等。
特例:Ca(OH)2是微溶物,作反应物,若为澄清石灰水,写离子形式;若为石灰乳,写分子式。
③可溶盐(请观察溶解性表120页)
钾、钠、铵、硝酸盐全溶
SO42-不溶于Ba2+、Ca2+、Ag+
Cl-不溶于Ag+
CO32-只溶K+、Na+、NH4+(Mg2+微溶)
盐的溶解性基本规律
2:不可拆成离子的物质
①气体、单质、氧化物
②弱酸:HF 、CH3COOH 、H2S、HClO等
③弱碱: NH3 · H2O
④难溶的碱、盐
⑤水
二、常见离子方程式书写
H2SO4 CH3COOH、H2S
活泼金属 Mg
碱性氧化物 CaO
强碱 NaOH、Ca(OH)2
弱碱 NH3·H2O
盐 CaCO3、Na2CO3、NaClO
NaHCO3、NaHS
1、酸碱的中和反应
(1)强酸与强碱反应的离子方程式
OH- + H+ == H2O
特例:H2SO4与Ba(OH)2反应的离子方程式
Ba(OH)2 + H2SO4== BaSO4↓ +2H2O
Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓ +2H2O
H2SO4与Ba(OH)2反应,除了有水生成,还有沉淀产生。
(2)强酸与弱碱反应的离子方程式
HCl与氨水反应的离子方程式
H+ + NH3·H2O== H2O +NH4+
HCl与Cu(OH)2反应的离子方程式
2H+ + Cu(OH)2== 2H2O +Cu2+
强酸/强碱在离子方程式以“H+/OH-”表示,
弱酸/弱碱包括氨水和难溶的碱在离子方程式以其分子式表示。
(3)强碱与弱酸反应的离子方程式
CH3COOH与NaOH反应的离子方程式
OH- + CH3COOH== H2O + CH3COO-
H2S与NaOH反应的离子方程式
2OH- + H2S== 2H2O + S2-
OH- + H2S== H2O + HS-
(4)弱碱与弱酸反应的离子方程式
CH3COOH与氨水反应的离子方程式
NH3·H2O + CH3COOH== H2O + NH4+ + CH3COO-
H2S与氨水反应的离子方程式
2NH3·H2O + H2S== 2H2O + 2NH4+ + S2-
多元弱酸与碱反应,
若碱过量,则生成正盐;
酸过量,则生成酸式盐。
NH3·H2O + H2S== H2O + NH4+ + HS-
2、活泼金属与酸反应
试写出金属Mg与HCl、H2SO4、CH3COOH反应的离子方程式
Mg + 2H+ == Mg2+ + H2↑
Mg与HCl、H2SO4反应的离子方程式
Mg与CH3COOH反应的离子方程式
Mg + 2CH3COOH == Mg2+ + 2CH3COO- + H2↑
3、金属氧化物与酸反应
试写出CaO与HCl、H2SO4、CH3COOH反应的离子方程式
CaO + 2H+ == Ca2+ + H2O
CaO与HCl、H2SO4等强酸反应的离子方程式
CaO与CH3COOH等弱酸反应的离子方程式
CaO + 2CH3COOH == Ca2+ + 2CH3COO- + H2O
4、非金属氧化物与碱反应
试写出CO2与NaOH反应的离子方程式
CO2 + 2OH-== CO32- + H2O
(1)CO2与足量NaOH反应的离子方程式
规律:多元弱酸的酸酐(CO2、SO2等)与碱反应,
若碱过量,则生成正盐;碱不足则生成酸式盐。
试题中常见如下表达方式:“少量CO2通入NaOH溶液中的离子方程式”
CO2 + OH-== HCO3-
(2)CO2与少量NaOH反应的离子方程式
试题中常见如下表达方式:“足量CO2通入NaOH溶液中的离子方程式”
CO2 + 2NaOH(足量)== Na2CO3(正盐)+ H2O
CO2 + NaOH(不足)== NaHCO3(酸式盐)
趁热打铁
试写出SO2与NaOH反应的离子方程式
SO2 + 2OH-== SO32- + H2O
(1)CO2与足量NaOH反应的离子方程式
SO2 + OH-== HSO3-
(2)SO2与少量NaOH反应的离子方程式
SO2 + 2NaOH(足量)== Na2SO3(正盐)+ H2O
SO2 + NaOH(不足)== NaSCO3(酸式盐)
试写出CO2与Ca(OH)2反应的离子方程式
CO2 + Ca2+ + 2OH-== CaCO3 + H2O
(1)少量CO2通入澄清石灰水中的离子方程式与现象
CO2 + OH-== HCO3-
(2)足量CO2通入澄清石灰水中的离子方程式与现象
Ca(OH)2是微溶物,作反应物,若为澄清石灰水,写离子形式;若为石灰乳,写分子式。
溶液变浑浊
无明显现象
CO2 + Ca2+ + 2OH-== CaCO3 + H2O
(3)向澄清石灰水中缓慢、持续通入CO2的离子方程式与现象
开始时CO2不足,
溶液变浑浊
沉淀逐渐溶解,溶液最终变澄清。
CO2 + CaCO3 + H2O== Ca2+ + 2HCO3-
CO2 + Ca(OH)2== CaCO3 + H2O
CO2通入石灰乳中的离子方程式与现象
因为石灰乳本身是浑浊的,且浓度很大,所以看不出沉淀产生,也不存在足量、少量问题。
试写出CO2与NH3·H2O反应的离子方程式
CO2 + 2NH3·H2O== CO32- +2NH4+ + H2O
(1)CO2与足量氨水反应的离子方程式
(2)CO2与少量氨水反应的离子方程式
CO2 + NH3·H2O== HCO3- +NH4+
5、弱酸盐与酸反应--强酸制弱酸
(1)向可溶性正盐Na2CO3溶液中逐滴加盐酸的离子方程式与现象
CO32-+ 2H+ ==CO2↑+H2O
CO32-+ H+ == HCO3-
后,酸过量,产生气泡
先,酸不足,无气泡
(2)向可溶性正盐Na2CO3溶液中一次性加足量盐酸的离子方程式与现象
HCO3-+ H+ == H2O+ CO2↑
Na2CO3溶液
Na2CO3溶液
稀硫酸
稀硫酸
开始酸不足无气泡,
后酸足量产生气泡。
酸足量一开始即产生气泡。
CO32-+ H+ == HCO3-
HCO3-+ H+ == H2O+ CO2↑
CO32-+ 2H+ ==CO2↑+H2O
实战演练
(3)向难溶性正盐CaCO3固体中加盐酸的离子方程式与现象
CaCO3+ 2H+ ==CO2↑+ Ca2+ + H2O
生成气泡
加酸即生成气泡
(4)向可溶性酸式盐NaHCO3溶液中加盐酸的离子方程式与现象
HCO3-+ H+ == H2O+ CO2↑
写出分别向Na2CO3、NaHCO3溶液、CaCO3固体中加醋酸的离子方程式与现象
CaCO3+ 2CH3COOH ==CO2↑+ Ca2+ + 2CH3COO- +H2O
HCO3-+ CH3COOH == H2O + CH3COO- + CO2↑
实战演练
CO32-+ 2CH3COOH ==CO2↑+ 2CH3COO- + H2O
小结:酸与挥发性多元弱酸的盐反应,
若酸不足,则生成酸式盐,酸足量则产生气泡;
(5)酸与一些特殊的弱酸的盐反应,
如HCl与NaClO、CH3COONa反应的离子方程式
ClO-+ H+ == HClO
CH3COO- + H+ == CH3COOH
酸与难挥发的弱酸的盐反应,则直接生成难电离的弱酸分子。
(1)NaHCO3溶液与NaOH溶液反应的离子方程式
HCO3-+ OH- == H2O + CO32-
6、盐与碱反应
(2)NaHCO3溶液与Ca(OH)2溶液反应的离子方程式
HCO3-+ OH- + Ca2+== H2O + CaCO3↓
NaHCO3 + Ca(OH)2==H2O + NaOH + CaCO3↓
碱过量
2HCO3-+ 2OH- + Ca2+== 2H2O + CO32- + CaCO3↓
2NaHCO3 + Ca(OH)2==2H2O + Na2CO3 + CaCO3↓
碱不足
(4)铵盐与强碱的反应,不加热时生成NH3·H2O, 加热时生成NH3。如NaOH与NH4Cl反应
NH4+ +OH-== NH3·H2O
NH4+ +OH-=== NH3↑+H2O
△
(3)NaHCO3溶液与氨水溶液反应的离子方程式
NH3·H2O+ HCO3- == NH4+ +CO32-+H2O
(5)MgCl2、CuSO4等与NaOH溶液的反应,遵循强碱制弱碱的原则,一般生成难溶的碱。
(6)向Ba(OH)2溶液中滴加NaHSO4溶液,
当溶液呈中性时的离子方程式
Ba2+ +2OH-+ 2H++SO42- == BaSO4↓ +2H2O
Ba(OH)2 + 2NaHSO4== BaSO4↓ +2H2O +Na2SO4
当Ba2+沉淀完全时的离子方程式
Ba(OH)2 + NaHSO4== BaSO4↓ + H2O +NaOH
Ba2+ +OH-+ H++SO42- == BaSO4↓ +H2O
此时溶液呈碱性
(7)向AlNH4(SO4)2溶液中滴加Ba(OH)2溶液(Al3+优先与OH-反应)
当Al3+沉淀完全时的离子方程式
Al3+ +3OH-+1.5Ba2++1.5SO42- == Al(OH)3↓+1.5BaSO4↓
AlNH4(SO4)2+1.5Ba(OH)2==Al(OH)3↓+1.5BaSO4↓+0.5(NH4)2SO4
2Al3+ +6OH-+3Ba2++3SO42- == 2Al(OH)3↓+3BaSO4↓
当SO42-沉淀完全时的离子方程式
AlNH4(SO4)2+2Ba(OH)2==Al(OH)3↓+2BaSO4↓+NH3·H2O
Al3+ +4OH-+2Ba2++2SO42-+NH4+ == Al(OH)3↓+2BaSO4↓+NH3·H2O
(7)向AlNH4(SO4)2溶液中滴加Ba(OH)2溶液(Al3+优先与OH-反应)
盐与盐反应一般有沉淀、气体或水生成
如NaCl与AgNO3溶液的反应;CaCl2与Na2CO3反应等
Ba2+ + SO42- == BaSO4↓
BaCl2 + NaHSO4== BaSO4↓ +HCl +NaCl
7、盐与盐反应
比较特殊的盐是NaHSO4,其溶液显强酸性,可与钡盐反应,也可某些弱酸盐反应,如NaHCO3、Na2S、NaClO等。
NaHCO3 + NaHSO4== Na2SO4 + H2O + CO2↑
HCO3-+ H+ == H2O+ CO2↑
课堂小结
1、离子反应发生的条件,除了生成沉淀、气体、水之外,还可以生成难电离的物质,另外溶液中的置换反应也属于离子反应。
要注意观念的更新。
2、注意弱酸酸式盐的相关反应
多元弱酸与强碱反应,
碱过量生成正盐,酸过量生成酸式盐;
多元弱酸对应的氧化物与强碱反应也有类似情况;
弱酸的酸式盐即能与强酸反应生成弱酸,
又能与强碱反应正盐。
弱酸的酸式酸根HCO3- 、HSO3- 、HS-
反应物的过量或不足会导致不一样的离子反应,所以审题时要特别注意理解题意。
如“向盛有碳酸钠溶液的试管中逐滴加盐酸”,意味着开始时试管中的Na2CO3是过量的,则HCl是不足的,故一开始并无气泡产生,随着HCl的滴加,会产生气泡。
“向盛有盐酸的试管中逐滴加碳酸钠溶液”,意味着开始时试管中的HCl是过量的,则一开始就会产生气泡。
条件不同,现象不同,离子方程式自然不同。
3、注意分析反应中物质的过量或不足问题
