江苏省镇江市十校2022-2023学年高一下学期5月校际联考化学试题(PDF版含答案)
文档属性
| 名称 | 江苏省镇江市十校2022-2023学年高一下学期5月校际联考化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-21 20:00:56 | ||
图片预览


文档简介
高一年级第二学期五月校际联考
化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 C1-35.5 Fe-56
一、单项选择题:共 14题,每题 3分,共 42 分。每题只.有.一.个.选.项.最符合题意。
1. 化学与生产、生活、科技等密切相关,下列说法不.正.确.的是
A. 手机使用的锂电池属于二次电池,在一定条件下可实现化学能和电能的相互转化
B. 因为催化剂不能影响化学平衡,不同种催化剂对同一反应的生产效率不产生影响
C. 锌锰碱性电池,锌电极是负极,放电时发生氧化反应
D. 开发使用生物质能、太阳能、风能等新型能源可减少化石燃料的使用
2.反应 A(g)+3B(g) 2C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的
是
- - - -
A. v(A)=0.3 mol·L 1·s 1 B. v(B)=0.6 mol·L 1·s 1
- -
C. v(C)=0.4 mol·L 1·s 1
-1 -D. v(D)=0.1 mol·L ·s 1
3.在给定条件下,下列选项所示的物质间转化能实现的是
BaCl2(aq) FeCl3(aq)
A.SO2(g) BaSO3(s) B.Cu Fe(s)
O
2电解
C.MgCl2(aq) Mg(s) D.NO
H2O HNO3
4.对于反应 2NO(g)+O2(g) 2NO2(g) ΔH=-114.2kJ·mol-1,下列说法正确的是
A. 该反应的 ΔS>0
B. 使用高效催化剂能提高 NO 的平衡转化率
C. 增大压强,化学平衡正向移动,平衡常数 K 增大
D. 每消耗 1molO2,转移电子的数目约为 4×6.02×1023
阅读下列材料,完成 5~6 题:
黄铁矿(FeS2)是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化:
2FeS2+7O2+2H2O=2FeSO4+2H2SO4。工业上常选择黄铁矿为原料制备硫酸,其中发生的
反应有:4FeS2+11O2 2Fe2O3+8SO2;2SO2(g)+O2(g) 2SO3(g) 。
5.下列物质性质与用途具有对应关系的是
A.FeSO4具有还原性,可用作自来水厂的净水剂
B.Fe2O3 属于碱性氧化物,可用作粉刷墙壁的红色涂料
C.SO2 具有还原性,可用于葡萄酒的保存
D.浓硫酸具有脱水性,可干燥氯气
6.2SO2(g)+O2(g) 2SO3(g) ΔH 的反应机理如下:
反应Ⅰ:V2O5 (s)+SO2(g) = V2O4(s)+SO3(g) ΔH1= 24kJ·mol 1
反应Ⅱ:2V O (s)+O (g) = 2V O (s) ΔH =-246 kJ·mol 12 4 2 2 5 2
反应中的能量变化如右图所示,下列说法不.正.确.的是
A.ΔH=-198kJ·mol 1
B.反应Ⅰ的 ΔS<0
C.通入过量空气,可提高 SO2 的平衡转化率
D.反应速率由反应Ⅱ决定
7.下列有关实验装置、原理和操作正确,且能达到相应实验目的的是
1
铜片 铁制品
甲 乙 丙 丁
A.用图甲所示装置在铁制品表面镀铜
B.图乙所示装置中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C.图丙所示的实验: 用浓硫酸和 NaOH 溶液反应测定中和热
D.根据图丁所示的两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断
2NO2(g) N2O4(g) 正反应是放热反应
8.工业合成氨是人类科学技术的一项重大突破,其热化学方程式为 N2(g)+3H2(g) 2NH3(g)
ΔH = 92.4 kJ mol 1,氨气经氧化等步骤制得硝酸。N2、NH3 在催化剂 a、b 表面分别发生如
下图所示的反应,下列说法正确的是
A. 催化剂 a 表面形成 N-H 键时需吸收能量
B. 使用催化剂 a 可以加快合成氨反应的正反应速率,减慢逆反应速率
C. 反应时催化剂 b 表面有共价键的断裂和形成
催化剂
D. 催化剂 b 表面反应的化学方程式为:2NH3 +O2 2NO+3H2
9.由碳酸锰矿(主要成分 MnCO3,还含有 FeCO3、MnO2、Al2O3、SiO2等)中提取金属锰的
一种流程如下:
下列有关说法不.正.确.的是
A. 适当提高酸浸温度并不断搅拌,可以提高锰元素的浸出率
2
B. 酸浸时,FeCO3溶于稀硫酸的离子方程式为:
+
CO 3 +2H =H2O+CO2↑
C. 用 NaOH 溶液和 CO2 两种物质,可将滤渣Ⅱ中的两种物质分离
D. 电解浸出过程中,溶液的 pH 值减小
10. N +2O 和 CO 是环境污染性气体,可在 Pt2O 表面转化为无害气体,其反应为:
N2O(g)+CO(g)=CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程如图 1 所示,能量变化过程
如图 2 所示,下列说法正确的是
2
A. 由图 1、2 可知 ΔH=ΔH1+ΔH2=ΔE2-ΔE1
B. 加入 Pt +2O 作为反应物,可使反应的焓变减小
C. 由图 2 可知正反应的活化能小于逆反应的活化能
D. 物质的量相等的 N2O、CO 的键能总和大于 CO2、N2的键能总和
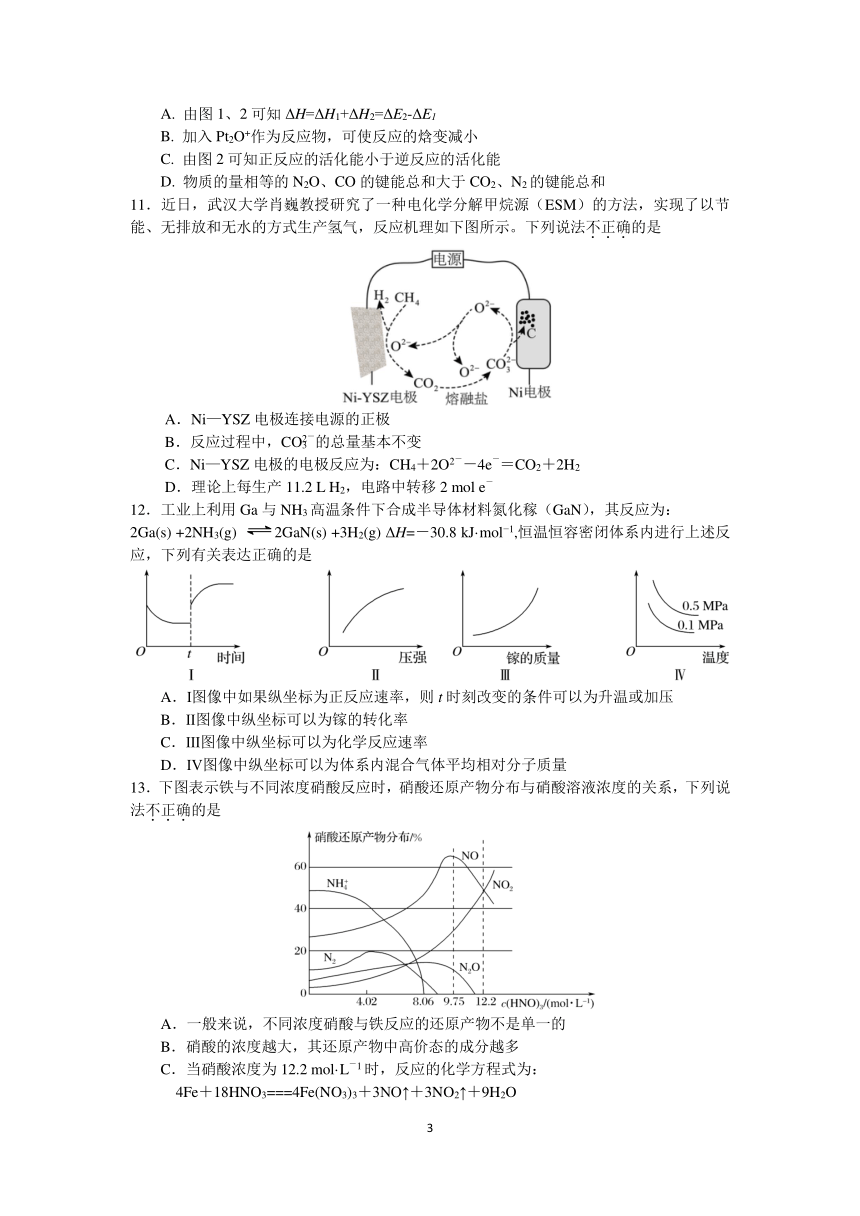
11.近日,武汉大学肖巍教授研究了一种电化学分解甲烷源(ESM)的方法,实现了以节
能、无排放和无水的方式生产氢气,反应机理如下图所示。下列说法不.正.确.的是
A.Ni—YSZ 电极连接电源的正极
-
B.反应过程中,CO23 的总量基本不变
- -
C.Ni—YSZ 电极的电极反应为:CH 24+2O -4e =CO2+2H2
-
D.理论上每生产 11.2 L H2,电路中转移 2 mol e
12.工业上利用 Ga 与 NH3 高温条件下合成半导体材料氮化稼(GaN),其反应为:
2Ga(s) +2NH3(g) 2GaN(s) +3H2(g) ΔH=-30.8 kJ·mol 1,恒温恒容密闭体系内进行上述反
应,下列有关表达正确的是
A.Ⅰ图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温或加压
B.Ⅱ图像中纵坐标可以为镓的转化率
C.Ⅲ图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
13.下图表示铁与不同浓度硝酸反应时,硝酸还原产物分布与硝酸溶液浓度的关系,下列说
法不.正.确.的是
A.一般来说,不同浓度硝酸与铁反应的还原产物不是单一的
B.硝酸的浓度越大,其还原产物中高价态的成分越多
-
C.当硝酸浓度为 12.2 mol·L 1 时,反应的化学方程式为:
4Fe+18HNO3===4Fe(NO3)3+3NO↑+3NO2↑+9H2O
3
-
D.用一定量的铁粉与足量的 9.75 mol·L 1 HNO3 溶液反应得到标准状况下气体 2.24 L,
则被还原的硝酸的物质的量为 0.1 mol
14. H2S 分解的热化学方程式为 2H2S(g) 2H2(g)+S2(g) ΔH>0。向体积为 1L 的恒容密闭容
器中充入 n(H2S)+n(Ar)=0.1mol 的混合气体(Ar 不参与反应),不同温度下 H2S 的平衡转化
n H2S
率随 比值的变化如图所示。下列说法正确的是
n Ar
A. T1<T2
c2 H2S
B. 反应的平衡常数可表示为 K=
c2 H2 c S2
2
C. 反应在 X 点对应条件下达到平衡时,H2的体积分数为
9
D. 维持 X 点时 n(H2S)不变,向容器中充入 Ar,H2S 的平衡转化率减小
二、非选择题:共 4 题,共 58分。
15. (14 分)工业上由含铜废料(含有 Cu、CuS、CuSO 等)制备硝酸铜晶体的流程如图: 4
(1) 提高焙烧效率的方法有: ▲ (写一种),“焙烧”时 CuS 转化为 CuO 和SO ,2
反应的化学方程式为 ▲ ;
(2)“酸化”步骤反应的离子方程式为 ▲ ;
(3)“淘洗”所用的溶液 A 应选用 ▲ (填序号)。
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(4)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO 和H O 的物质的量之比为 ▲ ; 3 2 2
②若不加 10% H 只用浓2O2 HNO ,随着反应的进行,容器内持续出现大量红棕色气体,写3
出该反应的离子方程式 ▲ ;
(5)由“反应”所得溶液中尽可能多地析出Cu NO3 3H O 晶2 2
体的方法是:将“反应”所得溶液蒸发浓缩、 ▲ (填
操作名称)、过滤、冰水洗涤、低温烘干即可获得。(相关物质
的溶解度曲线如图所示)
16.(18 分)利用化学反应原理的知识可以有效的服务于生产
和生活当中。
I.工业生产中经常用活性炭还原处理氮氧化物,起到了很好的
效果。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式 ▲ 。
(2)在 2L 恒容密闭容器中加入足量 C 与 NO 发生反应,所得数据如表,回答下列问题。
4
实验编号 温度/℃ 起始时 NO 的物质的量/mol 平衡时 N2 的物质的量/mol
1 700 0.40 0.09
2 800 0.24 0.08
①结合表中数据,判断该反应的 ΔH ▲ 0(填“>”或“<”)。
②判断该反应达到平衡状态的依据是 ▲ (填字母)。
A.2v 正(NO)=v 逆(N2) B.容器内各气体浓度恒定
C.容器内压强恒定 D.容器内气体平均相对分子质量恒定
Ⅱ. 某同学设计利用一氧化氮—空气质子交换膜燃料电池将化学能转化为电能,实现了制硝
酸、发电、环保三位一体的结合。
(3) 甲装置中 Pt1 上的电极反应式为 ▲ ;每转移 1 mol 电子,通过质子交换
+
膜的 H 的物质的量为 ▲ 。
(4) 乙装置中C2上的电极反应式为 ▲ ,乙装置中物质X是 ▲ (填化学式)。
(5) 装置丙用于含锌粗铜的精炼。装置中电极 A 是 ▲ (填“粗铜”或“纯铜”),工作一
段时间后,CuSO4 溶液的浓度将 ▲ (填“增大”“减小”或“不变”)。
17.(14 分)为消除燃煤烟气中含有的 SO2、NO,研究者提出若干烟气“脱硫”“脱硝”的方法。
2
I.以 NaClO 作为吸收剂进行一体化“脱硫”“脱硝”,将烟气中的 SO2、NO 转化为SO4 、NO
3 。
(1)300mL1.0mol L 1 NaClO溶液理论上最多能吸收标准状况下 NO 的体积为 ▲ L。
(2)实验室利用模拟烟气探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率
的影响曲线如图所示。
①此方法“脱硫”“脱硝”探究实验的最佳温度为 ▲ ℃。
②SO2 的脱除率高于NO ,其原因除 SO2的还原性比NO 强外,还可能是 ▲ 。
Ⅱ. SCR 技术(选择性催化还原氮氧化物)
研究表明,铁基催化剂在 260~300℃范围内实现SCR 技术的过程如图所示。
(3)根据上述机理,H+在反应过程中的作用为 ▲ ;等物质的量的 NH3、NO 在有
氧条件下转化为 N2 的总反应化学方程式为 ▲ ;
5
(4)若使用锰基催化剂(活性物质为 MnO2)代替铁基催化剂,烟气中含有的 SO2会使催化剂失
效而降低 NO 脱除率,用化学方程式表示催化剂失效的原因: ▲ 。
(5)向反应体系中添加 NH4NO3 可显著提高NO 脱除率,原因是NO3 与 NO 反应生成 NO2 和
阴离子 M;阴离子 M 再与NH4 发生反应转化为 N2,则阴离子 M 为 ▲ 。
18. (12 分) “碳达峰”“碳中和”是我国社会发展重大战略之一。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以 CO2 为原料制
CH3OH。在某 CO2催化加氢制 CH3OH 的反应体系中,发生的主要反应有:
① CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1 kJ·mol-1
② CO(g)+2H2(g) CH3OH(g) △H2= 90.0 kJ·mol-1
③ CO2(g)+ 3H2(g) CH3OH(g) +H2O(g) △H3= 48.9 kJ·mol-1
(1)5Mpa 时,往某密闭容器中按投料比 n(H2):n(CO2)=3︰1 充
入 H2 和 CO2。反应达到平衡时,测得各组分的物质的量分数随温
度变化的曲线如右图所示。
①图中 Y 代表 ▲ (填化学式)。
②体系中CO2的物质的量分数受温度影响不大,原因是 ▲ 。
II.CH4 还原 CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
① CH4(g)+CO2(g) 2CO(g)+2H2(g) △H =a kJ·mol-11
② CO2(g)+H2(g) CO(g)+H2O(g) △H2=b kJ·mol-1
请回答:
(2)反应 CH4(g)+3CO2(g) 4CO(g)+2H2O(g)的△H = ▲ kJ·mol-1(用 a,b 表示)。
(3)恒压,750℃时,CH4 和 CO2 按物质的量之比 1︰3 投料,经如下流程可实现 CO2 高效
转化。
①写出过程ⅱ产生 H2O(g)的化学方程式 ▲ 。
②过程ⅱ的催化剂是 ▲ 。
③过程ⅱ平衡后通入稀有气体 He,测得一段时间内 CO 物质的量上升,根据过程ⅲ,结合
平衡移动原理,解释 CO 物质的量上升的原因 ▲ 。
6
高一年级第二学期五月校际联考
化学答案
一、单项选择题(14 题,共 42 分)
1.B 2.A 3.D 4.D 5.C 6.B 7.D 8.C 9.B 10.C
11.D 12.A 13.D 14.C
二、非选择题(4 题,共 58 分)
15.(14 分,每空 2 分)
(1)将含铜废料粉碎(其它合理答案也可以) 2CuS+3O2 2CuO+2SO2
(2) CuO+2H+═Cu2++H2O (3)a
(4) ①2:1 ②Cu+4H++2NO 2+3 =Cu +2NO2↑+2H2O
(5) 降温至温度略高于 26.4℃结晶
16.(18 分,每空 2 分)
(1) (2)①> ②BD
(3) 1mol
(4) H2SO4 (5)粗铜 减小
17.(14 分,每空 2 分)
(1) 4.48
(2) ① 50℃ ②NO 难溶于水,故NO 与NaClO反应速率慢,一定时间内的去除率低
铁基催化剂
(3) 作催化剂 4NH3 4NO O2 4N2 6H2O
(4) MnO2 SO2 =MnSO4 (5) NO2
18.(12 分,每空 2 分)
(1)①CH3OH
②随温度升高,反应①正向进行的程度与反应③逆向进行的程度相差不大。
(2)a+2b
(3)① ②CaO、Fe3O4
③通入稀有气体 He,相当于减压,CaCO3 分解平衡右移,导致 减小,促进 Fe 还
原 CO2平衡右移,CO 物质的量上升。
- 1 -
化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 C1-35.5 Fe-56
一、单项选择题:共 14题,每题 3分,共 42 分。每题只.有.一.个.选.项.最符合题意。
1. 化学与生产、生活、科技等密切相关,下列说法不.正.确.的是
A. 手机使用的锂电池属于二次电池,在一定条件下可实现化学能和电能的相互转化
B. 因为催化剂不能影响化学平衡,不同种催化剂对同一反应的生产效率不产生影响
C. 锌锰碱性电池,锌电极是负极,放电时发生氧化反应
D. 开发使用生物质能、太阳能、风能等新型能源可减少化石燃料的使用
2.反应 A(g)+3B(g) 2C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的
是
- - - -
A. v(A)=0.3 mol·L 1·s 1 B. v(B)=0.6 mol·L 1·s 1
- -
C. v(C)=0.4 mol·L 1·s 1
-1 -D. v(D)=0.1 mol·L ·s 1
3.在给定条件下,下列选项所示的物质间转化能实现的是
BaCl2(aq) FeCl3(aq)
A.SO2(g) BaSO3(s) B.Cu Fe(s)
O
2电解
C.MgCl2(aq) Mg(s) D.NO
H2O HNO3
4.对于反应 2NO(g)+O2(g) 2NO2(g) ΔH=-114.2kJ·mol-1,下列说法正确的是
A. 该反应的 ΔS>0
B. 使用高效催化剂能提高 NO 的平衡转化率
C. 增大压强,化学平衡正向移动,平衡常数 K 增大
D. 每消耗 1molO2,转移电子的数目约为 4×6.02×1023
阅读下列材料,完成 5~6 题:
黄铁矿(FeS2)是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化:
2FeS2+7O2+2H2O=2FeSO4+2H2SO4。工业上常选择黄铁矿为原料制备硫酸,其中发生的
反应有:4FeS2+11O2 2Fe2O3+8SO2;2SO2(g)+O2(g) 2SO3(g) 。
5.下列物质性质与用途具有对应关系的是
A.FeSO4具有还原性,可用作自来水厂的净水剂
B.Fe2O3 属于碱性氧化物,可用作粉刷墙壁的红色涂料
C.SO2 具有还原性,可用于葡萄酒的保存
D.浓硫酸具有脱水性,可干燥氯气
6.2SO2(g)+O2(g) 2SO3(g) ΔH 的反应机理如下:
反应Ⅰ:V2O5 (s)+SO2(g) = V2O4(s)+SO3(g) ΔH1= 24kJ·mol 1
反应Ⅱ:2V O (s)+O (g) = 2V O (s) ΔH =-246 kJ·mol 12 4 2 2 5 2
反应中的能量变化如右图所示,下列说法不.正.确.的是
A.ΔH=-198kJ·mol 1
B.反应Ⅰ的 ΔS<0
C.通入过量空气,可提高 SO2 的平衡转化率
D.反应速率由反应Ⅱ决定
7.下列有关实验装置、原理和操作正确,且能达到相应实验目的的是
1
铜片 铁制品
甲 乙 丙 丁
A.用图甲所示装置在铁制品表面镀铜
B.图乙所示装置中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C.图丙所示的实验: 用浓硫酸和 NaOH 溶液反应测定中和热
D.根据图丁所示的两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断
2NO2(g) N2O4(g) 正反应是放热反应
8.工业合成氨是人类科学技术的一项重大突破,其热化学方程式为 N2(g)+3H2(g) 2NH3(g)
ΔH = 92.4 kJ mol 1,氨气经氧化等步骤制得硝酸。N2、NH3 在催化剂 a、b 表面分别发生如
下图所示的反应,下列说法正确的是
A. 催化剂 a 表面形成 N-H 键时需吸收能量
B. 使用催化剂 a 可以加快合成氨反应的正反应速率,减慢逆反应速率
C. 反应时催化剂 b 表面有共价键的断裂和形成
催化剂
D. 催化剂 b 表面反应的化学方程式为:2NH3 +O2 2NO+3H2
9.由碳酸锰矿(主要成分 MnCO3,还含有 FeCO3、MnO2、Al2O3、SiO2等)中提取金属锰的
一种流程如下:
下列有关说法不.正.确.的是
A. 适当提高酸浸温度并不断搅拌,可以提高锰元素的浸出率
2
B. 酸浸时,FeCO3溶于稀硫酸的离子方程式为:
+
CO 3 +2H =H2O+CO2↑
C. 用 NaOH 溶液和 CO2 两种物质,可将滤渣Ⅱ中的两种物质分离
D. 电解浸出过程中,溶液的 pH 值减小
10. N +2O 和 CO 是环境污染性气体,可在 Pt2O 表面转化为无害气体,其反应为:
N2O(g)+CO(g)=CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程如图 1 所示,能量变化过程
如图 2 所示,下列说法正确的是
2
A. 由图 1、2 可知 ΔH=ΔH1+ΔH2=ΔE2-ΔE1
B. 加入 Pt +2O 作为反应物,可使反应的焓变减小
C. 由图 2 可知正反应的活化能小于逆反应的活化能
D. 物质的量相等的 N2O、CO 的键能总和大于 CO2、N2的键能总和
11.近日,武汉大学肖巍教授研究了一种电化学分解甲烷源(ESM)的方法,实现了以节
能、无排放和无水的方式生产氢气,反应机理如下图所示。下列说法不.正.确.的是
A.Ni—YSZ 电极连接电源的正极
-
B.反应过程中,CO23 的总量基本不变
- -
C.Ni—YSZ 电极的电极反应为:CH 24+2O -4e =CO2+2H2
-
D.理论上每生产 11.2 L H2,电路中转移 2 mol e
12.工业上利用 Ga 与 NH3 高温条件下合成半导体材料氮化稼(GaN),其反应为:
2Ga(s) +2NH3(g) 2GaN(s) +3H2(g) ΔH=-30.8 kJ·mol 1,恒温恒容密闭体系内进行上述反
应,下列有关表达正确的是
A.Ⅰ图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温或加压
B.Ⅱ图像中纵坐标可以为镓的转化率
C.Ⅲ图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
13.下图表示铁与不同浓度硝酸反应时,硝酸还原产物分布与硝酸溶液浓度的关系,下列说
法不.正.确.的是
A.一般来说,不同浓度硝酸与铁反应的还原产物不是单一的
B.硝酸的浓度越大,其还原产物中高价态的成分越多
-
C.当硝酸浓度为 12.2 mol·L 1 时,反应的化学方程式为:
4Fe+18HNO3===4Fe(NO3)3+3NO↑+3NO2↑+9H2O
3
-
D.用一定量的铁粉与足量的 9.75 mol·L 1 HNO3 溶液反应得到标准状况下气体 2.24 L,
则被还原的硝酸的物质的量为 0.1 mol
14. H2S 分解的热化学方程式为 2H2S(g) 2H2(g)+S2(g) ΔH>0。向体积为 1L 的恒容密闭容
器中充入 n(H2S)+n(Ar)=0.1mol 的混合气体(Ar 不参与反应),不同温度下 H2S 的平衡转化
n H2S
率随 比值的变化如图所示。下列说法正确的是
n Ar
A. T1<T2
c2 H2S
B. 反应的平衡常数可表示为 K=
c2 H2 c S2
2
C. 反应在 X 点对应条件下达到平衡时,H2的体积分数为
9
D. 维持 X 点时 n(H2S)不变,向容器中充入 Ar,H2S 的平衡转化率减小
二、非选择题:共 4 题,共 58分。
15. (14 分)工业上由含铜废料(含有 Cu、CuS、CuSO 等)制备硝酸铜晶体的流程如图: 4
(1) 提高焙烧效率的方法有: ▲ (写一种),“焙烧”时 CuS 转化为 CuO 和SO ,2
反应的化学方程式为 ▲ ;
(2)“酸化”步骤反应的离子方程式为 ▲ ;
(3)“淘洗”所用的溶液 A 应选用 ▲ (填序号)。
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(4)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO 和H O 的物质的量之比为 ▲ ; 3 2 2
②若不加 10% H 只用浓2O2 HNO ,随着反应的进行,容器内持续出现大量红棕色气体,写3
出该反应的离子方程式 ▲ ;
(5)由“反应”所得溶液中尽可能多地析出Cu NO3 3H O 晶2 2
体的方法是:将“反应”所得溶液蒸发浓缩、 ▲ (填
操作名称)、过滤、冰水洗涤、低温烘干即可获得。(相关物质
的溶解度曲线如图所示)
16.(18 分)利用化学反应原理的知识可以有效的服务于生产
和生活当中。
I.工业生产中经常用活性炭还原处理氮氧化物,起到了很好的
效果。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式 ▲ 。
(2)在 2L 恒容密闭容器中加入足量 C 与 NO 发生反应,所得数据如表,回答下列问题。
4
实验编号 温度/℃ 起始时 NO 的物质的量/mol 平衡时 N2 的物质的量/mol
1 700 0.40 0.09
2 800 0.24 0.08
①结合表中数据,判断该反应的 ΔH ▲ 0(填“>”或“<”)。
②判断该反应达到平衡状态的依据是 ▲ (填字母)。
A.2v 正(NO)=v 逆(N2) B.容器内各气体浓度恒定
C.容器内压强恒定 D.容器内气体平均相对分子质量恒定
Ⅱ. 某同学设计利用一氧化氮—空气质子交换膜燃料电池将化学能转化为电能,实现了制硝
酸、发电、环保三位一体的结合。
(3) 甲装置中 Pt1 上的电极反应式为 ▲ ;每转移 1 mol 电子,通过质子交换
+
膜的 H 的物质的量为 ▲ 。
(4) 乙装置中C2上的电极反应式为 ▲ ,乙装置中物质X是 ▲ (填化学式)。
(5) 装置丙用于含锌粗铜的精炼。装置中电极 A 是 ▲ (填“粗铜”或“纯铜”),工作一
段时间后,CuSO4 溶液的浓度将 ▲ (填“增大”“减小”或“不变”)。
17.(14 分)为消除燃煤烟气中含有的 SO2、NO,研究者提出若干烟气“脱硫”“脱硝”的方法。
2
I.以 NaClO 作为吸收剂进行一体化“脱硫”“脱硝”,将烟气中的 SO2、NO 转化为SO4 、NO
3 。
(1)300mL1.0mol L 1 NaClO溶液理论上最多能吸收标准状况下 NO 的体积为 ▲ L。
(2)实验室利用模拟烟气探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率
的影响曲线如图所示。
①此方法“脱硫”“脱硝”探究实验的最佳温度为 ▲ ℃。
②SO2 的脱除率高于NO ,其原因除 SO2的还原性比NO 强外,还可能是 ▲ 。
Ⅱ. SCR 技术(选择性催化还原氮氧化物)
研究表明,铁基催化剂在 260~300℃范围内实现SCR 技术的过程如图所示。
(3)根据上述机理,H+在反应过程中的作用为 ▲ ;等物质的量的 NH3、NO 在有
氧条件下转化为 N2 的总反应化学方程式为 ▲ ;
5
(4)若使用锰基催化剂(活性物质为 MnO2)代替铁基催化剂,烟气中含有的 SO2会使催化剂失
效而降低 NO 脱除率,用化学方程式表示催化剂失效的原因: ▲ 。
(5)向反应体系中添加 NH4NO3 可显著提高NO 脱除率,原因是NO3 与 NO 反应生成 NO2 和
阴离子 M;阴离子 M 再与NH4 发生反应转化为 N2,则阴离子 M 为 ▲ 。
18. (12 分) “碳达峰”“碳中和”是我国社会发展重大战略之一。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以 CO2 为原料制
CH3OH。在某 CO2催化加氢制 CH3OH 的反应体系中,发生的主要反应有:
① CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1 kJ·mol-1
② CO(g)+2H2(g) CH3OH(g) △H2= 90.0 kJ·mol-1
③ CO2(g)+ 3H2(g) CH3OH(g) +H2O(g) △H3= 48.9 kJ·mol-1
(1)5Mpa 时,往某密闭容器中按投料比 n(H2):n(CO2)=3︰1 充
入 H2 和 CO2。反应达到平衡时,测得各组分的物质的量分数随温
度变化的曲线如右图所示。
①图中 Y 代表 ▲ (填化学式)。
②体系中CO2的物质的量分数受温度影响不大,原因是 ▲ 。
II.CH4 还原 CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
① CH4(g)+CO2(g) 2CO(g)+2H2(g) △H =a kJ·mol-11
② CO2(g)+H2(g) CO(g)+H2O(g) △H2=b kJ·mol-1
请回答:
(2)反应 CH4(g)+3CO2(g) 4CO(g)+2H2O(g)的△H = ▲ kJ·mol-1(用 a,b 表示)。
(3)恒压,750℃时,CH4 和 CO2 按物质的量之比 1︰3 投料,经如下流程可实现 CO2 高效
转化。
①写出过程ⅱ产生 H2O(g)的化学方程式 ▲ 。
②过程ⅱ的催化剂是 ▲ 。
③过程ⅱ平衡后通入稀有气体 He,测得一段时间内 CO 物质的量上升,根据过程ⅲ,结合
平衡移动原理,解释 CO 物质的量上升的原因 ▲ 。
6
高一年级第二学期五月校际联考
化学答案
一、单项选择题(14 题,共 42 分)
1.B 2.A 3.D 4.D 5.C 6.B 7.D 8.C 9.B 10.C
11.D 12.A 13.D 14.C
二、非选择题(4 题,共 58 分)
15.(14 分,每空 2 分)
(1)将含铜废料粉碎(其它合理答案也可以) 2CuS+3O2 2CuO+2SO2
(2) CuO+2H+═Cu2++H2O (3)a
(4) ①2:1 ②Cu+4H++2NO 2+3 =Cu +2NO2↑+2H2O
(5) 降温至温度略高于 26.4℃结晶
16.(18 分,每空 2 分)
(1) (2)①> ②BD
(3) 1mol
(4) H2SO4 (5)粗铜 减小
17.(14 分,每空 2 分)
(1) 4.48
(2) ① 50℃ ②NO 难溶于水,故NO 与NaClO反应速率慢,一定时间内的去除率低
铁基催化剂
(3) 作催化剂 4NH3 4NO O2 4N2 6H2O
(4) MnO2 SO2 =MnSO4 (5) NO2
18.(12 分,每空 2 分)
(1)①CH3OH
②随温度升高,反应①正向进行的程度与反应③逆向进行的程度相差不大。
(2)a+2b
(3)① ②CaO、Fe3O4
③通入稀有气体 He,相当于减压,CaCO3 分解平衡右移,导致 减小,促进 Fe 还
原 CO2平衡右移,CO 物质的量上升。
- 1 -
同课章节目录
