2023年高三化学物质制备型实验专题复习——以高锰酸钾的制备为例 课件(共23张PPT)
文档属性
| 名称 | 2023年高三化学物质制备型实验专题复习——以高锰酸钾的制备为例 课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 45.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-24 08:59:48 | ||
图片预览



文档简介
(共23张PPT)
化
学
实
验
物质制备型实验专题复习
---以高锰酸钾的制备为例
情境导入
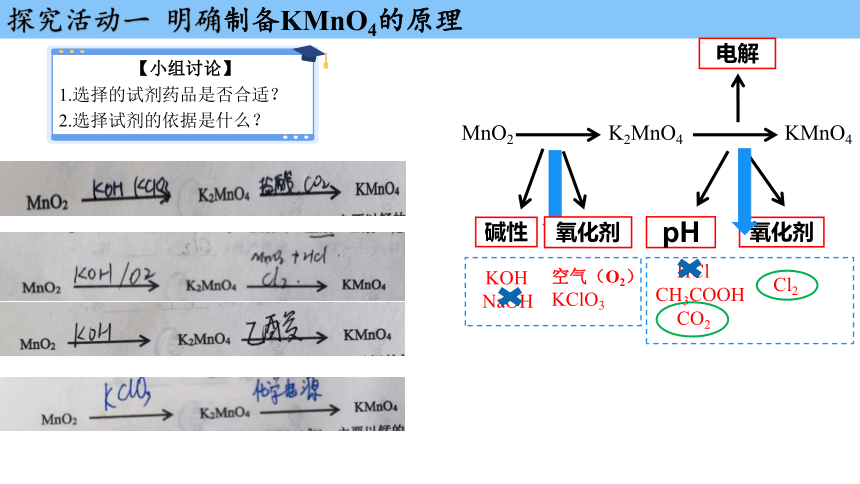
探究活动一 明确制备KMnO4的原理
【小组讨论】
1.选择的试剂药品是否合适?
2.选择试剂的依据是什么?
电解
MnO2 K2MnO4 KMnO4
pH
氧化剂
碱性
氧化剂
KOH
NaOH
空气(O2)
KClO3
HCl
CH3COOH
CO2
Cl2
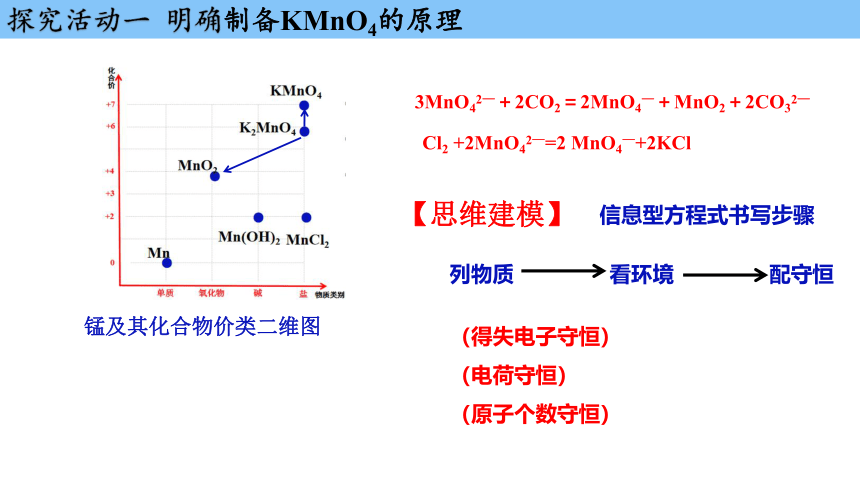
锰及其化合物价类二维图
3MnO42—+2CO2=2MnO4—+MnO2+2CO32—
Cl2 +2MnO42—=2 MnO4—+2KCl
信息型方程式书写步骤
【思维建模】
列物质 看环境 配守恒
(得失电子守恒)
(电荷守恒)
(原子个数守恒)
探究活动一 明确制备KMnO4的原理
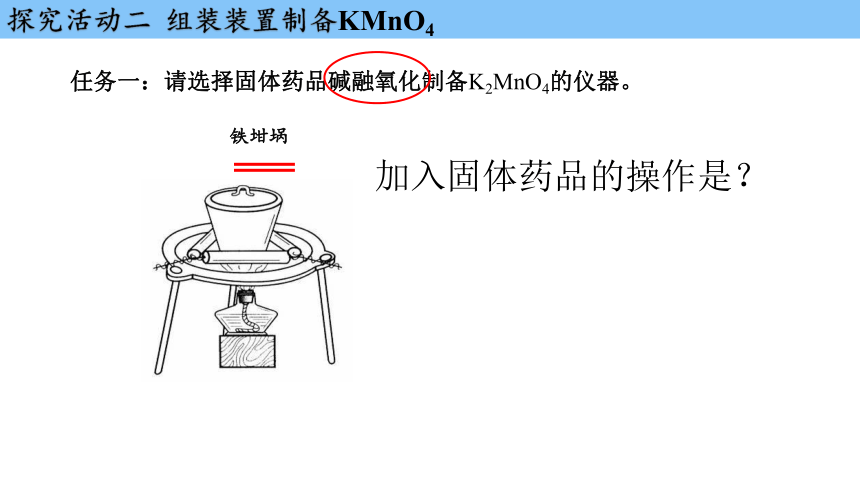
探究活动二 组装装置制备KMnO4
铁坩埚
加入固体药品的操作是?
任务一:请选择固体药品碱融氧化制备K2MnO4的仪器。
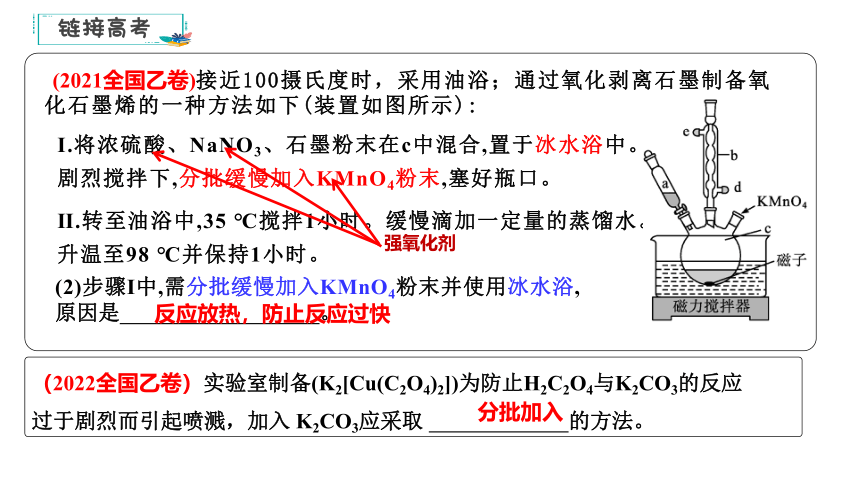
(2021全国乙卷)接近100摄氏度时,采用油浴;通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):
Ⅰ.将浓硫酸、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
Ⅱ.转至油浴中,35 ℃搅拌1小时。缓慢滴加一定量的蒸馏水。升温至98 ℃并保持1小时。
(2)步骤Ⅰ中,需分批缓慢加入KMnO4粉末并使用冰水浴,原因是 。
反应放热,防止反应过快
强氧化剂
(2022全国乙卷)实验室制备(K2[Cu(C2O4)2])为防止H2C2O4与K2CO3的反应过于剧烈而引起喷溅,加入 K2CO3应采取 的方法。
分批加入
链接高考
【小组活动】
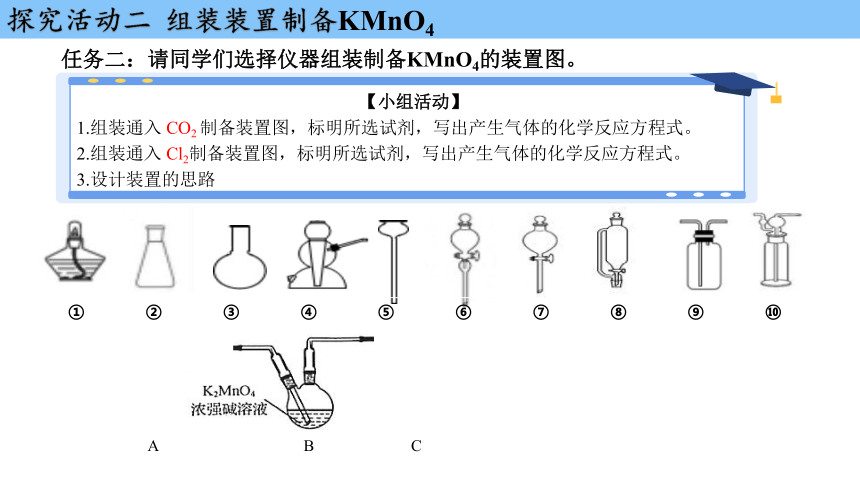
1.组装通入 CO2 制备装置图,标明所选试剂,写出产生气体的化学反应方程式。
2.组装通入 Cl2制备装置图,标明所选试剂,写出产生气体的化学反应方程式。
3.设计装置的思路
任务二:请同学们选择仪器组装制备KMnO4的装置图。
① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
A B C
探究活动二 组装装置制备KMnO4
HCl
CaCO3
饱和NaHCO3溶液
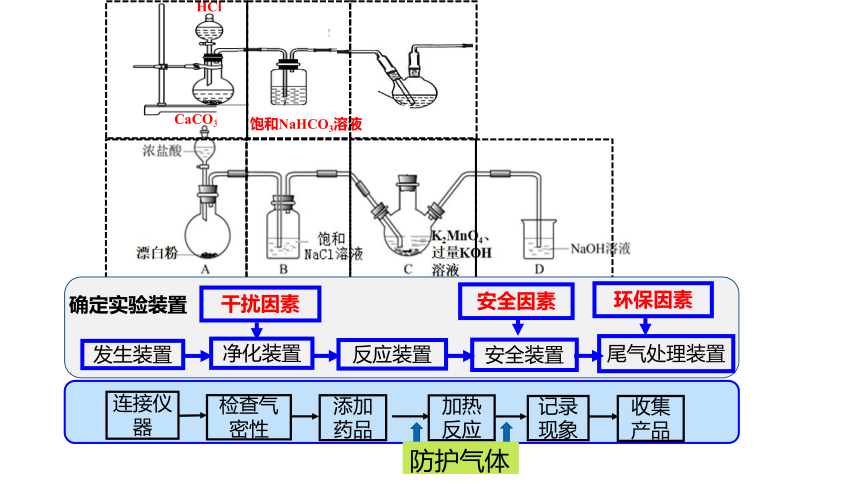
确定实验装置
净化装置
发生装置
安全装置
反应装置
尾气处理装置
干扰因素
安全因素
环保因素
检查气密性
连接仪器
加热反应
收集产品
记录现象
添加药品
防护气体
(2020山东)某同学利用Cl2氧化K2MnO4制备KMnO4的装置如右图所示。
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: 3Mn+2H2O == 2Mn+MnO2↓+4OH-
链接高考
装置A中a的作用是 ;
装置C中的试剂为 ;
装置存在一处缺陷会导致KMnO4产率降低,
改进的方法是 。
在装置A、B之间加装盛有饱和食盐水的洗气瓶
平衡压强使液体顺利滴下
NaOH溶液
【思维建模】装置缺陷解决思路
1.未除杂
2.未干燥
3.未吸收尾气
4.未防氧化
5.未防爆炸
6.未防倒吸
在XX装置之间,添加一个装有XX的XX(干燥管,洗气瓶等)
常见装置缺陷
解决思路
(2021山东卷)六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,装置如图所示(夹持装置略)。回答下列问题:
(1)检查装置气密性并加入WO3。先通N2,其目的是 ;一段时间后,加热管式炉,改通H2,对B处逸出的H2进行后续处理。仪器A的名称为 ,证明WO3已被完全还原的现象是 。
排除装置中的空气
直形冷凝管
不再有水凝结
链接高考
(2021山东卷)六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,装置如图所示(夹持装置略)。回答下列问题:
⑵ WO3完全还原后,进行的操作为:
① 冷却,停止通H2;
② 以干燥的接收装置替换E;
③ 在B处加装盛有碱石灰的干燥管;
④ ……;
⑤ 加热,通Cl2;
⑥ ……。
碱石灰的作用是 ;
操作④是 ,目的是 。
吸收多余氯气,防止污染空气,防止空气中的水蒸气进入E
排除装置中的H2
再次通入N2
链接高考
防爆炸
鼓气
实验前
实验中
实验后
鼓入CO2或N2通常是为了排出装置中的空气,防止原料气(或产品)被氧化。
目的是为了将反应中产生的气体,全部转入后续装置并完全吸收。
目的是为了将反应中产生的有害气体(如Cl2,SO2等),全部转入尾气吸收装置完全吸收,防污染.
防爆炸
【思维建模】易水解类保护模型
装置前后都需要用干燥剂干燥
前方干燥剂除去原料气、装置中的水蒸气
后方干燥剂防止空气中的蒸气进入
【思维建模】气体实验中的鼓气
?
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
物质 KMnO4 K2MnO4 K2CO3 KHCO3 CH3COOK
20℃溶解度/g 6.4 11.1 111 33.7 217
探究活动二 组装装置制备KMnO4
任务三:提取KMnO4晶体
蒸发浓缩
冷却结晶
过滤
蒸发结晶
【思维建模】
从溶液中析出晶体的一般方法
至大量晶体出现,余热蒸干
蒸发溶剂至饱和溶液,有晶膜出现
任务三:提取KMnO4晶体
探究活动二 组装装置制备KMnO4
(2021·河北卷)向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为 、 、 洗涤、干燥。
冷却结晶 过滤
链接高考
(2018·浙江下半年选考)(1)硫酸锌的溶解度随温度变化如图所示,硫酸锌溶液结晶操作得到ZnSO4·7H2O的正确顺序是 (操作可重复使用)
a.蒸发至溶液出现晶膜,停止加热;
b.在60℃蒸发溶剂; c.冷却至室温;
d.在100℃蒸发溶剂; e.过滤。
ZnSO4·7H2O
ZnSO4·H2O
d a b a c e
温度℃
(2022山东卷8题)实验室制备KMnO4过程为:
①高温下在熔融强碱性介质中用KClO3氧化MnO2制备;
②水溶后冷却,调溶液至弱碱性,歧化生成KMnO4和MnO2;
③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得KMnO4
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
链接高考
任务三:提取KMnO4晶体
探究活动二 组装装置制备KMnO4
链接高考——装置延伸
减压过滤(抽滤)和普通过滤相比优点是?
原理:当打开自来水龙头时,启动抽气泵,装置中的气体随水流带走,压强降低,加快过滤速度。
加快过滤速度,得到较干燥的沉淀
抽滤瓶
注意事项:
1.布氏漏斗下端的斜口要面向抽滤瓶的支管口。
2.抽滤结束后先拆下橡皮管,再关闭水龙头防止倒吸。
探究活动三 KMnO4的纯度测定
准确称量0.9000g的KMnO4(M=158g/mol)产品,配置成100ml溶液,称取0.2680g Na2C2O4(M=134g/mol),置于锥形瓶中,加入蒸馏水加热至75℃~80℃使其溶解,再加入少量硫酸酸化,用所配置高锰酸钾溶液趁热滴定至终点,消耗高锰酸钾溶液20.00ml,回答下列问题:
1.滴定反应方程式为
2.判断达到滴定终点的现象为
3.样品中高锰酸钾的质量分数为 (保留3位有效数字)。
16H++2MnO4-+5C2O42- ===10CO2↑+2Mn2++8H2O
当滴入最后半滴高锰酸钾溶液时,锥形瓶内颜色由无色变为红色,且半分钟内不褪色
70.2%
n(C2O42- )=0.002mol n(MnO4-)=0.002×—mol
0.002×—×158×5
0.9000
2
5
2
5
×100%=70.2%
【思维建模】
计量数值比——体积——计算要求
(2020山东)KMnO4常作氧化还原滴定的氧化剂,某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成。
Ⅰ.取m g样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol/L的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
实验步骤如下:
链接高考
问题1.试求出样品中所含Fe元素的质量分数。
问题2.试求样品中所含H2C2O4·2H2O的质量分数(简要写出计算过程,已知M(H2C2O4·2H2O)=126g/mol)
由步骤Ⅰ、Ⅱ过程中得失电子守恒得方程:
}
净化装置
发生装置
安全装置
尾气处理装置
干扰因素
安全因素
环保因素
反应装置
物质制备实验中的答题思路
检查气密性
连接仪器
加热反应
收集产品
记录现象
添加药品
明确实验目的
确定实验原理
确定实验操作步骤
确定实验装置
结论
数据处理
课堂总结
谢
谢
聆
听
祝同学们心想事成,考上理想的大学
化
学
实
验
物质制备型实验专题复习
---以高锰酸钾的制备为例
情境导入
探究活动一 明确制备KMnO4的原理
【小组讨论】
1.选择的试剂药品是否合适?
2.选择试剂的依据是什么?
电解
MnO2 K2MnO4 KMnO4
pH
氧化剂
碱性
氧化剂
KOH
NaOH
空气(O2)
KClO3
HCl
CH3COOH
CO2
Cl2
锰及其化合物价类二维图
3MnO42—+2CO2=2MnO4—+MnO2+2CO32—
Cl2 +2MnO42—=2 MnO4—+2KCl
信息型方程式书写步骤
【思维建模】
列物质 看环境 配守恒
(得失电子守恒)
(电荷守恒)
(原子个数守恒)
探究活动一 明确制备KMnO4的原理
探究活动二 组装装置制备KMnO4
铁坩埚
加入固体药品的操作是?
任务一:请选择固体药品碱融氧化制备K2MnO4的仪器。
(2021全国乙卷)接近100摄氏度时,采用油浴;通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):
Ⅰ.将浓硫酸、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
Ⅱ.转至油浴中,35 ℃搅拌1小时。缓慢滴加一定量的蒸馏水。升温至98 ℃并保持1小时。
(2)步骤Ⅰ中,需分批缓慢加入KMnO4粉末并使用冰水浴,原因是 。
反应放热,防止反应过快
强氧化剂
(2022全国乙卷)实验室制备(K2[Cu(C2O4)2])为防止H2C2O4与K2CO3的反应过于剧烈而引起喷溅,加入 K2CO3应采取 的方法。
分批加入
链接高考
【小组活动】
1.组装通入 CO2 制备装置图,标明所选试剂,写出产生气体的化学反应方程式。
2.组装通入 Cl2制备装置图,标明所选试剂,写出产生气体的化学反应方程式。
3.设计装置的思路
任务二:请同学们选择仪器组装制备KMnO4的装置图。
① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
A B C
探究活动二 组装装置制备KMnO4
HCl
CaCO3
饱和NaHCO3溶液
确定实验装置
净化装置
发生装置
安全装置
反应装置
尾气处理装置
干扰因素
安全因素
环保因素
检查气密性
连接仪器
加热反应
收集产品
记录现象
添加药品
防护气体
(2020山东)某同学利用Cl2氧化K2MnO4制备KMnO4的装置如右图所示。
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: 3Mn+2H2O == 2Mn+MnO2↓+4OH-
链接高考
装置A中a的作用是 ;
装置C中的试剂为 ;
装置存在一处缺陷会导致KMnO4产率降低,
改进的方法是 。
在装置A、B之间加装盛有饱和食盐水的洗气瓶
平衡压强使液体顺利滴下
NaOH溶液
【思维建模】装置缺陷解决思路
1.未除杂
2.未干燥
3.未吸收尾气
4.未防氧化
5.未防爆炸
6.未防倒吸
在XX装置之间,添加一个装有XX的XX(干燥管,洗气瓶等)
常见装置缺陷
解决思路
(2021山东卷)六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,装置如图所示(夹持装置略)。回答下列问题:
(1)检查装置气密性并加入WO3。先通N2,其目的是 ;一段时间后,加热管式炉,改通H2,对B处逸出的H2进行后续处理。仪器A的名称为 ,证明WO3已被完全还原的现象是 。
排除装置中的空气
直形冷凝管
不再有水凝结
链接高考
(2021山东卷)六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,装置如图所示(夹持装置略)。回答下列问题:
⑵ WO3完全还原后,进行的操作为:
① 冷却,停止通H2;
② 以干燥的接收装置替换E;
③ 在B处加装盛有碱石灰的干燥管;
④ ……;
⑤ 加热,通Cl2;
⑥ ……。
碱石灰的作用是 ;
操作④是 ,目的是 。
吸收多余氯气,防止污染空气,防止空气中的水蒸气进入E
排除装置中的H2
再次通入N2
链接高考
防爆炸
鼓气
实验前
实验中
实验后
鼓入CO2或N2通常是为了排出装置中的空气,防止原料气(或产品)被氧化。
目的是为了将反应中产生的气体,全部转入后续装置并完全吸收。
目的是为了将反应中产生的有害气体(如Cl2,SO2等),全部转入尾气吸收装置完全吸收,防污染.
防爆炸
【思维建模】易水解类保护模型
装置前后都需要用干燥剂干燥
前方干燥剂除去原料气、装置中的水蒸气
后方干燥剂防止空气中的蒸气进入
【思维建模】气体实验中的鼓气
?
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
物质 KMnO4 K2MnO4 K2CO3 KHCO3 CH3COOK
20℃溶解度/g 6.4 11.1 111 33.7 217
探究活动二 组装装置制备KMnO4
任务三:提取KMnO4晶体
蒸发浓缩
冷却结晶
过滤
蒸发结晶
【思维建模】
从溶液中析出晶体的一般方法
至大量晶体出现,余热蒸干
蒸发溶剂至饱和溶液,有晶膜出现
任务三:提取KMnO4晶体
探究活动二 组装装置制备KMnO4
(2021·河北卷)向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为 、 、 洗涤、干燥。
冷却结晶 过滤
链接高考
(2018·浙江下半年选考)(1)硫酸锌的溶解度随温度变化如图所示,硫酸锌溶液结晶操作得到ZnSO4·7H2O的正确顺序是 (操作可重复使用)
a.蒸发至溶液出现晶膜,停止加热;
b.在60℃蒸发溶剂; c.冷却至室温;
d.在100℃蒸发溶剂; e.过滤。
ZnSO4·7H2O
ZnSO4·H2O
d a b a c e
温度℃
(2022山东卷8题)实验室制备KMnO4过程为:
①高温下在熔融强碱性介质中用KClO3氧化MnO2制备;
②水溶后冷却,调溶液至弱碱性,歧化生成KMnO4和MnO2;
③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得KMnO4
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
链接高考
任务三:提取KMnO4晶体
探究活动二 组装装置制备KMnO4
链接高考——装置延伸
减压过滤(抽滤)和普通过滤相比优点是?
原理:当打开自来水龙头时,启动抽气泵,装置中的气体随水流带走,压强降低,加快过滤速度。
加快过滤速度,得到较干燥的沉淀
抽滤瓶
注意事项:
1.布氏漏斗下端的斜口要面向抽滤瓶的支管口。
2.抽滤结束后先拆下橡皮管,再关闭水龙头防止倒吸。
探究活动三 KMnO4的纯度测定
准确称量0.9000g的KMnO4(M=158g/mol)产品,配置成100ml溶液,称取0.2680g Na2C2O4(M=134g/mol),置于锥形瓶中,加入蒸馏水加热至75℃~80℃使其溶解,再加入少量硫酸酸化,用所配置高锰酸钾溶液趁热滴定至终点,消耗高锰酸钾溶液20.00ml,回答下列问题:
1.滴定反应方程式为
2.判断达到滴定终点的现象为
3.样品中高锰酸钾的质量分数为 (保留3位有效数字)。
16H++2MnO4-+5C2O42- ===10CO2↑+2Mn2++8H2O
当滴入最后半滴高锰酸钾溶液时,锥形瓶内颜色由无色变为红色,且半分钟内不褪色
70.2%
n(C2O42- )=0.002mol n(MnO4-)=0.002×—mol
0.002×—×158×5
0.9000
2
5
2
5
×100%=70.2%
【思维建模】
计量数值比——体积——计算要求
(2020山东)KMnO4常作氧化还原滴定的氧化剂,某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成。
Ⅰ.取m g样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol/L的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
实验步骤如下:
链接高考
问题1.试求出样品中所含Fe元素的质量分数。
问题2.试求样品中所含H2C2O4·2H2O的质量分数(简要写出计算过程,已知M(H2C2O4·2H2O)=126g/mol)
由步骤Ⅰ、Ⅱ过程中得失电子守恒得方程:
}
净化装置
发生装置
安全装置
尾气处理装置
干扰因素
安全因素
环保因素
反应装置
物质制备实验中的答题思路
检查气密性
连接仪器
加热反应
收集产品
记录现象
添加药品
明确实验目的
确定实验原理
确定实验操作步骤
确定实验装置
结论
数据处理
课堂总结
谢
谢
聆
听
祝同学们心想事成,考上理想的大学
同课章节目录
