【备考2023】浙江中考科学考前易错点查漏补缺(五):金属及其冶炼(含解析)
文档属性
| 名称 | 【备考2023】浙江中考科学考前易错点查漏补缺(五):金属及其冶炼(含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 150.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-24 00:00:00 | ||
图片预览



文档简介
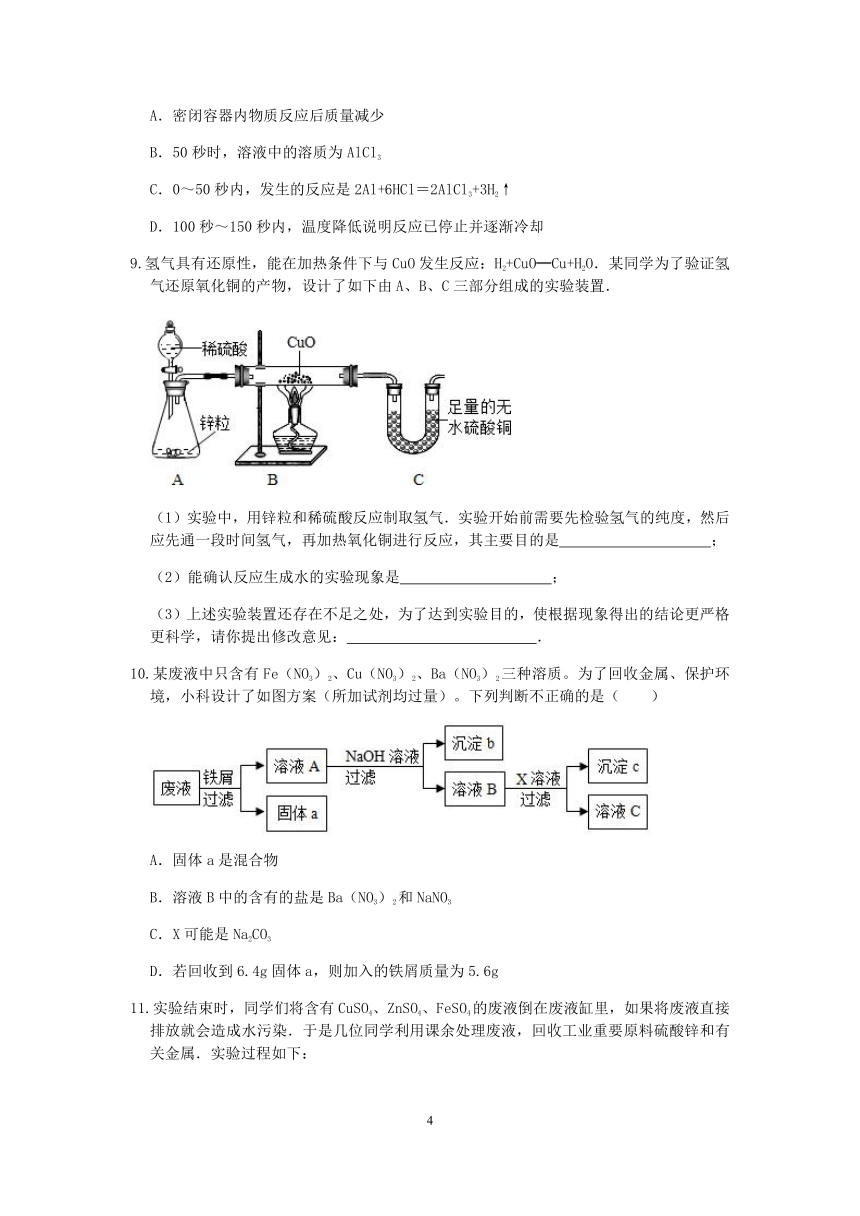
1.兴趣小组按如图流程进行实验(每步均充分反应)。反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象。下列说法不正确的是( )
A.滤渣中一定有Cu,一定没有Fe和Mg
B.滤液中的溶质一定有FeCl2、MgCl2和CuCl2
C.本实验可判断出铁、铜、镁的活动性顺序
D.两支试管混合后,固体总质量一定增加
2.为探究锌、铜、铁三种金属的活动性顺序及其相关性质,某学习小组做了如甲图所示实验。实验结束后,将试管①、试管②内的物质全部倒入同一洁净烧杯中,充分反应后如乙图所示。将烧杯乙中的物质过滤,得到滤渣和滤液。下列有关说法正确的是( )
温馨提示:CuO+H2SO4═CuSO4+H2O
A.滤渣中最多有三种物质
B.若滤液呈无色,滤液中的溶质可能有两种
C.若滤液中含有硫酸铜,滤渣中可能有两种物质
D.滤液的质量可能小于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和
3.下列图像与对应变化关系的描述:
①红磷在密闭容器中燃烧;
②盐酸和氯化铜的混合溶液中逐滴加入氢氧化钡溶液;
③等质量、等质量分数的稀硫酸中分别加入过量锌粉和铁粉;
④一定质量的稀盐酸中,逐滴加入与稀盐酸等质量、等质量分数的氢氧化钠溶液。
其中正确的是( )
A.①② B.①②③ C.①③④ D.①②③④
4.某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉进行处理,并绘制参加反应的锌与溶液中溶质种类的关系图(如图所示),下列说法中不正确的是( )
A.Cu的活动性比Ag强,只用盐酸无法探究两者活动性强弱
B.当溶质种类为1种时,金属单质种类可能为2种
C.c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+
D.从m1变化到m2时,溶液中硝酸铜的质量分数不变
5.某同学用细尼龙线将三根大小相同的铁钉,分别固定在如图所示的三个液面高度相同的装置中,放置几天后观察现象,下列表述中正确的是( )
A.装置Ⅰ、Ⅱ中的铁钉锈蚀了 B.装置Ⅲ中的铁钉几乎没锈蚀
C.装置Ⅰ的铁钉这一侧的液面下降D.装置Ⅱ的铁钉这一侧的液面上升
6.有一包白色固体,可能由 Na2CO3、CuSO4、Ca(NO3)2 和 NaCl中的一种或几种组成,某小组为了确定其组成,进行了以下实验:
①取少量白色固体投入足量水中,充分溶解得到无色溶液;
②取上述溶液,加入足量氯化钡溶液,过滤,得到白色沉淀和滤液;
③在所得滤液中加入硝酸银溶液,又有白色沉淀生成。
以下对白色固体的推断正确的是( )
A.一定含有Na2CO3 B.一定含有NaCl
C.可能含有CuSO4 D.可能含有Ca(NO3)2
7.小宁同学在做完铁与稀硫酸反应实验后,将反应后的混合物M全部倒入盛有一小块铜锌合金的烧杯中,发现有大量气泡产生。待充分反应后过滤,得到滤液和滤渣。对此他有如下的实验现象和结论:①M中不可能含铁单质;②烧杯中溶液由浅绿色变成蓝色;③滤液中一定含有ZnSO4和FeSO4;④滤渣中可能含有三种金属单质;⑤滤液中可能含有两种金属离子。其中正确的是( )
A.①③⑤ B.①④⑤ C.①③④⑤ D.①②③④⑤
8.小科将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用传感器测得容器内温度和压强的变化,如图所示。下列分析中正确的是( )
A.密闭容器内物质反应后质量减少
B.50秒时,溶液中的溶质为AlCl3
C.0~50秒内,发生的反应是2Al+6HCl=2AlCl3+3H2↑
D.100秒~150秒内,温度降低说明反应已停止并逐渐冷却
9.氢气具有还原性,能在加热条件下与CuO发生反应:H2+CuO═Cu+H2O.某同学为了验证氢气还原氧化铜的产物,设计了如下由A、B、C三部分组成的实验装置.
(1)实验中,用锌粒和稀硫酸反应制取氢气.实验开始前需要先检验氢气的纯度,然后应先通一段时间氢气,再加热氧化铜进行反应,其主要目的是 ;
(2)能确认反应生成水的实验现象是 ;
(3)上述实验装置还存在不足之处,为了达到实验目的,使根据现象得出的结论更严格更科学,请你提出修改意见: .
10.某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质。为了回收金属、保护环境,小科设计了如图方案(所加试剂均过量)。下列判断不正确的是( )
A.固体a是混合物
B.溶液B中的含有的盐是Ba(NO3)2和NaNO3
C.X可能是Na2CO3
D.若回收到6.4g固体a,则加入的铁屑质量为5.6g
11.实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是 ;
(2)写出步骤①其中一个反应的化学方程式 ;
(3)要检验步骤④中加入的稀硫酸是否足量的方法是 .
12.实验室里有一包白色固体,可能由氯化钠、碳酸钠、氢氧化钠中的一种或几种组成,为了检测及成分,按如图所示流程进行操作:
(1)上述中“操作Ⅰ”的名称是 。
(2)加少量硝酸钡溶液,产生白色沉淀,可以推出白色粉末中一定有 。
(3)滴加酚酞试剂后,溶液呈红色,能否说明白色粉末中是否一定含有氢氧化钠,并说明理由 。
13.氢气具有还原性,能在加热条件下与CuO发生反应:H2+CuO═Cu+H2O.某同学为了验证氢气还原氧化铜的产物,设计了如下由A、B、C三部分组成的实验装置.
(1)实验中,用锌粒和稀硫酸反应制取氢气.实验开始前需要先检验氢气的纯度,然后应先通一段时间氢气,再加热氧化铜进行反应,其主要目的是 ;
(2)能确认反应生成水的实验现象是 ;
(3)上述实验装置还存在不足之处,为了达到实验目的,使根据现象得出的结论更严格更科学,请你提出修改意见: .
参考答案
1.解:金属的活动性强弱是镁>铁>铜,在进行实验时,铁不能与氯化镁反应,镁能与氯化铜反应生成了氯化镁和铜,反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,说明了铁没有剩余,所以:
A、由上述分析可知,滤渣中一定有Cu,一定没有Fe和Mg,故A正确;
B、由上述分析可知,滤液中的溶质一定有FeCl2、MgCl2,可能含有CuCl2,故B错误;
C、根据铁不能与氯化镁反应,能与氯化铜反应,可以判断出铁、铜、镁的活动性顺序,故C正确;
D、由于每56份质量的铁能置换出64份质量的铜,所以两支试管混合后,固体总质量一定增加,故D正确。
故选:B。
2.解:由题意可知可知,在①中锌能与硫酸亚铁反应生成了铁和硫酸锌,在②稀硫酸能与氧化铜反应生成了硫酸铜和水。将试管①、试管②内的物质全部倒入同一洁净烧杯中,可能发生的反应有:锌与硫酸铜、稀硫酸反应
铁与稀硫酸、硫酸铜反应。
A、若锌是过量的,稀硫酸的量较少,滤渣中最多有锌、铁、铜、氧化铜四种物质,故A错误;
B、由于硫酸亚铁是浅绿色的、硫酸铜是蓝色的,若滤液呈无色,滤液中的溶质只有硫酸锌一种,故B错误;
C、若氧化铜的量较多,锌、硫酸亚铁和稀硫酸的量较少,若滤液中含有硫酸铜,滤渣中可能有铜、氧化铜两种物质,故C正确;
D、由于锌与硫酸亚铁反应溶液的质量增加,稀硫酸通过反应转化为盐的溶液质量一定增加,所以滤液的质量一定大于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和,故D错误。
故选:C。
3.解:①、由质量守恒定律可得,红磷在密闭容器中燃烧,物质的总质量不变,正确;
②、盐酸和氯化铜的混合溶液中逐滴加入氢氧化钡溶液,氢氧化钡和稀盐酸先反应生成氯化钡和水,后和氯化铜反应生成氢氧化铜沉淀和氯化钡,因此开始一段时间没有沉淀,一会儿后才有沉淀,反应结束,沉淀的质量不变,正确;
③、开始时,酸过量,相对原子质量小的生成氢气的质量多,则开始时,相同质量的金属,铁生成的氢气多,铁的曲线应该在锌的上面,反应结束,由于,金属质量过量,酸等量,因此生成氢气质量一样,错误;
④、一定质量的稀盐酸中,逐滴加入与稀盐酸等质量、等质量分数的氢氧化钠溶液,开始时,溶液的pH不为零,且稀盐酸和氢氧化钠反应的方程式为HCl+NaOH=NaCl+H2O,可以得出36.5份质量的氯化氢消耗40份质量的氢氧化钠,则反应后氢氧化钠过量,溶液的pH应该大于7,错误。
故选:A。
4.解:A、Cu的活动性比Ag强,铜、银均不能与稀盐酸反应,只用盐酸无法探究两者活动性强弱,故选项说法正确。
B、当溶质种类为1种时,可能是锌与硝酸铜恰好完全反应,金属单质种类可能为银、铜2种,故选项说法正确。
C、c~d间(不含两点),发生的是锌与硝酸铜的反应,溶液中金属离子为Zn2+、Cu2+,故选项说法正确。
D、从m1变化到m2时,发生的是Zn+2AgNO3═Zn(NO3)2+2Ag,由反应时的质量比可知,每65份质量的锌可置换出216份质量的银,溶液的质量会减少,则溶液中硝酸铜的质量分数增大,故选项说法错误。
故选:D。
5.解:A、装置Ⅰ(与水和氧气同时接触)、Ⅱ(与水和氧气同时接触,同时和盐酸反应)中的铁钉锈蚀了,该选项正确。
B、装置Ⅲ中的铁钉几乎没锈蚀,是因为浓硫酸能够吸收水蒸气,导致铁钉不能和水接触,该选项正确。
C、装置Ⅰ的铁钉这一侧的氧气消耗,液面上升,该选项不正确。
D、装置Ⅱ的铁钉这一侧氧气消耗,盐酸挥发,和铁反应生成氢气,不能判断液面的升降情况,该选项不正确。
故选:AB。
6.解:取一些白色固体投入足量水中,得到无色溶液,硫酸铜在溶液中显蓝色,所以白色固体中一定不含硫酸铜,硝酸钙和碳酸钠会生成碳酸钙沉淀,硝酸钙和碳酸钠不能同时存在,在上述溶液中,加入氯化钡溶液,有白色沉淀产生,所以白色固体中一定含有碳酸钠,一定不含硝酸钙,滤出白色沉淀,在所得滤液中加入硝酸银溶液,则又有白色沉淀生成,氯化钡也会引入氯离子,氯化钠中也含有氯离子,所以不能确定白色固体中是否含有氯化钠;
故选:A。
7.解:①将反应后的混合物M全部倒入盛有一小块铜锌合金的烧杯中,发现有大量气泡产生,是因为锌和稀硫酸反应生成硫酸锌和氢气,说明铁和稀硫酸反应后硫酸过量,铁完全反应M中不可能含铁单质,该选项正确。
②如果锌和稀硫酸恰好完全反应,则烧杯中溶液仍然是浅绿色,该选项不正确。
③滤液中一定含有ZnSO4,不一定含有FeSO4,例如锌和稀硫酸完全反应后过量,过量的锌能使硫酸亚铁完全反应,则滤液中不含有硫酸亚铁,该选项不正确。
④滤渣中可能含有三种金属单质,例如锌和稀硫酸、硫酸亚铁反应后仍然过量,则滤渣中含有铜、铁、锌,该选项正确。
⑤滤液中可能含有两种金属离子,例如锌和硫酸亚铁反应后不足,则滤液中含有亚铁离子和锌离子,该选项正确。
故选:B。
8.解:A、密闭容器内物质反应后质量不变,该选项不正确。
B、50秒时,溶液中的溶质为氧化铝和稀盐酸反应生成的AlCl3、过量的盐酸中的HCl,该选项不正确。
C、0~50秒内,发生的反应是Al2O3+6HCl═2AlCl3+3H2O,该选项不正确。
D、100秒~150秒内,温度降低说明反应已停止并逐渐冷却,该选项正确。
故选:D。
9.解:(1)氢气具有可燃性,点燃或加热氢气与空气的混合物容易发生爆炸,所以先通一段时间氢气,是赶尽装置中的空气,防止爆炸.故填:排净试管中的空气,防止加热时发生爆炸;
(2)白色的无水硫酸铜遇到水会变蓝色,故填:无水硫酸铜变蓝;
(3)制取的氢气中会混有水蒸气,为了防止对实验结果的干扰,应在AB之间防止一个干燥装置,故填:在AB之间放一个干燥装置.
10.解:由于铁的金属活动性大于铜,由题意可知,向废液中加入过量的铁屑,铁能与硝酸铜反应生成了铜和硝酸亚铁,过滤时得到的固体a中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸亚铁能与氢氧化钠反应生成了氢氧化亚铁沉淀和硝酸钠,氢氧化亚铁在空气中已被氧化为氢氧化铁;为了除去钡离子,应加入硫酸钠、碳酸钠等。所以:
A、由上述分析可知,固体a是铜、铁,故A说法正确;
B、由上述分析可知,溶液B中含有的盐有Ba(NO3)2、NaNO3,故B说法正确;
C、由上述分析可知,X可能是Na2SO4、Na2CO3,故C说法正确;
D、由反应方程式可知铁置换出铜后的固体质量还要增加;则依据D选项可知:两固体的质量差为6.4g﹣5.6g=0.8g
设反应的铁的质量是x
则有Fe+CuSO4=FeSO4+Cu
56 64△=8
x 0.8g
解得:x=5.6g 由题意知铁是过量的,所以5.6g不可能都反应,与题意矛盾,故D说法错误。
故选:D。
11.解:(1)利用金属活动性顺序,回收工业重要原料硫酸锌和有关金属,所以滤液A和滤液B含有相同的溶质,其名称是硫酸锌;
(2)锌和硫酸铜反应生成硫酸锌和铜,化学方程式为Zn+CuSO4=ZnSO4+Cu;
(3)检验加入的稀硫酸是否足量:取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量(或若无气泡产生,则酸已足量),即由题意可推知铁与稀硫酸反应.
故答案为:(1)硫酸锌;
(2)Zn+CuSO=Cu+ZnSO4或Zn+FeSO4=Fe+ZnSO4;
(3)取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量(或若无气泡产生则酸已足量).
12.解:(1)操作Ⅰ实现了固液分离,常用的方法为过滤;
故答案为:过滤。
(2)硝酸钡可与碳酸钠反应生成碳酸钡沉淀,所以此时白色粉末一定含有碳酸钠;
故答案为:碳酸钠。
(3)由于加入硝酸钡量不足,碳酸钠若有剩余,则溶液含有碳酸钠,此时加入酚酞试剂,溶液也会变红,无法判断是否含有氢氧化钠;
故答案为:不能,加入硝酸钡少量,若碳酸钠有残留,此时溶液也会显碱性,加入酚酞试剂后,溶液也变红。
13.解:(1)氢气具有可燃性,点燃或加热氢气与空气的混合物容易发生爆炸,所以先通一段时间氢气,是赶尽装置中的空气,防止爆炸.故填:排净试管中的空气,防止加热时发生爆炸;
(2)白色的无水硫酸铜遇到水会变蓝色,故填:无水硫酸铜变蓝;
(3)制取的氢气中会混有水蒸气,为了防止对实验结果的干扰,应在AB之间防止一个干燥装置,故填:在AB之间放一个干燥装置.
金属及其冶炼
A.滤渣中一定有Cu,一定没有Fe和Mg
B.滤液中的溶质一定有FeCl2、MgCl2和CuCl2
C.本实验可判断出铁、铜、镁的活动性顺序
D.两支试管混合后,固体总质量一定增加
2.为探究锌、铜、铁三种金属的活动性顺序及其相关性质,某学习小组做了如甲图所示实验。实验结束后,将试管①、试管②内的物质全部倒入同一洁净烧杯中,充分反应后如乙图所示。将烧杯乙中的物质过滤,得到滤渣和滤液。下列有关说法正确的是( )
温馨提示:CuO+H2SO4═CuSO4+H2O
A.滤渣中最多有三种物质
B.若滤液呈无色,滤液中的溶质可能有两种
C.若滤液中含有硫酸铜,滤渣中可能有两种物质
D.滤液的质量可能小于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和
3.下列图像与对应变化关系的描述:
①红磷在密闭容器中燃烧;
②盐酸和氯化铜的混合溶液中逐滴加入氢氧化钡溶液;
③等质量、等质量分数的稀硫酸中分别加入过量锌粉和铁粉;
④一定质量的稀盐酸中,逐滴加入与稀盐酸等质量、等质量分数的氢氧化钠溶液。
其中正确的是( )
A.①② B.①②③ C.①③④ D.①②③④
4.某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉进行处理,并绘制参加反应的锌与溶液中溶质种类的关系图(如图所示),下列说法中不正确的是( )
A.Cu的活动性比Ag强,只用盐酸无法探究两者活动性强弱
B.当溶质种类为1种时,金属单质种类可能为2种
C.c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+
D.从m1变化到m2时,溶液中硝酸铜的质量分数不变
5.某同学用细尼龙线将三根大小相同的铁钉,分别固定在如图所示的三个液面高度相同的装置中,放置几天后观察现象,下列表述中正确的是( )
A.装置Ⅰ、Ⅱ中的铁钉锈蚀了 B.装置Ⅲ中的铁钉几乎没锈蚀
C.装置Ⅰ的铁钉这一侧的液面下降D.装置Ⅱ的铁钉这一侧的液面上升
6.有一包白色固体,可能由 Na2CO3、CuSO4、Ca(NO3)2 和 NaCl中的一种或几种组成,某小组为了确定其组成,进行了以下实验:
①取少量白色固体投入足量水中,充分溶解得到无色溶液;
②取上述溶液,加入足量氯化钡溶液,过滤,得到白色沉淀和滤液;
③在所得滤液中加入硝酸银溶液,又有白色沉淀生成。
以下对白色固体的推断正确的是( )
A.一定含有Na2CO3 B.一定含有NaCl
C.可能含有CuSO4 D.可能含有Ca(NO3)2
7.小宁同学在做完铁与稀硫酸反应实验后,将反应后的混合物M全部倒入盛有一小块铜锌合金的烧杯中,发现有大量气泡产生。待充分反应后过滤,得到滤液和滤渣。对此他有如下的实验现象和结论:①M中不可能含铁单质;②烧杯中溶液由浅绿色变成蓝色;③滤液中一定含有ZnSO4和FeSO4;④滤渣中可能含有三种金属单质;⑤滤液中可能含有两种金属离子。其中正确的是( )
A.①③⑤ B.①④⑤ C.①③④⑤ D.①②③④⑤
8.小科将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用传感器测得容器内温度和压强的变化,如图所示。下列分析中正确的是( )
A.密闭容器内物质反应后质量减少
B.50秒时,溶液中的溶质为AlCl3
C.0~50秒内,发生的反应是2Al+6HCl=2AlCl3+3H2↑
D.100秒~150秒内,温度降低说明反应已停止并逐渐冷却
9.氢气具有还原性,能在加热条件下与CuO发生反应:H2+CuO═Cu+H2O.某同学为了验证氢气还原氧化铜的产物,设计了如下由A、B、C三部分组成的实验装置.
(1)实验中,用锌粒和稀硫酸反应制取氢气.实验开始前需要先检验氢气的纯度,然后应先通一段时间氢气,再加热氧化铜进行反应,其主要目的是 ;
(2)能确认反应生成水的实验现象是 ;
(3)上述实验装置还存在不足之处,为了达到实验目的,使根据现象得出的结论更严格更科学,请你提出修改意见: .
10.某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质。为了回收金属、保护环境,小科设计了如图方案(所加试剂均过量)。下列判断不正确的是( )
A.固体a是混合物
B.溶液B中的含有的盐是Ba(NO3)2和NaNO3
C.X可能是Na2CO3
D.若回收到6.4g固体a,则加入的铁屑质量为5.6g
11.实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是 ;
(2)写出步骤①其中一个反应的化学方程式 ;
(3)要检验步骤④中加入的稀硫酸是否足量的方法是 .
12.实验室里有一包白色固体,可能由氯化钠、碳酸钠、氢氧化钠中的一种或几种组成,为了检测及成分,按如图所示流程进行操作:
(1)上述中“操作Ⅰ”的名称是 。
(2)加少量硝酸钡溶液,产生白色沉淀,可以推出白色粉末中一定有 。
(3)滴加酚酞试剂后,溶液呈红色,能否说明白色粉末中是否一定含有氢氧化钠,并说明理由 。
13.氢气具有还原性,能在加热条件下与CuO发生反应:H2+CuO═Cu+H2O.某同学为了验证氢气还原氧化铜的产物,设计了如下由A、B、C三部分组成的实验装置.
(1)实验中,用锌粒和稀硫酸反应制取氢气.实验开始前需要先检验氢气的纯度,然后应先通一段时间氢气,再加热氧化铜进行反应,其主要目的是 ;
(2)能确认反应生成水的实验现象是 ;
(3)上述实验装置还存在不足之处,为了达到实验目的,使根据现象得出的结论更严格更科学,请你提出修改意见: .
参考答案
1.解:金属的活动性强弱是镁>铁>铜,在进行实验时,铁不能与氯化镁反应,镁能与氯化铜反应生成了氯化镁和铜,反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,说明了铁没有剩余,所以:
A、由上述分析可知,滤渣中一定有Cu,一定没有Fe和Mg,故A正确;
B、由上述分析可知,滤液中的溶质一定有FeCl2、MgCl2,可能含有CuCl2,故B错误;
C、根据铁不能与氯化镁反应,能与氯化铜反应,可以判断出铁、铜、镁的活动性顺序,故C正确;
D、由于每56份质量的铁能置换出64份质量的铜,所以两支试管混合后,固体总质量一定增加,故D正确。
故选:B。
2.解:由题意可知可知,在①中锌能与硫酸亚铁反应生成了铁和硫酸锌,在②稀硫酸能与氧化铜反应生成了硫酸铜和水。将试管①、试管②内的物质全部倒入同一洁净烧杯中,可能发生的反应有:锌与硫酸铜、稀硫酸反应
铁与稀硫酸、硫酸铜反应。
A、若锌是过量的,稀硫酸的量较少,滤渣中最多有锌、铁、铜、氧化铜四种物质,故A错误;
B、由于硫酸亚铁是浅绿色的、硫酸铜是蓝色的,若滤液呈无色,滤液中的溶质只有硫酸锌一种,故B错误;
C、若氧化铜的量较多,锌、硫酸亚铁和稀硫酸的量较少,若滤液中含有硫酸铜,滤渣中可能有铜、氧化铜两种物质,故C正确;
D、由于锌与硫酸亚铁反应溶液的质量增加,稀硫酸通过反应转化为盐的溶液质量一定增加,所以滤液的质量一定大于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和,故D错误。
故选:C。
3.解:①、由质量守恒定律可得,红磷在密闭容器中燃烧,物质的总质量不变,正确;
②、盐酸和氯化铜的混合溶液中逐滴加入氢氧化钡溶液,氢氧化钡和稀盐酸先反应生成氯化钡和水,后和氯化铜反应生成氢氧化铜沉淀和氯化钡,因此开始一段时间没有沉淀,一会儿后才有沉淀,反应结束,沉淀的质量不变,正确;
③、开始时,酸过量,相对原子质量小的生成氢气的质量多,则开始时,相同质量的金属,铁生成的氢气多,铁的曲线应该在锌的上面,反应结束,由于,金属质量过量,酸等量,因此生成氢气质量一样,错误;
④、一定质量的稀盐酸中,逐滴加入与稀盐酸等质量、等质量分数的氢氧化钠溶液,开始时,溶液的pH不为零,且稀盐酸和氢氧化钠反应的方程式为HCl+NaOH=NaCl+H2O,可以得出36.5份质量的氯化氢消耗40份质量的氢氧化钠,则反应后氢氧化钠过量,溶液的pH应该大于7,错误。
故选:A。
4.解:A、Cu的活动性比Ag强,铜、银均不能与稀盐酸反应,只用盐酸无法探究两者活动性强弱,故选项说法正确。
B、当溶质种类为1种时,可能是锌与硝酸铜恰好完全反应,金属单质种类可能为银、铜2种,故选项说法正确。
C、c~d间(不含两点),发生的是锌与硝酸铜的反应,溶液中金属离子为Zn2+、Cu2+,故选项说法正确。
D、从m1变化到m2时,发生的是Zn+2AgNO3═Zn(NO3)2+2Ag,由反应时的质量比可知,每65份质量的锌可置换出216份质量的银,溶液的质量会减少,则溶液中硝酸铜的质量分数增大,故选项说法错误。
故选:D。
5.解:A、装置Ⅰ(与水和氧气同时接触)、Ⅱ(与水和氧气同时接触,同时和盐酸反应)中的铁钉锈蚀了,该选项正确。
B、装置Ⅲ中的铁钉几乎没锈蚀,是因为浓硫酸能够吸收水蒸气,导致铁钉不能和水接触,该选项正确。
C、装置Ⅰ的铁钉这一侧的氧气消耗,液面上升,该选项不正确。
D、装置Ⅱ的铁钉这一侧氧气消耗,盐酸挥发,和铁反应生成氢气,不能判断液面的升降情况,该选项不正确。
故选:AB。
6.解:取一些白色固体投入足量水中,得到无色溶液,硫酸铜在溶液中显蓝色,所以白色固体中一定不含硫酸铜,硝酸钙和碳酸钠会生成碳酸钙沉淀,硝酸钙和碳酸钠不能同时存在,在上述溶液中,加入氯化钡溶液,有白色沉淀产生,所以白色固体中一定含有碳酸钠,一定不含硝酸钙,滤出白色沉淀,在所得滤液中加入硝酸银溶液,则又有白色沉淀生成,氯化钡也会引入氯离子,氯化钠中也含有氯离子,所以不能确定白色固体中是否含有氯化钠;
故选:A。
7.解:①将反应后的混合物M全部倒入盛有一小块铜锌合金的烧杯中,发现有大量气泡产生,是因为锌和稀硫酸反应生成硫酸锌和氢气,说明铁和稀硫酸反应后硫酸过量,铁完全反应M中不可能含铁单质,该选项正确。
②如果锌和稀硫酸恰好完全反应,则烧杯中溶液仍然是浅绿色,该选项不正确。
③滤液中一定含有ZnSO4,不一定含有FeSO4,例如锌和稀硫酸完全反应后过量,过量的锌能使硫酸亚铁完全反应,则滤液中不含有硫酸亚铁,该选项不正确。
④滤渣中可能含有三种金属单质,例如锌和稀硫酸、硫酸亚铁反应后仍然过量,则滤渣中含有铜、铁、锌,该选项正确。
⑤滤液中可能含有两种金属离子,例如锌和硫酸亚铁反应后不足,则滤液中含有亚铁离子和锌离子,该选项正确。
故选:B。
8.解:A、密闭容器内物质反应后质量不变,该选项不正确。
B、50秒时,溶液中的溶质为氧化铝和稀盐酸反应生成的AlCl3、过量的盐酸中的HCl,该选项不正确。
C、0~50秒内,发生的反应是Al2O3+6HCl═2AlCl3+3H2O,该选项不正确。
D、100秒~150秒内,温度降低说明反应已停止并逐渐冷却,该选项正确。
故选:D。
9.解:(1)氢气具有可燃性,点燃或加热氢气与空气的混合物容易发生爆炸,所以先通一段时间氢气,是赶尽装置中的空气,防止爆炸.故填:排净试管中的空气,防止加热时发生爆炸;
(2)白色的无水硫酸铜遇到水会变蓝色,故填:无水硫酸铜变蓝;
(3)制取的氢气中会混有水蒸气,为了防止对实验结果的干扰,应在AB之间防止一个干燥装置,故填:在AB之间放一个干燥装置.
10.解:由于铁的金属活动性大于铜,由题意可知,向废液中加入过量的铁屑,铁能与硝酸铜反应生成了铜和硝酸亚铁,过滤时得到的固体a中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸亚铁能与氢氧化钠反应生成了氢氧化亚铁沉淀和硝酸钠,氢氧化亚铁在空气中已被氧化为氢氧化铁;为了除去钡离子,应加入硫酸钠、碳酸钠等。所以:
A、由上述分析可知,固体a是铜、铁,故A说法正确;
B、由上述分析可知,溶液B中含有的盐有Ba(NO3)2、NaNO3,故B说法正确;
C、由上述分析可知,X可能是Na2SO4、Na2CO3,故C说法正确;
D、由反应方程式可知铁置换出铜后的固体质量还要增加;则依据D选项可知:两固体的质量差为6.4g﹣5.6g=0.8g
设反应的铁的质量是x
则有Fe+CuSO4=FeSO4+Cu
56 64△=8
x 0.8g
解得:x=5.6g 由题意知铁是过量的,所以5.6g不可能都反应,与题意矛盾,故D说法错误。
故选:D。
11.解:(1)利用金属活动性顺序,回收工业重要原料硫酸锌和有关金属,所以滤液A和滤液B含有相同的溶质,其名称是硫酸锌;
(2)锌和硫酸铜反应生成硫酸锌和铜,化学方程式为Zn+CuSO4=ZnSO4+Cu;
(3)检验加入的稀硫酸是否足量:取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量(或若无气泡产生,则酸已足量),即由题意可推知铁与稀硫酸反应.
故答案为:(1)硫酸锌;
(2)Zn+CuSO=Cu+ZnSO4或Zn+FeSO4=Fe+ZnSO4;
(3)取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量(或若无气泡产生则酸已足量).
12.解:(1)操作Ⅰ实现了固液分离,常用的方法为过滤;
故答案为:过滤。
(2)硝酸钡可与碳酸钠反应生成碳酸钡沉淀,所以此时白色粉末一定含有碳酸钠;
故答案为:碳酸钠。
(3)由于加入硝酸钡量不足,碳酸钠若有剩余,则溶液含有碳酸钠,此时加入酚酞试剂,溶液也会变红,无法判断是否含有氢氧化钠;
故答案为:不能,加入硝酸钡少量,若碳酸钠有残留,此时溶液也会显碱性,加入酚酞试剂后,溶液也变红。
13.解:(1)氢气具有可燃性,点燃或加热氢气与空气的混合物容易发生爆炸,所以先通一段时间氢气,是赶尽装置中的空气,防止爆炸.故填:排净试管中的空气,防止加热时发生爆炸;
(2)白色的无水硫酸铜遇到水会变蓝色,故填:无水硫酸铜变蓝;
(3)制取的氢气中会混有水蒸气,为了防止对实验结果的干扰,应在AB之间防止一个干燥装置,故填:在AB之间放一个干燥装置.
金属及其冶炼
同课章节目录
