7.4.1糖类 课件(共25张PPT)2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 7.4.1糖类 课件(共25张PPT)2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-24 17:24:28 | ||
图片预览







文档简介
(共25张PPT)
第一课时
糖类
第四节
有机营养物质
第七章 有机化合物
1.糖类的结构与分类
分子组成大多数都符合:Cm(H2O)n
糖类被称为碳水化合物
(1)糖类的组成
总结感悟
可糖类中的氢原子和氧原子的个数比并不都是2:1,也并不以水分子的形式存在
如鼠李糖 C6H12O5
而有些符合Cn(H2O)m通式的物质也不是碳水化合物
如甲醛 CH2O , 乙酸 C2H4O2 等
(3)糖类的分类——以水解状况来分
①单糖
不能再水解为更小分子的多羟基醛和多羟基酮。如葡萄糖、果糖等。
②低聚糖
能水解为二、三个或几个单糖的碳水化合物。
如蔗糖、麦芽糖、纤维二糖、乳糖等水解生成二个单糖,又称二糖。
③多糖
水解后能生成若干分子单糖的碳水化合物。如:淀粉、纤维素。
总结感悟
(2)糖类的结构
糖类是多羟基醛或多羟基酮及水解后能生成多羟基醛或多羟基酮的一类化合物
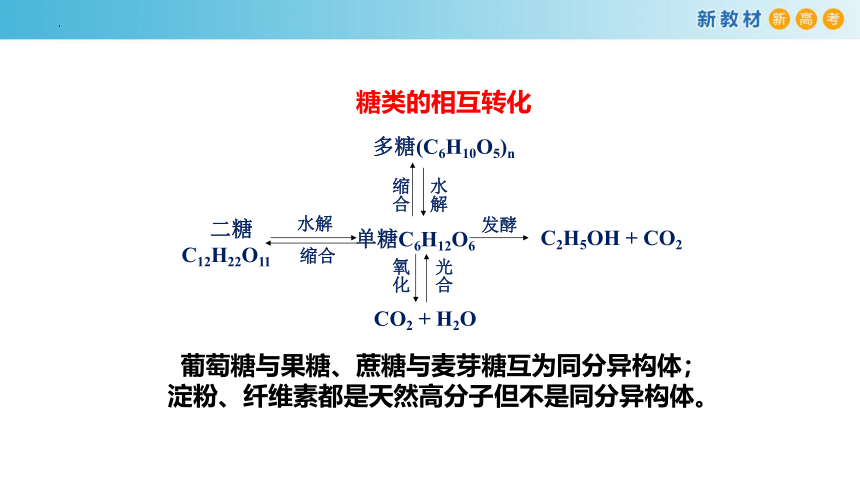
糖类的相互转化
多糖(C6H10O5)n
单糖C6H12O6
缩合
二糖
C12H22O11
水解
发酵
C2H5OH + CO2
氧化
CO2 + H2O
光合
缩合
水解
葡萄糖与果糖、蔗糖与麦芽糖互为同分异构体;
淀粉、纤维素都是天然高分子但不是同分异构体。
常见的糖类
糖类不一定有甜味,有甜味的不一定属于糖类。
可溶于水,甜味
同分异构体
C6H12O6
葡萄糖
C12H22O11
蔗糖
C12H22O11
麦芽糖
无味,有些淀粉可溶于水
不属于同分异构体,
都是高分子化合物
(C6H10O5)n
淀粉
(C6H10O5)n
纤维素
生活经验
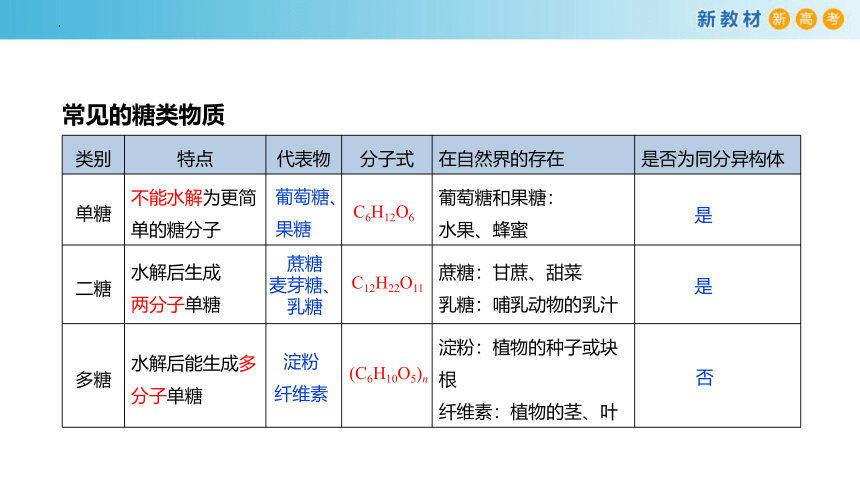
类别 特点 代表物 分子式 在自然界的存在 是否为同分异构体
单糖 不能水解为更简单的糖分子 葡萄糖和果糖: 水果、蜂蜜
二糖 水解后生成 两分子单糖 蔗糖:甘蔗、甜菜 乳糖:哺乳动物的乳汁
多糖 水解后能生成多分子单糖 淀粉:植物的种子或块根 纤维素:植物的茎、叶
常见的糖类物质
葡萄糖、
果糖
C6H12O6
蔗糖
麦芽糖、乳糖
C12H22O11
淀粉
纤维素
(C6H10O5)n
是
是
否
分子式:C6H12O6
结构:
结构简式:
CH2 CH CH CH CH CHO
OH
OH
OH
OH
OH
预测:葡萄糖的化学性质
一、单糖:葡萄糖与果糖
1、葡萄糖:
白色晶体、有甜味、能溶于水
所含官能团:
醛基、醇羟基
CH2OH(CHOH)4CHO+2Cu(OH)2 + NaOH
CH2OH(CHOH)4COONa+Cu2O +3H2O
CH2OH(CHOH)4CHO+2 Ag(NH3)2OH
2Ag +CH2OH(CHOH)4COONH4+3NH3 +H2O
2、化学性质:
银镜反应
①醛基的性质:
与新制Cu(OH)2 悬浊液的反应
与H2加成
②羟基的性质
与氢卤酸取代
分子内脱水
酯化反应
与活泼金属置换
催化氧化反应
③在体内生理反应
④分解生成乙醇(酿酒)
3、葡萄糖用途:
制药、制镜、制糖果
C6H12O6
2C2H5OH+2CO2↑
酒曲酶
C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)
葡萄糖的检验方法
官能团决定化学性质
醛基的性质
醇羟基的性质
—OH
银镜反应
与新制Cu(OH)2悬浊液的反应
与H2的加成反应
与Na反应
氧化反应
酯化反应
2、果糖
(1) 物性:
(2) 分子式:
(3) 结构简式:
无色晶体、易溶于水、最甜
C6H12O6
CH2—CH—CH—CH—CO—CH2
OH
OH
OH
OH
OH
多羟基酮
(4) 化性:
① 多元醇和酮的性质;
② 体内氧化,程度缓慢;
③ 强还原性:
银镜反应;与新制Cu(OH)2反应
可用溴水区分葡萄糖和果糖。
蔗糖
分子式: C12H22O11
化学性质
(不含有醛基的非还原性糖)
——水解反应
C6H12O6 + C6H12O6
(葡萄糖) (果糖)
稀硫酸
C12H22O11 + H2O
(蔗糖)
白色晶体,易溶于水,有甜味.
二、双糖:蔗糖 麦芽糖
麦芽糖
易溶于水,有甜味。
分子式: C12H22O11(与蔗糖互为同分异构体)
化学性质:
①还原性糖: 能发生银镜反应(分子中含有醛基)
C12H22O11 + H2O 2 C6H12O6
(麦芽糖) (葡萄糖)
酸或酶
②水解反应: 产物为葡萄糖一种.
蔗糖与麦芽糖的比较:
蔗糖 C12H22O11 同分异构 非还原性糖 (无-CHO) 水解成一分子葡萄糖,一分子果糖 二糖
麦芽糖 还原性糖 (有-CHO) 水解成二分子葡萄糖 二糖
2、遇碘变蓝色
3、水解最终生成葡萄糖
(C6H10O5)n + nH2O n C6H12O6
淀粉 葡萄糖
酶或酸
化学性质
分子式(C6H10O5)n 属于天然高分子化合物
无甜味,不溶于冷水,在热水中部分溶解,成糊状
淀 粉
物理性质:
1、无还原性
应用:酿酒
三、多糖:淀粉 纤维素
(2)淀粉的水解
实验现象:最终有砖红色沉淀生成
实验结论:淀粉水解生成的葡萄糖,
与新制的Cu(OH)2共热生成氧化亚铜(Cu2O)
(C6H10O5)n + nH2O
淀粉
nC6H12O6
葡萄糖
催化剂
【交流与思考】如何判断淀粉是完全水解、部分水解还是尚未水解?
需要用到哪些试剂 如何操作
用到的试剂:
碘水和新制的氢氧化铜
完全水解:
部分水解:
尚未水解:
没有淀粉,只有葡萄糖
有淀粉,有葡萄糖
只有淀粉,没有葡萄糖
NaOH
溶液
稀H2SO4
△
淀粉
水解液
碘水
现象A
中和液
银氨溶液
△
现象B
现象A 现象B 结论
①
②
③
变蓝
无银镜
尚未水解
变蓝
有银镜
部分水解
不变蓝
有银镜
完全水解
(4)纤维素的水解
纤维素在稀酸的催化下,发生水解反应,最终生成葡萄糖。
纤维素在人体内不水解,其作用是刺激肠道蠕动,有助于消化和排泄。
5. 糖类的应用
(1)淀粉为人体提供能量。
(2)人体内无纤维素酶,但纤维素能刺激肠道蠕动,促进消化和排泄。
(3)以富含淀粉的农作物为原料酿酒,以富含纤维素的植物秸秆为原料生产燃料乙醇。
纤维素的酯化反应
(C6H7O2)
O—NO2
O—NO2
O—NO2
n
(C6H7O2)
OH
OH
OH
n
3n HNO3
浓硫酸
3nH2O
+
+
纤维素硝酸酯
(硝酸纤维)
纤维素硝酸酯
(硝化纤维)
一种烈性炸药
糖类的结构和分类
糖类的性质
醛糖银镜反应
斐林反应
低聚糖、多糖
水解
本课小结
糖类的应用
糖类的应用
葡萄糖:用于制镜业、糖果制造业、医药工业。
果糖:最甜的糖,可用于食品工业。
麦芽糖:医药工业。
蔗糖:常用调味剂。
淀粉:食品工业原料,人体重要的能量来源。
纤维素:促进肠胃蠕动。造纸、纺织工业的原料,纤维素酯化产物是重要的化工原料。
总结感悟
当堂巩固
1、下列有关葡萄糖的叙述中,错误的是( )
A.能加氢生成六元醇 B.能发生银镜反应
C.能与醇发生酯化反应 D.能被氧化为CO2和H2O
C
第一课时
糖类
第四节
有机营养物质
第七章 有机化合物
1.糖类的结构与分类
分子组成大多数都符合:Cm(H2O)n
糖类被称为碳水化合物
(1)糖类的组成
总结感悟
可糖类中的氢原子和氧原子的个数比并不都是2:1,也并不以水分子的形式存在
如鼠李糖 C6H12O5
而有些符合Cn(H2O)m通式的物质也不是碳水化合物
如甲醛 CH2O , 乙酸 C2H4O2 等
(3)糖类的分类——以水解状况来分
①单糖
不能再水解为更小分子的多羟基醛和多羟基酮。如葡萄糖、果糖等。
②低聚糖
能水解为二、三个或几个单糖的碳水化合物。
如蔗糖、麦芽糖、纤维二糖、乳糖等水解生成二个单糖,又称二糖。
③多糖
水解后能生成若干分子单糖的碳水化合物。如:淀粉、纤维素。
总结感悟
(2)糖类的结构
糖类是多羟基醛或多羟基酮及水解后能生成多羟基醛或多羟基酮的一类化合物
糖类的相互转化
多糖(C6H10O5)n
单糖C6H12O6
缩合
二糖
C12H22O11
水解
发酵
C2H5OH + CO2
氧化
CO2 + H2O
光合
缩合
水解
葡萄糖与果糖、蔗糖与麦芽糖互为同分异构体;
淀粉、纤维素都是天然高分子但不是同分异构体。
常见的糖类
糖类不一定有甜味,有甜味的不一定属于糖类。
可溶于水,甜味
同分异构体
C6H12O6
葡萄糖
C12H22O11
蔗糖
C12H22O11
麦芽糖
无味,有些淀粉可溶于水
不属于同分异构体,
都是高分子化合物
(C6H10O5)n
淀粉
(C6H10O5)n
纤维素
生活经验
类别 特点 代表物 分子式 在自然界的存在 是否为同分异构体
单糖 不能水解为更简单的糖分子 葡萄糖和果糖: 水果、蜂蜜
二糖 水解后生成 两分子单糖 蔗糖:甘蔗、甜菜 乳糖:哺乳动物的乳汁
多糖 水解后能生成多分子单糖 淀粉:植物的种子或块根 纤维素:植物的茎、叶
常见的糖类物质
葡萄糖、
果糖
C6H12O6
蔗糖
麦芽糖、乳糖
C12H22O11
淀粉
纤维素
(C6H10O5)n
是
是
否
分子式:C6H12O6
结构:
结构简式:
CH2 CH CH CH CH CHO
OH
OH
OH
OH
OH
预测:葡萄糖的化学性质
一、单糖:葡萄糖与果糖
1、葡萄糖:
白色晶体、有甜味、能溶于水
所含官能团:
醛基、醇羟基
CH2OH(CHOH)4CHO+2Cu(OH)2 + NaOH
CH2OH(CHOH)4COONa+Cu2O +3H2O
CH2OH(CHOH)4CHO+2 Ag(NH3)2OH
2Ag +CH2OH(CHOH)4COONH4+3NH3 +H2O
2、化学性质:
银镜反应
①醛基的性质:
与新制Cu(OH)2 悬浊液的反应
与H2加成
②羟基的性质
与氢卤酸取代
分子内脱水
酯化反应
与活泼金属置换
催化氧化反应
③在体内生理反应
④分解生成乙醇(酿酒)
3、葡萄糖用途:
制药、制镜、制糖果
C6H12O6
2C2H5OH+2CO2↑
酒曲酶
C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)
葡萄糖的检验方法
官能团决定化学性质
醛基的性质
醇羟基的性质
—OH
银镜反应
与新制Cu(OH)2悬浊液的反应
与H2的加成反应
与Na反应
氧化反应
酯化反应
2、果糖
(1) 物性:
(2) 分子式:
(3) 结构简式:
无色晶体、易溶于水、最甜
C6H12O6
CH2—CH—CH—CH—CO—CH2
OH
OH
OH
OH
OH
多羟基酮
(4) 化性:
① 多元醇和酮的性质;
② 体内氧化,程度缓慢;
③ 强还原性:
银镜反应;与新制Cu(OH)2反应
可用溴水区分葡萄糖和果糖。
蔗糖
分子式: C12H22O11
化学性质
(不含有醛基的非还原性糖)
——水解反应
C6H12O6 + C6H12O6
(葡萄糖) (果糖)
稀硫酸
C12H22O11 + H2O
(蔗糖)
白色晶体,易溶于水,有甜味.
二、双糖:蔗糖 麦芽糖
麦芽糖
易溶于水,有甜味。
分子式: C12H22O11(与蔗糖互为同分异构体)
化学性质:
①还原性糖: 能发生银镜反应(分子中含有醛基)
C12H22O11 + H2O 2 C6H12O6
(麦芽糖) (葡萄糖)
酸或酶
②水解反应: 产物为葡萄糖一种.
蔗糖与麦芽糖的比较:
蔗糖 C12H22O11 同分异构 非还原性糖 (无-CHO) 水解成一分子葡萄糖,一分子果糖 二糖
麦芽糖 还原性糖 (有-CHO) 水解成二分子葡萄糖 二糖
2、遇碘变蓝色
3、水解最终生成葡萄糖
(C6H10O5)n + nH2O n C6H12O6
淀粉 葡萄糖
酶或酸
化学性质
分子式(C6H10O5)n 属于天然高分子化合物
无甜味,不溶于冷水,在热水中部分溶解,成糊状
淀 粉
物理性质:
1、无还原性
应用:酿酒
三、多糖:淀粉 纤维素
(2)淀粉的水解
实验现象:最终有砖红色沉淀生成
实验结论:淀粉水解生成的葡萄糖,
与新制的Cu(OH)2共热生成氧化亚铜(Cu2O)
(C6H10O5)n + nH2O
淀粉
nC6H12O6
葡萄糖
催化剂
【交流与思考】如何判断淀粉是完全水解、部分水解还是尚未水解?
需要用到哪些试剂 如何操作
用到的试剂:
碘水和新制的氢氧化铜
完全水解:
部分水解:
尚未水解:
没有淀粉,只有葡萄糖
有淀粉,有葡萄糖
只有淀粉,没有葡萄糖
NaOH
溶液
稀H2SO4
△
淀粉
水解液
碘水
现象A
中和液
银氨溶液
△
现象B
现象A 现象B 结论
①
②
③
变蓝
无银镜
尚未水解
变蓝
有银镜
部分水解
不变蓝
有银镜
完全水解
(4)纤维素的水解
纤维素在稀酸的催化下,发生水解反应,最终生成葡萄糖。
纤维素在人体内不水解,其作用是刺激肠道蠕动,有助于消化和排泄。
5. 糖类的应用
(1)淀粉为人体提供能量。
(2)人体内无纤维素酶,但纤维素能刺激肠道蠕动,促进消化和排泄。
(3)以富含淀粉的农作物为原料酿酒,以富含纤维素的植物秸秆为原料生产燃料乙醇。
纤维素的酯化反应
(C6H7O2)
O—NO2
O—NO2
O—NO2
n
(C6H7O2)
OH
OH
OH
n
3n HNO3
浓硫酸
3nH2O
+
+
纤维素硝酸酯
(硝酸纤维)
纤维素硝酸酯
(硝化纤维)
一种烈性炸药
糖类的结构和分类
糖类的性质
醛糖银镜反应
斐林反应
低聚糖、多糖
水解
本课小结
糖类的应用
糖类的应用
葡萄糖:用于制镜业、糖果制造业、医药工业。
果糖:最甜的糖,可用于食品工业。
麦芽糖:医药工业。
蔗糖:常用调味剂。
淀粉:食品工业原料,人体重要的能量来源。
纤维素:促进肠胃蠕动。造纸、纺织工业的原料,纤维素酯化产物是重要的化工原料。
总结感悟
当堂巩固
1、下列有关葡萄糖的叙述中,错误的是( )
A.能加氢生成六元醇 B.能发生银镜反应
C.能与醇发生酯化反应 D.能被氧化为CO2和H2O
C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
