陕西省西安市周至县第六中学2022-2023学年高一下学期5月期中考试化学试题(含答案)
文档属性
| 名称 | 陕西省西安市周至县第六中学2022-2023学年高一下学期5月期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 285.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-25 11:41:21 | ||
图片预览



文档简介
周至县第六中学2022-2023学年高一下学期5月期中考试
化学试题
可能用到的原子量:H 1 Fe 56 C 12 O 16 N 14 S 32 Zn 65
一选择题 (22道共66分每题只有一个正确选项)
1.下列关于SO2和NO2的叙述中正确的是( )
A.SO2可使紫色石蕊溶液褪色
B.SO2与水作用生成H2SO4
C.可用排水法收集NO2
D.实验室可用NaOH溶液处理NO2和SO2废气
2.0 ℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100 ℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:
N2O4(g)??2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2的消耗速率与N2O4的消耗速率之比为2:1
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.②③⑥⑦ B.①④⑧
C.只有①④ D.只有⑦⑧
3.下列说法正确的是( )
A.向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
4.NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)??2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min时,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率的式子中不正确的是( )
A.v(N2)=0.125 mol/(L·min)
B.v(H2O)=0.375 mol/(L·min)
C.v(O2)=0.225 mol/(L·min)
D.v(NH3)=0.250 mol/(L·min)
5.Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2===2CuO+4NO2↑+O2↑,将所得气体充满一干燥烧瓶(标准状况),再将烧瓶倒置于水中,过较长时间后,烧瓶中溶液的物质的量浓度可能为(假设烧瓶中的溶质不扩散到外面)( )
A. mol·L-1 B. mol·L-1
C.0 mol·L-1 D. mol·L-1
6.在含有FeCl3和BaCl2的酸性混合溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是( )
A.白色沉淀是BaSO4和BaSO3
B.溶液的酸性增强
C.白色沉淀是BaSO4
D.FeCl3全部被还原为FeCl2
7.物质的量均为1 mol的气体A2和B2放在1 L的密闭容器中反应生成C,2 min时,测得c(A2)=0.58 mol·L-1,c(B2)=0.16 mol·L-1,c(C)=0.84 mol·L-1,则C的分子式是( )
A.AB2 B.A2B
C.A3B2 D.A2B3
8.铁镍蓄电池又称爱迪生电池,放电时的总反应为
Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池放电时,电子经电解质溶液流入Ni2O3一极
D.电池放电时,Ni2O3在正极上被还原
9.如图是酸雨形成图,下列说法不正确的是( )
A.在酸雨形成过程中没有发生氧化还原反应
B.二氧化硫、二氧化氮是形成酸雨的主要因素
C.煤和石油的燃烧、汽车尾气等是酸雨污染物的主要来源
D.酸雨的危害有破坏农作物,使土壤、湖泊酸化以及加速建筑物、桥梁的腐蚀等
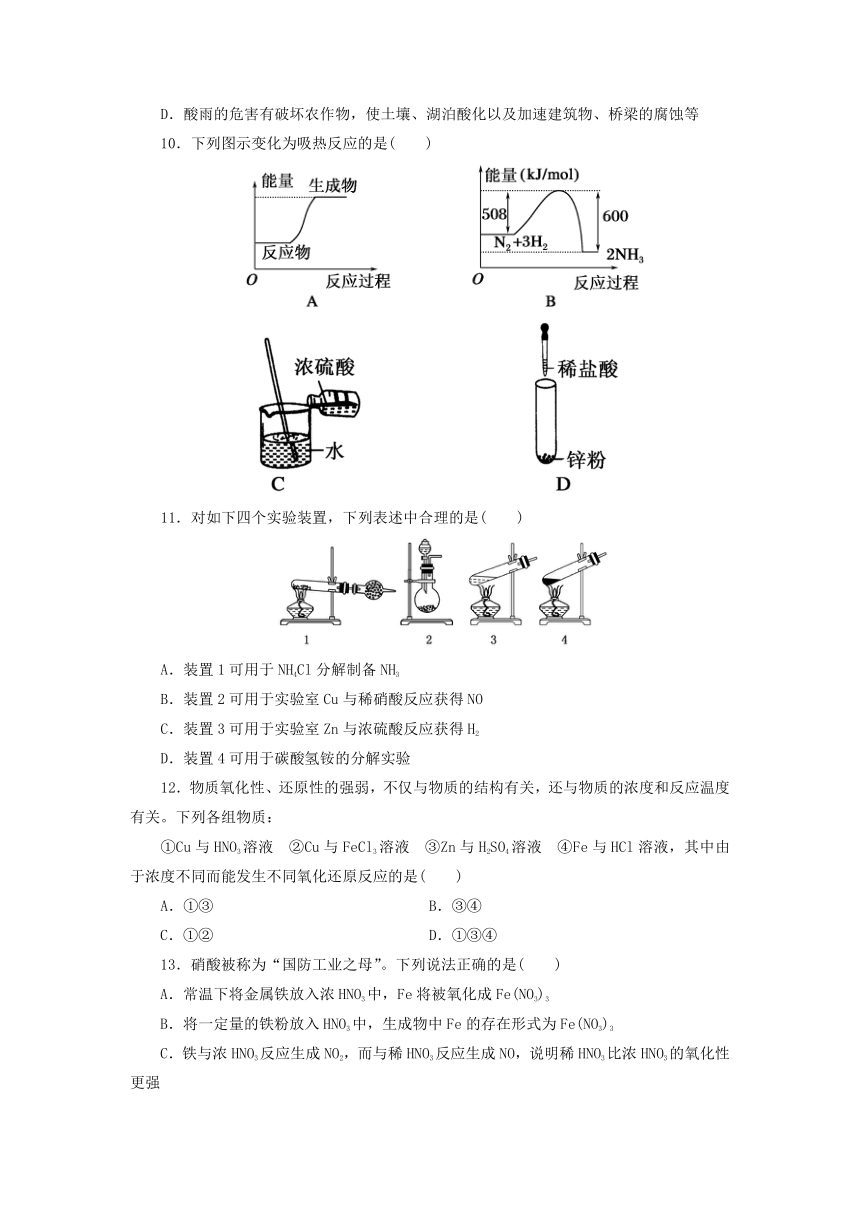
10.下列图示变化为吸热反应的是( )
11.对如下四个实验装置,下列表述中合理的是( )
A.装置1可用于NH4Cl分解制备NH3
B.装置2可用于实验室Cu与稀硝酸反应获得NO
C.装置3可用于实验室Zn与浓硫酸反应获得H2
D.装置4可用于碳酸氢铵的分解实验
12.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,其中由于浓度不同而能发生不同氧化还原反应的是( )
①③ B.③④
C.①② D.①③④
13.硝酸被称为“国防工业之母”。下列说法正确的是( )
A.常温下将金属铁放入浓HNO3中,Fe将被氧化成Fe(NO3)3
B.将一定量的铁粉放入HNO3中,生成物中Fe的存在形式为Fe(NO3)3
C.铁与浓HNO3反应生成NO2,而与稀HNO3反应生成NO,说明稀HNO3比浓HNO3的氧化性更强
D.将一定量的Fe放入稀HNO3中,其产物可能是Fe(NO3)3,也可能是Fe(NO3)2或它们的混合物
14.已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,②1 mol I2蒸气中化学键断裂时需要吸收151 kJ的能量,③由H原子和I原子形成1 mol HI分子时释放299 kJ的能量。下列判断不正确的是( A )
A.I2蒸气比H2分子稳定
B.2 mol HI(g)发生分解反应吸收11 kJ热量
C.HI与NaOH反应属于放热反应
D.0.5 mol H2(g)与0.5 mol I2(g)完全反应释放出5.5 kJ 热量
15.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-=== CO2+6H2O
C.随着放电的进行,溶液的pH不变
D.放电时溶液中的阴离子向负极移动
16.为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应的化学方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
17. 下列说法正确的是( )
A. 醇在Cu或Ag的催化作用下都可被氧化
B. 乙醇的分子间脱水反应属于消去反应
C. 醇都可以在浓硫酸作用及加热条件下发生消去反应
D. 二元饱和脂肪醇的分子式都可以用通式CnH2n+2O2表示(n≥2)
18. A、B、C三种醇与足量的金属钠完全反应,在相同的条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子里羟基数之比是( )
A. 3∶2∶1 B. 2∶6∶3
C. 3∶1∶2 D. 2∶1∶3
19. 某常见有机物(含碳、氢、氧三种元素)分子的比例模型如图所示。请根据其结构特点判断下列有关说法( )
①该有机物的化学式为C2H4O
②该有机物的水溶液呈酸性的原因是其分子结构中含有羟基
③当温度低于16.6 ℃时,该物质就会凝结成像冰一样的晶体
④常温常压下,该有机物是具有强烈刺激性气味的液体
⑤该有机物的酸性比碳酸强,因此生活中可用其溶液除去水壶内的水垢
A. 全部正确 B. 只有①②错误
C. ②③④⑤正确 D. 全部错误
20. 巴豆酸的结构简式为。现有下列说法,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
①氯化氢 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤酸性KMnO4溶液
A. ②④⑤ B. ①③④
C. ①②③④ D. ①②③④⑤
21. 下列说法正确的是( )
A. 花生油是纯净物,油脂是油和脂肪的统称
B. 不含杂质的油脂是纯净物
C. 动物脂肪和矿物油都属于油脂
D. 同种简单甘油酯可组成纯净物,同种混合甘油酯也可组成纯净物
22. 下列关于油脂和乙酸乙酯的比较中,正确的是( )
①油脂和乙酸乙酯都是纯净物,在室温下都是液体
②油脂和乙酸乙酯都能水解生成羧酸和醇
③油脂和乙酸乙酯都不能使溴水褪色
④油脂和乙酸乙酯都不溶于水,而易溶于有机溶剂
A. ①② B. ②④
C. ①④ D. ③④
二、填空题(共三道)
23、(10分)已知:SO2+I2+2H2O===H2SO4+2HI,碘的淀粉溶液呈蓝色。某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
(1)若原料气的流向为从左向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”或“e”)。
(2)装置Ⅱ中发生反应的离子方程式为__________________________________________
________________________________________________________________________;
当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol·L-1、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),则SO2的体积分数为________。
24、(12分)某课外活动小组在实验室用下图所示的装置进行实验,验证氨的某些性质并收集少量纯净氮气。试回答:
(1)实验前先将仪器按图连接好,然后______________,此操作进行的方法是________________________________________________________________________
________________________________________________________________________,
然后再开始实验。
(2)实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成________色,盛无水CuSO4的干燥管内出现________色,并在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,硬质试管中反应的化学方程式为________________________________
________________________________________,
这个反应说明氨气具有________(填字母)。
A.碱性 B.氧化性
C.还原性 D.不稳定性
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气的原因是________________________________________________________________________。
烧瓶中的生石灰可以用______(填药品名称)代替。
(4)洗气瓶中浓硫酸的作用是吸水和______________。
(5)在最后出气管口收集干燥、纯净的氮气,收集方法是________(填字母)。
A.排气法
B.排水法
C.用塑料袋或球胆收集
25、(12). 松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
(1)α-松油醇的分子式________。
(2)α-松油醇所属的有机物类别是________。
a. 醇 b. 酚 c. 饱和一元醇
(3)α-松油醇能发生的反应类型是________。
a. 加成 b. 水解 c. 氧化
(4)在许多香料中松油醇还有少量以酯的形式出现,写出RCOOH和α-松油醇反应的化学方程式__________________________________________
__________________________________________。
(5)写结构简式:β-松油醇________,γ-松油醇__________________。
周至县第六中学2022-2023学年高一下学期5月期中考试
化学答案
一、1、D 2、B 3、B 4、C 5、A 6、A 7、A 8、C 9、A 10、A 11、B 12、A
D 14、A 15、D 16、B 17、D 18、D 19、B 20、D 21、D 22、B
二、
23、(10分)答案:(1)c→d→b→a→e (2)SO2+I2+2H2O===4H++SO+2I- 蓝色褪去 (3)7%
24、(12分)
答案:(1)检查装置的气密性 关闭分液漏斗活塞,向广口瓶内加水,浸没进气导管口,用酒精灯在烧瓶下稍加热,若导气管口有少量气泡冒出,停止加热后,导管内水面上升,形成一段水柱,就可以说明装置的气密性良好
(2)红 蓝 3CuO+2NH33Cu+3H2O+N2 C
(3)生石灰与水反应放热促使NH3逸出 氢氧化钠或碱石灰 (4)吸收多余NH3,保护环境 (5)C
25、(12分)
答案:(1)C10HO (2)a (3)ac
化学试题
可能用到的原子量:H 1 Fe 56 C 12 O 16 N 14 S 32 Zn 65
一选择题 (22道共66分每题只有一个正确选项)
1.下列关于SO2和NO2的叙述中正确的是( )
A.SO2可使紫色石蕊溶液褪色
B.SO2与水作用生成H2SO4
C.可用排水法收集NO2
D.实验室可用NaOH溶液处理NO2和SO2废气
2.0 ℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100 ℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:
N2O4(g)??2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2的消耗速率与N2O4的消耗速率之比为2:1
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.②③⑥⑦ B.①④⑧
C.只有①④ D.只有⑦⑧
3.下列说法正确的是( )
A.向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
4.NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)??2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min时,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率的式子中不正确的是( )
A.v(N2)=0.125 mol/(L·min)
B.v(H2O)=0.375 mol/(L·min)
C.v(O2)=0.225 mol/(L·min)
D.v(NH3)=0.250 mol/(L·min)
5.Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2===2CuO+4NO2↑+O2↑,将所得气体充满一干燥烧瓶(标准状况),再将烧瓶倒置于水中,过较长时间后,烧瓶中溶液的物质的量浓度可能为(假设烧瓶中的溶质不扩散到外面)( )
A. mol·L-1 B. mol·L-1
C.0 mol·L-1 D. mol·L-1
6.在含有FeCl3和BaCl2的酸性混合溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是( )
A.白色沉淀是BaSO4和BaSO3
B.溶液的酸性增强
C.白色沉淀是BaSO4
D.FeCl3全部被还原为FeCl2
7.物质的量均为1 mol的气体A2和B2放在1 L的密闭容器中反应生成C,2 min时,测得c(A2)=0.58 mol·L-1,c(B2)=0.16 mol·L-1,c(C)=0.84 mol·L-1,则C的分子式是( )
A.AB2 B.A2B
C.A3B2 D.A2B3
8.铁镍蓄电池又称爱迪生电池,放电时的总反应为
Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池放电时,电子经电解质溶液流入Ni2O3一极
D.电池放电时,Ni2O3在正极上被还原
9.如图是酸雨形成图,下列说法不正确的是( )
A.在酸雨形成过程中没有发生氧化还原反应
B.二氧化硫、二氧化氮是形成酸雨的主要因素
C.煤和石油的燃烧、汽车尾气等是酸雨污染物的主要来源
D.酸雨的危害有破坏农作物,使土壤、湖泊酸化以及加速建筑物、桥梁的腐蚀等
10.下列图示变化为吸热反应的是( )
11.对如下四个实验装置,下列表述中合理的是( )
A.装置1可用于NH4Cl分解制备NH3
B.装置2可用于实验室Cu与稀硝酸反应获得NO
C.装置3可用于实验室Zn与浓硫酸反应获得H2
D.装置4可用于碳酸氢铵的分解实验
12.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,其中由于浓度不同而能发生不同氧化还原反应的是( )
①③ B.③④
C.①② D.①③④
13.硝酸被称为“国防工业之母”。下列说法正确的是( )
A.常温下将金属铁放入浓HNO3中,Fe将被氧化成Fe(NO3)3
B.将一定量的铁粉放入HNO3中,生成物中Fe的存在形式为Fe(NO3)3
C.铁与浓HNO3反应生成NO2,而与稀HNO3反应生成NO,说明稀HNO3比浓HNO3的氧化性更强
D.将一定量的Fe放入稀HNO3中,其产物可能是Fe(NO3)3,也可能是Fe(NO3)2或它们的混合物
14.已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,②1 mol I2蒸气中化学键断裂时需要吸收151 kJ的能量,③由H原子和I原子形成1 mol HI分子时释放299 kJ的能量。下列判断不正确的是( A )
A.I2蒸气比H2分子稳定
B.2 mol HI(g)发生分解反应吸收11 kJ热量
C.HI与NaOH反应属于放热反应
D.0.5 mol H2(g)与0.5 mol I2(g)完全反应释放出5.5 kJ 热量
15.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-=== CO2+6H2O
C.随着放电的进行,溶液的pH不变
D.放电时溶液中的阴离子向负极移动
16.为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应的化学方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
17. 下列说法正确的是( )
A. 醇在Cu或Ag的催化作用下都可被氧化
B. 乙醇的分子间脱水反应属于消去反应
C. 醇都可以在浓硫酸作用及加热条件下发生消去反应
D. 二元饱和脂肪醇的分子式都可以用通式CnH2n+2O2表示(n≥2)
18. A、B、C三种醇与足量的金属钠完全反应,在相同的条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子里羟基数之比是( )
A. 3∶2∶1 B. 2∶6∶3
C. 3∶1∶2 D. 2∶1∶3
19. 某常见有机物(含碳、氢、氧三种元素)分子的比例模型如图所示。请根据其结构特点判断下列有关说法( )
①该有机物的化学式为C2H4O
②该有机物的水溶液呈酸性的原因是其分子结构中含有羟基
③当温度低于16.6 ℃时,该物质就会凝结成像冰一样的晶体
④常温常压下,该有机物是具有强烈刺激性气味的液体
⑤该有机物的酸性比碳酸强,因此生活中可用其溶液除去水壶内的水垢
A. 全部正确 B. 只有①②错误
C. ②③④⑤正确 D. 全部错误
20. 巴豆酸的结构简式为。现有下列说法,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
①氯化氢 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤酸性KMnO4溶液
A. ②④⑤ B. ①③④
C. ①②③④ D. ①②③④⑤
21. 下列说法正确的是( )
A. 花生油是纯净物,油脂是油和脂肪的统称
B. 不含杂质的油脂是纯净物
C. 动物脂肪和矿物油都属于油脂
D. 同种简单甘油酯可组成纯净物,同种混合甘油酯也可组成纯净物
22. 下列关于油脂和乙酸乙酯的比较中,正确的是( )
①油脂和乙酸乙酯都是纯净物,在室温下都是液体
②油脂和乙酸乙酯都能水解生成羧酸和醇
③油脂和乙酸乙酯都不能使溴水褪色
④油脂和乙酸乙酯都不溶于水,而易溶于有机溶剂
A. ①② B. ②④
C. ①④ D. ③④
二、填空题(共三道)
23、(10分)已知:SO2+I2+2H2O===H2SO4+2HI,碘的淀粉溶液呈蓝色。某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
(1)若原料气的流向为从左向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”或“e”)。
(2)装置Ⅱ中发生反应的离子方程式为__________________________________________
________________________________________________________________________;
当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol·L-1、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),则SO2的体积分数为________。
24、(12分)某课外活动小组在实验室用下图所示的装置进行实验,验证氨的某些性质并收集少量纯净氮气。试回答:
(1)实验前先将仪器按图连接好,然后______________,此操作进行的方法是________________________________________________________________________
________________________________________________________________________,
然后再开始实验。
(2)实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成________色,盛无水CuSO4的干燥管内出现________色,并在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,硬质试管中反应的化学方程式为________________________________
________________________________________,
这个反应说明氨气具有________(填字母)。
A.碱性 B.氧化性
C.还原性 D.不稳定性
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气的原因是________________________________________________________________________。
烧瓶中的生石灰可以用______(填药品名称)代替。
(4)洗气瓶中浓硫酸的作用是吸水和______________。
(5)在最后出气管口收集干燥、纯净的氮气,收集方法是________(填字母)。
A.排气法
B.排水法
C.用塑料袋或球胆收集
25、(12). 松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
(1)α-松油醇的分子式________。
(2)α-松油醇所属的有机物类别是________。
a. 醇 b. 酚 c. 饱和一元醇
(3)α-松油醇能发生的反应类型是________。
a. 加成 b. 水解 c. 氧化
(4)在许多香料中松油醇还有少量以酯的形式出现,写出RCOOH和α-松油醇反应的化学方程式__________________________________________
__________________________________________。
(5)写结构简式:β-松油醇________,γ-松油醇__________________。
周至县第六中学2022-2023学年高一下学期5月期中考试
化学答案
一、1、D 2、B 3、B 4、C 5、A 6、A 7、A 8、C 9、A 10、A 11、B 12、A
D 14、A 15、D 16、B 17、D 18、D 19、B 20、D 21、D 22、B
二、
23、(10分)答案:(1)c→d→b→a→e (2)SO2+I2+2H2O===4H++SO+2I- 蓝色褪去 (3)7%
24、(12分)
答案:(1)检查装置的气密性 关闭分液漏斗活塞,向广口瓶内加水,浸没进气导管口,用酒精灯在烧瓶下稍加热,若导气管口有少量气泡冒出,停止加热后,导管内水面上升,形成一段水柱,就可以说明装置的气密性良好
(2)红 蓝 3CuO+2NH33Cu+3H2O+N2 C
(3)生石灰与水反应放热促使NH3逸出 氢氧化钠或碱石灰 (4)吸收多余NH3,保护环境 (5)C
25、(12分)
答案:(1)C10HO (2)a (3)ac
同课章节目录
