江西省宜春市高安市名校2022-2023学年高一下学期5月期中考试化学试题(含解析)
文档属性
| 名称 | 江西省宜春市高安市名校2022-2023学年高一下学期5月期中考试化学试题(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-25 12:01:21 | ||
图片预览



文档简介
高安市名校2022-2023学年高一下学期5月期中考试
化学
考生注意:
1.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
一.单选题(每小题3分,共30分)
1.下列化工生产中不涉及氧化还原反应的是
A.工业制玻璃 B.工业制硫酸 C.工业制硅 D.工业制硝酸
2.下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应的是
①;②;③;④;⑤;⑥
A.①②③④⑤⑥ B.①②③ C.①②③⑤ D.②③⑤
3.利用如图微型实验装置制取H2S和SO2,并探究硫元素之间的转化。实验时挤压胶头滴管使硫酸滴到药匙中,然后倾斜试管使硫酸滴到药匙外与FeS反应。下列说法错误的是
A.实验开始一段时间后,试管内壁上有黄色颗粒出现
B.玻璃导气管中塞有蘸NaOH棉花的目的是吸收尾气
C.实验过程中发生的反应均可用离子方程式表示
D.生成SO2的离子反应为SO+2H+=SO2↑+H2O
4.有关阿伏加德罗常数叙述正确的是
A.常温下,1mol铁与足量的浓硫酸反应转移3NA个电子
B.1mol铜与足量的硫在加热条件下反应,转移得电子数目为NA
C.2mol浓硫酸与足量的铜在加热条件下反应,生成SO2的体积标准状况下为22.4L
D.在NO2与水的反应中每消耗3molNO2,反应转移NA个电子
5.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示
下列有关判断正确的是
A.常温下,Cu遇浓硝酸发生钝化,不可能发生上述反应
B.收集的氮氧化物的体积为20.16 L
C.反应过程中生成的Cu(NO3)2既是氧化产物,又是还原产物
D.若铜片为51.2 g,则生成0.2 mol NaNO3
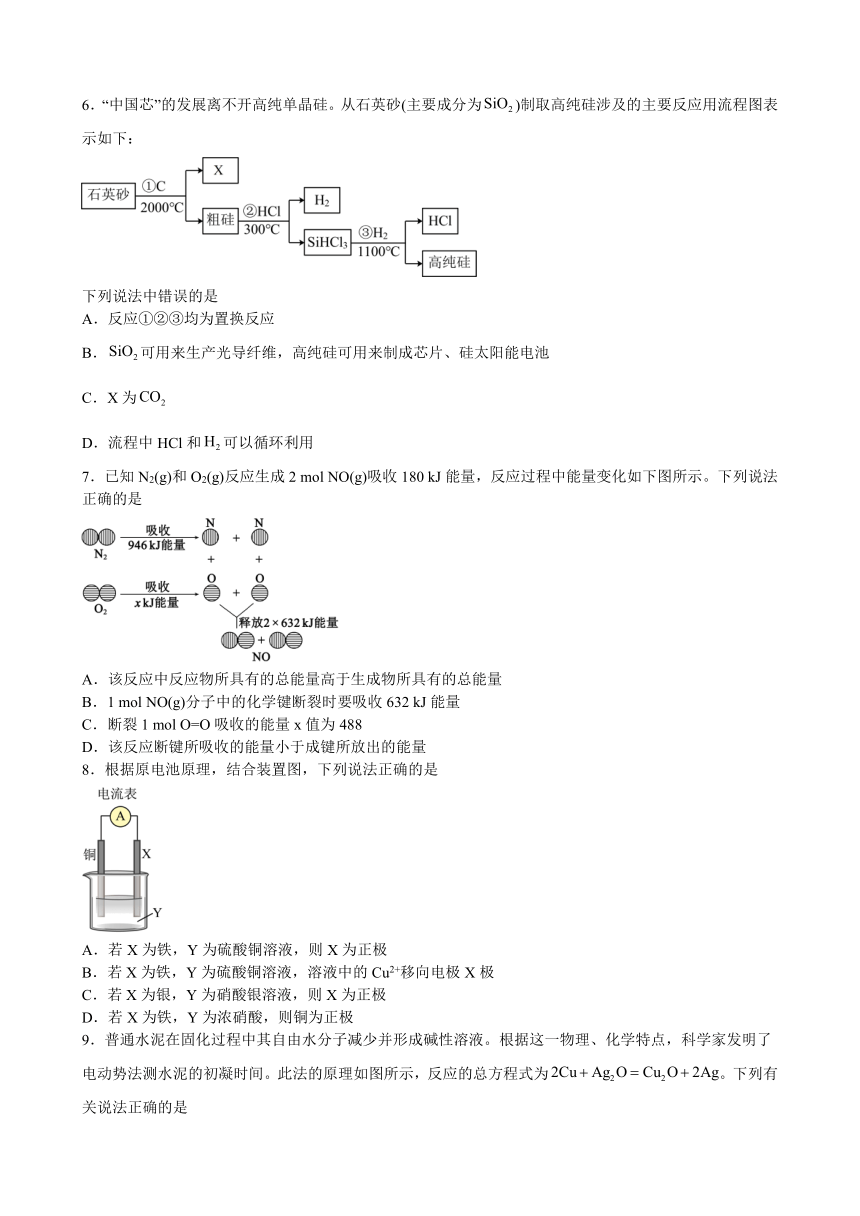
6.“中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为)制取高纯硅涉及的主要反应用流程图表示如下:
下列说法中错误的是
A.反应①②③均为置换反应
B.可用来生产光导纤维,高纯硅可用来制成芯片、硅太阳能电池
C.X为
D.流程中HCl和可以循环利用
7.已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如下图所示。下列说法正确的是
A.该反应中反应物所具有的总能量高于生成物所具有的总能量
B.1 mol NO(g)分子中的化学键断裂时要吸收632 kJ能量
C.断裂1 mol O=O吸收的能量x值为488
D.该反应断键所吸收的能量小于成键所放出的能量
8.根据原电池原理,结合装置图,下列说法正确的是
A.若X为铁,Y为硫酸铜溶液,则X为正极
B.若X为铁,Y为硫酸铜溶液,溶液中的Cu2+移向电极X极
C.若X为银,Y为硝酸银溶液,则X为正极
D.若X为铁,Y为浓硝酸,则铜为正极
9.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为。下列有关说法正确的是
A.负极的电极反应式为
B.测量原理示意图中,电子从电极经导线流向Cu
C.电池工作时,向Cu电极移动
D.电池工作时,浓度增大
10.我国某科研机构研究表明,利用可实现含苯酚废水的有效处理,其工作原理如图所示。下列说法正确的是
A.加热可以加快废水中苯酚的消除速率
B.通过阳离子交换膜移向M电极,通过阴离子交换膜移向N电极
C.当N电极反应,中间室中溶液的浓度降低
D.M的电极反应式为
二、多项选择题(每题有一个以上个选项,每题4分,共16分)
11.有一瓶可能部分被氧化的溶液,某同学取少量此溶液,滴入溶液,产生白色沉淀,再加入足量稀盐酸,充分振荡后,仍有白色沉淀。下述有关此实验的结论正确的是
A.已部分被空气中的氧气氧化
B.该实验说明不溶于盐酸
C.加入稀盐酸后,不溶的沉淀一定是
D.此实验能确定没有被氧化
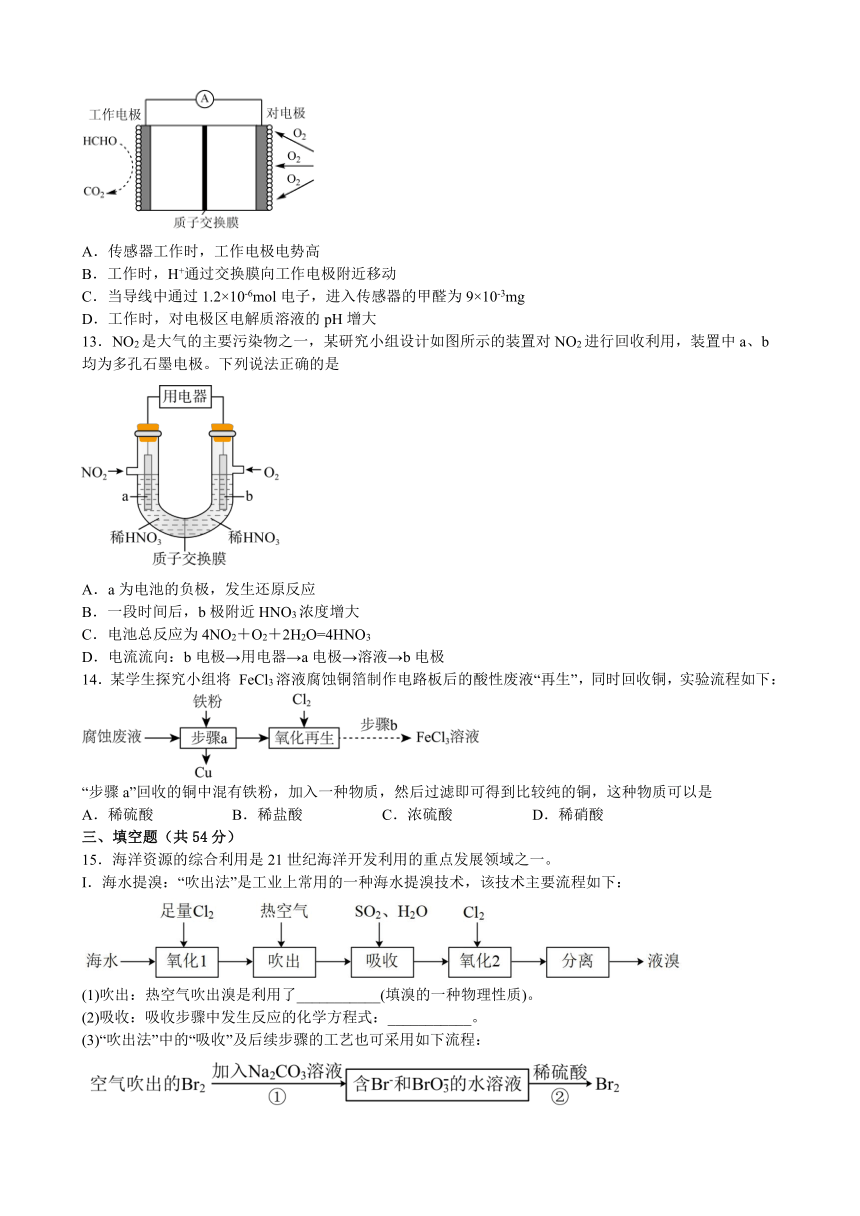
12.一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是
A.传感器工作时,工作电极电势高
B.工作时,H+通过交换膜向工作电极附近移动
C.当导线中通过1.2×10-6mol电子,进入传感器的甲醛为9×10-3mg
D.工作时,对电极区电解质溶液的pH增大
13.NO2是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2进行回收利用,装置中a、b均为多孔石墨电极。下列说法正确的是
A.a为电池的负极,发生还原反应
B.一段时间后,b极附近HNO3浓度增大
C.电池总反应为4NO2+O2+2H2O=4HNO3
D.电流流向:b电极→用电器→a电极→溶液→b电极
14.某学生探究小组将 FeCl3溶液腐蚀铜箔制作电路板后的酸性废液“再生”,同时回收铜,实验流程如下:
“步骤a”回收的铜中混有铁粉,加入一种物质,然后过滤即可得到比较纯的铜,这种物质可以是
A.稀硫酸 B.稀盐酸 C.浓硫酸 D.稀硝酸
三、填空题(共54分)
15.海洋资源的综合利用是21世纪海洋开发利用的重点发展领域之一。
I.海水提溴:“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
(1)吹出:热空气吹出溴是利用了___________(填溴的一种物理性质)。
(2)吸收:吸收步骤中发生反应的化学方程式:___________。
(3)“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:
写出上述步骤①中发生反应生成一种气体的离子方程式:___________。
II.海带提碘:从海带浸出液中提取碘的流程如下:
(4)实验室“过滤”操作通常使用的玻璃仪器包括烧杯、___________。
(5)“氧化”步骤发生反应的离子方程式为___________。
(6)设计简单的实验验证溴的非金属性比碘强。___________。(实验中须使用的试剂:溴水、KI溶液、CCl4)
16.利用“价一类”二维图是研究、推测元素的单质、化合物化学性质的重要学习手段。如下图是硫元素的“价-类”二维图,请回答下列问题:
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________(填化学式)。
(2)将X的溶液与Y混合反应,该反应中氧化剂与还原剂的物质的量之比为___________。
(3)Z的浓溶液与S单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为___________。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________(填字母)。
A.Na2S+S B.Na2SO3+S C.SO2+Na2SO4 D.Na2SO3+Na2SO4
(5)Z的浓溶液具有强的氧化性、吸水性和脱水性,常可作干燥剂,则下列气体可用乙干燥的是___________
A.X B.Y C.氨气 D.HI
(6)已知Na2SO3能被K2X2O7氧化为Na2SO4,则24mL0.05mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2X2O7溶液恰好反应时,X元素在还原产物中的化合价为___________。
17.下图为实验室制取氨气,二氧化硫及有关性质实验的组合装置。
(1)如果A、E是气体制取装置,则按照题目要求,A中制取气体的化学反应方程式为___________;
(2)B仪器称为___________,在此实验中B应加入___________(写名称);
(3)先加热A装置,使产生气体通入烧瓶F中,此时弹簧夹a、b打开、c关闭。当F中充满A中气体后,A停止制气,关闭a,打开弹簧夹c,使E中气体通入F中;
①如何测知F中已充满大量A中气体:___________;
②D的作用是干燥气体,D中盛的是___________(写名称);
(4)A、E中产生的气体都是有污染性的,吸收A尾气的试剂是___________,吸收E尾气的离子方程式为___________。
(5)生石灰与水反应生成并放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。用此方法制取氨气应选用的气体发生装置是___________(填“a”“b”或“c”)。
(6)为使生成的氨被硫酸吸收时不发生倒吸,可以选用下列装置中的___________(填“A”“B”或“C”)。
(7)该小组又设计如图所示的实验装置(固定装置略),进行SO2性质的研究:
①当通入SO2时,A中紫色石蕊溶液变红,用化学方程式解释其原因是___________。
②可用来验证SO2具有漂白性的现象是:___________。
③从元素化合价的角度分析,SO2的性质:
a、当通入SO2一段时间后,可观察C中溶液褪色,说明SO2具有___________性。
b、如要验证SO2还具有另一方面的性质,D装置中的药品应为___________。
A.FeCl3溶液 B.氯水 C.氢硫酸 D.浓硝酸
18.完成下列问题
(1)被氧化为时放出热量198kJ,反应的能量变化如图。
①图中A点表示___________,E的大小对该反应的热量变化___________(填“有”或“无”)影响。
②和充分反应放出的热量___________198kJ(填“>”、“<”或“=”)。
(2)一定温度下,在体积为2L的密闭容器中,充入和发生如下反应:。测定得和的物质的量随时间变化如图。
①从反应开始到平衡,的平均反应速率___________。
②达到平衡时,的转化率为___________。(用百分数表示)
③下列措施不能提高化学反应速率的是___________。
A.升高温度
B.加入适当催化剂
C.缩小体积,增大压强
D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是___________。
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C.在混合气体中的质量分数保持不变
D.反应中与的物质的量之比为
E.单位时间内每消耗同时生成
(3)如图所示,左侧石墨上通入,右侧石墨上通入,电解质溶液为KOH溶液。完成下列问题:
①属于___________化合物(填“离子”或“共价”),KOH中的化学键类型有___________。
②放电时向___________(填“正”或“负”)极移动。负极反应式为___________。
③当外电路通过电子的物质的量为7mol时,正极通入的在标准状况下的体积为___________(假设能量全部转化为电能)。
1.A
A.工业制玻璃,碳酸钠、碳酸钙、二氧化硅在高温条件下生成硅酸钠、硅酸钙、二氧化碳,元素化合价不变,属于非氧化还原反应,故选A;
B.工业制硫酸,发生反应4FeS2+11O2=2Fe2O3+8SO2、2SO2+O22SO3、SO3+H2O=H2SO4,4FeS2+11O2=2Fe2O3+8SO2、2SO2+O22SO3反应中S、O元素化合价有变化,属于氧化还原反应,故不选B;
C.工业制硅发生反应SiO2+2CSi+2CO,C、Si元素化合价有变化,属于氧化还原反应,故不选C;
D.工业制硝酸发生反应、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,N、O元素化合价有变化,属于氧化还原反应,故不选D;
选A。
2.B
①与稀硫酸反应生成硫酸钠、二氧化碳和水,与氢氧化钠反应生成碳酸钠和水;②与硫酸反应生成硫酸铵、二氧化硫和水,与氢氧化钠反应生成亚硫酸钠、氨气和水;③和硫酸反应生成硫酸铝和水,与氢氧化钠反应生成偏铝酸钠和水;④与硫酸不反应;⑤与硫酸不反应;⑥与硫酸反应生成硅酸和硫酸钠,与氢氧化钠溶液不反应;因此①②③既能与稀硫酸反应,又能与氢氧化钠溶液反应,故B符合题意。
综上所述,答案为B。
3.C
A.硫酸分别与FeS和反应生成和,二者发生反应:,所以能看到黄色硫颗粒附着在试管内壁上,A项正确;
B.由于和均有毒,用浸有NaOH的棉花吸收尾气,B项正确;
C.硫酸与FeS、的反应均为离子反应,而与的反应是气体之间的反应,不属于离子反应,不能用离子方程式表示,C项错误;
D.实验中用和反应制取,对应的离子方程式为,D项正确;
故选C。
4.B
A.常温下铁在浓硫酸中钝化,故A错误;
B.铜与硫在加热条件下反应生成Cu2S,铜元素化合价由0升高为+1,1mol铜与足量的硫在加热条件下反应,转移得电子数目为NA,故B正确;
C.稀硫酸与铜不反应,2mol浓硫酸与足量的铜在加热条件下反应,随反应进行,硫酸变稀,反应停止,参加反应的硫酸的物质的量小于2mol,生成SO2的物质的量小于1mol,故C错误;
D.在NO2与水生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,反应中每消耗3molNO2,反应转移2NA个电子,故D错误;
选B。
5.D
A.常温下,Cu能与浓硝酸反应,选项A错误;
B.没有说明标准状况下0.9mol氮的氧化物无法计算其体积,不一定为20.16 L,选项B错误;
C.反应过程中生成的Cu(NO3)2是氧化产物,不是还原产物,选项C错误;
D.分析整个反应过程可知仅有两种元素的化合价发生变化,即Cu→Cu2+,HNO3→NaNO2,51.2gCu的物质的量为0.8mol,共失电子0.8mol×2=1.6mol,由得失电子守恒可知HNO3→NaNO2得1.6mol电子,故产物中NaNO2的物质的量为0.8mol,由Na元素守恒可知另一种产物NaNO3为0.2mol,选项D正确;
答案选D。
6.C
A.由分析可知,反应①②③均为置换反应,A正确;
B.SiO2可用来生产光导纤维,生产太阳能电池的原料是硅,B正确;
C.由分析可知,X为CO,C错误;
D.流程中HCl和H2都是既在反应中使用,又在反应中生成,所以二者都可以循环利用,D正确;
故选C。
7.B
A.该反应为吸热反应,反应物所具有的总能量低于生成物所具有的总能量,A错误;
B.由图可知,生成2molNO要吸收2×632 kJ能量,则1 mol NO(g)分子中的化学键断裂时要吸收632 kJ能量,故B正确;
C.根据图示,断裂旧化学键所吸收能量为(x + 946)kJ,形成新化学键所释放能量为2 × 632 kJ = 1264 kJ,每生成2 mol NO(g)所吸收能量为180 kJ,因此有180 kJ = (x + 946) kJ - 1264 kJ,故x为498,C错误;
D.该反应为吸热反应,断键所吸收的能量大于成键所放出的能量,D错误;
故选B。
8.C
A.铁的活泼性比铜强,正极为铜,A错误;
B.若X为铁,铁不铜活泼,铁作负极,铜作正极,溶液中的Cu2+移向正极铜,B错误;
C.若X为银,铜比银活泼,铜作负极,Ag作正极,故C正确;
D.若X为铁,Y为浓硝酸,铁与浓硝酸发生钝化,铜与浓硝酸反应,则铜为负极,D错误;
故选:C。
9.C
A.由分析可知,Cu为负极,发生氧化反应,,A错误;
B.Cu作负极,Ag2O/Ag电极作正极,电子由从Cu经导线流向Ag2O/Ag电极, B错误;
C.电池工作时,阴离子移向负极,则OH-向Cu电极移动,C正确;
D.反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,电池工作时,OH-浓度不变,D错误;
故选C。
10.D
A.M极含有微生物,加热能使微生物失去活性,不能加快废水中苯酚的消除速率,故A错误;
B.M是负极,N是正极,阳离子移向正极、阴离子移向负极,不能通过阳离子交换膜移向M电极,不能通过阴离子交换膜移向N电极,故B错误;
C.负极生成的氢离子移向中间室,正极生成的氢氧根离子移向中间室,氢离子、氢氧根离子在中间室反应生成水,中间室中的物质的量不减少,故C错误;
D.M是负极,苯酚在负极失电子生成二氧化碳和氢离子,M的电极反应式为,故D正确;
选D。
11.AC
A.滴入溶液,产生白色沉淀,再加入足量稀盐酸,充分振荡后,仍有白色沉淀,说明没有溶解的沉淀为硫酸钡,原溶液中含有硫酸根,则说明已部分被空气中的氧气氧化,故A正确;
B.该实验说明不溶于盐酸,而溶于盐酸,故B错误;
C.加入稀盐酸后,不溶的沉淀一定是,故C正确;
D.反应后仍然有白色沉淀不溶于盐酸,说明已部分被氧化,故D错误。
综上所述,答案为AC。
12.CD
A.由上述分析可知,工作电极为负极,则传感器工作时,工作电极电势低,故A错误;
B.原电池中阳离子会向正极移动,因此工作时H+通过交换膜向对电极附近移动,故B错误;
C.根据可知,当导线中通过1.2×10-6mol电子,消耗甲醛的物质的量为3×10-7mol,质量为3×10-7mol×30g/mol=9×10-6g=9×10-3mg,故C正确;
D.对电极的电极反应式为,反应过程中消耗H+,同时生成水,则对电极电解质溶液的pH增大,故D正确;
答案选CD。
13.CD
A.由分析可知,a为电池的负极,失电子发生氧化反应,A不正确;
B.电池工作时,在b极发生反应O2+4e-+4H+=2H2O,所以b极附近HNO3浓度减小,B不正确;
C.负极4NO2-4e-+4H2O=4+8H+,正极反应为O2+4e-+4H+=2H2O,则电池总反应为4NO2+O2+2H2O=4HNO3,C正确;
D.电流由正极出发,经过用电器进入负极,然后在溶液中通过离子的定向移动传导电流,所以电流方向为:b电极→用电器→a电极→溶液→b电极,D正确;
故选CD。
14.AB
A.据分析,稀硫酸能用于铁、铜的分离,A符合;
B.据分析,稀盐酸能用于铁、铜的分离,B符合;
C. 铁在冷的浓硫酸据中钝化、铜很难与冷的浓硫酸反应,加热时铁和铜均与浓硫酸反应而溶解,则浓硫酸不能用于铁、铜的分离,C不符合;
D.铁和铜均与稀硝酸反应而溶解,则稀硝酸不能用于铁、铜的分离,D不符合;
答案选AB。
15.(1)溴的挥发性
(2)SO2+Br2+2H2O=2HBr+H2SO4
(3)3Br2+3=5Br-++3CO2↑
(4)玻璃棒、漏斗
(5)Cl2+2I-=2Cl-+I2
(6)取少量KI溶液于试管中,加入溴水,再加入CCl4振荡,静置,溶液分层,下层呈紫色
16.(1)SO2、H2SO3、Na2SO3
(2)1:2
(3)S+2H2SO4(浓)2H2O+3SO2↑
(4)B
(5)B
(6)+3
17.(1)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O
(2)干燥管或球形干燥管 碱石灰或固体氢氧化钠或固体氧化钙
(3)用湿润的红色石蕊试纸靠近b管口,看试纸有无变蓝(用蘸有浓盐酸的玻璃棒靠近b管口,看有无白烟产生) 浓硫酸
(4)水(稀硫酸)
(5)c
(6)AB
(7)SO2+H2O=H2SO3 B中品红溶液褪色 还原 C
18.(1)和的总能量 无 <
(2) 75% D DE
(3)共价 离子键、共价键 负 39.2L
化学
考生注意:
1.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
一.单选题(每小题3分,共30分)
1.下列化工生产中不涉及氧化还原反应的是
A.工业制玻璃 B.工业制硫酸 C.工业制硅 D.工业制硝酸
2.下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应的是
①;②;③;④;⑤;⑥
A.①②③④⑤⑥ B.①②③ C.①②③⑤ D.②③⑤
3.利用如图微型实验装置制取H2S和SO2,并探究硫元素之间的转化。实验时挤压胶头滴管使硫酸滴到药匙中,然后倾斜试管使硫酸滴到药匙外与FeS反应。下列说法错误的是
A.实验开始一段时间后,试管内壁上有黄色颗粒出现
B.玻璃导气管中塞有蘸NaOH棉花的目的是吸收尾气
C.实验过程中发生的反应均可用离子方程式表示
D.生成SO2的离子反应为SO+2H+=SO2↑+H2O
4.有关阿伏加德罗常数叙述正确的是
A.常温下,1mol铁与足量的浓硫酸反应转移3NA个电子
B.1mol铜与足量的硫在加热条件下反应,转移得电子数目为NA
C.2mol浓硫酸与足量的铜在加热条件下反应,生成SO2的体积标准状况下为22.4L
D.在NO2与水的反应中每消耗3molNO2,反应转移NA个电子
5.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示
下列有关判断正确的是
A.常温下,Cu遇浓硝酸发生钝化,不可能发生上述反应
B.收集的氮氧化物的体积为20.16 L
C.反应过程中生成的Cu(NO3)2既是氧化产物,又是还原产物
D.若铜片为51.2 g,则生成0.2 mol NaNO3
6.“中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为)制取高纯硅涉及的主要反应用流程图表示如下:
下列说法中错误的是
A.反应①②③均为置换反应
B.可用来生产光导纤维,高纯硅可用来制成芯片、硅太阳能电池
C.X为
D.流程中HCl和可以循环利用
7.已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如下图所示。下列说法正确的是
A.该反应中反应物所具有的总能量高于生成物所具有的总能量
B.1 mol NO(g)分子中的化学键断裂时要吸收632 kJ能量
C.断裂1 mol O=O吸收的能量x值为488
D.该反应断键所吸收的能量小于成键所放出的能量
8.根据原电池原理,结合装置图,下列说法正确的是
A.若X为铁,Y为硫酸铜溶液,则X为正极
B.若X为铁,Y为硫酸铜溶液,溶液中的Cu2+移向电极X极
C.若X为银,Y为硝酸银溶液,则X为正极
D.若X为铁,Y为浓硝酸,则铜为正极
9.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为。下列有关说法正确的是
A.负极的电极反应式为
B.测量原理示意图中,电子从电极经导线流向Cu
C.电池工作时,向Cu电极移动
D.电池工作时,浓度增大
10.我国某科研机构研究表明,利用可实现含苯酚废水的有效处理,其工作原理如图所示。下列说法正确的是
A.加热可以加快废水中苯酚的消除速率
B.通过阳离子交换膜移向M电极,通过阴离子交换膜移向N电极
C.当N电极反应,中间室中溶液的浓度降低
D.M的电极反应式为
二、多项选择题(每题有一个以上个选项,每题4分,共16分)
11.有一瓶可能部分被氧化的溶液,某同学取少量此溶液,滴入溶液,产生白色沉淀,再加入足量稀盐酸,充分振荡后,仍有白色沉淀。下述有关此实验的结论正确的是
A.已部分被空气中的氧气氧化
B.该实验说明不溶于盐酸
C.加入稀盐酸后,不溶的沉淀一定是
D.此实验能确定没有被氧化
12.一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是
A.传感器工作时,工作电极电势高
B.工作时,H+通过交换膜向工作电极附近移动
C.当导线中通过1.2×10-6mol电子,进入传感器的甲醛为9×10-3mg
D.工作时,对电极区电解质溶液的pH增大
13.NO2是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2进行回收利用,装置中a、b均为多孔石墨电极。下列说法正确的是
A.a为电池的负极,发生还原反应
B.一段时间后,b极附近HNO3浓度增大
C.电池总反应为4NO2+O2+2H2O=4HNO3
D.电流流向:b电极→用电器→a电极→溶液→b电极
14.某学生探究小组将 FeCl3溶液腐蚀铜箔制作电路板后的酸性废液“再生”,同时回收铜,实验流程如下:
“步骤a”回收的铜中混有铁粉,加入一种物质,然后过滤即可得到比较纯的铜,这种物质可以是
A.稀硫酸 B.稀盐酸 C.浓硫酸 D.稀硝酸
三、填空题(共54分)
15.海洋资源的综合利用是21世纪海洋开发利用的重点发展领域之一。
I.海水提溴:“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
(1)吹出:热空气吹出溴是利用了___________(填溴的一种物理性质)。
(2)吸收:吸收步骤中发生反应的化学方程式:___________。
(3)“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:
写出上述步骤①中发生反应生成一种气体的离子方程式:___________。
II.海带提碘:从海带浸出液中提取碘的流程如下:
(4)实验室“过滤”操作通常使用的玻璃仪器包括烧杯、___________。
(5)“氧化”步骤发生反应的离子方程式为___________。
(6)设计简单的实验验证溴的非金属性比碘强。___________。(实验中须使用的试剂:溴水、KI溶液、CCl4)
16.利用“价一类”二维图是研究、推测元素的单质、化合物化学性质的重要学习手段。如下图是硫元素的“价-类”二维图,请回答下列问题:
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________(填化学式)。
(2)将X的溶液与Y混合反应,该反应中氧化剂与还原剂的物质的量之比为___________。
(3)Z的浓溶液与S单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为___________。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________(填字母)。
A.Na2S+S B.Na2SO3+S C.SO2+Na2SO4 D.Na2SO3+Na2SO4
(5)Z的浓溶液具有强的氧化性、吸水性和脱水性,常可作干燥剂,则下列气体可用乙干燥的是___________
A.X B.Y C.氨气 D.HI
(6)已知Na2SO3能被K2X2O7氧化为Na2SO4,则24mL0.05mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2X2O7溶液恰好反应时,X元素在还原产物中的化合价为___________。
17.下图为实验室制取氨气,二氧化硫及有关性质实验的组合装置。
(1)如果A、E是气体制取装置,则按照题目要求,A中制取气体的化学反应方程式为___________;
(2)B仪器称为___________,在此实验中B应加入___________(写名称);
(3)先加热A装置,使产生气体通入烧瓶F中,此时弹簧夹a、b打开、c关闭。当F中充满A中气体后,A停止制气,关闭a,打开弹簧夹c,使E中气体通入F中;
①如何测知F中已充满大量A中气体:___________;
②D的作用是干燥气体,D中盛的是___________(写名称);
(4)A、E中产生的气体都是有污染性的,吸收A尾气的试剂是___________,吸收E尾气的离子方程式为___________。
(5)生石灰与水反应生成并放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。用此方法制取氨气应选用的气体发生装置是___________(填“a”“b”或“c”)。
(6)为使生成的氨被硫酸吸收时不发生倒吸,可以选用下列装置中的___________(填“A”“B”或“C”)。
(7)该小组又设计如图所示的实验装置(固定装置略),进行SO2性质的研究:
①当通入SO2时,A中紫色石蕊溶液变红,用化学方程式解释其原因是___________。
②可用来验证SO2具有漂白性的现象是:___________。
③从元素化合价的角度分析,SO2的性质:
a、当通入SO2一段时间后,可观察C中溶液褪色,说明SO2具有___________性。
b、如要验证SO2还具有另一方面的性质,D装置中的药品应为___________。
A.FeCl3溶液 B.氯水 C.氢硫酸 D.浓硝酸
18.完成下列问题
(1)被氧化为时放出热量198kJ,反应的能量变化如图。
①图中A点表示___________,E的大小对该反应的热量变化___________(填“有”或“无”)影响。
②和充分反应放出的热量___________198kJ(填“>”、“<”或“=”)。
(2)一定温度下,在体积为2L的密闭容器中,充入和发生如下反应:。测定得和的物质的量随时间变化如图。
①从反应开始到平衡,的平均反应速率___________。
②达到平衡时,的转化率为___________。(用百分数表示)
③下列措施不能提高化学反应速率的是___________。
A.升高温度
B.加入适当催化剂
C.缩小体积,增大压强
D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是___________。
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C.在混合气体中的质量分数保持不变
D.反应中与的物质的量之比为
E.单位时间内每消耗同时生成
(3)如图所示,左侧石墨上通入,右侧石墨上通入,电解质溶液为KOH溶液。完成下列问题:
①属于___________化合物(填“离子”或“共价”),KOH中的化学键类型有___________。
②放电时向___________(填“正”或“负”)极移动。负极反应式为___________。
③当外电路通过电子的物质的量为7mol时,正极通入的在标准状况下的体积为___________(假设能量全部转化为电能)。
1.A
A.工业制玻璃,碳酸钠、碳酸钙、二氧化硅在高温条件下生成硅酸钠、硅酸钙、二氧化碳,元素化合价不变,属于非氧化还原反应,故选A;
B.工业制硫酸,发生反应4FeS2+11O2=2Fe2O3+8SO2、2SO2+O22SO3、SO3+H2O=H2SO4,4FeS2+11O2=2Fe2O3+8SO2、2SO2+O22SO3反应中S、O元素化合价有变化,属于氧化还原反应,故不选B;
C.工业制硅发生反应SiO2+2CSi+2CO,C、Si元素化合价有变化,属于氧化还原反应,故不选C;
D.工业制硝酸发生反应、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,N、O元素化合价有变化,属于氧化还原反应,故不选D;
选A。
2.B
①与稀硫酸反应生成硫酸钠、二氧化碳和水,与氢氧化钠反应生成碳酸钠和水;②与硫酸反应生成硫酸铵、二氧化硫和水,与氢氧化钠反应生成亚硫酸钠、氨气和水;③和硫酸反应生成硫酸铝和水,与氢氧化钠反应生成偏铝酸钠和水;④与硫酸不反应;⑤与硫酸不反应;⑥与硫酸反应生成硅酸和硫酸钠,与氢氧化钠溶液不反应;因此①②③既能与稀硫酸反应,又能与氢氧化钠溶液反应,故B符合题意。
综上所述,答案为B。
3.C
A.硫酸分别与FeS和反应生成和,二者发生反应:,所以能看到黄色硫颗粒附着在试管内壁上,A项正确;
B.由于和均有毒,用浸有NaOH的棉花吸收尾气,B项正确;
C.硫酸与FeS、的反应均为离子反应,而与的反应是气体之间的反应,不属于离子反应,不能用离子方程式表示,C项错误;
D.实验中用和反应制取,对应的离子方程式为,D项正确;
故选C。
4.B
A.常温下铁在浓硫酸中钝化,故A错误;
B.铜与硫在加热条件下反应生成Cu2S,铜元素化合价由0升高为+1,1mol铜与足量的硫在加热条件下反应,转移得电子数目为NA,故B正确;
C.稀硫酸与铜不反应,2mol浓硫酸与足量的铜在加热条件下反应,随反应进行,硫酸变稀,反应停止,参加反应的硫酸的物质的量小于2mol,生成SO2的物质的量小于1mol,故C错误;
D.在NO2与水生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,反应中每消耗3molNO2,反应转移2NA个电子,故D错误;
选B。
5.D
A.常温下,Cu能与浓硝酸反应,选项A错误;
B.没有说明标准状况下0.9mol氮的氧化物无法计算其体积,不一定为20.16 L,选项B错误;
C.反应过程中生成的Cu(NO3)2是氧化产物,不是还原产物,选项C错误;
D.分析整个反应过程可知仅有两种元素的化合价发生变化,即Cu→Cu2+,HNO3→NaNO2,51.2gCu的物质的量为0.8mol,共失电子0.8mol×2=1.6mol,由得失电子守恒可知HNO3→NaNO2得1.6mol电子,故产物中NaNO2的物质的量为0.8mol,由Na元素守恒可知另一种产物NaNO3为0.2mol,选项D正确;
答案选D。
6.C
A.由分析可知,反应①②③均为置换反应,A正确;
B.SiO2可用来生产光导纤维,生产太阳能电池的原料是硅,B正确;
C.由分析可知,X为CO,C错误;
D.流程中HCl和H2都是既在反应中使用,又在反应中生成,所以二者都可以循环利用,D正确;
故选C。
7.B
A.该反应为吸热反应,反应物所具有的总能量低于生成物所具有的总能量,A错误;
B.由图可知,生成2molNO要吸收2×632 kJ能量,则1 mol NO(g)分子中的化学键断裂时要吸收632 kJ能量,故B正确;
C.根据图示,断裂旧化学键所吸收能量为(x + 946)kJ,形成新化学键所释放能量为2 × 632 kJ = 1264 kJ,每生成2 mol NO(g)所吸收能量为180 kJ,因此有180 kJ = (x + 946) kJ - 1264 kJ,故x为498,C错误;
D.该反应为吸热反应,断键所吸收的能量大于成键所放出的能量,D错误;
故选B。
8.C
A.铁的活泼性比铜强,正极为铜,A错误;
B.若X为铁,铁不铜活泼,铁作负极,铜作正极,溶液中的Cu2+移向正极铜,B错误;
C.若X为银,铜比银活泼,铜作负极,Ag作正极,故C正确;
D.若X为铁,Y为浓硝酸,铁与浓硝酸发生钝化,铜与浓硝酸反应,则铜为负极,D错误;
故选:C。
9.C
A.由分析可知,Cu为负极,发生氧化反应,,A错误;
B.Cu作负极,Ag2O/Ag电极作正极,电子由从Cu经导线流向Ag2O/Ag电极, B错误;
C.电池工作时,阴离子移向负极,则OH-向Cu电极移动,C正确;
D.反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,电池工作时,OH-浓度不变,D错误;
故选C。
10.D
A.M极含有微生物,加热能使微生物失去活性,不能加快废水中苯酚的消除速率,故A错误;
B.M是负极,N是正极,阳离子移向正极、阴离子移向负极,不能通过阳离子交换膜移向M电极,不能通过阴离子交换膜移向N电极,故B错误;
C.负极生成的氢离子移向中间室,正极生成的氢氧根离子移向中间室,氢离子、氢氧根离子在中间室反应生成水,中间室中的物质的量不减少,故C错误;
D.M是负极,苯酚在负极失电子生成二氧化碳和氢离子,M的电极反应式为,故D正确;
选D。
11.AC
A.滴入溶液,产生白色沉淀,再加入足量稀盐酸,充分振荡后,仍有白色沉淀,说明没有溶解的沉淀为硫酸钡,原溶液中含有硫酸根,则说明已部分被空气中的氧气氧化,故A正确;
B.该实验说明不溶于盐酸,而溶于盐酸,故B错误;
C.加入稀盐酸后,不溶的沉淀一定是,故C正确;
D.反应后仍然有白色沉淀不溶于盐酸,说明已部分被氧化,故D错误。
综上所述,答案为AC。
12.CD
A.由上述分析可知,工作电极为负极,则传感器工作时,工作电极电势低,故A错误;
B.原电池中阳离子会向正极移动,因此工作时H+通过交换膜向对电极附近移动,故B错误;
C.根据可知,当导线中通过1.2×10-6mol电子,消耗甲醛的物质的量为3×10-7mol,质量为3×10-7mol×30g/mol=9×10-6g=9×10-3mg,故C正确;
D.对电极的电极反应式为,反应过程中消耗H+,同时生成水,则对电极电解质溶液的pH增大,故D正确;
答案选CD。
13.CD
A.由分析可知,a为电池的负极,失电子发生氧化反应,A不正确;
B.电池工作时,在b极发生反应O2+4e-+4H+=2H2O,所以b极附近HNO3浓度减小,B不正确;
C.负极4NO2-4e-+4H2O=4+8H+,正极反应为O2+4e-+4H+=2H2O,则电池总反应为4NO2+O2+2H2O=4HNO3,C正确;
D.电流由正极出发,经过用电器进入负极,然后在溶液中通过离子的定向移动传导电流,所以电流方向为:b电极→用电器→a电极→溶液→b电极,D正确;
故选CD。
14.AB
A.据分析,稀硫酸能用于铁、铜的分离,A符合;
B.据分析,稀盐酸能用于铁、铜的分离,B符合;
C. 铁在冷的浓硫酸据中钝化、铜很难与冷的浓硫酸反应,加热时铁和铜均与浓硫酸反应而溶解,则浓硫酸不能用于铁、铜的分离,C不符合;
D.铁和铜均与稀硝酸反应而溶解,则稀硝酸不能用于铁、铜的分离,D不符合;
答案选AB。
15.(1)溴的挥发性
(2)SO2+Br2+2H2O=2HBr+H2SO4
(3)3Br2+3=5Br-++3CO2↑
(4)玻璃棒、漏斗
(5)Cl2+2I-=2Cl-+I2
(6)取少量KI溶液于试管中,加入溴水,再加入CCl4振荡,静置,溶液分层,下层呈紫色
16.(1)SO2、H2SO3、Na2SO3
(2)1:2
(3)S+2H2SO4(浓)2H2O+3SO2↑
(4)B
(5)B
(6)+3
17.(1)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O
(2)干燥管或球形干燥管 碱石灰或固体氢氧化钠或固体氧化钙
(3)用湿润的红色石蕊试纸靠近b管口,看试纸有无变蓝(用蘸有浓盐酸的玻璃棒靠近b管口,看有无白烟产生) 浓硫酸
(4)水(稀硫酸)
(5)c
(6)AB
(7)SO2+H2O=H2SO3 B中品红溶液褪色 还原 C
18.(1)和的总能量 无 <
(2) 75% D DE
(3)共价 离子键、共价键 负 39.2L
同课章节目录
